|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"Inmunología de la Pulpa Dental y de los Tejidos Periapicales" por: Dra. Carol Abdulmesih T. Odontólogo. Universidad Santa María. 2006 Especialista en Endodoncia. Universidad Central de Venezuela 2010 e-mail: carolabdulmesih@gmail.com
INTRODUCCIÓN La Inmunología estudia las diferentes formas mediante las cuales el cuerpo se defiende de agentes infecciosos y otras sustancias extrañas en su ambiente. Definido de amplio modo, la inmunología cubre muchas líneas de defensa, incluso las barreras físicas como la piel, sustancias químicas protectoras en la sangre y en los líquidos tisulares, y las reacciones fisiológicas de los tejidos a la lesión o a la infección.(1,2) Los individuos sanos están expuestos a una diversidad de agentes infecciosos capaces de desencadenar patologías de distinta gravedad. Existen varios mecanismos que participan en la protección frente a estas agresiones externas. Estos mecanismos incluyen desde barreras físicas, hasta células y mediadores químicos.(3,4) Básicamente, existen dos formas de enfrentar el ingreso de un agente extraño en el organismo. La primera, una respuesta innata o inespecífica que en general es la primera barrera de defensa y está constituida por células entre las cuales se encuentran macrófagos, neutrófilos, eosinófilos, mastocitos y células asesinas naturales (NK), por mediadores químicos como componentes solubles del sistema de complemento y citocinas, tales como Interleucina &endash; 1 (IL-1) y el Factor de necrosis tumoral (TNF). La segunda, una respuesta específica o adaptativa, que es mucho mas compleja y eficiente que la anterior, completa la eliminación de los patógenos del organismo y genera memoria inmunológica. (3,4) Las células involucradas en la respuesta específica son los linfocitos T y B. También hay un componente humoral constituido por anticuerpos y citocinas del tipo Interleucina &endash; 2 (IL-2), Interleucina &endash; 4 (IL-4) e Interferón gamma (INF), entre otras. (3,4) Estas reacciones inmunológicas se presentan igualmente en el campo de la Endodoncia, donde existe una respuesta defensiva del tejido pulpar ante estímulos agresores como la caries dental, traumatismos, preparaciones cavitarias, entre otros, que de una u otra manera activan el sistema inmune como un mecanismo de defensa. (3,4) En consecuencia, esta revisión bibliográfica tiene por objeto estudiar todos los fenómenos inmunológicos innatos y adquiridos que se generan ante la presencia de antígenos, tanto en el tejido pulpar como en los tejidos periapicales, que desencadenan una respuesta inmunológica celular con la activación de células de defensa, y una respuesta inmunológica humoral con la consiguiente producción de anticuerpos. (3,4)
GENERALIDADES DE LA INMUNOLOGÍA La Inmunología se ocupa de los mecanismos de defensa frente a infecciones. Estos mecanismos se dividen en dos tipos de respuestas. La inmunidad innata y la adquirida. Las células que forman parte del sistema inmune se organizan en órganos y tejidos. Estas estructuras reciben el nombre de sistema linfoide.(5) (Gráfico.1)
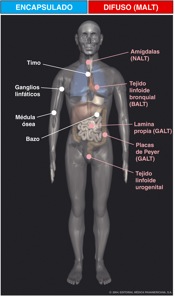
Gráfico 1. Sistema linfoide. Tomado de Regueiro(5) Los órganos del sistema linfoide se dividen en dos, el primero, desde el punto de vista anatómico constituido por: a) órganos con cápsula bien definida (bazo, timo, ganglios linfáticos y médula ósea) y b) acumulaciones difusas de tejido linfoide no encapsulado que se asocia a las mucosas (MALT); y el segundo, desde el punto de vista funcional, constituido por los órganos y los tejidos linfoides, los cuales se dividen en órganos primarios o centrales (médula ósea y timo) y órganos secundarios o periféricos (bazo, ganglios linfáticos y MALT).(5)
1. Inmunidad Innata Se refiere a la resistencia existente en el recién nacido, que se presenta la primera vez que se enfrenta el organismo a un patógeno; no requiere la exposición previa y no se modifica de manera importante con exposiciones repetidas al patógeno durante la vida de un individuo. (6) La Inmunidad Innata, está conformada por barreras naturales que están constituidas por la piel y por las mucosas de los tejidos que tapizan el tracto respiratorio, gastrointestinal y genitouirinario, cuenta con varios mecanismos de defensa como son la producción de ácidos grasos por parte de las glándulas sebáceas y la descamación de las células epiteliales; lo que implica la eliminación de microorganismos(6) La Inmunidad innata es activada con la invasión inicial de microorganismos. Si la respuesta innata no consigue solventar esta invasión, la inmunidad adquirida con la respuesta celular (inmunidad mediada por células) y la respuesta específica de anticuerpos (inmunidad humoral) aumentan los mecanismos protectores de la inmunidad innata.(7) Dentro de la inmunidad innata. La inflamación es la primera respuesta de defensa ante el ingreso de antígenos al organismo.
1.1. Inflamación El objetivo fundamental de la inflamación es atraer células, líquidos y proteínas desde la sangre hasta el tejido dañado. Al principio se trata de un fenómeno local que se manifiesta en forma de dolor e hinchazón por la entrada de líquidos (edema) y que puede estar acompañado de calor y rubor (eritema). La evolución de la inflamación dependerá de la extensión del daño. Estos signos y síntomas constituyen la Tétrada de Celso.(3,6) La inflamación esta constituida por cuatro fases: la primera fase es una respuesta vascular aguda, caracterizada por una vasodilatación inicial pocos segundos después de iniciada la lesión, aumento de permeabilidad capilar y edema. Posteriormente, se presenta la segunda fase de respuesta celular aguda entre 6-24 horas después de iniciada la lesión. En este punto migran al tejido polimorfonucleares neutrófilos (PMNs) que tendrán la función de fagocitar las bacterias o los detritos ocasionados por la muerte celular. Estas células primero se adhieren al endotelio de los vasos capilares, fenómeno que se llama marginación; una vez producida la marginación, los neutrófilos atraviesan el endotelio y pasan hacia el tejido, proceso denominado diapédesis. Tanto la marginación como la diapédesis están gobernadas por factores quimiotácticos liberados en la zona de la lesión.(3) La quimiotáxis es el fenómeno por el cual las células se mueven siguiendo el gradiente de concentración del factor que las activa. Seguidamente sucede la tercera fase de respuesta celular crónica entre 24-48 horas después de iniciado el proceso; si el daño es lo suficientemente grande, se caracteriza por un infiltrado celular constituido por macrófagos y linfocitos. Finalmente la cuarta fase de resolución en la que se restablece la arquitectura tisular. Si por cualquier circunstancia el agente patógeno no hubiera sido eliminado por completo, puede formarse un granuloma.(3,6) (Ver Gráfico 2)
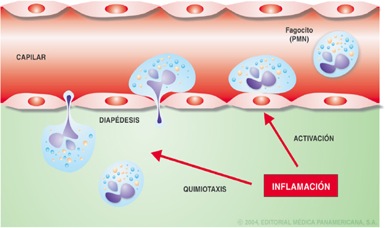
Gráfico 2. Extravasación de neutrófilos en respuesta a una inflamación local. Tomado de Regueiro(5)
Mediadores químicos de la inflamación Los mediadores químicos son sustancias solubles y difusibles que pueden actuar localmente en el sitio de la lesión, así como también a distancia.(3,5,6) Pueden clasificarse en
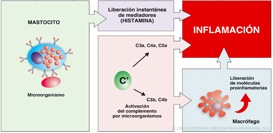
Gráfico 3. El reconocimiento de los patógenos por los diferentes componentes del sistema innato. Tomado de Regueiro(5)
Células involucradas en la inflamación - Fagocitos: Dentro de los elementos de la inmunidad innata, los fagocitos desempeñan un papel fundamental en la eliminación de microorganismos tales como bacterias extracelulares. Su función primordial consiste en fagocitar partículas incluso agentes infecciosos, ingerirlas y destruirlas. Para ello están estratégicamente contenidos a lo largo de los capilares sanguíneos en los distintos tejidos. En la sangre esta función la cumplen los neutrófilos, los monocitos que una vez que llegan a los tejidos, se convierten en macrófagos y los eosinófilos.(3,6,8) - Neutrófilos: Constituyen un ejército de fagocitos circulantes, listos para responder rápidamente y en gran número, siempre que se produzcan lesiones tisulares. Se caracterizan por un núcleo multilobulado y abundantes gránulos en su citoplasma que almacenan agentes bactericidas y enzimas lisosómicas. Su función es la quimiotáxis, fagocitosis y destrucción bacteriana. (3,6,8)
Gráfico 4. Neutrófilos. Tomado de http://www.amazings.com/ciencia/noticias/160807e.html 16.11.2009, 11:30pm
- Monocitos/ Macrófagos: Son células relativamente grandes de 12-20 micrómetros, con núcleo en forma de riñón, cromatina nuclear laxa y citoplasma abundante. Son producidos en la médula ósea y liberados después a la sangre, donde circulan durante aproximadamente un día; una vez situados en los tejidos las células se denominan macrófagos tisulares o histiocitos.Su función es similar al neutrófilo ya que es quimiotáctico, fagocita y destruye bacterias; la diferencia con los neutrófilos estriba en que los macrófagos tienen la capacidad de seguir madurando fuera de la médula ósea y bajo ciertos estímulos como endotoxinas, interferón o el fragmento C3b de la cascada de complemento.El neutrófilo muere después de haber fagocitado y destruido a la partícula ingerida. Por último, el macrófago puede actuar como célula presentadora de antígeno (CPA) de la respuesta inmune adquirida. (3,6,8) - Eosinófilos: Estas células residen fundamentalmente en los tejidos submucosos y comparten la capacidad fagocítica con los neutrófilos. Sus gránulos contienen grandes cantidades de proteínas catiónicas con gran capacidad para destruir parásitos extracelulares. Elaboran mediadores importantes de hipersensibilidad tipo I o anafilaxia. También sintetizan citocinas tales como Interleucina &endash; 3 (IL-3), Interleucina &endash; 5 (IL-5) y factor estimulante de colonias de granulocitos &endash;macrófagos (GM-CSF) que actúan como factores de crecimiento para eosinófilos. (3,6,8) - Células Asesinas Naturales o Natural Killer (NK): Estas células también se denominan linfocitos granulares grandes; tienen la capacidad de reconocer cambios en la membrana de ciertas células, como por ejemplo, las células tumorales o células infectadas por virus. Estos linfocitos destruyen a estas células diana, pero a diferencia de los linfocitos T parecen no usar sistemas de reconocimiento. También, destruyen las células que tienen anticuerpos unidos en su superficie, un fenómeno denominado citotoxidad celular dependiente de anticuerpos (CCDA). (3,6,8) Las poblaciones celulares involucradas en la inflamación y que pertenecen al sistema inmune, se resumen en el Gráfico 5.
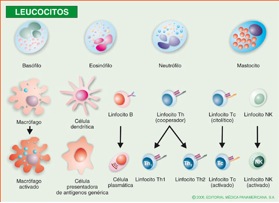
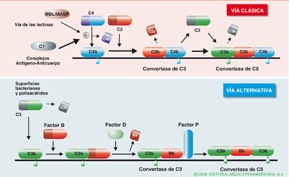
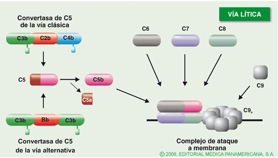
Gráfico 5. Poblaciones celulares del sistema inmune. Tomado de Regueiro(5) Sistema de Complemento Consiste en un grupo de proteínas plasmáticas que median varios mecanismos efectores de la respuesta inmune. La activación del complemento facilita la eliminación de antígenos del organismo y aumenta la actividad de la respuesta humoral. (3,5,8)Entre sus funciones se destaca la opsonización, la cual se define como el fenómeno por el cual el antígeno cubierto por anticuerpos y/o componentes activados del complemento es eliminado por células fagocíticas; este sistema interviene en el proceso de inflamación, lisis y solubilización de los inmunocomplejos antígeno-anticuerpo.El complemento puede activarse por dos vías. La vía clásica que consiste en 9 componentes a los que asigna al número la letra C. (C1, C4,C3, etc) y la vía alternativa cuyos componentes se conocen como factores.Ambos terminan en el mismo fenómeno final como lo es la formación de complejos de ataque de membrana, que insertos en la membrana de la célula infectada o del patógeno causan la lisis de ésta por desequilibrio osmótico. (3,5,8) (Gráfico 6)
Gráfico 6. Vía Clásica, Vía alternativa y Vía lítica del complemento. Tomado de Regueiro(5)
1.2 Inmunidad Adquirida La Inmunidad adquirida, tiene capacidad de responder mucho mas activamente cuando el agente patógeno entra por segunda vez, a diferencia de la Inmunidad innata, la cual constituye la primera barrera frente a la invasión de los microorganismos; sin embargo, y a pesar de ser muy eficiente, este sistema carece de especificidad y es incapaz de generar memoria inmunológica.(4,9)
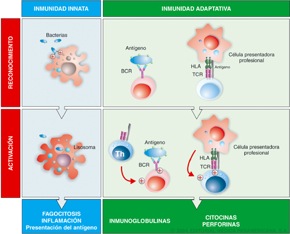
Gráfico 7. Reconocimiento, activación y efectos de la inmunidad celular innata y adquirida. Tomado de Regueiro(5)
Los mecanismos inmunológicos involucrados en la respuesta adquirida pueden ser humorales o celulares. En la inmunidad humoral, la respuesta está mediada por anticuerpos. Éstos consisten de un grupo de glicoproteínas presentes en el suero y en los líquidos tisulares. Algunas inmunoglobulinas (anticuerpos) se encuentran en la superficie de los linfocitos B y actúan como receptores antigénicos. Cuando el linfocito B reconoce el antígeno a través de la superficie de la inmunoglobulina, se convierte en una célula productora de anticuerpos, también llamada célula plasmática. Hay 5 clases de inmunoglobulinas (Ig) reconocidas en la mayoría de los mamíferos y que se denominan IgG, IgM, IgA, IgE e IgD. (4,9)
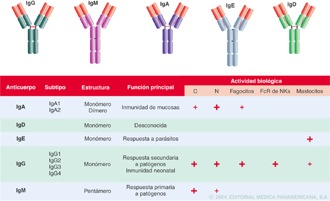
Gráfico 8.Clasificación de inmunoglobulinas. Tomado de Regueiro(5)
La Inmunoglobulina G (IgG), es la inmunoglobulina que constituye la mayor porción de anticuerpos humorales, la cual llega a máximas concentraciones en el fluido vascular (aproximadamente 40% del total de la IgG) extravascular (aproximadamente 60% del total de IgG). Es producida fundamentalmente por una respuesta secundaria. Esta Ig atraviesa la placenta y le confiere inmunidad pasiva al neonato.(10)
La IgA es la principal inmunoglobulina encontrada en secreciones exocrinas como leche humana, saliva, lágrimas así como en fluidos de los tractos respiratorio, urinario y gastrointestinal. (10) La IgM es una molécula pentamérica que es buen aglutinador bacterial y fijador del complemento. El sistema de complemento enzimático, trabaja en conjunto con las inmunoglobulinas para mediar la respuesta inmune y la inflamación. (10) Se ha demostrado que el Complemento C3 es activo en la iniciación de la quimiotáxis y la liberación de sustancias vasoactivas. La cuantificación de C3 ayuda a indicar la presencia de respuestas inflamatorias e inmunes. (10) Durante la respuesta primaria se produce un pico de anticuerpos de tipo IgM alrededor de los 10 días siguientes al contacto con el antígeno. En cambio, durante la respuesta secundaria se producen principalmente anticuerpos de tipo IgG entre los 3 y los 5 días después de un nuevo contacto antigénico.(3,6) (Ver Gráfico 11)
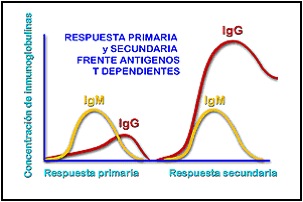
Gráfico 11. Respuesta primaria y secundaria frente antígenos. Tomado de http://www.sanidadanimal.info/cursos/inmuno2/ca043.htm 16.11.2009, 5:30pm
Los anticuerpos están constituidos por dos tipos de cadenas polipeptídicas distintas; la mas pequeña es denominada liviana y la cadena mayor denominada pesada. Todas las cadenas livianas poseen dos regiones o dominios, a saber, una región denominada región constante de la cadena liviana la cual permanece constante en todas las Ig, y una región remanente que contiene el extremo N terminal denominada región variable de cadena liviana. La interacción de los dominios de la región variable forman el sitio de reconocimiento antigénico.(3,6) Las funciones de los anticuerpos consisten en neutralizar la actividad biológica de las toxinas o de los virus e impedir la interacción de los mismos con los blancos donde van a actuar. (3,6) La inmunidad celular está mediada por linfocitos T a través de su receptor de célula T (TCR). A su vez los linfocitos T pueden ser CD4 o CD8. El linfocito T puede reconocer antígenos a través de su TCR cuando éste es procesado por una célula presentadora de antígenos (CPA) y expuesto en forma de pequeños péptidos asociados con moléculas del complejo mayor de histocompatibilidad (CMH).Las células que intervienen en la inmunidad adquirida son principalmente linfocitos T y B y las células presentadoras de antígeno.(4,9)
Ontogenia T La palabra Ontogenia proviene del griego "onto" ser y "genon" producir, por lo que se relaciona con la diferenciación y maduración de los linfocitos.Los linfocitos T maduran principalmente en el timo y ésta comienza cuando una población de precursores de linfocitos pre-T derivados de la médula ósea viaja a través de la sangre e ingresan a la corteza tímica. Estos precursores están comprometidos con el linaje T pero todavía no producen el receptor T ni moléculas coestimuladoras, por lo que son incapaces de reconocer antígenos. A partir de este momento comienzan a producir una serie de fenómenos, entre ellos su proliferación y diferenciación en Linfocitos T-CD4 y Linfocitos T-CD8 y la muerte celular por apoptosis. Mediante el mecanismo de apoptosis, aquellos timocitos que no reconocieron el receptor de la membrana a través de la célula presentadora de antígeno y aquellos timocitos que sobrevivieron a esta muerte celular serán de selección negativa y sufrirán anergia clonal, que consiste en silenciar aquellos clones T con capacidad autorreactiva. Los linfocitos T maduros salen a la sangre periférica, migran a los órganos linfáticos secundarios, tienen fenotipo T-CD4 o T-CD8 y pueden reconocer péptidos extraños presentados por las moléculas del Complejo Mayor de Histocompatibilidad.(4,9) Complejo Mayor de Histocompatibilidad El Complejo Mayor de Histocompatibilidad (CMH), es un conjunto de genes que codifican una serie de glicoproteínas presentes en la superficie celular, cuya función es la de presentar péptidos antigénicos a los linfocitos T. Existen dos tipos de proteínas codificadas por el CMH: las moléculas clase I, que cumplen la función de presentarle péptidos antigénicos a los T-CD8 y las moléculas clase II que las presentan a los T-CD4.(4,9) (Gráfico 13)
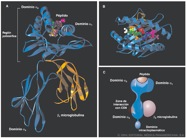 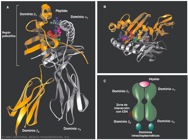
Gráfico 13.Estructura de las moléculas Clase I y Clase II respectivamente del CMH. Tomado de Regueiro(5) Ontogenia B Ocurre en la médula ósea a partir de los precursores Pre-B, que proliferan, reordenan los genes para las cadenas pesada y liviana de las Inmunoglobulinas (Igs) y se diferencian hasta producir Inmunoglobulina M (IgM) e Inmunoglobulina D (IgD) de membrana. Estas células, poseen en su membrana un receptor de células B llamado BCR.(4,9) Células presentadoras de Antígeno (CPA) Las células dendríticas y los macrófagos se diferencian a partir de precursores mieloides en la médula ósea. Las células natural Killer y los linfocitos B activados también pueden presentar antígenos. .(4,9)
1.3 Presentación antigénica y Activación Linfocitaria El procesamiento antigénico implica la degradación del mismo en pequeños péptidos que serán ensamblados en las moléculas de histocompatibilidad recién sintetizadas y llevados a la superficie celular de la CPA. De acuerdo con la naturaleza del antígeno procesado y las vías metabólicas intracelulares utilizadas para tal fin, se pueden describir dos grandes vías de presentación antigénica: la vía exógena y la vía endógena. La vía exógena es utilizada para procesar antígenos exógenos (proteínas solubles provenientes de la lisis bacteriana) unidas a las moléculas de clase II, las cuales viajan a la membrana celular donde serán reconocidos por los linfocitos T-CD4. La vía endógena, en la cual se presentan péptidos generados a partir de proteínas sintetizadas en forma endógena, en moléculas de clase I que serán reconocidos por los linfocitos T-CD8 los cuales poseen un receptor de linfocito T (TCR) específico para ellos.(4,9)
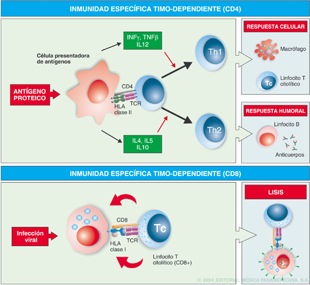
Gráfico 14. Respuesta inmune celular, humoral y citotóxica. Tomado de Regueiro(5)
1.4 Citotoxicidad Celular El mecanismo efector mas importante frente a infecciones virales, es la generación de linfocitos T citotóxicos. Estos linfocitos son capaces de destruir células blanco que presentan péptidos virales en las moléculas de histocompatibilidad clase I. Los precursores de linfocitos T-CD8 (Pre-T-CD8) son liberados desde el timo y tienen la capacidad necesaria para reconocer al péptido viral en la molécula de clase I, a través de su TCR. Una vez activados por medio del reconocimiento del péptido viral, interactúan con la célula diana y forman un conjugado que produce un impacto letal; este impacto consiste en la liberación de gránulos presentes en el citoplasma del T-CD8, los cuales contienen perforinas que forman poros en la membrana celular de la célula diana y granzimas que actúan en su interior, fragmentando su ADN. Las granzimas son enzimas proteolíticas que producen la muerte celular; a esto se le conoce como Citotoxicidad mediada por células.(4,9) (Gráfico 15)
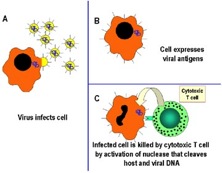
Gráfico 15. Citotoxicidad mediada por células. Tomado de http://pathmicro.med.sc.edu/Spanish-immuno/imm-chapter9.htm. 16.11.2009, 6:00
Las células NK son capaces de atacar a ciertas células transformadas o infectadas por virus. Esta destrucción no es específica de algún epítopo tumoral o viral y no requiere la clásica presentación antigénica por las moléculas de histocompatibilidad. Estas células NK también participan en reacciones de citotoxidad celular dependiente de anticuerpos (CCDA); en donde las células blanco están recubiertas por anticuerpos del tipo IgG (anticuerpos que reconocen epítopos tumorales o virales en la superficie de dichas células). Las células NK poseen un receptor específico para un foco llamado Fc de IgG por medio del cual quedan adheridas a la célula diana. Esta interacción desencadena un mecanismo de lisis celular que da como resultado la destrucción de la célula diana. (4) (Gráfico 16)

Gráfico 16.Citotoxicidad mediada por anticuerpos. Tomado de http://www.sanidadanimal.info/cursos/inmuno2/ca041.htm 16.11.2009, 6:00pm
2.- Tejido Pulpar 2.1 Pulpa como tejido conjuntivo La pulpa es un tejido conjuntivo único situado y encapsulado entre la dentina mineralizada. Como tejido conjuntivo el mayor constituyente es la matriz extracelular, que está formada por dos componentes principales: el primer componente son las proteínas fibrilares, entre ellas la elastina que le confiere elasticidad al tejido, y el colágeno que le confiere fuerza y el segundo componente es la sustancia fundamental, la cual es responsable de las funciones de viscoeslasticidad y filtración del tejido conectivo. Los fibroblastos son la principal célula del tejido conjuntivo. Éstos forman una red con la matriz extracelular y producen un amplio número de componentes de la matriz. Igualmente, son responsables de la degradación de los elementos extracelulares por lo que son esenciales en la remodelación del tejido conectivo.(11)
2.1.1 Organización estructural del tejido pulpar Inicialmente se encuentra la capa odontoblástica constituida por odontoblastos, los cuales son células especializadas que elaboran dentina. La superficie externa de la pulpa está circunscrita por la capa odontoblástica y forman una única capa que delinea la periferia de la pulpa, con cuerpos celulares en la pulpa y prolongaciones citoplasmáticas que se extienden en los túbulos dentinarios.(11,12)
Gráfico 17. Complejo dentino pulpar. A) dentina mineralizada, b) predentina y c) odontoblastos. Tomado de Stock
La forma del cuerpo de los odontoblastos, varía de acuerdo a la localización: en la zona coronaria, son altos y columnares; en la porción media, son cortos y columnares y en la porción radicular son cuboidales y planos. En esta capa se encuentra una gran cantidad de capilares llamada red capilar terminal, al igual que fibras nerviosas entrelazadas en ramos llamadas plexo de Raschkow, los cuales pasan entre odontoblastos. Así mismo, se encuentra una gran cantidad de moléculas del CMH Clase II expresadas en las células dendríticas que son responsables de detectar los estímulos antigénicos transdentales. (11,12)
Subyacente a la capa odontoblástica se sucede la zona libre de células conocida como Zona de Weil, constituida principalmente por fibras nerviosas amielínicas, capilares sanguíneos y fibroblastos. Más profundamente está situada la zona rica en células que tiene una alta densidad de fibroblastos, células mesenquimatosas indiferenciadas, células de defensa (macrófagos y linfocitos), capilares sanguíneos y nervios. La pulpa se considera junto con la dentina como un complejo dentino-pulpar, dada su relación anatómica, de desarrollo y de función. Los procesos odontoblásticos y las terminaciones nerviosas se extienden en la dentina. La funcionalidad de ambas se ejemplifica en los siguientes aspectos: 1) la pulpa es capaz de elaborar dentina tanto fisiológicamente como en respuesta a un estímulo externo, 2) la pulpa contiene nervios que le dan la sensibilidad a la dentina, 3) el tejido conjuntivo pulpar es capaz de responder a lesiones dentinarias aún cuando no es directamente estimulada, 4) la dentina que rodea la pulpa crea un ambiente de baja capacidad de expansión que limita el potencial de defensa de la pulpa. (11,12) (Gráfico 18)
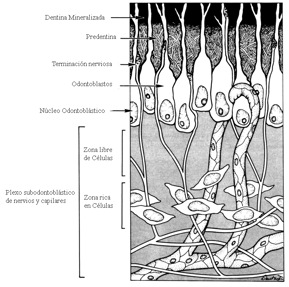
Gráfico 18. Organización Estructural de la pulpa. Tomado de Pashley(12)
La capacidad del tejido conectivo para generar y soportar la inflamación local y las reacciones inmunes, lo hacen un participante activo en las respuestas de defensa del hospedero. Una considerable parte de esta capacidad depende de las células inmunocompetentes que se encuentran en el tejido pulpar. Estas células son reclutadas de la sangre, donde residen como habitantes transitorios. Una vez que los antígenos extraños ganan acceso al tejido conectivo, estas células interactúan para ejecutar mecanismos que ayudan a defender al tejido de la invasión antigénica.(11,12)
3.- Inmunidad de la Pulpa y Tejidos Periapicales 3.1 Efecto de lesiones pulpares en las células inmunocompetentes pulpares Las células inmunocompetentes residentes en el tejido conectivo pulpar pueden responder a distintas condiciones clínicas que causan pérdida de la integridad del tejido duro como la caries, fractura y preparaciones cavitarias. Las bacterias y sus productos provenientes de la cavidad bucal, son elementos importantes asociados con tal respuesta. Es importante destacar que la respuesta pulpar puede iniciarse aún cuando ésta no esté directamente expuesta a la cavidad bucal. Algunos estudios han revelado que las células que poseen la molécula clase II del CMH responden pronta y activamente a la lesión dentinaria, preferiblemente por medio de la detección de antígenos; posteriormente se inicia la respuesta inmune actuando como células presentadoras de antígeno.(13,14) Las células que poseen la molécula clase II del CMH, están compuestas en su mayoría por verdaderas células dendríticas y macrófagos. Estos dos tipos de células conjuntamente, se denominan células pulpares dendríticas. La preparación cavitaria causa una rápida e intensa acumulación de células dendríticas pulpares bajo los túbulos dentinarios expuestos. Esta acumulación es transitoria y gradualmente cede, seguido a la iniciación de la dentinogénesis reparativa. Las células dendríticas pulpares, son capaces de responder a la invasión bacteriana transdentinal como resultado de la exposición dentinaria aguda. La restauración reduce en su mayoría la invasión bacteriana y disminuye la respuesta de células dendríticas pulpares. La respuesta pulpar inicial, se caracteriza por la acumulación localizada de células dendríticas debajo de las terminaciones pulpares de los túbulos dentinarios en comunicación con las lesiones cariosas. La acumulación en esta posición, indica que estas células responden rápidamente a los antígenos bacterianos que se difunden a través de los túbulos dentinarios.(13,14,15) Por otra parte, no se ha evidenciado la formación de dentina reparadora posterior a la acumulación de células dendríticas, lo que sugiere que el influjo de antígenos bacterianos es menor. Sin embargo, estas células rápidamente se acumulan cuando la dentina reparadora es invadida por caries Estos hallazgos apoyan la idea propuesta de que la intensidad de la respuesta inmunológica/ inflamatoria debajo de la caries dentaria no necesariamente corresponde a la profundidad de la lesión, sino que puede estar asociada con el estado y la calidad del proceso reparativo de la dentina y su influencia en la permeabilidad dentaria. Hay estudios que han demostrado que los linfocitos T aumentan en estas condiciones. Este aumento es evidente aún en dientes con lesiones cariosas superficiales, mientras que el aumento de linfocitos B es detectable sólo en dientes con lesiones profundas, por lo que los linfocitos T están mas involucrados en las reacciones inmunológicas iniciales.(11,12) Tomando en cuenta todas estas afirmaciones, se sugiere una intervención importante en la interacción local entre las células dendríticas y los linfocitos T de memoria en la inmunodefensa inicial de la pulpa contra estímulos cariosos. Esta interacción resulta en la activación de ambos, linfocitos T y células dendríticas pulpares, las cuales facilitan la activación de distintos tipos de células efectoras y disparan la cascada de fenómenos inmunopatológicos involucrados en el proceso de lesión pulpar asociada a la caries dental.(11)
3.2 Relación de la caries dental con la inmunidad de la Pulpa. La caries dental, una enfermedad del tejido conjuntivo duro, es la enfermedad humana más frecuente. Se ha demostrado a través de diversos estudios, que la pulpa dental tiene varios mecanismos de defensa contra la caries dental. Así mismo, se ha observado un aumento en el cúmulo de células inmunocompetentes en los tejidos pulpares, debajo de la dentina reparadora.(13) La microflora de la caries dental es compleja, y varía entre lesiones individuales. Su composición depende de la dieta, saliva y la cronicidad de la lesión. Para la iniciación y progresión de la caries los microorganismos más importantes son del grupo de los Estreptococos como: el Streptococcus mutans y el Streptococcus sobrinos y el grupo de los Lactobacilos. A medida de que la lesión progresa hacia la dentina, hay una transición de bacterias, predominantemente facultativas y Gram positivas, las cuales se encuentran en caries superficiales, cambiando a Lactobacilos y bacterias anaerobias en mayor proporción en caries profundas. Esta transición se debe a cambios en el ecosistema, oxígeno y nutrientes. Cuando la caries invade la pulpa, la inflamación se manifiesta con dolor e hipersensibilidad, debido a los productos metabólicos de las bacterias y los componentes de la pared celular como el ácido Lipoteicoíco (Gram positivas) y Lipopolisacáridos (Gram negativas). El ácido Lipoteicoíco (LTA), es una molécula anfifílica, liberada extracelularmente por las bacterias acidogénicas Gram positivas, que se difunden hacia la pulpa a través de los túbulos dentinarios y provocan respuestas inmunes, así como los lipopolisacáridos (LPS). Ambos, activan el sistema inmune innato por medio de mecanismos similares. Estos componentes se unen a la molécula CD14 de los linfocitos T, y activan las señales a través de los receptores de células T (TLRs) e inducen a la liberación de citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-), IL-1, la interleucina 8 (IL-8), la interleucina 12(IL-12), y las citocinas antiinflamatorias como la interleucina 10 (IL-10). (13,14) Aunque el LTA es mucho menos potente que los LPS para inducir la liberación de citocinas proinflamatorias por parte de los macrófagos, posee similar capacidad en cuanto a la inducción de macrófagos para la liberación del factor de crecimiento vascular endotelial (VEGF), el cual es un potente inductor de la angiogénesis y permeabilidad vascular. Un rápido incremento de éste, puede resultar en un aumento agudo de la presión tisular intersticial en un espacio pulpar limitado conllevando a la necrosis pulpar. (13,14) Según Hahn y col, la inmunidad innata del complejo dentino-pulpar ante la caries, incluye los siguientes componentes: a) Fluido dentinario y la deposición de inmunoglobulinas intratubularmente b) Odontoblastos c) Neuropéptidos e inflamación neurogénica d) Células de inmunidad innata e) Citocinas de inmunidad innata f) Quimiocinas(7)
3.2.1 Fluido dentinario y deposición de inmunoglobulinas intratubulares La primera respuesta protectora de la pulpa ante la caries, es el aumento en la salida del fluido dentinario como resultado de la presión intrapulpar positiva que reduce la difusión de estímulos nocivos a través de los túbulos dentinarios. (7,15,16) La composición del fluido dentinario no está completamente estudiado, sin embargo, se considera que contiene fluido tisular derivado del suero con proteínas e Igs. En la pulpa normal la IgG es detectada en el fluido intersticial y está localizadas en los túbulos dentinarios cerca al área de la predentina. Debajo de las caries superficiales se han detectado IgG, IgA1 e IgM en túbulos dentinarios no infectados.(17,18) En dientes con caries mas profundas, se han localizado inmunoglobulinas en túbulos dentinarios, específicamente y en mayor cantidad las IgG, IgA1, IgA2 e IgM. Estas inmunoglobulinas pueden tener dos efectos diferentes y contrarios: el primero es que disminuyen la difusión de antígenos hacia el tejido pulpar y el segundo, consiste en que los productos de la degradación de Igs en el túbulo dentinario, pueden servir como fuente de nutriente para microorganismos de la caries. (7,15,16) (Gráfico 19: muestra la presencia de inmunoglobulinas en túbulos dentinarios infectados con caries)
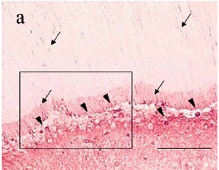
Gráfico 19.Presencia de IgG en la predentina y alrededor de túbulos dentinarios. Tomado de Hanh (16)
3.2.2 Odontoblastos Los odontoblastos son los primeros en enfrentarse con los antígenos de la caries bacteriana, por lo que su participación es sumamente importante en distintos aspectos: - Los genes de los odontoblastos liberan bajos niveles de IL-8 - Los genes relacionados con las quimiocinas como CCL2, CXCL10, CXCL12, CXCL14, atraen células dendríticas inmaduras, leucocitos, y también genes relacionados a receptores de quimiocinas como CCL26 que suprime esta aproximación. - Los odontoblastos de la pulpa normal poseen receptores similares de células (TLRs) que reconocen productos bacterianos como LTA. - Los odontoblastos de la pulpa inducen a la producción del factor de crecimiento vascular endotelial (VEGF) el cual es un estimulador de la angiogénesis y la permeabilidad vascular e induce a las células pulpares cunado son invadidas por ácido lipoteicoico (LTA) - La pulpa normal libera Beta-defensina 1 y beta-defensina 2 (BD-2). Esta última, estimula la diferenciación de odontoblastos y su acción bactericida contra microorganismos del grupo de Estreptococos y Lactobacilos, además de ser quimioatrayentes para células NK, T-CD4, linfocitos T de memoria y células dendríticas inmaduras. Por ser los odontoblastos atrayentes de células de defensa se sugiere que poseen actividad quimiotáctica y fagocítica. - En pulpas sanas, los Odontoblastos, secretan el Factor Transformador de Crecimiento Beta (TGF-), y su expresión aumenta en la pulpitis irreversible. Es importante en la dentinogénesis y reparación ya que promueve la secreción de la matriz de metaloproteinasas (MMP) y la mineralización de la dentina. En la etapa temprana de la inflamación, actúa como proinflamatorio, reclutando células inmunes, tales como células dendríticas (CD), y en la etapa tardía actúa a manera de antiinflamatorio, reprimiendo la activación de macrófagos y células dendríticas y la proliferación de linfocitos. (7,17,19) (Gráfico 20)
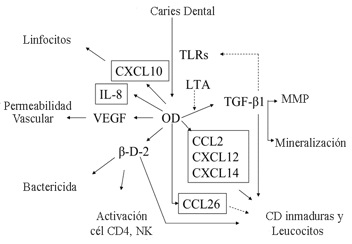
Gráfico 20. Respuesta inmune innata de los odontoblastos ante la caries dental. Tomada de Hahn(7)
3.2.3 Neuropéptidos e Inflamación Neurogénica La pulpa dental es uno de los tejidos mas densamente inervados del cuerpo, por lo que agentes neurales son señales importantes para la inflamación neurogénica, para la estimulación, para la reparación y para regular las funciones homeostáticas de la pulpa. Los neuropéptidos se describen como neurotransmisores peptídicos o neuromoduladores, lo que implica que son sintetizados y liberados por neuronas y presentan efectos biológicos por la activación de receptores localizados en la membrana plasmática de las células blanco.(18) Entre los neuropéptidos mas frecuentes en la pulpa dental se encuentran: Sustancia P (SP): fue el primer neuropéptido identificado en la pulpa dental, en la parte central de la pulpa. Las fibras de SP viajan próximas a los vasos sanguíneos. En la periferia, muchas fibras SP están directamente asociadas con pequeños vasos sanguíneos. Sin embargo, algunas fibras de SP no tienen relación con vasos sanguíneos y de hecho, no todos los vasos están acompañados por estas fibras. Igualmente algunas fibras de SP se observan en la capa subodontoblástica, donde se ramifican hacia la predentina con algunas fibras penetrando en la dentina.(20) La sustancia P es liberada por efecto de varios tipos de estímulos nocivos, tales como estímulos térmicos, químicos, eléctricos y mecánicos. A su vez, en muchas fibras la SP es liberada conjuntamente con el péptido regulador del gen de la calcitonina (CGRP) y la neuroquinina A (NKA) en las mismas terminaciones nerviosas; generalmente son liberados por el mismo estímulo que activa a la sustancia P. La sustancia P, se localiza en las fibras C (amielínicas) y las A (mielínicas). Los mastocitos, macrófagos, células mesenquimatosas, odontoblastos, linfocitos T y B, presentan receptores en su membrana para este neuropéptido. Su efecto biológico consiste en la vasodilatación, extravasación de plasma, estimulación del sistema inmune, quimiotáxis, aumento de la actividad de macrófagos, actuación en la formación de tejidos duros y reparación tisular.(18,19) Péptido Regulador del Gen de la Calcitonina (CGRP): muchos estudios han registrado la presencia de éste neuropéptido en la pulpa dental. En estudios realizados de inmunohistoquímico, el CGRP, se encuentra ubicado en la pulpa coronaria cerca de los cuernos pulpares y entrando a la dentina a más de 0,1mm. Estudios previos han demostrado que la presencia del CGRP es mayor en pulpas inflamadas que en pulpas sanas.(21) El CGRP se localiza igualmente en las fibras C y las A; responde a los mismos estímulos nocivos que la SP. Los mastocitos, macrófagos, células mesenquimatosas, linfocitos T y B, fibroblastos y ameloblastos, liberan receptores para éste neuropéptido. Su efecto biológico se basa en la vasodilatación, extravasación de plasma, quimiotáxis, supresión del linfocitos T, formación de tejido duro, reparación, dolor y control del proceso resortivo.(20,21,22,23) Neuropéptido Y (NPY): fue el primer neuropéptido reportado por Uddman en 1984. Se han observado las fibras del NPY junto con los vasos sanguíneos, envolviéndolos. Se presenta en el plexo subodontoblástico y también en la capa odontoblástica, como nervios libres proyectándose hacia la dentina, particularmente en el área de los cuernos pulpares. En el tejido pulpar, la estimulación eléctrica de las fibras nerviosas simpáticas causa vasoconstricción y disminuye la presión del flujo sanguíneo. Estos efectos pueden ser atribuidos a la liberación de NPY y norepinefrina. Los irritantes mecánicos, térmicos y la caries que afecta al complejo dentino-pulpar también estimulan la liberación de éste neuropéptido, por lo que su efecto biológico es la vasoconstricción, el dolor y los procesos de reparación. Se localiza en las fibras simpáticas y tiene receptores en las células del músculo liso, células mesenquimatosas y neuronas sensoriales.(18,24) Péptido Vasoactivo Intestinal (VIP): liberado predominantemente en las neuronas parasimpáticos. Aunque han habido controversias en cuanto a la inervación parasimpática en la pulpa dental, se ha encontrado liberación de VIP en neuronas de la pulpa dental, que viajan a lo largo de los vasos sanguíneos. En la capa subodontoblásticas hay muy pocas fibras con VIP y también se ha encontrado el lesiones perirradiculares. Se localiza en las fibras parasimpáticas. Poseen receptores específicos en osteoclastos, mastocitos, macrófagos, linfocitos T y B. Su efecto biológico es de vasodilatación y la regulación de la inflamación.(18) Se han desarrollado estudios relacionando la liberación de neuropéptidos con la inflamación, dando como resultado, que la liberación de éstos, altera múltiples procesos incluyendo la permeabilidad vascular y la vasodilatación en el sitio de la lesión. El aumento en la producción y liberación de neuropéptidos, cumple una importante función en la iniciación y propagación de la inflamación pulpar, dado que tienen la habilidad para interactuar con las células inmunocompetentes.(25)
En el gráfico 21, se muestra el efecto de varios neuropéptidos en la inflamación neurogénica.
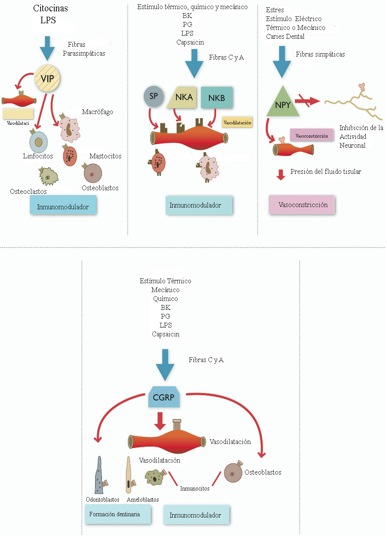
Gráfico 21. Estímulos que activan la liberación de neuropéptidos y su rol en la inflamación neurogénica. Tomado de Caviedes-Bucheli(20)
Mediante la utilización de procesos inmunohistoquímicos(18) se ha demostrado que la inervación de la pulpa dental está estrechamente relacionada con la microvasculatura. La regulación hemodinámica de la pulpa dental tiene varias funciones importantes, entre ellas proveer nutrición a las células pulpares, la remoción de metabolitos y productos de desecho y además de que mantiene la presión sanguínea pulpar en armonía con la presión de los tejidos pulpares.(18) La activación del sistema nervioso simpático reduce el flujo sanguíneo pulpar por medio de la liberación de neutransmisores de la pulpa incluyendo norepinefrina y NPY que contraen los vasos sanguíneos al liberar los receptores correspondientes. Se ha demostrado que esta vasoconstricción simpática es mediada por receptores adrenérgicos localizados en las células del músculo liso vascular y en las vénulas y arteriolas. La modulación simpática también influencia la transmisión del dolor, ya que se ha demostrado que la vasoconstricción simpática inhibe fuertemente la excitabilidad de los nervios sensoriales intradentales.(26) Se ha demostrado igualmente, que la vasoconstricción simpática en la pulpa es propensa a inhibirse después de la irritación local del tejido, como ocurre durante las preparaciones cavitarias profundas y las variaciones térmicas.(18,19) Igualmente el control del flujo sanguíneo involucra nervios aferentes peptídicos provenientes del ganglio trigeminal. Aunque estos nervios se clasifican como sensoriales por el gran contenido de neuropéptidos, estas fibras causan vasodilatación e inhiben la vasoconstricción simpática en respuesta a la estimulación del diente. La liberación de neuropéptidos de estas fibras incluyen SP, NKA y CGRP.(18) La SP y el CGRP son potentes vasodilatadores de la pulpa, la SP se libera inicialmente y el CGRP tiene un efecto sostenido de liberación, mientras que el efecto de la Neuroquinina A posee menor efecto en la alteración del flujo sanguíneo pulpar. Otros estímulos tales como la preparación de cavidades, la estimulación de la dentina expuesta, la aplicación de ultrasonido o percusión de dientes, también causan vasodilatación.(20,21) (Gráfico 22)
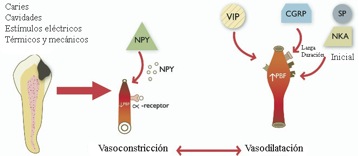
Gráfico 22. Cambios vasculares en la pulpa dental dada a la interacción de neuropéptidos. Tomado de Caviedes-Bucheli(20)
En pulpas inflamadas, los títulos de SP y CGRP son elevados y el número de fibras nerviosas inmunoreactivas a CGRP, SP, VIP y NPY aumenta significativamente en la región del cuerno pulpar con la progresión de la caries dental. La SP es quimiotáctica para células T e induce la producción de IL-2 e INF. La SP también regula la producción de IL-12 por parte de las células presentadoras de antígeno e induce a la producción de IL-8 por parte de las células pulpares.(13)
CGRP y VIP en pulpas inflamadas, pueden rápidamente reclutar células dendríticas inmaduras a los sitios de inflamación aguda e inhibir la migración de células dendríticas maduras a los nódulos linfáticos regionales. VIP es capaz también de inducir la maduración de células dendríticas inmaduras conllevando a un aumento en la producción de IL-12.(13)
3.2.4. Mediadores inflamatorios en la pulpa dental La liberación de mediadores inflamatorios (como bradiquinina y prostaglandinas) puede activar la producción de neuropéptidos y formar parte de una reacción positiva en el proceso inflamatorio.(13) Entre los mediadores inflamatorios mencionados encontramos la bradiquinina, la cual puede estimular las terminaciones nerviosas nociceptivas para producir dolor y sensibilizar las fibras nerviosas a estímulos térmicos, químicos y mecánicos.(27,28) Lepinski y col, 2000,(27) realizaron un estudio in vivo evaluando la concentración de bradiquinina en la pulpa humana, comprobando la hipótesis de que en pulpas inflamadas los niveles de bradiquinina inmunoreactiva eran mayores que en pulpas sanas. Para este estudio se utilizó la sonda de microdiálisis, la cual permite calcular los niveles de bradiquinina extracelular con una mínima disrupción del tejido inflamado. Este método presenta diversas ventajas ya que permite la exclusión de precursores que puedan interferir con la medición y no disuelve la muestra. Se utilizaron 21 pacientes en total, de los cuales 10 tenían un diagnóstico de pulpa normal y 11 de pulpitis irreversible. La sonda fue insertada en el tejido pulpar antes de la realización del tratamiento endodóntico o extracción.(27) Los resultados demuestran que en pulpitis irreversible la concentración de bradiquinina inmunoreactiva es significativamente mayor que en pulpas normales (262 / 19) y estos niveles estaban directamente relacionados con pacientes que en el pasado habrían tenido historia de dolor.(27,29) Otro de los mediadores involucrados son las prostaglandinas, las cuales son sustancias biológicamente activas que pueden participar en la inflamación, el dolor y la resorción ósea.(29,30) Las prostaglandinas (PGs) son derivados del ácido araquidónico por medio de la enzima fosfolipasa A2 que es la clave para la biosíntesis y liberación de las prostaglandinas en sus diferentes formas (PGF, PGI, PGE, PGD y tromboxano A2. Las PGs son el mediador mas importante de la inflamación, ya que se han encontrado niveles elevados en tejidos inflamados y daño tisular, además que hay considerable evidencia de que la bradiquinina, otro mediador inflamatorio, participa indirectamente en la síntesis y liberación de PGs, estimulando la fosfolipasa A2 y proporcionando precursores para la síntesis de las mismas. Las PGs, tienen la capacidad de aumentar la permeabilidad vascular y causar vasodilatación, por lo que las prostaglandinas y sus derivados como tromboxanos A2 junto con otros mediadores de la inflamación como histamina, bradiquinina y serotonina tienen importancia en la génesis de la inflamación.(31,32) Igualmente se ha encontrado que PGs, actúan en la generación del dolor ya que potencian el estímulo doloroso y por los efectos vasculares que causan presión tisular y edema, estimulando físicamente a los nociceptores, causando dolor.(30) En cuanto a la resorción ósea, se sabe que el hueso consiste en fibras colágenas compactadas densamente en una matriz de calcio y fósforo. Estudios in vitro han demostrado que las PGs son potentes estimuladores de la liberación del calcio y sus inhibidores de la síntesis de colágeno. La colagenasa causa la liberación de PGE y es por eso que se ha considerado este mediador revelante en la fisiología ósea. (30,31) La PG causa vasodilatación que incrementa la oxigenación local y consecuentemente potencia la acción de factores sistémicos estimuladores de resorción ósea, como vitamina A y D y la hormona paratiroidea.(30,31) En la inflamación neurogénica existe un control local e intríseco del flujo sanguíneo pulpar, que involucra varios neuropéptidos como SP, NKA, VIP, CGRP y NPY. Estos polipéptidos vasoactivos se han observado directamente en la pulpa dental como se ha mencionado anteriormente;(18) al igual que la Endotelina 1 (ET-1), la cual es un agente vasoconstrictor que es producida por células endoteliales también inhibe el aumento de la permeabilidad vascular y causa dolor ya que actúa sinérgicamente con las prostaglandinas.(32) Gilbert y col, 2002;(32) realizaron un estudio en el cual determinaron el efecto de la ET- 1 en la pulpa de dientes de perros, usando la fluometría láser doppler. Ellos utilizaron 11 perros adultos de edades comprendidas entre 3 y 6 años; se colocaron infusiones de péptidos vasoactivos y de ET-1 por 5 min, posteriormente realizaron las mediciones usando la fluometría de láser doppler. Los resultados de este estudio demostraron que la ET-1 provoca un efecto vasoconstrictor en la microcirculación; de allí que surgió la posibilidad de tener en las células endoteliales receptores específicos de Endotelina, lo cual produce una respuesta local intensa ya sea de reparación tisular o de necrosis pulpar.(32) De todo lo mencionado anteriormente, se puede concluir que la inflamación de la pulpa dental es un proceso complejo que incluye una gran variedad de reacciones nerviosas y vasculares, las cuales son componentes claves de la inflamación neurogénica que pueden llevar a la necrosis pulpar.
3.2.5 Células de la Inmunidad Innata en la Pulpa Dental Las reacciones inflamatorias en la pulpa dental como respuesta a una gran variedad de situaciones clínicas, han sido descritas y extensamente estudiadas. Se ha observado reacciones vasculares, así como migración y acumulación de células inflamatorias, tanto en la fase de respuesta inicial como en la fase reparativa. Hallazgos experimentales han demostrado que los antígenos de microorganismos de la cavidad bucal inducen reacciones inflamatorias en los tejidos de la pulpa a través de la dentina expuesta.(7) En diversos estudios (33,34,35,36), se ha demostrado que bajo condiciones de normalidad, la pulpa dental se encuentra equipada con una variedad de células asociadas con el sistema inmune de defensa. Las principales células efectoras innatas en la mayoría de los tejidos, son los neutrófilos, fagocitos mononucleares y linfocitos incluyendo células NK.
1. Neutrófilos Los neutrófilos son células fagocíticas de la respuesta inmune innata. Los neutrófilos pueden no ser de importancia en la pulpitis reversible, ya que pocos neutrófilos se han observado en las tejidos pulpares bajo caries superficiales y la barrera física de dentina previene el contacto íntimo entre las bacterias y los neutrófilos. En cambio, se ha demostrado una acción fagocítica por parte de los odontoblastos en la respuesta inmune innata.(33)
2. Macrófagos Los macrófagos son constituyentes del sistema fagocítico mononuclear, el cual consiste en poblaciones heterogéneas de células provenientes de la médula ósea, cuya función principal es la fagocitosis. Los macrófagos son activados por una gran variedad de estímulos y adquieren múltiples propiedades que contribuyen con la defensa y reparación del tejido conectivo. Con la liberación de la molécula Clase II del CMH en la superficie de los macrófagos, adquieren la capacidad de presentar antígenos y juegan un papel fundamental en la activación de linfocitos.(34,35,36) Los macrófagos muestran diversidad en términos de morfología, fenotipo y función. Esta heterogeneidad refleja sobre todo, las condiciones microambientales y el resultado de diferentes estados de diferenciación y activación. La morfología de los macrófagos varía de acuerdo al estado de activación y diferenciación, pero generalmente está caracterizada por una superficie irregular con prolongaciones e indentaciones, un aparato de Golgi bien desarrollado y muchos lisosomas y retículo rugoso endoplasmático prominente.(11) Los macrófagos en la pulpa se localizan predominantemente en la proximidad de los vasos sanguíneos. Muchos estudios que aplican la técnica de inmunohistoquímico, han demostrado que hay una gran cantidad de células que liberan antígenos asociados a macrófagos y éstas están localizadas en la zona perivascular de la pulpa. Los macrófagos de la pulpa tiene múltiples fenotipos. Ellos poseen variadas combinaciones de moléculas asociados a macrófagos como CD14, CD68, factor XIIIa de la coagulación y HLA-DR en humanos.(34,35) Los macrófagos activados eliminan patógenos en las respuestas inmunes innata y adaptativa y son importantes en la hemostasia tisular y la reparación de los tejidos después de la inflamación. Además, el número de macrófagos aumenta con la progresión de la caries y siempre es mayor que las células dendríticas en todas las etapas de la invasión de la caries, por lo que estos macrófagos derivados de monocitos pueden ser activados en la etapa temprana de la pulpitis para proteger la pulpa dental, aumentando la permeabilidad vascular y removiendo antígenos extraños y tejido dañado desde la pulpa afectada. (36,37,38,39) A medida que la infección progresa, el infiltrado celular se intensifica con células T-cooperadoras y células T-citotóxicos, células B, células plasmáticas, inmunoglobulinas y componentes no específicos, que incluyen células PMNs, monocitos, componentes del complemento células NK.(32)
3. Células Natural Killer Las células NK, son linfocitos largos granulares que se encuentran en el torrente sanguíneo. Debido a que las células NK y las células dendríticas inmaduras poseen receptores similares para quimiocinas y tienen el potencial de atraerse mutuamente a través de la producción de estas quimiocinas, ambas células coexisten en tejidos inflamados. Las células NK activadas, promueven la maduración de células dendríticas y la producción de citocinas, las cuales aumentan la proliferación de células NK, la producción de INF y la citotoxidad.(40) Mousavi y col, 2006; (40) realizan un estudio inmunohistoquímico para identificar y cuantificar las células NK en pulpas normales e inflamadas. Utilizaron 30 pulpas coronarias de terceros molares extraídos, de los cuales 15 pertenecían al grupo de pulpar normal y 15 al grupo de pulpa inflamada; las pulpas coronarias se colocaron en portaobjetos y se realizaron tinciones con eosina/hematoxilina e inmunoperoxidasa indirecta. Al microscopio óptico, no se observaron células NK en pulpas normales, al contrario de lo encontrado en pulpas inflamadas, que contenían un intenso infiltrado con células NK.(40)
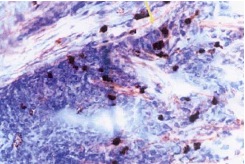
Gráfico 24. Células NK con tinción de H&E en pulpas coronarias inflamadas. Tomado de Mousavi(40)
A su vez, estas células se encontraban dispuestas en un patrón focal, posiblemente por la presencia de diferentes factores quimiotácticos para células NK en distintas zonas de la pulpa inflamada o por variaciones en las concentraciones de patógenos en diversas regiones de la pulpa.(41) Como se ha mencionado anteriormente, las células NK, son capaces de producir grandes cantidades de interferón gamma (INF) y han demostrado citotoxidad contra células tumorales y células infectadas por virus; por lo que las células NK juegan un papel importante en la primera respuesta defensiva contra infecciones virales y transformación maligna. Se ha demostrado que estás células pueden liberar receptores específicos de distintas interleucinas como IL-10, IL-15, IL-2 e IL-12.(36,40) Se demostró que en lesiones cariosas, abunda una gran cantidad de microorganismos S. mutans, por lo que son los primeros antígenos procesados por las células dendríticas y macrófagos de la pulpa. Se ha encontrado que el S. mutans activa rápidamente células mononucleares sanguíneas periféricas para producir niveles elevados de INF e IL-12, por lo que es posible que células NK y el S. mutans induzcan la respuesta inflamatoria inicial a la caries, para ser una respuesta mediada por células tipo 1. Igualmente el S. mutans puede transformar rápidamente monocitos en células dendríticas maduras en las primeras 24 horas lo que contribuye a la maduración local de CD en pulpas inflamadas.(7)
4.- Linfocitos T En pulpas sanas, se ha observado una mayor cantidad de linfocitos T-CD8 que de linfocitos T-CD4. Se sabe que los linfocitos T-CD8 destruyen células infectadas por virus o células del huésped transformadas ya sea por apoptosis o por medio de la producción de perforinas y que producen INF para aumentar la fagocitosis. Aunque no se ha explicado la presencia de que los T-CD8 en pulpas sanas, estudios recientes han demostrado de linfocitos T-CD8 presentan una mayor capacidad migratoria conjuntamente con las células endoteliales, que los linfocitos T-CD4, por lo que se propone una inmunosupervivencia de los T-CD8.(42) Así mismo se ha demostrado que las células B como tal, no se encuentran como células residentes de la pulpa sana, lo que sugiere que no participan en las fases iniciales de la respuesta inmunológica de la pulpa.(34) Sin embargo, otro estudio sostienen el hecho de que en pulpas sanas hay mayor cantidad de linfocitos T y que a su vez, es mas predominante el linfocitos T-CD8 sobre el T-CD4.(42) En este estudio se utilizaron 23 dientes con diferentes condiciones pulpares (pulpas sanas, pulpitis reversible y pulpitis irreversible). Usando anticuerpos monoclonales y técnica de tinción inmunoperoxidasa indirecta, se evidenció la presencia de linfocitos T y pocos linfocitos B en pulpas sanas. En pulpitis reversible se observaron focos de pocas células inflamatorias, mas que todo neutrófilos y linfocitos, de donde mas del 90% eran linfocitos T con mayor relación de T-CD8 que T-CD4. En contraste, en pulpitis irreversible se demostraron mas focos de células inflamatorias y áreas necróticas o de abscesos; así como mayor cantidad de linfocitos T (T-CD4 y T-CD8) que de linfocitos B.(42) Por otro lado, Freitas y col(43) realizaron estudios similares a los anteriores, con la finalidad de identificar y cuantificar los diferentes tipos de células inflamatorias e inmunocompetentes en la pulpa de dientes permanentes humanos en diferentes condiciones clínicas, demostrando que con la utilización de técnicas de inmunohistoquímicas; se evidenció la presencia de linfocitos T-CD4 y T-CD8 en la pulpa dental normal de dientes no erupcionados, dientes parcial o totalmente erupcionados, resaltando la probable participación de estas células en la inmunosupervivencia del tejido pulpar; por lo que es razonable asumir que la pulpa está equipada con células inmunes aún en la ausencia de comunicación con el medio bucal o estímulos cariosos. En este estudio se observó mayor número de linfocitos T-CD8 que T-CD4 en pulpas no inflamadas, concordando con otros estudios mencionados anteriormente.(43) En la pulpa humana normal, los linfocitos T usualmente expresan CD45RO, el cual es un marcador para linfocitos T de memoria, por lo que la pulpa está formada por éstos. (44)
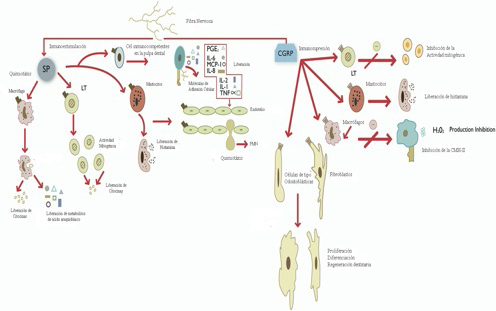
5. Células dendríticas Las células dendríticas son poblaciones hematopoyéticas derivadas de leucocitos, distribuidos en todos los tejidos y órganos del cuerpo. Se caracterizan por su morfología peculiar dendrítica, liberación de la molécula clase II del CMH, alta movilidad, actividad fagocítica limitada y gran capacidad para la presentación de antígenos a los linfocitos T.(13) Durante la respuesta inmunológica primaria, son las únicas células capaces de estimular a los linfocitos intactos. Las CD captan antígenos y luego migran a tejidos linfoides en donde maduran y presentan el antígeno a los linfocitos T cooperadores. Durante la respuesta inmune secundaria, tanto las células dendríticas como los macrófagos con la molécula Clase II del CMH, pueden presentar el antígeno a los linfocitos T de memoria.(45) La fisiología de las DC es funcional y representada por dos estados de maduración íntimamente relacionados con la hemostasia tisular y la inflamación. En el sitio de la lesión, preparación de cavidades o caries, se produce un rápido acumulo de células dendríticas, gracias a la acción quimiotáctica de los neuropéptidos como SP, CGRP y VIP. Por ende, las CD inmaduras pertenecen a la fase innata de la respuesta inmunológica. Se cree que las CD se localizan en la región odontoblástica y en la predentina, donde, una vez captado el antígeno por medio de la liberación de la molécula Clase II del CMH, migran a la región de los nódulos linfáticos para presentar el antígeno a los linfocitos T, por tanto funcionan como CPA. Con esto inician el programa funcional de maduración de CD, el cual incluye la migración de tejidos periféricos a nódulos linfáticos secundarios. Las CD maduras producen una gran cantidad de citocinas como IL-12, IL-1 y TNF- y quimiocinas como CXCL9, CCL2, CCL3, CCL5 y CXCL10 y 11.(46) La importancia de las CD no sólo radica en la inmunosupervivencia y la respuesta inmunológica adquirida, sino también en la diferenciación y regeneración de odontoblastos. Varios estudios, han mostrado estrecha relación de las células que expresan la molécula Clase II del CMH con los odontoblastos y fibras nerviosas localizados en la capa de predentina y odontoblástica, en donde existe una relación dinámica entre las CD y la diferenciación de células similares a odontoblastos después de la lesión. A su vez, el número de CD en la pulpa y fibras nerviosas aumenta en la medida que la caries se profundiza; esto puede explicarse por la propiedad quimiotáctica de los neuropéptidos.(47,49) En conclusión, la pulpa está ocupada con células dendríticas como una subpoblación menor pero distinta de CD que poseen la molécula Clase II del CMH. Su función primaria consiste en monitorear la invasión de antígenos, seguida por la ingestión de estos antígenos por dos vías: 1) migrando a los nódulos linfáticos regionales en donde presentan antígenos a linfocitos T intactos para iniciar la respuesta inmune primaria, 2) presentación de antígenos locales a los linfocitos T de memoria circulantes, cuando estos antígenos de nuevo invaden a la pulpa, lo que correspondería la respuesta inmunológica secundaria.(13)
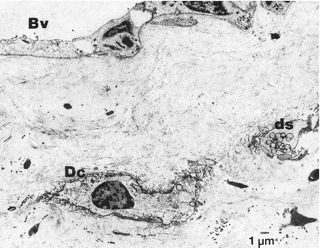
Gráfico 25. Células dendríticas en la pulpa dental. Tomado de Jontell(41)
3.2.6 Interleucinas de la Inmunidad Innata Las bacterias y sus componentes inducen la producción de mediadores polipeptídicos o citocinas inmunes, por células inflamatorias. Entre estas citocinas se incluyen, la IL-1 y y el TNF derivado de linfocitos B, que presentan múltiples actividades en la regulación de la respuesta inmune y la inflamación.(7) La proteína quimiotáctica monocítica 1 (MCP-1) es un miembro de la familia de las quimiocinas que induce a la quimiotáxis de los monocitos en los procesos inflamatorios y la liberación de esta quimiocina puede estar inducida por IL-1 y TNF, por lo que pareciera que la producción local de IL-1 y TNF por células inflamatorias y células endoteliales es una reacción temprana de la fase aguda y que estas citocinas inducen a la producción de MCP-1 en pulpas inflamadas.(40) Las citocinas secretadas por las células de la inmunidad innata incluyen el TNF, IL-1, IL-12, IL-18, INF, IL-6 e IL-10.(7) El TNF y la IL-1, son rápidamente producidas por monocitos/macrófagos activados para reclutar neutrófilos y monocitos al sitio de la infección, por medio de la expresión de moléculas de adhesión que promueven la extravasación de fagocitos durante la inflamación. Así mismo, las paredes celulares de las bacterias gram positivas estimulan la liberación de TNF, mientras que la pared celular de las bacterias gram negativas, específicamente los lipopolisacáridos, inducen a las células de la pulpa a la producción de IL-1 e IL-6.(50,51) El TNF, tiene un potente efecto quimiotáctico para los neutrófilos, así mismo produce vasodilatación y aumento de la permeabilidad vascular produciendo la extravasación de los leucocitos de la sangre al área infectada. Se han observado grandes concentraciones de TNF en pulpitis irreversible sintomática en comparación con pulpas sanas. A medida que esta pulpitis avanza la concentración de TNF disminuye; esto se cree que es por la finalización de la inflamación y el comienzo de la necrosis pulpar.(40,41,49) Barkhodar y col, 2002;(53) han demostrado por medio de ensayos biológicos de dientes con caries y usando la técnica de inmunohistoquímica, que la pulpa presenta niveles elevados de IL-1, liberada por los macrófagos pulpares que se encuentran en el estroma del tejido conectivo. La IL-1, es la forma activa predominante de esta citocina y parece ser importante en la patogénesis de la inflamación pulpar crónica, por lo que se realiza un estudio con la finalidad de determinar los niveles de IL-1 derivados de pulpas sanas y de pulpas crónicamente inflamadas y determinar el efecto exógeno de IL-1 en la síntesis de colágeno de fibroblastos cultivados.(54,55,56) Se extrajeron los fibroblastos de pulpas sanas, de pulpas enfermas y del tejido gingival, para hacer cultivos. Los resultados hallados en este estudio miden los niveles de IL-1 en cada grupo y demuestran mayor cantidad de IL-1 en pulpas enfermas, casi 3 veces mas que en pulpas sanas. También se ha demostrado que los niveles de IL-1 en la pulpa dental aumentan en presencia de LPS de Porphyromonas endodontalis, por lo que esta citocina está directamente involucrada en la respuesta pulpar inflamatoria a la invasión bacteriana. En cuanto a la síntesis de proteínas, este estudio mostró que los fibroblastos de pulpas enfermas tienen mayor síntesis de colágeno, lo cual puede responder a pulpas crónicamente inflamadas que se convierten en fibróticas y calcificadas; concluyendo que IL-1 estimula la síntesis de colágeno tipo I por parte de fibroblastos pulpares. (53,54,55,56) (Gráfico 26)
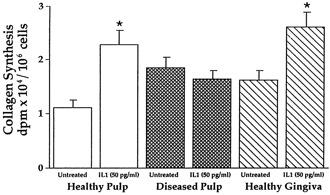
Gráfico 26. Síntesis de colágeno por fibroblastos pulpares y gingivales en presencia de IL-1. Tomado de Barkhodar(53)
La IL-10 es producida por macrófagos activados y a su vez tiene un efecto autocrino sobre las funciones de estos macrófagos y células dendríticas que controlan las reacciones inmunes innatas y la inmunidad mediada por células. Las bacterias presentes en la caries dental profunda, tales como lactobacilos, están negativamente asociadas con sensibilidad térmica. En algunas situaciones clínicas se pueden encontrar dientes con pulpas vitales y caries profunda, que no responden a cambios térmicos; esto se debe al efecto supresor de los ácidos orgánicos producidos por estas bacterias y en parte por la inducción de IL-10 y células T reguladoras.(13) Las bacterias del grupo de los Lactobacilos inducen a una gran producción de IL-10 por medio de su adhesión a las CD inmaduras, activando a las células T supresoras. Adicionalmente los Lactobacilos generan CD tolerantes, el cual es un fenotipo caracterizado por el aumento de marcadores coestimuladores y la baja expresión de citocinas proinflamatorias. Estas CD tolerantes contribuyen a la producción in vivo de células T supresoras (TREG), por lo que este tipo de citocina por el contrario, tiene un efecto supresor, en vez de estimular al sistema inmune. La IL-6, es secretada por varios tipos de células en respuesta a microorganismos o varios tipos de citocinas, particularmente IL-1 y TNF. La IL-6 estimula la síntesis de proteínas de la fase aguda como proteína C reactiva, que aumenta la tasa de fagocitosis y suero amieloide lo que influencia la adhesión, migración, proliferación y agregación. Así mismo, también estimula la producción de neutrófilos de la médula ósea en la inmunidad innata. Además participa en la inmunidad adquirida, ya que induce la diferenciación permanente de las células B a células plasmáticas que producen anticuerpos. La IL-6 junto con IL-1 es secretada cuando las células pulpares se encuentran con bacterias Gram positivas, por lo que IL-6 puede ser importante en la etapa tardía de la pulpitis, cuando el número de linfocitos B aumenta. La pared celular de las bacterias Gram positivo estimula la síntesis de TNF e IL-6. El Peptidoglucano es el mayor componente de la pared celular de las bacterias Gram positivas y una delgada capa también está presente en las bacterias Gram negativas. Por otro lado, el lipopolisacárido es el mayor componente de la pared celular de las bacterias Gram negativas e induce a la producción de citocinas como IL-6, IL-8 e IL-1. La IL-12, es mayormente secretada por células dendríticas y macrófagos; su función es estimular la producción de INF por medio de células T activadas y NK. El INF activa a los macrófagos para destruir microorganismos fagocitados, al igual que activa a otras células presentadoras de antígenos. Igualmente potencia muchas de las acciones del TNF en células endoteliales, las cuales incluyen la adhesión y extravasación de linfocitos T al sitio de infección. El INF, también es secretado por linfocitos T activados y es importante en la respuesta inmune adquirida.(13) 3.2.7 Quimiocinas en la pulpa dental Son mediadores inflamatorios, los cuales atraen al sitio de infección leucocitos y estimulan su migración extravascular; las quimiocinas no sólo dirigen la migración de neutrófilos y monocitos, sino que también atraen a células dendríticas inmaduras y activan linfocitos T de memoria y efectores durante la infección.(7) La interleucina 8 (IL-8), es una citocina quimiotáctica para neutrófilos y es producida por una gran variedad de células incluyendo fibroblastos, monocitos, queratinocitos, hepatocitos y células endoteliales. El efecto de la IL-8 sobre los neutrófilos, consiste en inducir a la degranulación y la liberación de enzimas que causan la destrucción tisular.(57,58) La IL-8 también afecta otros tipos de células además de los neutrófilos, como los linfocitos T, linfocitos B, Células Natural Killer activadas por la IL-2 y basófilos. Se ha determinado la presencia de IL-8 en pulpas normales y en pulpas irreversiblemente inflamadas, por medio del ensayo inmunoenzimático (ELISA), inmunohistoquímica y análisis de Northern Blot; los resultados revelan un aumento significativo de la IL-8, en 71% de las pulpas inflamadas (10/14) en comparación con 53% de las pulpas normales (8/15). La IL-8 fue liberada por los odontoblastos, aunque fue mas predominantes su liberación en macrófagos y linfocitos sobre todo cuando se refiere a pulpas inflamadas.(57,58) La inflamación pulpar se manifiesta debajo de la caries antes de que los microorganismos invadan el tejido pulpar. Esta reacción consiste en la acumulación de leucocitos en el tejido subodontoblástico por debajo de la lesión cariosa. Es posible que las bacterias y sus productos como lipopolisacáridos, puedan estimular y aumentar la producción de la IL-8 por parte de odontoblastos para reclutar leucocitos. A medida que la caries progresa, mas células pulpares se ven involucradas en la producción de IL-8. Esto resulta en la formación de microabscesos, caracterizados por un acumulo de neutrófilos que puede ceder y dar lugar a la inflamación crónica con macrófagos y linfocitos como células predominantes. Como se mencionó anteriormente, las bacterias se relacionan con la liberación de IL-8. Los lipopolisacáridos de las bacterias Gram negativas como P. intermedia, liberan la IL-8 y ésta es producida por fibroblastos pulpares. En los fibroblastos gingivales, hay una liberación de IL-8 llegando a un máximo nivel a las 12h, en comparación con fibroblastos pulpares en donde su liberación se inicia a las 2h y llega al máximo nivel de 4 a 8h. Debido a que la pulpa dental está rodeada por dentina, su propiedad de expansión es limitada, a diferencia del tejido gingival. Igualmente, la pulpa carece de circulación colateral a pesar de que hay algunos vasos sanguíneos que suplen la pulpa por medio de conductos accesorios; sin embargo, esto no se considera una circulación colateral óptima como la de otros tejidos conjuntivos. Es por esto, que los fibroblastos pulpares son mas sensibles a la liberación de IL-8 en presencia de pequeñas cantidades de estímulo bacteriano.(57,58) A medida que la inflamación pulpar se hace mas notable e irreversible, se inicia una respuesta inmune adquirida, la cual es específica de acuerdo al antígeno y ayuda a aumentar los mecanismos protectores de la inmunidad innata no específica.
3.3 Inmunidad Adquirida de la pulpa dental Es también conocida como inmunidad adaptativa o específica, para enfatizar el hecho de que esta respuesta protectora potente se adquiere o aprende como consecuencia de la experiencia. La inmunidad adquirida incluye linfocitos (células T y B) y sus productos, los cuales incluyen las quimiocinas ya mencionadas, las citocinas y los anticuerpos. El resultado final de la inmunidad adquirida es la respuesta inflamatoria exagerada (inflamación inmune) intentando eliminar la infección. Sin embargo, si la fuente de infección (caries) no es eliminada, la inflamación inmune pulpar evidentemente conlleva a la destrucción irreversible de la pulpa.(11,13,59)
3.3.1 Células de la inmunidad Adquirida 1. Células presentadoras de Antígeno (CPA) En primera instancia contamos con las CPA, las cuales captan, procesan y presentan antígenos a las células T. Estas células pueden clasificarse en: CPA profesionales que poseen la capacidad única para activar e inducir la expansión clonal de células T, simples y de memoria; y CPA no profesionales que incluyen células (células B, monocitos, macrófagos y células endoteliales) capaces de liberar el complejo mayor de histocompatibilidad Clase II y de interactuar localmente con las células T de memoria.(59) Se debe recordar que la expansión clonal se refiere a la migración, proliferación y diferenciación de timocitos en células dobles negativas, por medio de la selección negativa y luego a células dobles positivas, en donde los timocitos poseen moléculas en su membrana y pueden coexpresar CD4 y CD8. Posteriormente los timocitos pasan a ser simples positivos en el cual su fenotipo será CD4 o CD8, sucediendo a la selección positiva, en donde los timocitos presentan el receptor de membrana TCR específico; aquellos que no lo presentan morirán por apoptosis. Por último se produce la anergia clonal, en donde aquellos clones T con capacidad autorreactiva que no hayan sido eliminados durante la selección negativa serán silenciados; esto significa que pueden reconocer autoantígenos pero serán incapaces de activarse y producir una respuesta inmune. En conclusión, los linfocitos T maduros que salen a la sangre periférica, migran a los órganos linfáticos secundarios, tienen fenotipo CD4 o CD8 y pueden reconocer péptidos extraños presentados en moléculas del complejo mayor de histocompatibilidad; a esto se le conoce como expansión clonal.(4) 2. Células dendríticas Las células dendríticas son migratorias y son las células mas efectivas en la presentación antigénica. Los macrófagos tienen una profunda capacidad para la fagocitosis, pero el bajo nivel de liberación de la molécula de histocompatibilidad clase II (MHC-II) en macrófagos activados, explica por qué estas células son menos eficientes en la presentación antigénica y en la estimulación de células T. En las células B, proteínas solubles antigénicas se les unen a la molécula de Ig de la membrana que luego son internalizados, procesados y presentados como antígenos a las células T-CD4 durante la respuesta inmunológica humoral. Las células dendríticas y macrófagos participan en los estadios tempranos de pulpitis, mientras que las células B aumentan en la pulpitis irreversible.(59) 3. Macrófagos En la inflamación, los macrófagos tienen tres funciones principales: 1) presentación de antígeno como se mencionó anteriormente, 2) fagocitosis, 3) inmunomodulación, a través de la producción de citocinas y factores de crecimiento. Los macrófagos activados producen el TNF, la IL-1, la IL-12, la IL-10, las quimiocinas y los mediadores lipídicos, como factor activador de plaquetas, prostaglandinas y leucotrienos para orquestar la inflamación local.(59)
Gráfico 27. Macrófagos. Tomado de http://autorneto.com/referencia/salud-y-bienestar/sistema-inmune/ 16.11.2009, 12:00am
4. Linfocitos Por otro lado, la inmunidad adquirida también cuenta con linfocitos como células principales. Después de que estas células quedan activadas por antígenos presentados por las CPA, ellos secretan citocinas y se diferencian en varias células efectoras como linfocitos T-CD4, linfocitos T-CD8 y células de memoria o reguladoras. Los linfocitos T-CD4, comienzan a activarse a medida que la infección se continua en el tejido pulpar coronario y radicular; estos linfocitos son activados por macrófagos y se inicia una respuesta inmune mediada por células. Se ha demostrado que la relación de CD4/CD8 en pulpas irreversiblemente inflamadas, es mayor cuando se compara con pulpas normales. Mientras la respuesta inflamatoria continúa, la integridad estructural de la vasculatura pulpar se ve comprometida, ocurre una destrucción del tejido pulpar y la respuesta inmune comienza a ser menos efectiva en la remoción de bacterias. La pulpa necrótica y las bacterias residuales sirven de nido y nutrición para la formación de la lesión periapical.(59) La naturaleza de la respuesta adquirida es determinada por la precedida reacción inmune innata. Las células dendríticas inmaduras son capaces de polarizar las células T-CD4 en subtipos funcionales o subpoblaciones asociadas a determinada producción de citocinas como los linfocitos T-cooperadores 1 (Th1) o linfocitos T-cooperadores 2 (Th2) dependiendo de la dosis, afinidad, naturaleza del antígeno y el tipo y concentración de citocina en el tejido. Las células Th1, secretan IL-2 e INF mientras que los clones Th2, producen IL-4, IL-5, IL-6, IL-13 e IL-10. También se ha descrito una subpoblación que produce un patrón de citocinas mixto, constituido por la IL-2, INF e IL-4 denominada Th0, la cual se cree que podría ser la precursora de las subpoblaciones Th1 y Th2.(4,59) Está demostrado que los clones Th1 median respuestas celulares inflamatorias, tales como hipersensibilidad retardada (HR), por medio del INF y la citotoxicidad por linfocitos CD8 frente a la acción de la IL-2 y el INF. Este ultimo también induce la producción de anticuerpos fijadores de complemento y opsonizantes.(36)
3.3.2 Interleucinas de la inmunidad adquirida en la pulpa dental La IL-2 es una citocina secretada por linfocitos T-CD4; actúa para estimular la proliferación de células T, activa células NK y promueve la función de células B a través de la activación de células T cooperadoras. Los linfocitos T activados, asisten a las células B para reconocer antígenos y diferenciarse en células plasmáticas productoras de anticuerpos. Estas actividades enfatizan la importancia de la IL-2 en la respuesta inmunológica y se sugiere que pueden cumplir un papel principal en la inflamación pulpar.(60) Diversos autores proponen analizar los niveles de IL-2 en la pulpa, como indicador de inflamación pulpar y así obtener diagnósticos clínicamente aceptables. Se realizó un estudio (60) usando un estuche para la medición de IL-2 humana en 80 muestras de tejido pulpar recientemente extraído. Las muestras se dividieron en 3 grupos: Grupo 1 pulpa normal (24 muestras) Grupo 2 pulpitis irreversible (32 muestras) y Grupo 3 pulpa necrótica (23 muestras). Los resultados indican niveles elevados de IL-2 en los pacientes que presentaban pulpitis irreversible y pulpa necrótica. A comienzos de los años 1990, los investigadores descubrieron tres subpoblaciones de linfocitos CD4. Las células Th1, que poseen la capacidad para secretar la IL-2 y el INF, mientras que las células Th2 secretan la IL-4, IL-5 e IL-10. Una tercera subpoblación fue designada como Th0, estas células fueron inicialmente consideradas células Th1 o Th2 indiferenciadas; sin embargo, otros estudios demostraron la capacidad de estas células para producir tanto IL-2 como IL-4 a través de la influencia de la prostaglandina E2 (PGE2). Esto indica la participación de diferentes subpoblaciones linfocitarias en la inflamación pulpar.(59) Por otra parte, se ha demostrado que la PGE2 inhibe la producción de las citocinas de Th,1 mas no de las citocinas de Th2. La presencia de PGE2 en pulpas inflamadas está bien establecida, y tiene diversos efectos en el sistema inmune, tales como la inhibición de IL-2 e INF, la supresión de la actividad de células NK y la inhibición de la producción de IL-1 por parte de macrófagos. Las células presentadoras de antígenos como los macrófagos, secretan la IL-1 para estimular las células Th1 y a su vez éstas células secreten IL-2.(49) La acción local de PGE2 en pulpas inflamadas puede teóricamente aumentar la producción de las citocinas producidas por linfocitos Th2. Sin embargo, las células Th0 son capaces de producir citocinas de Th1 o Th2 sin un cambio permanente en la presentación fenotípica. Estas observaciones sugieren que en presencia de PGE2, las células Th2 o Th0 son responsables de la producción de citocinas; mientras que las células Th1, las cuales producen IL-2, son inhibidas por la PGE2 y por ende no están activadas. Estos datos, apoyan fuertemente los intentos de determinar los niveles de citocinas Th2 como la IL-4, IL-5 e IL-10 que están presentes en pulpas inflamadas. Se han observado en diversos estudios la presencia tanto de IL-6 como IL-8 en pulpas inflamadas y en tejidos periapicales.(60,61) Adicionalmente, los clones Th2 son potentes inductores de la respuesta humoral. La IL-4 y la IL-13 estimulan la producción de anticuerpos neutralizantes del tipo IgG, mientras que la IL-4 sólo conduce la producción de la IgE. La IL-4, IL-13 e IL-10, actúan como reguladores negativos de la inflamación. Es por esto que las citocinas secretadas por Th1 y Th2 son mutuamente inhibitorias al nivel de las células T. El INF producido por los clones Th1 inhiben la proliferación de los linfocitos Th2, mientras que la IL-10 producida por los linfocitos Th2, inhibe la proliferación de los Th1. De ahí se explica la regulación entre citocinas.(4) También se ha determinado que la IL-5, activa eosinófilos que participan en la eliminación de parásitos. Las citocinas producidas por Th2 suprimen la activación de macrófagos y estimulan la proliferación de células B para su diferenciación en células plasmáticas. En pulpas inflamadas, los niveles de citocinas tanto de Th1 como Th2, se encuentran elevados. Al igual que los linfocitos T-CD4, los linfocitos T-CD8 pueden clasificarse en subpoblaciones de T citotóxico 1 (Tc1), T citotóxico 2 (Tc2) y CD8 de regulación (Treg), de acuerdo igualmente al patrón de la citocina. Las células Tc1 secretan INF, las Tc2 secretan IL-4 e IL-5 y las células T-CD8 reguladoras (Treg) secretan IL-10 para suprimir la respuesta inmune. Ambas Tc1 y Tc2 inducen reacciones inflamatorias fuertes y Tc2 es mas potente en aumentar la proliferación de células B pero menos citotóxica que las células Tc1.(48) La distribución de las células Tc1, Tc2 y células CD8 reguladoras (Treg), en la pulpa dental inflamada es desconocida; sin embargo, pocas células T-CD8 más que T-CD4, están presentes en muestras de pulpitis reversible. Esta preferencia de las células T-CD8 puede ser debida a la naturaleza de los antígenos, quimiocinas o citocinas. Estudios recientes han demostrado que cepas de S. mutans activan más células T-CD8 que T-CD4.(40,48) A medida que la caries progresa, aumenta significativamente el número de células B y células plasmáticas encontradas en la pulpitis irreversible, junto con un aumento en la relación de CD8/CD4; esto soporta una respuesta inmune de tipo 2. Aunque las subpoblaciones de células Th1 y Th2 en pulpas inflamadas no han sido identificadas, se puede evidenciar un cambio de la inmunidad celular asociada con caries superficial, a una mezcla de inmunidad celular/humoral en pulpas inflamadas irreversiblemente por debajo de caries profundas. Esto se atribuye a varios factores asociados al hospedero y a los productos bacterianos, puesto que un aumento en los antígenos peptídicos genera un cambio de la respuesta de tipo 1 a la respuesta de tipo 2. Al igual que ocurre un cambio en los tipos de respuesta de acuerdo al avance de la caries y microorganismos presentes, también se ha evidenciado que en estados tempranos existen pocas células B. Esto aumenta a medida que la caries se aproxima a la pulpa junto con un aumento en las células T-CD4.(40,48,50)
3.3.3 Células B y producción de Anticuerpos Las células B, además de ser productoras de anticuerpos, también funcionan como CPA, modulan las funciones de las células dendríticas y producen citocinas como la IL-10, IL-4 y el INF en respuesta a patógenos. Se han realizado estudios(61,62,63) en donde se observa la presencia de células que contienen inmunoglobulinas (IgG, IgA o IgM). Ésto lleva a sugerir que existe una producción local de anticuerpos por parte de la pulpa dental; sin embargo, no se han cuantificado los niveles de inmunoglobulinas en pulpas inflamadas, por lo que se realiza un estudio(10) con la finalidad de cuantificar los niveles de inmunoglobulinas IgG, IgM e IgA, en pulpas normales y en pulpas inflamadas. Para este estudio se utilizaron 33 dientes extraídos por razones ortodónticas o prostodónticas. El primer grupo correspondía a pulpas normales no inflamadas; el segundo grupo constó de 31 dientes extraídos por presentar síntomas de pulpas inflamadas. Posterior a la extracción, se removió el tejido pulpar intacto y se colocó en frascos que contenían solución salina y se enfriaron a -85ºC, se centrifugaron las muestras y se volvieron a enfriar. Los extractos de tejido se reconstituyeron y se analizaron para diferentes inmunoglobulinas IgG, IgA, IgM, C3 y albúmina. Los resultados encontrados indican niveles elevados de IgG, IgA y C3 elevados, en comparación con pulpas no inflamadas, mientras que los niveles de IgM y albúmina disminuyeron, comparándolos con los niveles en pulpas no inflamadas. Este estudio ha demostrado un aumento en la cantidad de inmunoglobulinas IgA e IgG y una aparente disminución en la fracción del complemento C3, cuando se comparan pulpas inflamadas con pulpas normales. También se observó una ausencia en los niveles de IgM en las muestras pulpares; esto se debe a dos posibles explicaciones. En primer lugar, porque las muestras fueron obtenidas de dientes expuestos con caries, en donde se encontraban en un estado crónico de inflamación. Y en segundo lugar, la IgM es una molécula grande pentamérica y esto la hace susceptible al fraccionamiento cuando se emplean métodos de congelación para realizar diferentes estudios.(10) Estos resultados coinciden con los estudios de Pulver y col(36), en donde observaron un aumento en la cantidad de células inmunes a medida que la inflamación pulpar avanza a la vez que la caries, por lo que no es raro encontrar células que producen inmunoglobulinas en dientes con caries. Existe una fuerte relación en la segregación de IgG directamente asociada a la presencia de bacterias. Igualmente, se han observado cantidades de IgE en muestras de pulpas inflamadas, lo cual sugiere la presencia de componentes para una reacción de hipersensibilidad de tipo I anafiláctica, debido al contenido de mastocitos en pulpas inflamadas. Existen controversias en cuanto a la presencia de mastocitos en la pulpa, sin embargo, se ha demostrado la existencia de histamina en el tejido pulpar, la cual se almacena principalmente en mastocitos. La histamina, participa directamente en la vasodilatación y por ende en la inflamación pulpar. Estos hallazgos, mas la presencia de IgE sugiere que los componentes necesarios para las reacciones de hipersensibilidad de tipo anafiláctica, pueden estar presentes en pulpas inflamadas.(62,63,64)
3.3.4 Relación entre los microorganismos y la producción de citocinas La presencia de inmunoglobulinas en la pulpa, como se mencionó anteriormente, está relacionada con la presencia de microorganismos. Falkler y col en 1987,(62) realizaron un estudio en donde se evalúan las inmunoglobulinas reactivas de 17 microorganismos aislados en fluídos de cultivos pulpares por medio de la técnica de ELISA. Los microorganismos utilizados fueron Streptococcus mutans, Actinomyces naeslundii, Lactobacillus casei, Actinomyces iraelii, Eubacterium alactolyticum, Peptostreptococcus micros, Veillonella parvula, Eubacterium brachy, Eubacterium nodatum, Capnocytophaga ochracea, Bacteroides intermedius, Peptostreptococcus anaerobius, Fusobacterium nucleatum, Peptostreptococcus magnus y Actinomyces viscosus. Se observaron niveles estadísticamente significativos de anticuerpos reactivos anti-S. mutans y L. casei, en pulpas con respuesta positiva al frío cuando se compararon con aquellas pulpas normales o que respondían tanto al frío como el calor. Ésto indica que las inmunoglobulinas están presentes en la pulpa y reaccionan con los microorganismos implicados en el proceso carioso. Por otro lado Hahn y col(63), también evalúan por ELISA la presencia de moléculas de inmunoglobulina en fluidos sobrenadantes de cultivos pulpares, que reaccionan con microoganismos implicados en infecciones del conducto radicular. Se observó la reactividad a 6 tipos de microorganismos frecuentes en lesiones cariosas. Entre los microorganismos usados se encuentran, L. casei, L. acidophillus, S. mutans, B. intermedius, E. brachy y E. alactolyticum. Se reveló la existencia de inmunoglobulinas en especial de IgG, tanto en las muestras de pulpas normales como en pulpas inflamadas. La presencia de anticuerpos en la pulpa normal, sugiere una posible función protectora de estos anticuerpos durante la invasión de microorganismos en el proceso carioso.(57) Así mismo, Nakanishi y col(47), comparan por medio de métodos para la recolección de sangre pulpar, los niveles de Ig (IgG, Iga e IgM) elastasa, prostaglandina E2 y citocinas como IL-1. IL-1 y TNF en pulpas clínicamente inflamadas, con pulpas normales. En este estudio, a diferencia de otros se tomó como muestra la sangre pulpar en lugar de todo el tejido pulpar y se encontraron diferencias significativas en los niveles de IgG, IgA e IgM entre pulpa inflamada y no inflamada. En pulpas inflamadas se observaron niveles elevados de IgG (3.81mg/ml) seguidas por IgA (0,33mg/ml) y bajos niveles de IgM. También se observaron inmunoglobulinas en pulpas no inflamadas en sangre periférica, pero con menor concentración, IgG (1,82mg/ml) e IgA (0,18mg/ml).(16) La elastasa una proteasa sérica natural, es un componente granular lisosomal de los leucocitos polimornucleares (PMNs). La liberación de elastasa con la degranulación del PMNs, elimina las bacterias, sin embargo este proceso resulta en la degradación simultánea de proteoglicanos y colágeno tipo III, el mayor componente extracelular de la pulpa dental. Este proceso puede contribuir con la destrucción pulpar. En este estudio se observó que los niveles de elastasa crecen a medida que aumenta la inflamación. En cuanto a las prostaglandinas, la PGE2 induce muchos efectos inflamatorios incluyendo dolor, vasodilatación, aumento de la permeabilidad vascular y migración leucocitaria. Al igual que la elastasa, los niveles de PGE2 aumentan conforme se establece la inflamación pulpar, así como la liberación de citocinas como la IL-1, la IL-1 y el TNF; todo esto representa marcadores específicos de un estado de inflamación pulpar y pueden ser usado como métodos auxiliares para el diagnóstico de pulpitis irreversible.(61) Generalmente, el dolor pulpar está asociado con inflamación pulpar. La mayoría de los mediadores inflamatorios tales como las prostaglandinas activan y sensibilizan las neuronas periféricas. La hiperalgesia y alodinia, es responsable de muchos síntomas como dolor pulsátil, espontáneo y sensibilidad a la percusión. Sin embargo, algunas pulpitis son indoloras y presentan un estado de inflamación crónico. Se sabe que factores locales derivados del huésped y factores bacterianos, modulan la intensidad del dolor, lo que explica la discrepancia entre los síntomas clínicos con el estado histopatológico de la pulpa. Entre estos factores se incluyen opioides endógenos.(48)
3.3.5 Pulpitis indolora Los opioides endógenos, son producidos por linfocitos y encefalinas inducidas por bradiquininas en pulpas inflamadas, que suprimen la sensación dolorosa.(65) En pulpas normales, se ha demostrado la presencia de opioides endógenos tales como -endorfinas, dinorfin y somastotin. Los opioides endógenos aumentan tras la estimulación con bradiquinina y después del movimiento ortodóntico. Algunos estudios reportan concentraciones elevadas de -endorfinas y de somastotin en pulpas inflamadas; esto da como resultado un estado de pulpitis no dolorosa que muchas veces puede confundir el diagnóstico con necrosis pulpar. (65,66,67)
3.4 Mecanismo Inmunopatológico de la periodontitis apical La infección de la pulpa dental ocurre como resultado de caries, trauma y procedimientos operatorios y pueden resultar en necrosis pulpar y en ocasiones con pérdida ósea perirradicular. Los clásicos estudios de Kakehashi en 1965, demuestran la relación entre la infección bacteriana de la pulpa dental y la formación de la lesión periapical. En estos estudios, la exposición mecánica e infección de la pulpa por bacterias provenientes de la cavidad bucal, resultan en la formación y desarrollo de lesiones periapicales.(69,70,71) Los microorganismos de conductos radiculares infectados pueden afectar directamente los componentes celulares y estructurales del hueso periapical por medio de la liberación de sus productos de desecho nocivos y proteolíticos. Estos bioproductos bacterianos pueden desencadenar una respuesta inmunológica que daña los tejidos del huésped.(72) Las lesiones periapicales, las cuales se forman como resultado de la infección del conducto radicular, se caracterizan por la respuesta del hospedero ante la continua estimulación antigénica en conductos infectados y la destrucción ósea periapical.(73,74)
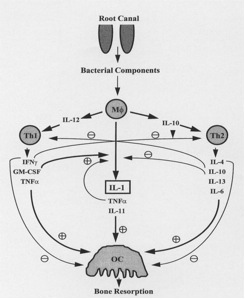
Gráfico 28. Patogénesis de la periodontitis apical. Tomado de Stashenko(61)
La periodontitis apical es una respuesta inflamatoria e inmunológica local, ante la infección pulpar; es una reacción que actúa como una segunda línea de defensa con el objeto de localizar la infección en los confines del sistema del conducto radicular. Dependiendo de la intensidad y duración del estímulo, la lesión perirradicular puede ser aguda o crónica.(75)
3.4.1 Periodontitis apical aguda En la periodontitis apical aguda, se contempla una respuesta inmune innata para mantener la salud periapical, en donde células epiteliales y células endoteliales del ligamento periodontal, expresan bajos niveles de moléculas de adhesión y quimiocinas que generan un estímulo para la atracción y activación de macrófagos y polimorfonucleares; se inicia con la vasodilatación, congestión vascular, edema, extravasación de macrófagos y leucocitos neutrófilos en el ligamento periodontal.(76) A su vez se observa una disrupción de la lámina dura y una limitada resorción ósea. Con esta primera línea de defensa la invasión de microorganismos puede limitarse, sin embargo, la virulencia de los mismos pueden darles acceso al forámen apical y establecerse en la superficie externa de la raíz.(77,78,79) Una vez que las bacterias y sus productos logran llegar al forámen apical y salen de la raíz, se activa la primera línea de citocinas proinflamatorias tales como la IL-1 y el TNF; así como moléculas de adhesión y quimiocinas, que inducen al infiltrado abundante de células inflamatorias hacia el ligamento periodontal. La IL-8 (quimiocina), se ha encontrado en el citoplasma de los restos epiteliales de Malassez y la proteína quimiotáctica para monocitos 1 (MCP-1) se encontró en las células endoteliales. Estas células nuevas reclutadas propagan y prolongan la expresión de moléculas de adhesión y quimiocinas.(81,82,83)
3.4.2 Periodontitis apical crónica La periodontitis apical crónica representa un balance dinámico entre agentes irritantes exógenos, generalmente la microbiota del conducto radicular y sus productos y los mecanismos de defensa del huésped que no fueron capaces de eliminar por completo los factores patogénicos, formando una barrera tanto funcional como histológica, que previniese la invasión. La lesión crónica, llamada granuloma perirradicular está constituido por polimorfonucleares neutrófilos y elementos fibrovasculares. Está formada por varias capas, zona necrótica, zona exudativa, zona granulomatosa y zona fibrosa. (81) (Gráfico 29)
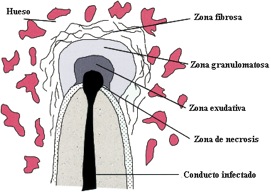
Gráfico 29. Zonas de la lesión periapical crónica. Tomado de Kiss(81)
La progresión de la inflamación pulpar crónica, es capaz de formar una lesión periapical de origen endodóntico, si se deja sin tratar. La mayor diferencia entre la respuesta pulpar a la inflamación crónica y la respuesta periapical, radica en la observación de que la pulpa carece de células B necesarias para activar la respuesta humoral del proceso inflamatorio.(86,87,88) Las características histopatológicas de las lesiones periapicales, son las mismas observadas en otros tejidos de granulación que se forman de tejido conjuntivo circundante al área lesionada.(89) Un rasgo común de las lesiones periapicales es la exudación persistente de gran cantidad de células inmunocompetentes como PMNs, macrófagos, linfocitos, células plasmáticas, células gigantes, células NK y mastocitos. Los PMN y los macrófagos son importantes tipos celulares que están involucrados en la inmunidad innata mediada por células, las cuales fagocita y opsoniza microoganismos y células muertas. Las células T y B son componentes celulares predominantes en las lesiones periapicales humanas. Estas células cumplen su función central en la respuesta inmune antigénica específica. Numerosos estudios sugieren que tanto la respuesta inmune humoral como la celular, son importantes en la patogénesis de las lesiones periapicales. Los componentes estructurales de las lesiones, dependen del balance entre los microorganismos y las defensas del huésped. Cuando la lesión incluye neutrófilos, no sólo ataca y destruye los microorganismos, sino que también libera leucotrienos y prostaglandinas. Los leucotrienos atraen mas neutrófilos y macrófagos a la zona y estos macrófagos activan los osteoclastos provocando pérdida ósea.(90) (Gráfico 30) 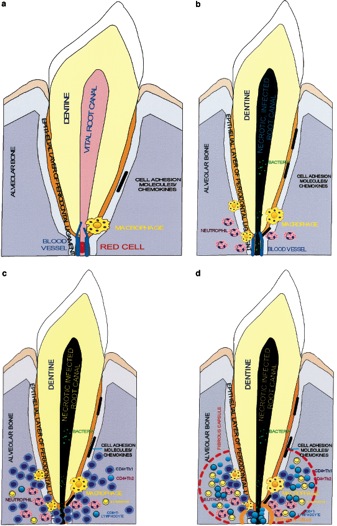
Gráfico 30. Progresión de la periodontitis apical. Tomado de Kiss(81)
3.4.3 Neuropéptidos en la periodontitis apical Los neuropéptidos se han asociado con el desarrollo de lesiones periapicales crónicas, como resultado de la densa inervación de este tejido. El neuropétido VIP puede participar en el proceso de crecimiento y maduración de la lesión, ya que se ha asociado con la resorción ósea y la regulación de las funciones osteoclásticas. Se ha observado que tanto osteoblastos como osteoclastos están constituidos por receptores de VIP, por lo que se considera que éste neuropéptido, regula la resorción ósea. La presencia del VIP en las lesiones periapicales ha sido recientemente reportada, y sus niveles son inversamente relacionados con el tamaño de la lesión, por lo que se ha hipotetizado que el neuropéptido VIP, participa en la regulación del crecimiento de las lesiones periapicales. (Gráfico 31)
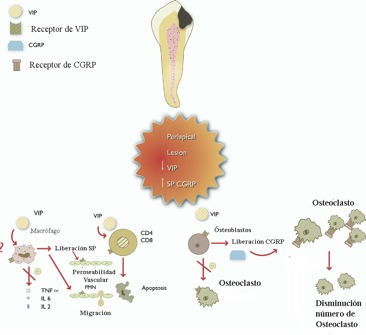
Gráfico 31. Participación de Neuropéptidos en la periodontitis apical. Tomando de Caviedes-Bucheli(20)
Se ha demostrado en diversos estudios la presencia de variadas células inflamatorias e inmunocompetentes en las lesiones periapicales. Estas observaciones indican, que un gran rango de reacciones de defensa incluyendo la inmunidad humoral, la inmunidad mediada por células y las reacciones inflamatorias no específicas, se encuentran funcionando en las lesiones periapicales.(93)
Durante los estados mas tardíos de la respuesta aguda, los macrófagos comienzan a aparecer a la altura del periápice. Se ha demostrado que éstos tienen una función importante en el desarrollo de la lesión perirradicular, así como también perpetuando las lesiones inflamatorias crónicas por medio de la activación de las respuestas inmunológicas humoral y celular. Los macrófagos producen una gran variedad de mediadores y citocinas proinflamatorias y quimiotácticas. Éstas citocinas intensifican la respuesta vascular local, la resorción ósea osteoclástica y la degradación de la matriz extracelular.
La respuesta aguda puede intensificarse con la formación de complejos antígeno-anticuerpo. Si los irritantes persisten y no son removidos se produce una transformación de una lesión con predominio de neutrófilos, a una lesión constituida por macrófagos, linfocitos y células plasmáticas encapsulas en un tejido conectivo colagenoso.
3.4.4 Células de la periodontitis apical y la producción de citocinas Los macrófagos son las células inmunocompetentes mas dominantes durante todas las etapas de la lesión perirradicular; estas células participan en diversas funciones como fagocitosis de cuerpos extraños y presentación de antígenos, por lo que actúan en la inmunoinducción de células, la producción de sustancias activas biológicas tales como enzimas, prostaglandinas y citocinas. En las lesiones periapicales se han encontrado la IL-1 y el TNF en niveles elevados, coincidiendo con niveles igualmente elevados de macrófagos; por lo que se asocia la secreción de éstas citocinas con los macrófagos.(82) La IL-1, constituye el mayor componente (aproximadamente entre 60%-80%) del factor activador de osteoclastos. Tanto la IL-1 como el TNF son principalmente producidos por el sistema fagocítico mononuclear. Se realiza un estudio(82), con muestras de tejido de 10 pacientes con dientes no tratados y granulomas periapicales establecidos histológicamente con microscopio electrónico y de luz y análisis inmunohistoquímico con anticuerpos monoclonales para IL-1 y TNF. Se encontraron pocas células en los granulomas periapicales que fueron positivos para IL-1 y TNF, lo cual indica que sólo una pequeña fracción de monocitos/macrófagos están en un estado activo de producción de citocinas. Esto sugiere una producción limitada de estas citocinas durante la inflamación crónica del tejido y explicaría porque puede haber resorciones óseas limitadas en los granulomas periapicales. Las células positivas para el TNF fueron encontradas principalmente en las zonas periféricas del tejido de granulación, mientras que las células positivas para IL-1 fueron encontradas principalmente alrededor de los linfocitos. Esto sugiere que estas últimas pueden actuar de manera paracrina para activar las células linfoides. El hecho de que la mayoría de los macrófagos resultaran negativo para la IL-1 y TNF, indica que la actividad fagocítica no está asociada con la producción de citocinas. Otro factor que actúa en la resorción ósea es el receptor activador del factor nuclear kB (RANKL), el cual cumple una función importante en la resorción ósea alrededor del ápice. El factor RANKL es requerido para la diferenciación y activación de osteoclastos (osteoclastogénesis).(83,89) En áreas periapicales inflamadas, así como en cualquier enfermedad inflamatoria, se pueden generar dos patrones de respuesta, Th1, caracterizado por la producción e IL-2, IFN y Th2, caracterizado por la producción de IL-4, IL-5, IL-6, IL-10 e IL-13. Se ha demostrado que Th2 domina en las lesiones regenerativas periapicales, mientras que en los tejidos de granulación la respuesta predominante es de Th1. A su vez, en las lesiones periapicales se observan niveles mas elevados de RANKL en comparación con los tejidos periodontales clínicamente sanos. Cuando se comparan quistes, con granulomas hay mayor cantidad de RANKL en granulomas que en quistes, lo que sugiere mayor actividad resortiva.(83). Los macrófagos también pueden activar a las células T, las subpoblaciones de células T- cooperadoras y las células B para la producción de anticuerpo.(85)
El impacto de las células Th1 y Th2 en la resorción ósea asociada con lesiones periapicales, no está completamente dilucidado y se han reportado resultados controversiales. La resorción ósea inflamatoria puede estar aumentada por mediadores de Th1 como INF y disminuida por mediadores de Th2 como IL-10 e IL-4. Sin embargo, debido a un aumento en RANKL, un marcador de la respuesta de Th1, sugiere que Th1 puede modular la expresión de RANKL y la osteogénesis en los granulomas.(87) Recientemente, se ha descrito un nuevo tipo de célula T llamada Th17. Se ha reportado que IL-17, un tipo de citocina derivado de Th17 es detectable en el fluido crevicular gingival. Th17, también regula la osteoclastogénesis, posiblemente por medio del RANKL inducido por la IL-17. La IL-17 es un tipo de citocina que es producida casi exclusivamente por células T activadas y es un nuevo tipo de subpoblación de las células T efectoras llamada Th17, la cual es distinta de los subtipos Th1 y Th2. La IL-17 es una citocina proinflamatoria con potentes efectos en numerosas células inflamatorias del sistema inmune innato, particularmente el linaje de granulocitos y se considera una importante molécula de unión entre la respuesta innata y adquirida. Las funciones proinflamatorias de la IL-17 se han examinado en varios contextos. En estudios "in vitro" se ha demostrado que la IL-17 activa fibroblastos, células epiteliales, células endoteliales y osteoblastos para producir citocinas proinflamatorias como IL-6, IL-8, factor estimulador de colonias de granulocitos y matriz de metaloproteinasas.Esta citocina cumple una función esencial en la activación y maduración de neutrófilos y hemostasia. Igualmente puede promover la resorción ósea por medio de la estimulación de osteoblastos que producen el receptor activador del factor nuclear kB (RANKL), que afecta la actividad y formación de osteoclastos. En la patogénesis de las lesiones periapicales, se ha observado una rápida expansión y resorción ósea desde el día 0 al 14, lo que se denomina fase activa. Otro hallazgo significativo es que se evidenció la presencia de IL-17 en todas las etapas de la periodontitis apical, sugiriendo que ésta citocina es importante en la iniciación y desarrollo de las lesiones periapicales.(87) En granulomas periapicales la cantidad de linfocitos T citotóxicos/supresores TCD8, aumenta para contribuir con la eliminación mas efectiva de las células infectadas y destruidas o para suprimir la intensidad de las reacciones inflamatorias o ambas.(81) A su vez, se ha determinado la presencia de inmunoglobulinas y complemento en las lesiones periapicales, siendo la mas abundante la IgG seguida por la IgA y la IgE, mas no se observó la IgM, y también se determino la presencia de C3.(86,87)
DISCUSIÓN El tejido pulpar es un tejido conjuntivo que está constituido por componentes inmunológicos importantes que sirven para la protección de la pulpa ante agresiones o estímulos nocivos; sin embargo, cuando la agresión antigénica sobrepasa esta capacidad defensiva provoca una cantidad de fenómenos inmunológicos que desarrollan y mantienen la inflamación pulpar (pulpitis irreversible), que a medida que pasa el tiempo se degenera el tejido (necrosis), para posteriormente infectarse tanto la pulpa como los tejidos periapicales (periodontitis apical)(11) La capacidad del tejido conectivo para generar y soportar la inflamación local y las reacciones inmunes, lo hace un participante activo en las respuestas de defensa del huésped. Una considerable parte de esta capacidad depende de las células inmunocompetentes que residen en el tejido. Estas células son reclutadas de la sangre, donde residen como habitantes transitorios. Una vez que los antígenos extraños ganan acceso al tejido conjuntivo, estas células interactúan para crear mecanismos que ayudan a defender al tejido de la invasión antigénica.(12) Jontell y col (1987), han demostrado que la pulpa dental bajo condiciones de normalidad, se encuentra equipada con una gran variedad de células asociadas con el sistema inmune de defensa.(33) Así mismo, Kim y Lim (2002), demuestran que estas células de defensa, en especial subpoblaciones de linfocitos T pueden variar de acuerdo al tipo de agresión y tipo de microorganismo. La infección bacteriana, que es una de las causas más importantes de inflamación pulpar, aumenta significativamente la expresión de moléculas CD25 y CD54 en linfocitos T-CD4. Igualmente, en etapas tempranas de la inflamación pulpar inducida por P. endodontalis, se ha observado una fuerte reacción y secreción de INF.(29) Los microorganismos pueden alcanzar la pulpa dental por varias rutas. Entrada en el tejido duro dental causado por la caries, procedimientos clínicos o trauma inducido por fracturas y fisuras son los portales mas comunes para la infección pulpar. Sin embargo, se han aislado algunos microorganismos de dientes con pulpas necróticas, pero con coronas intactas. La infección endodóntica en estos dientes es precedida por necrosis. Algunos sugieren que las bacterias del saco gingival o sacos periodontales pueden alcanzar el conducto radicular a través de vasos sanguíneos del periodonto. Sin embargo, es poco probable que los microorganismos sobrevivan a defensas inmunológicas entre el margen gingival y el foramen apical. Otra vía de entrada es por medio de túbulos dentinarios expuestos en las zonas cervicales y algunos investigadores apoyan la idea de que los microorganismos pueden llegar al conducto radicular por medio de la circulación sanguínea, un proceso denominado Anacoresis.(11) La caries bacteriana se considera el mayor agente etiológico de la inflamación e infección pulpar. El resultado del ataque a la pulpa es un proceso dinámico que depende tanto de los microorganismos que invaden al tejido pulpar como de la respuesta del hospedero a estos, los cuales incluyen inflamación e inmunidad.(7) Cuando la caries invade la pulpa, la inflamación se manifiesta con dolor e hipersensibilidad, por medio de los productos metabólicos de las bacterias y los componentes de la pared celular como el ácido Lipoteicoíco (Gram positivas) y Lipopolisacáridos (Gram negativas). La primera respuesta de la pulpa ante la invasión antigénica, consta de la salida del flujo del fluido dentinario y la presencia de Igs en este fluido, lo que evita la difusión de microorganismos hacia el tejido pulpar. Posteriormente los odontoblastos son las primeras células que están en contacto con el antígeno; éstos atraen células de defensa en etapas tempranas de la inflamación por lo que tienen una actividad fagocítica, mientras que en etapas tardías reprimen la activación de células de defensa.(7,16) Por otro lado, se ha observado la presencia de neuropéptidos en la pulpa dental como SP, CGRP, VIP, NY, etc. Estos neuropéptidos se encuentran en las fibras nerviosas de la pulpa, las cuales están estrechamente relacionadas con la microvasculatura y se producen cambios vasculares como vasodilatación, aumento de la permeabilidad vascular, lo que inicia y propaga la inflamación pulpar.(7,20,21) Algunos estudios demuestran que el CGRP y SP son neuropéptidos responsables de la inflamación neurogénica. Caviedes-Buchelli y col (2004), realizan un estudio en donde evalúan la presencia de CGRP por medio de anticuerpos. Son identificados con la citometría de flujo, evidenciando que el CGRP está activo en la inflamación pulpar y modula la respuesta inflamatoria. Por otra parte, Killogh y col (2009), determinan la liberación de la SP en fibroblastos pulpares, por medio de la transcriptasa reversa de PCR (Reacción en cadena de la Polimerasa), encontrando que la SP se libera en fibroblastos pulpares tanto a nivel de ARNm como a nivel de proteínas, sugiriendo que los fibroblastos pulpares cumplen una importante función en la inflamación neurogénica.(20,21,22,23) Junto con la activación de neuropéptidos, surge también la liberación de mediadores que inician y sostienen el proceso inflamatorio. Diversos estudios han demostrado por medio del proceso de microdiálisis, que la concentración de bradiquinina inmunoreactiva es significativamente mayor en pulpas inflamadas. Con este estudio y otros que le preceden, se entiende que la medición bioquímica de los mediadores inflamatorios, muestra cambios importantes durante la pulpitis irreversible y estos mediadores (histamina, bradiquinina, prostaglandinas y serotonina), contribuyen con signos y síntomas clínicos en la histología pulpar, sin un cambio dramático.(27,28) Nucci y col (2008), evidenciaron que el óxido nítrico, el cual es una molécula intracelular mensajera con importantes funciones cardiovasculares, neurológicas e inmunológicas, aumenta en pulpas inflamadas junto con mediadores inflamatorios, ellos observaron 6 premolares sin inflamación y 6 premolares con síntomas de pulpitis irreversible, después de ser procesados con hematoxilina eosina; los resultados demuestran un aumento significativo en pulpas inflamadas, que en pulpas normales. Esto puede ser usado como marcador para identificar patologías pulpares junto con otros mediadores inflamatorios.(93) En la pulpa dental, se han encontrado diversas poblaciones de células de defensa como neutrófilos, que participan en la respuesta inmune innata y macrófagos, los cuales son efectivos para eliminar patógenos en las respuestas inmunes innata y adquirida. También encontramos células T-CD4 y T-CD8, células B y células plasmáticas productoras de anticuerpos.(40,41) Se ha asumido que la caries dental está constituida por microorganismos bacterianos. Sin embargo, las infecciones endodónticas son de tipo polimicrobial, caracterizados por una respuesta inflamatoria iniciada por la migración de microorganismos oportunistas, conllevando a un aumento en las células inflamatorias, causando patologías pulpares y periapicales. Estas células inflamatorias contienen virus herpético que cumplen una función importante en la etiopatogenia de las infecciones pulpares y periapicales. El virus herpético, esta compuesto de tres grupos: 1) alphaherpesviridae (herpes virus simple 1 y 2 y herpes virus zoster), 2) betaherpesviridae (cytomegalovirus), y 3) Gammaherpesviridae (virus de Epstein Barr). Se ha identificado en lesiones endodónticas la presencia de herpes virus, lo cual provoca la destrucción de células epiteliales, facilitando la penetración de bacterias al tejido conectivo. Igualmente el herpes virus destruye componentes del complejo mayor de histocompatibilidad en los macrófagos, lo que afecta la capacidad de presentación de antígenos y por tanto altera el mecanismo inmunológico.(94,95) Li y col, realizan un estudio en donde evalúan 82 pacientes con pulpitis irreversible (29 especímenes), periodontitis apical (30 especímenes) y periodontitis apical previamente tratada (23 especímenes) y 19 pulpas sanas control. Determinando por medio de la prueba de reacción en cadena de la polimerasa (PCR) y la transcripción reversa (RT); la presencia de virus herpético, específicamente Citomegalovirus (CMVH), Epstein- Barr (VEB), Herpes Virus Simple 1 (HVS-1) y Virus de Varicela Zoster (VVZ).(94,94,96,97) El ADN y ARN del VEB estuvo presente en patologías endodónticas en altos porcentajes, 43,9% y 25,6% respectivamente, comparado con pulpas sanas con 0% en ambas moléculas. El ADN y ARN de CMVH se encontró en patologías pulpares en 15,9% y 29,3% respectivamente y en pulpas sanas 42,1% y 10,5% respectivamente. El ADN del HVS-1 se encontró en bajos porcentajes (13,4%) y un solo paciente mostró VVZ. En conclusión, el VEB puede estar asociado con pulpitis irreversible y periodontitis apical determinado por medio de la PCR.(94) Estos hallazgos sugieren que la infección viral y bacteriana se "potencian", es decir, la infección viral crea un ambiente propicio para que las bacterias puedan actuar también y aumente el proceso infeccioso; la lesión se vuelve mas agresiva y la reacción inmunológica e inflamatoria asciende.(98) El sistema inmunológico de la pulpa es variado y complejo; ocurren una serie de fenómenos inmunológicos e inflamatorios simultáneos que son importantes para determinar y conocer el estado pulpar en un momento determinado y así emplear los procedimientos terapéuticos que sean necesarios para obtener resultados exitosos. Teniendo en cuenta todos estos hechos inmunológicos mencionados y detallados con anterioridad, se realizó un modelo hipotético que se presentará a continuación, de cómo se pudiera dar el proceso con visión integral, en cuanto a la respuesta inmunológica que ocurre en la pulpa dental producto de diferentes estímulos mecánicos, químicos, bacteriológicos y térmicos. (Gráfico 32)
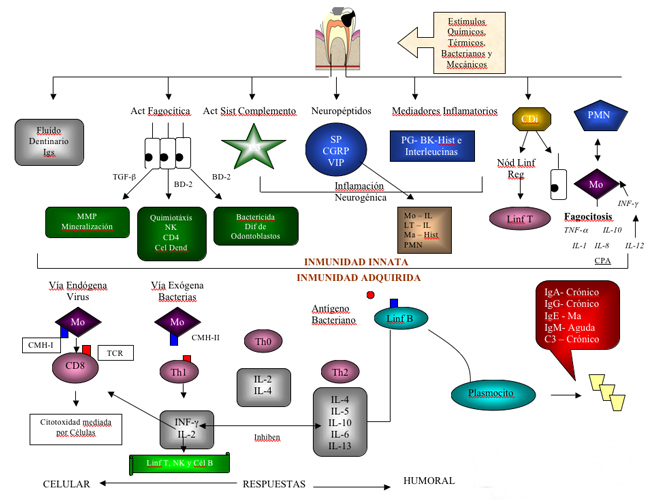
Gráfico 32. Modelo hipotético de la respuesta inmune de la pulpa (Carol Abdulmesih).
CONCLUSIONES
REFERENCIAS BIBLIOGRÁFICAS 1. Talmage D. Historia de la Inmunología.
En: Stites D, Terr A, Parslow T. Inmunología
básica y clínica. 9 ed.
México, 1998: XVII 2. Lowell C. Bases de la Biología de las
Células Sanguíneas. En: Stites D,
Terr A, Parslow T. Inmunología básica
y clínica. 9 ed. México, 1998:
3-20 3. Achino B. Generalidades sobre la Inmunidad e
Inmunidad natural. En: Negroni M.
Microbiología estomatológica
fundamentos y guía práctica.
Argentina, 2001: 127-37 4. Achino B. Inmunidad Adquirida o
Específica. En: Negroni M.
Microbiología estomatológica
fundamentos y guía práctica.
Argentina, 2001: 139-79 5. Regueiro J, López C, González S,
Martínez E. Inmunología.
Biología y Patología del Sistema
Immune. 3a ed. Madrid. 2008 6. Parslow T, Bainton D. Inmunidad Innata. En:
Stites D, Terr A, Parslow T. Inmunología
básica y clínica. 9 ed.
México, 1998: 21-40 7. Hahn C, Liewehr F. Innate Immune Responses of
the Dental Pulp to Caries. J Endod 2007; 33:
643-51 8. Parslow T. Linfocitos y Tejidos Linfoides. En:
En: Stites D, Terr A, Parslow T. Inmunología
básica y clínica. 9 ed.
México, 1998: 41-62 9. Parslow T. Respuesta Inmunitaria. En: Stites D,
Terr A, Parslow T. Inmunología básica
y clínica. 9 ed. México, 1998:
65-78 10. Speer M, Madonia L, Heuer M. Quantitative
Evaluation of the Immunocompetence of the Dental
Pulp. J Endod 1977; 3(11): 418-23 11. Okiji T. Pulp as a Connective Tissue. En:
Hargreaves K, Goodis H. Seltzer and Bender´s
dental pulp. Quintessence Publishing Co, Inc.
China. 2002: 95-122 12. Pashley D, Walton R, Slavkin H. Histology and
Physiology of the Dental Pulp. En: Ingle J.
Endodontics. México. 2003: 25-61 13. Hahn C, Liewehr F. Relationships Between Caries
Bacteria, Host Responses, and Clinical Signs and
Symptoms of pulpitis. J Endod 2007; 33: 213-19 14. Trowbridge H, Oaniels T. Abnormal Immune
Response to Infection of the Dental Pulp. Oral Surg
1977;43:902-9. 15. Bergenholtz G. Inflammatory Response of the
Dental Pulp to Bacterial Irritation. J Endod 1981;
7(3): 100-4 16. Hahn C, Best A. The Pulpal Origin of
Immunogloblulins in Dentin Beneath Caries: A
Immunohistochemical Study. J Endod 2006;
32:178&endash;182 17. Nakanishi T, Matsuo T, Ebisu S. Quantitative
Analysis of Immunoglobulins and Inflammatory
Factors in Human Pulpal Blood from Exposed Pulps. J
Endod 1995; 21(3): 131-36 18. Artese L, Rubini C, Ferrero G, Fioroni M,
Santinelli A, Piattelli A. Vascular Endothelial
Growth Factor (VEGF) Expression in Healthy and
Inflamed Human Dental Pulps. J Endod 2002; 28(1):
20-3 19. Ohshima H, Nakakura-Ohshima K, Takeuchi K,
Hoshino M, Takano Y, Maeda T. Pulpal Regeneration
after Cavity Preparation, with Special Reference to
Close Relationships Between Odontoblasts and
Immunocompetent Cells. Microsc Res Tech
2003;60(5):483&endash;90. 20. Caviedes-Bucheli J, Muñoz R,
Azuero-Holguín M, Ulate E. Neuropeptides in
Dental Pulp: the Silent Protagonists. J Endod 2008;
34: 773-88 21. Killough S, Lundy F, Irwin C. Substance P
Expression by Human Dental Pulp Fibroblast: A
Potential Role in Neurogenic Inflammation. J Endod
2009; 35: 73-79 22. Rodd H, Boissonade F. Substance P Expression in
Human Tooth Pulp in Relation to Caries and Pain
Experience. Eur J Oral Sci 2000;108
(6):467&endash;74. 23. Caviedes-Bucheli J, Camargo-Beltrán C,
Gómez-la-rotta M, Moreno S, Moreno G,
González-Escobar J. Expression of Calcitonin
Gene-Related Peptide (CGRP) in Irreversible Acute
Pulpitis. J Endod 2004; 30(4): 201-4 24. Fehrenbacher J, Sun X, Locke E, Henry M,
Hargreaves K. Capsaicin-Evoked ICGRP Release from
Human Dental Pulp: A Model System for the Study of
Peripheral Neuropéptido Secretion in Normal
Healthy Tissue. Pain. 2009; 144(3): 1-9 25. Calland JW, Harris SE, Carnes DL. Human Pulp
Cells Respond to Calcitonin Gene-Related Peptide In
Vitro. J Endodon 1997;23:485- 9. 26. Byers M, Taylor P, Khazat B, Kimberly C. Effects
of Injury and Inflammation on Pulpal and Periapical
Nerves. J Endod 1990; 16(2): 78-84 27. Lepinski A, Hargreaves K, Goodis H, Bowles W.
Bradykinin Levels in Dental Pulp by Microdialysis.
J Endod 2000; 26(12): 744-47 28. Heyeraas K, Berggreen E. Interstitial Fluid
Pressure in Normal and Inflamed Pulp. Crit Rev Oral
Biol Med 1999; 10(3):328 &endash;36 29. Kim S, Liu M, Simchon S. Effects of Selected
Inflammatory Mediators on Blood Flow and Vascular
Permeability in the Dental Pulp. Proc Finn Dent Soc
1992; 56: 131-90 30. Nio D, Moylan R, Roche J. Modulation of T
Lymphocyte Function by Neuropeptides. Evidence for
their Role as Local Immunoregulatory Elements. J
Immunol 1993;150(12):5281&endash; 8. 31. Torabinejad M, Bakland L. Prostaglandins: Their
Possible Role in the Pathogenesis of Pulpal and
Periapical Diseases, Part 1. J Endod 1980; 6 (9):
733-9. 32. Gilbert T, Pashley D, Anderson R. Response of
Pulpal Blood Flow to Intra-arterial Infusion of
Endothelin. J Endod 1992; 18(5): 228-31 33. Jontell M,. Gunraj M, Bergenholtz G.
Immunocompetent Cells in the Normal Dental Pulp. J
Dent Res 1987; 66: 1149- 1153 34. Torabinejad M, Kettering JD. Identification and
Relative Concentration of B and T Lymphocytes in
Human Chronic Periapical Lesions. J Endodon
1985;11:122-5. 35. Trowbridge H. Immunological Aspects of Chronic
Inflammation and Repair. J Endod 1990; 16(2): 54-
61 36. Pulver W, Taubman M, Smith D. Immune Components
in Normal and Inflamed Human Dental Pulp. Archs
Oral Biol 1977; 22: 103-11 37. Veerayutthwilai O, Byers M, Pham T, Darveau R,
Dale B. Differential Regulation of Immune Responses
by Odontoblasts. Oral Microbiology Immunology.
2007; 22: 5-13 38. Goldberg M, Farges J, Lacerda-Pinheiro S, Six N,
Jegat N, Decup F et all. Inflammatory and
Immunological Aspects of Dental Pulp Repair.
Pharmacological Research 2008; 58: 137-147 39. Kawashima N, Okiji T, Kosaka T, Suda H. Kinetics
of Macrophages and Lymphoid Cells During the
Development of Experimentally Induced Periapical
Lesions in Rat Molars: A Quantitative
Immunohistochemical Study. J Endod 1996; 22(6):
311-16 40. Mousavi S, Talebi A, Kianoosh S.
Immunohistochemical Assessment of Natural Killer
Cells in Normal and Inflamed Dental Pulps. JRMS
2006; 11(2): 119-121 41. Jontell M, Okiji T, Dahlgren U, Bergenholtz G.
Immune Defense Mechanisms of the Dental Pulp. Crit.
Rev. Oral Biol. Med 1998; 9; 179-200 42. Hahn C, Falkler W, Siegel M. A Study of T And B
Cells in Pulpal Pathosis. J Endod 1989; 15(1):
20-6 43. Freitas P. Purens C, Oliveira C, Carvalho A,
Soares V. Mast Cells and Lymphocyte Subsets in
Pulps from Healthy and Carious Human Teeth. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod 2007;
103: e95-e102. 44. Pisterna G, Siragusa M. CD44 Presence in
Inflamed Pulp Tissue. J Endod 2007; 33: 1203-7 45. Harmon M, Tew J, Hahn C. Mature Dendritic Cells
in Inflamed Human Pulps Beneath Deep Caries. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod 2009;
107: 727-732 46. Nakanishi T, Takahashi K, Hosokawa Y, Adachi T,
Nakae H, Matsuo T. Expression Of Macrophage
Inflammatory Protein 3alpha in Human Inflamed
Dental Pulp Tissue. J Endod 2005;31(2):84
&endash;7 47. Okiji T, Suda H, Kawashima N, Kaneko T, Sakurai
K. Response of Pulpal Dendritic Cells to Microbial
Challenges Across Dentin. In: Ishikawa T, Takahashi
K, Maeda T, Suda H, Shimono M, Inoue T, eds.
Proceedings of the International Conference on
Dentin/Pulp Complex 2001, Chiba, Japan. Chicago:
Quintessence, 2001; 24 &endash;30 48. Caux C, Vanbervliet B, Massacrier C, Ait-Yahia
S. Regulation of Dendritic Cell Recruitment by
Chemokines. Transplatation 2002; 73: 7-11. 49. Trowbridge H. Pathogenesis of Pulpitis Resulting
from Dental Caries. J Endod 1981;7:52-60. 50. Hernández-Guerrero J,
Jiménez-Farfán D,
Castel-Rodríguez A, Garcés-Ortiz M,
Ledesma-Montes C. Inmunoexpression of HLA-DR Clase
II Molecule in Cells from Inflamed Dental Pulp.
Arch Med Res 2006; 37: 461-464 51. Pezelj-Ribaric S, Anic I, Brekalo I, Miletic I,
Hasan M, Simunovic M. Detection of Tumor Necrosis
Factor in Normal and Inflamed Human Dental Pulps.
Archives of Medical Research 2002; 33: 482-4 52. Brekalo I, Kocjan W, Brumini G. Tumor Necrosis
Factor-Alpha and Interleukin 6 in Human Periapical
Lesions. Mediators of inflammation. 2007; 1-4 53. Barkhordar R, Ghani P, Russell T, Hussain Z.
Interleukin-1 Activity and Collagen Synthesis in
Human Dental Pulp Fibroblast. J Endod 2002; 28(3):
157-9 54. Shimauchi H, Takayama S, Imai-Tanaka T, Okada H.
Balance of Interleukin-1 Beta and Interleukin-1
Receptor Antagonist in Human Periapical Lesions. J
Endodon 1998;24: 116 &endash;9. 55. Lertchirakarn V, Birner R, Messer H. Effects of
Interleukin-1 on Human Pulpal Fibroblast
Proliferation and Collagen Synthesis. J Endod 1998;
24(6): 409-13 56. Zehnder M, Delaleu N, Du Y, Bickel M. Cytokine
Gene Expression&endash;Part of Host Defense in
Pulpitis. Cytokine 2003; 22(3&endash; 4):84
&endash; 8 57. Nagaoka S, Tokuda M, Sakuta T, Taketoshi Y,
Tamura M, Takada et al. Interleukin-8 Gene
Expression by Human Dental Pulp Fibroblast in
Cultures Stimulated with Prevotella Intermedia
Lipopolysaccharide. J Endod 1996; 22(1): 9-12 58. Huang G, Potente A, Kim J, Chugal N, Zhang X.
Increased Interleukin-8 Expression in Inflamed
Human Dental Pulps. Oral Surg, Oral Med, Oral
Pathol 1999; 88(2): 214-20 59. Hahn C, Liewehr F. Update on the Adaptive Immune
Responses of the Dental Pulp. J Endod 2007; 33:
773-81 60. Anderson L, Dumsha T, McDonald N, Spitznagel J.
Evaluating IL-2 Levels in Human Pulp Tissue. J
Endond 2002; 28(9): 651-5 61 Wisithphrom K, Windson J. The Effects of Tumor
Necrosis Factor-, Interleukin-1, Interleukin-6, and
Transforming Growth Factor-1 on Pulp Fibroblast
Mediated Collagen Degradation. J Endod 2006; 32:
853-61 62. Falkler W, Martin S, Tolba M, Siegel M, Mackler
B. Reaction of Pulpal Immunoglobulins to Oral
Microorganisms by an Enzyme-Linked Immunosorbent
Assay. J Endod 1987; 13(6): 260-66 63. Hahn C, Falkler W. Antibodies in Normal and
Diseased Pulps Reactive with Microorganisms
Insolated from Deep Caries. J Endod 1992; 18(1):
28-31 64. Farnoush A. Mast Cells in Human Dental Pulp. J
Endod 1984; 10(6): 250-52 65. Mudie A, Holland G. Local Opioides in the
Inflamed Dental Pulp. J Endod 2006; 32: 319-23 66. Seltzer S. Pain in Endodontics. J Endod 2004;
30(7): 501-3 67. Hargreaves K. Pain Mechanisms of Pulpodentin
Complex. En: Hargreaves K, Goodis H. Seltzer and
Bender's dental pulp.Chicago: Quintessence, 2002;
181&endash;203 68. Bodnar R. Peptides Endogenous Opiates and
Behavior: 2007. 2008; 29: 2292-2375 69. Longwill D, Marshall J, Creamer H. Reactivity of
Human Lymphocytes to Pulp Antigens. J Endod 1982;
8: 27-32 70. Bonecchi R, Bianchi G, Bordignon PP, et al.
Differential Expression of Chemokine Receptors and
Chemotactic Responsiveness of Type 1 T Helper Cells
(Th1s) And Th2s. J Exp Med 1998;187(1):129
&endash;342 71. Kim S, Lim S. T Lymphocyte Subpopulations and
Interleukin-2, Interferon-, and Interleukin-4 in
Rat Pulpitis Experimentally Induced by Specific
Bacteria. J Endod 2002; 28: 202-5 72. Liapatas S, Nakou M, Rontogianni D. Inflammatory
Infiltrate of Chronic Periradicular Lesions: An
Immunohistochemical Study. Int Endod J
2003;36:464&endash;71. 73. Ledesma-Montes C, Garces-Ortiz M, Rosales-Garcia
G, Hernandez-Guerrero JC. Importance of Mast Cells
in Human Periapical Inflammatory Lesions. J Endod
2004;30:855&endash;9. 74. Stashenko P, Yu S, Wang C. Kinetics of Immune
Cell and Bone Resorptive Responses to Endodontic
Infections. J Endod 1992; 18(9): 422-26 75. Stashenko P. Role of Immune Cytokines in the
Pathogenesis of Periapical Lesions. Endod Dent
Traumatol 1995; 6:89-96. 76. Stashenko P, Teles R. Periapical Inflammatory
Responses and their Modulation. Crit Rev Oral Biol
Med 1998; 9(4): 498-521 77. Takashi K. Microbiological, Pathological,
Inflammatory, Immunological and Molecular
Biological Aspects of Perirradicular Disease. Int
Endod J 1998; 31: 311-25 78. Xiong H, Wei L, Peng B. Immunohistochemical
Localization of IL-17 in Induced Rat Periapical
Lesions. J Endod 2009; 35: 216-20. 79. Sawa Y, Yoshida S, Shibata KI, Suzuki M, Mukaida
A. Vascular Endothelium of Human Dental Pulp
Expresses Diverse Adhesion Molecules for Leukocyte
Emigration. Tissue Cell
1998;30(2):281&endash;9127 80 Shinoda S, Murayama Y, Okada H.
Immunopathological Role of Pulpal Tissue Components
in Periapical Pathosis. I. Detection of
¨New¨ Antigens in Modified Dog Pulpal
Extracts. J Endod 1986; 12(9): 388-95 81. Kiss C. Cell &endash; to- Cell Interactions.
Endodontic Topics 2004; 8: 88-103 82. Artese L, Piattelli A, Quaranta M, Colasante A,
Musani P. Immunoreactivity For Interleukin-1 and
Tumor Necrosis Factor- and Ultrastructural Features
of Monocytes/Macrophages in Periapical Granulomas.
J Endod 1991; 17(10): 483-87 83. Fukada S, Silva T, Garlet G, Rosa A, da Silva J,
Cunha F. Factors Involved in the T Helper Type 1
and Type 2 Cell Commitment and Osteoclast
Regulation in Inflammatory Apical Diseases. Oral
Micro Immunol 2009; 24: 25-31 84. Ninomiya J, Nakanishi K, Takemoto T, Higashi T,
Ogawa T, Kawaguchi H et al. Cellular
Immuno-Competence of Infected Root Canal Contents
in Pathogenesis of Periapical Lesions. J Endod
1997; 23(4): 213-6 85. Metzger Z. Macrophages in Periapical Lesions.
Endod Dent Traumatol 2000;16:1&endash; 8.. 86 Kettering J, Torabinejad M. Concentrations of
Immune Complexes, IgG, IgM, IgE, And C3 in Patients
with Acute Apical Abscesses. J Endod 1984;
10(9):417-21 87 Craig J, Falkler W. Detection of
Immunogloblulins from Explant Cultures of
Periapical Lesions. J Endod 1991; 17(3): 105-10 88. Cymerman J, Cymerman D, Walters J, Nevins A.
Human T Lymphocyte Subpopulations in Chronic
Periapical Lesions. J Endod 1984; 10(1): 9-11 89. Nair P. Pathogenesis of Apical Periodontitis and
the Causes of Endodontic Failures. Crit Rev Oral
Biol Med 2004; 15(6): 348-81 90. Cortes J, Torabinejad M, Rodriguez A, Gomez E.
Presence of Secretory IgA in Human Periapical
Lesions. J Endod 1994; 20(2): 87-9 91. Yamasaki M, Morimoto T, Tsuji M, Akihiro I,
Maekawa Y, Nakamura H. Role of IL-2 and Helper
T-Lymphocytes in Limiting Periapical Pathosis. J
Endod 2006; 32:24&endash;29 92. Shinoda S, Murayama Y, Okada H.
Immunopathological Role of Pulpal Tissue Components
in Periapical Pathosis. II. Specificities of
Antigenic Determinants on Modified Serum Albumins.
J Endod 1986; 12(11): 528-33 93. Nucci L, Mardegan J, Aparecida E. Action of
Nitric Oxide on Healthy and Inflamed Human Dental
Pulp Tissue. Micron 2008; 39: 797-801 94. Li H, Chen V, Chen Y, Graig J, Machida C.
Herpesviruses in endodontic pathoses: association
of epstein-barr virus with irreversible pulpitis
and apical periodontitis. J Endod 2009;
35:23&endash;29 95. Sabeti M, Valles Y, Nowzari H, Simon J,
Kermani-Arab V, Slots J. Cytomegalovirus and
Epstein-Barr Virus DNA Transcription in Endodontic
Symptomatic Lesions. Oral Microbiol Immunol
2003;18:104 &endash; 8. 96. Yildirim S, Yapar M, Kubar A, Slots J. Human
Cytomegalovirus, Epstein-Barr Virus and Bone
Resorption Inducing Cytokines in Periapical Lesions
Of Deciduous Teeth. Oral Microbiol Immunol
2006;21:107&endash;11. 97. Slots J, Saygun I, Sabeti M, Kubar A.
Epstein-Barr Virus in Oral Diseases. J Periodontal
Res 2006;41:235&endash; 44. 98. Silva T, Garlet G, Fukada S, Silva J, Cunha F.
Chemokines in Oral Inflammatory Diseases: Apical
Periodontitis and Periodontal Disease. J Dent Res
2007; 86: 306-19
Invitados Anteriores y sus Trabajos
¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||