|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Invitado # 41 : (Agosto 2004) "Aspectos Microbiológicos de la Periodontitis Apical Crónica Persistente" por Tatiana Aguilar Heredia Odontólogo, Universidad Central de Venezuela, 1999 Especialista en Endodoncia, U.C.V., Venezuela, 2002-2004 e-mail: tatianaaguilar@carlosboveda.com
Introducción En la odontología contemporánea, la endodoncia juega un papel esencial en la preservación de las estructuras dentarias y en consecuencia, en la función y equilibrio del aparato estomatognático. Esta especialidad de la odontología trata las enfermedades del órgano dentino-pulpar, así como la consecuente afección de los tejidos periodontales circundantes, por lo que el objetivo fundamental del tratamiento endodóntico consiste en curar y prevenir la periodontitis apical crónica. Para lograr este objetivo, es imprescindible durante los procedimientos de limpieza y conformación del sistema de conductos radiculares, la eliminación de los microorganismos. Estos constituyen el principal factor etiológico de las lesiones pulpares y periapicales, lo cual ha sido ampliamente comprobado desde mediados del siglo XX. Es esperado, que tras la realización del tratamiento de conductos, se desencadene un proceso de cicatrización periapical, que conducirá a la curación de la lesión. Sin embargo, la periodontitis apical constituye un factor de gran influencia en el pronóstico endodóntico, donde la evidencia científica ha demostrado el compromiso de reparación que muestran los dientes con lesiones periapicales. En la mayoría de los casos, la persistencia de estas lesiones es atribuida a la permanencia de infección intrarradicular, cuando los procedimientos del tratamiento no cumplen con los estándares satisfactorios para el control y eliminación de esta microbiota, o la recontaminación del sistema de conductos radiculares por vía coronaria. La microbiota relacionada con dientes tratados endodónticamente con periodontitis apical crónica no ha sido tan ampliamente estudiada como la involucrada en pulpas necróticas, sin embargo se ha logrado establecer que existen diferencias significativas en su composición. Así mismo, existen diversas hipótesis que tratan de explicar la persistencia de las lesiones periapicales. Por todo lo anteriormente expuesto, el objetivo de este trabajo es analizar los aspectos microbiológicos de la periodontitis apical crónica persistente.
Papel de los microorganismos en la patología pulpar y periapical. Generalidades Ha sido reconocido ampliamente que los microorganismos juegan un papel fundamental en el desarrollo y mantenimiento de las patologías pulpares y periapicales.(47,50,63,123) Normalmente la pulpa dental es un tejido estéril y está principalmente involucrada en la producción de dentina y en la sensibilidad del diente.(59) Cualquier lesión de la pulpa puede desencadenar una respuesta inflamatoria de la misma. Si bien los irritantes pueden ser de naturaleza física, térmica o química, los microorganismos son considerados el principal agente etiológico. Las patologías pulpares y periapicales suelen ser un resultado directo o indirecto de la presencia de bacterias y otros microorganismos en el medio bucal.(22,47,50,63,123) Dado que los microorganismos desempeñan un papel primordial en la patogénesis de las lesiones pulpares y perirradiculares es preciso manejar los fundamentos de la microbiología endodóntica para entender el papel que desempeñan en estas afecciones, las vías de difusión de la infección pulpar y periapical, las respuestas de los tejidos ante estos agresores y los métodos utilizados para controlar y erradicar las infecciones del sistema de conductos radiculares. La pulpa y la dentina forman un complejo funcional el cual es protegido tanto por sustancias exógenas de la cavidad bucal como por estructuras dentarias (el esmalte y el cemento). Cuando el complejo dentino-pulpar es infectado, los tejidos reaccionan en contra de los microorganismos invasores a fin de erradicarlos. La capacidad de este complejo de realizar esta función no ha sido subestimada, ya que los tejidos están dotados con procesos inmunocompetentes. Sin embargo, en términos clínicos, si la infección no es erradicada a través de esos procesos naturales o procedimientos operatorios, los microorganismos invaden el complejo dentino-pulpar venciendo las defensas y causando la enfermedad pulpar, e infectando la cámara pulpar y el sistema de conductos radiculares.(10,59,116) El sistema de conductos radiculares está en abierta comunicación con los tejidos periapicales (ligamento periodontal, cemento y hueso alveolar) por las vías del foramen apical, conductos laterales y accesorios. Los metabolitos y productos tóxicos son producidos principalmente por las bacterias presentes dentro del sistema de conductos radiculares y se difunden a los tejidos periapicales desencadenando la respuesta inflamatoria (periodontitis apical), la cual se caracteriza por resorción del hueso alveolar. La enfermedad periapical inducida por microorganismos por lo general comienza como una inflamación de tipo crónico y se manifiesta histopatológicamente como un granuloma.(59,116) La invasión de los túbulos dentinarios por microorganismos ocurre cuando la dentina está expuesta al medio bucal. Esto puede ocasionarse por lesiones de caries, procedimientos restauradores o periodontales, fisuras de esmalte o dentina, o traumatismo dental.(59,74,78) El avance de las bacterias del proceso carioso traerá como consecuencia la infección de la pulpa dental y del sistema de conductos radiculares y el consecuente desarrollo de lesión perirradicular. Sin embargo, las bacterias asociadas a la caries dental difieren de las asociadas a la infección pulpar.(59) En 1894, Miller fue el primero en demostrar la invasión bacteriana de los túbulos dentinarios tanto de dentina cariada como no cariada así como en tejido pulpar necrótico, reportando que esta microflora tubular consistía en cocos y bacilos. Pero no fue sino hasta 1.965 cuando Kakehashi et al.(47) proporcionaron evidencia experimental y establecieron claramente el papel fundamental de las bacterias en la en la enfermedad pulpar y periapical. Esta importante investigación(47), desarrollada por estos autores, señaló el efecto de los microorganismos sobre el tejido pulpar. En este estudio se demostró la aparición de enfermedad pulpar y periapical en pulpas dentales de molares de ratas quirúrgicamente expuestas sólo cuando existían bacterias en la cavidad bucal. En ratas gnotobióticas (libres de microorganismos) las pulpas expuestas permanecieron sanas e iniciaron la reparación formando un puente dentinario a nivel de la exposición pulpar. Estos resultados son confirmados posteriormente por Korzen et al.(51) quienes analizaron los efectos de la microbiota bucal normal y de la infección por Streptococcus mutans en la pulpa y los tejidos periapicales de ratas comunes y gnotobióticas. En dicho trabajo, los autores concluyen que la severidad de la inflamación pulpar y periapical estaba directamente relacionada con la cantidad de microorganismos existentes en el sistema de conductos radiculares y con el tiempo de permanencia de los mismos dentro del sistema, así como comprobaron que el grado de inflamación es de mayor intensidad en infecciones mixtas que en infecciones producidas por microorganismos pertenecientes a una sola especie. Poco después, Sundqvist(123), en 1976, tras un importante estudio realizado sobre dientes humanos con pulpas necróticas, demostró que sólo podían ser detectados signos de reacción inflamatoria en los tejidos periapicales de dientes que presentaran infección bacteriana dentro del sistema de conductos radiculares. Este autor realizó un estudio en 32 dientes monorradiculares con historia previa de traumatismo, los cuales presentaban pulpas necróticas y su corona clínica intacta. Diecinueve de estos dientes presentaban imagen radiolúcida; en 18 de estos dientes se encontró la presencia de microorganismos. Por otra parte, no se encontraron microorganismos en aquellos dientes traumatizados sin área periapical. Aunado a estos hallazgos, sus resultados sugieren también, una asociación entre la sintomatología y combinaciones específicas de bacterias. Un 90% de las especies aisladas por Sundqvist(123) fueron anaerobias; éstas comprenden un grupo de especies restringido, si se compara con la totalidad de la microbiota de la cavidad bucal. Estos resultados fueron posteriormente sustentados y corroborados por otros estudios.(21,28,63) Möller et al.(63) estudiaron las pulpas de 78 dientes de mono (Macaca fascicularis) con necrosis aséptica inducida. Veintiséis de estas pulpas se mantuvieron libres de bacterias y 52 fueron infectadas por la microbiota bucal, obteniendo resultados similares donde únicamente los dientes con pulpas infectadas mostraron reacciones clínicas y radiográficas de inflamación. Más de 300 especies bacterianas han sido reconocidas como componentes de la microflora bucal.(23) Sin embargo, pocas especies parecen ser capaces de invadir el espacio pulpar e infectarlo.(124) Esto sugiere que muchas de las especies en la cavidad bucal no poseen las propiedades necesarias para invadir los túbulos dentinarios y sobrevivir dentro de ese microambiente.(59) El hecho de que los microorganismos pueden acceder al sistema pulpar a través de la circulación sanguínea no ha sido comprobado hasta ahora. Delivanis y Fan(23) no lograron demostrar la presencia de bacterias en conductos de dientes de gato no obturados después de repetidas inoculaciones de cepas de Streptococcus sanguis. El sistema de conductos radiculares representa un micro-ambiente especial en el cual presiones selectivas conllevan al establecimiento de un grupo restringido de microorganismos de la microbiota bucal. Las interrelaciones bacterianas y el suplemento nutricional son factores determinantes del desarrollo de la infección.(124) Los factores nutricionales son fundamentales para el crecimiento microbiano dentro del espacio pulpar. En consecuencia, aquellos microorganismos que se establecen son los que pueden utilizar y compiten mejor por los factores de crecimiento disponible en la pulpa necrótica. Los componentes del tejido pulpar degenerado aportan una fuente nutricional importante en las fases iniciales de la colonización bacteriana.(11) Otro factor esencial lo constituye el exudado inflamatorio. Este exudado contiene elementos séricos y hemáticos que son producto de alteraciones inflamatorias pulpares y periapicales. Si se presenta una comunicación entre el espacio pulpar y el medio bucal, la saliva aportará elementos que fomentarán el crecimiento bacteriano.(11) Un factor muy selectivo de la microbiota endodóntica es la baja disponibilidad de oxígeno en los conductos radiculares infectados, especialmente cuando no existe comunicación cámara pulpar-cavidad bucal, en particular en las porciones apicales donde el bajo potencial de óxido-reducción en el tejido necrótico favorece en un principio el crecimiento de bacterias anaerobias facultativas y posteriormente anaerobias estrictas.(11) Otro aspecto de relevancia dentro del microambiente bacteriano pulpar son las interacciones bacterianas. Existe un intercambio de nutrientes entre diversas especies, de hecho, el crecimiento de ciertas especies bacterianas depende de los productos metabólicos de otras.(11) Así mismo, las bacterias pueden contrarrestarse entre sí produciendo metabolitos capaces de suprimir o eliminar otras especies, lo cual fomenta la complejidad del ecosistema que constituye el sistema de conductos radiculares.(11) La mayoría de los microorganismos patógenos así como su principal sustrato, los restos necróticos pulpares, pueden ser removidos por los procedimientos endodónticos rutinarios que incluyen la limpieza y conformación del espacio pulpar. Sin embargo, esto no se logra completamente en la práctica clínica, debido a las complejidades anatómicas de este sistema y las limitaciones en el acceso de los agentes terapéuticos.(11) Los microorganismos pueden permanecer en los túbulos dentinarios y en las demás irregularidades del conducto. Si existe suficiente número de bacterias remanentes y un microambiente adecuado, estas pueden multiplicarse y reestablecer la infección en el espacio pulpar.(11) El principal objetivo del tratamiento endodóntico es eliminar los microorganismos del sistema de conductos radiculares y prevenir la infección o sobreinfección de la pulpa, del sistema de conductos radiculares y de los tejidos periapicales. Por lo tanto, el éxito del tratamiento de conductos dependerá del amplio conocimiento de los factores etiológicos del proceso de la enfermedad.(59)
Microbiota del sistema de conductos radiculares en pulpas necróticas Características de la microbiota del sistema de conductos radiculares en pulpas necróticas Las bacterias presentes en conductos infectados comprenden un número restringido de especies comparadas con el total de la microbiota bucal. La mayoría de las especies encontradas en conductos radiculares también han sido aisladas de sacos periodontales, sin embargo, la microbiota endodóntica no es tan compleja como la periodontal.(65) Para que un microorganismo pueda establecerse en el sistema de conductos radiculares y consecuentemente participar en la etiopatogenia de las lesiones perirradiculares requiere de ciertas características: (110) a. El microorganismo debe presentarse en un número suficiente para iniciar y mantener la lesión perirradicular. b. El microorganismo debe poseer una matriz de factores de virulencia, la cual debe expresarse durante la infección del conducto radicular. c. El microorganismo debe estar localizado espacialmente en el sistema de conductos radiculares de tal manera que sus factores de virulencia puedan ganar acceso a los tejidos perirradiculares. d. El ambiente del sistema de conductos radiculares debe permitir la supervivencia y crecimiento del microorganismo, y proveer señales que estimulen la expresión de virulencia. e. Los microorganismos inhibidores deben estar presentes en bajo número o ausentes en el microambiente del sistema de conductos radiculares. f. El hospedero debe desarrollar una estrategia de defensa a nivel de los tejidos perirradiculares, con la finalidad de inhibir la diseminación de la infección. Este proceso dará como resultado un daño tisular. El análisis de estos requisitos puede proveer evidencia con respecto a la relación causa-efecto entre el microorganismo en estudio y la lesión perirradicular. Existen diferentes tipos de infecciones endodónticas del sistema de conductos radiculares, las cuales usualmente están asociadas con condiciones clínicas distintas. Siqueira(95) describe cuatro tipos: primaria, secundaria, persistente y extrarradicular. La infección primaria es aquella causada por la colonización de microorganismos en el tejido pulpar necrótico. La microbiota involucrada frecuentemente depende del tiempo de infección. Más aún, se ha sugerido que la microbiota difiere según el tipo de lesión perirradicular asociada. Mientras que un amplio rango de microorganismos se asocian a lesiones perirradiculares crónicas, un grupo más restringido de especies se asocian a lesiones perirradiculares sintomáticas como la periodontitis apical aguda y el absceso perirradicular agudo.(33,84b,107,110,125,136) Las infecciones secundarias son causadas por microorganismos ausentes durante la infección primaria y que han penetrado al sistema de conductos radiculares durante el tratamiento, entre citas o después de culminado el tratamiento endodóntico. Si estos microorganismos logran sobrevivir y colonizar el sistema de conductos, se establecerá la infección.(95) Otro tipo de infección endodóntica es la infección intrarradicular persistente. Esta es causada por microorganismos involucrados en la infección primaria o secundaria. Existen pocas especies microbianas capaces de resistir los cambios de ambiente efectuados durante la terapia endodóntica, y de esta manera involucrarse en el fracaso del tratamiento de conductos.(95) Esta microbiota será analizada posteriormente. Por último, se describen las infecciones endodónticas extrarradiculares. Estas infecciones pueden ser primarias, secundarias o persistentes. La forma más común es el absceso perirradicular agudo. La fuente de las infecciones extrarradiculares es usualmente la infección intrarradicular.(95) Este último tipo de infecciones ha tomado un considerable interés en los últimos tiempos, generado por el papel potencial de las mismas en el fracaso de la terapia endodóntica. Diversos estudios han comprobado la existencia de infección extrarradicular aún en dientes tratados endodónticamente.(40,44,85,119,121) Debido a que los procedimientos endodónticos no quirúgicos no tienen acceso a los tejidos perirradiculares, este tipo de infecciones constituyen una causa de fracaso endodóntico. Después de Miller en 1890, se desarrollaron múltiples investigaciones sobre la microbiota de los conductos radiculares las cuales reportaron la presencia de numerosas especies bacterianas. Dependiendo del medio de cultivo y las técnicas utilizadas para la identificación bacteriana, los tipos y el número de organismos aislados variaban significativamente. En las primeras investigaciones se reportó una pequeña incidencia de bacterias anaerobias en infecciones primarias,(26,41,61,69,139,140) mientras que en estudios posteriores se informó de una prevalencia del 90% de estas bacterias en conductos radiculares infectados.(6,7,28,39,45,52,79,124,125) Hasta principios de 1970, la mayoría de los estudios microbiológicos señalaban fundamentalmente la presencia de bacterias anaerobias facultativas en el sistema de conductos radiculares infectados. Sin embargo, con el advenimiento de las nuevas tecnologías en el aislamiento de bacterias anaerobias y el progreso en el conocimiento del papel fundamental de estos microorganismos en diversas patologías humanas, ha cambiando sustancialmente la bacteriología médica y bucal. Los estudios de Sundqvist,(123) en 1976, cambian diametralmente los conceptos hasta los momentos establecidos en la microbiología endodóntica. La presencia de un alto porcentaje de anaerobios estrictos reportados en su investigación, demostraron la necesidad de emplear medios de cultivo adecuados y técnicas para la identificación de microorganismos anaerobios en beneficio del avance en el conocimiento de la microbiología del sistema de conductos radiculares. Las pulpas necróticas presentan una flora polimicrobiana caracterizada por una amplia variedad de combinaciones de bacterias, un promedio de 4-7 especies por conducto, predominantemente anaerobias y aproximadamente igual proporción de bacterias Gram positivas y Gram negativas.(6,7,39,79,124,125) Siqueira et al.(109) califican las infecciones endodónticas como mixtas y semi-específicas con predominio de bacterias anaerobias estrictas. La característica de semi-específica de estas infecciones viene dada por la correlación entre algunos grupos bacterianos y algunas formas de enfermedad periapical. Cuando se realizan cultivos de conductos radiculares infectados, parece frecuente la aparición de ciertas especies asociadas. Esto indica que existen interrelaciones entre ciertas bacterias, comensales o antagonistas.(124)
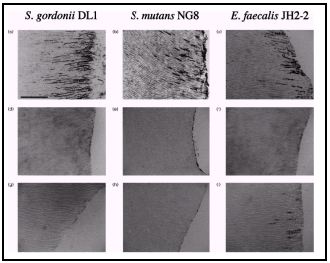
Las especies bacterianas dentro del sistema de conductos radicular infectado puede variar considerablemente. El predominio de la microbiota endodóntica se caracteriza por la presencia de cocos y bacilos.(36,91) Otros estudios han demostrado igualmente la presencia de filamentos y espiroquetas.(8,64)
El número de células bacterianas presentes en conductos radiculares infectados oscila por lo general entre <102 a >108. Se ha demostrado una correlación entre el tamaño de la lesión periapical y el número de especies bacterianas presentes en el sistema de conductos radiculares. Por lo tanto, dientes con grandes lesiones usualmente alojan mayor número de especies bacterianas y mayor densidad de bacterias en el conducto radicular que aquellos dientes con lesiones pequeñas.(124) Estudios recientes reportan la presencia de hongos en conductos radiculares infectados.(64,80,81,91,92,93,104,105,136) Los hongos no son microorganismos frecuentemente encontrados en infecciones endodónticas primarias, su presencia es más común en infecciones secundarias o persistentes, posterior a la preparación del conducto radicular, probablemente como resultado de contaminación durante el procedimiento, o en casos de dientes obturados endodónticamente con lesiones perirradiculares resistentes al tratamiento de conductos.(69) Como se mencionó anteriormente, existen varios factores capaces de influenciar la colonización microbiana en el interior del sistema de conductos radiculares. La disponibilidad de nutrientes, la baja tensión de oxígeno molecular en pulpas necróticas y las interacciones microbianas pueden ser determinantes en la ecología del sistema de conductos radiculares.(79,124) Existen condiciones dentro de los conductos radiculares que permiten el crecimiento de bacterias anaerobias capaces de catabolizar aminoácidos y péptidos simples. A medida que las bacterias obtienen energía de la fermentación de carbohidratos puede restringirse la disponibilidad de nutrientes en el ecosistema. El tejido pulpar degenerado y los fluidos tisulares constituyen fuentes esenciales de nutrientes dentro del sistema de conductos radiculares.(124) Así como los microorganismos proteolíticos presentes utilizan aminoácidos y péptidos simples como fuentes de energía, también producen ácidos carboxílicos, amoníaco y sulfuro de hidrógeno. La composición de la microbiota del sistema de conductos radiculares está significativamente influenciada por la toxicidad de sus productos metabólicos.(124) Otro factor importante en la ecología bacteriana es la producción de bacteriocinas. Una bacteriocina es una proteína producida por un microorganismo, capaz de inhibir el crecimiento de un número limitado de otras especies. Es posible que estas puedan influenciar la ecología de los conductos radiculares suprimiendo el crecimiento de otras especies que compiten por el mismo nicho ecológico. Esto explica porque algunas especies no están asociadas entre sí en el sistema de conductos radiculares. Por ejemplo, Streptococcus spp. es capaz de inhibir el crecimiento de varias bacterias anaerobias. Esta inhibición es mediada por la producción de peróxido de hidrógeno por parte del microorganismo y la misma puede tener lugar en las porciones coronales de los conductos, en dientes con pulpa expuesta al medio bucal donde existe suficiente disponibilidad de oxígeno molecular.(124) En 1982, Fabricius et al.(28) desvitalizaron mecánicamente pulpas de monos, las expusieron al medio bucal durante una semana y posteriormente las sellaron durante 3, 6 y 35 meses. Los análisis bacteriológicos de estos períodos de observación mostraron que el 85-98% de las bacterias aisladas fueron anaerobias. Cuando la pulpa se vuelve necrótica hay un aumento de las especies anaerobias estrictas Gram negativas y Gram positivas que ocurre a expensas de especies anaerobias facultativas. En el segmento apical de los conductos radiculares (donde ocurre la interacción con los tejidos periapicales), las bacterias proteolíticas constituyen la proporción principal de la microflora aislada. El contacto íntimo con los tejidos periapicales vitales se puede presumir que aumenta la presión de oxígeno e inhibe su crecimiento. Sin embargo, la pequeña proporción de anaerobios facultativos presentes en la región apical pueden consumir el oxígeno molecular disponible dando por resultado un potencial bajo de óxido-reducción que favorece la colonización de las especies anaerobias estrictas.(113) Lana et al.(52) analizaron las especies involucradas en las infecciones endodónticas. Sus resultados mostraron el aislamiento de 308 microorganismos en 27 de 31 conductos radiculares (87,1%) durante la primera recolección, y 278 (90,3%) de estos fueron identificados por género y especie. El número de especies aisladas en cada conducto infectado fue de 1-11 especies, con un promedio de 5 especies por conducto. Un 81,5% de los conductos mostraron infecciones polimicrobianas. En un 88,9% de los conductos fueron aislados microorganismos anaerobios estrictos, en un 51,8% anaerobios facultativos, en un 18,5% microaerofílicos y en un 7,4% de los conductos se aislaron hongos. Los autores hacen énfasis en la calidad polimicrobiana de la flora endodóntica predominantemente mixta, con predominio de bacilos anaerobios Gram negativos. Recientemente, Jacinto et al.(45) evaluaron la composición de la flora bacteriana de 48 conductos radiculares constituyendo las bacterias anaerobias estrictas más del 70% de los microorganismos aislados.
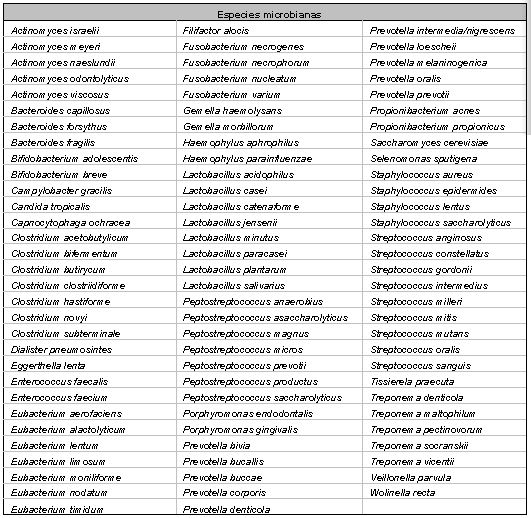
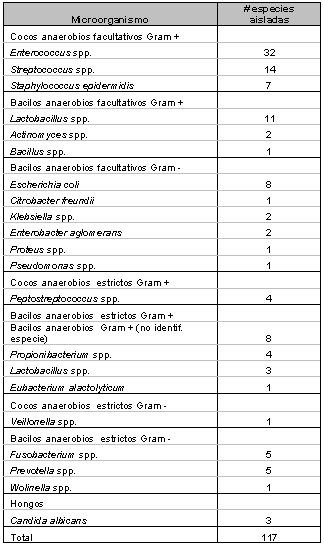
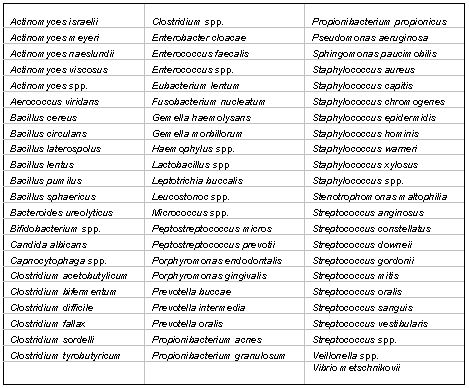
Tipos de microorganismos y especies involucradas en el sistema de conductos radiculares en pulpas necróticas Los primeros estudios(139) sobre la microbiología endodóntica, sugerían que la microflora bacteriana se presentaba con un predominio de especies aerobias y anaerobias facultativas sobre anaerobias estrictas. También se señalaba un predominio de bacterias sobre hongos, de cocos sobre bacilos y espirilos, y predominio de Gram positivos sobre Gram negativos, reportándose la presencia de Streptococcus ssp. (_ y ß-hemolíticos), cocos Gram negativos y lactobacilos junto a una variedad de anaerobios (que varían en su resistencia al oxígeno atmosférico) en un número que se suponía era menor del 50% del total de microorganismos aislados. Como se mencionó anteriormente, los estudios de Sundqvist(123), en 1976, marcan pauta en la tipificación de microorganismos anaerobios estrictos y anaerobios facultativos involucrados en las lesiones pulpares y periapicales, con la introducción de las técnicas de anaerobiosis. La genética molecular, más recientemente empleada para la identificación de patógenos bucales, ha permitido la tipificación de cada vez más especies relacionadas a la infección endodóntica, así como ha conllevado a variaciones en la taxonomía microbiológica, provocando cambios serios en la definición de la microbiota predominante en el sistema de conductos radiculares. Actualmente se conoce una amplia variedad de microorganismos capaces de colonizar el sistema de conductos radiculares. En la tabla I se muestran las especies aisladas hasta la fecha en diferentes estudios microbiológicos sobre conductos necróticos. En estas investigaciones fueron empleadas desde técnicas de identificación por tinción, hasta las más recientes técnicas de hibridación de ADN.
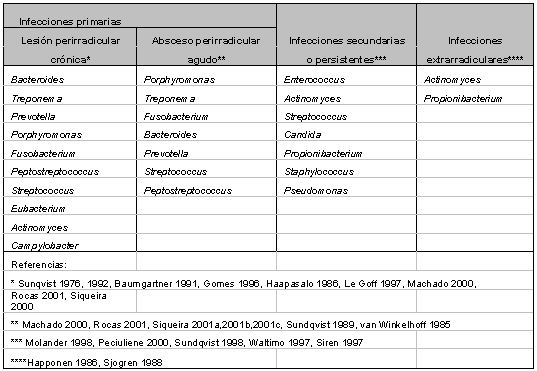
Dados los resultados de múltiples investigaciones se puede afirmar que el sistema de conductos radiculares puede ser altamente infectado y consecuentemente, alojar microorganismos en todas las áreas del mismo.(91) En general, las especies más frecuentes en infecciones primarias de conductos radiculares infectados pertenecen usualmente a los géneros Fusobacterium, Prevotella, Porphyromonas, Treponema, Peptostreptococcus, Eubacterium, Actinomyces y Streptococcus.(45,52,79,109,122,124,125) Sin embargo, pareciera que no todas las especies presentes en las infecciones endodónticas son capaces de producir la enfermedad. Evidencias científicas sugieren que un restringido grupo de especies microbianas presenta mayor prevalencia en las diferentes formas de lesiones perirradiculares.(33,62,84b,123,124,125,136) Esta asociación sugiere un papel patogénico de las mismas. Es así como ha sido reportado que algunos grupos de especies microbianas están asociadas con formas específicas de lesiones perirradiculares, lo cual le confiere a la infección endodóntica la calidad de semi-específica. La tabla II presenta los principales microorganismos asociados a formas específicas de lesiones perirradiculares.
Sundqvist(122) investigó las relaciones comensales o antagónicas entre los microorganismos en los conductos radiculares de dientes con periodontitis apical. Se tomaron muestras de 65 conductos radiculares humanos infectados y se analizaron según especies, frecuencia de aparición y proporción de la flora aislada total. Las especies más frecuentes fueron Fusobacterium nucleatum, Prevotella intermedia, Peptostreptococcus micros, Peptostreptococcus anaerobius, Eubacterium alactolyticum, Eubacterium lentum y Wolinella recta. Las asociaciones positivas más evidentes fueron encontradas entre F. nucleatum y P. micros, Porphyromonas endodontalis, Selenomona sputigena y W. recta. También se evidenció una asociación positiva entre P. intermedia y P. micros, P. anaerobius y Eubacterium. Los resultados de este estudio son consistentes con el concepto de que existe un ambiente especial y selectivo dentro del sistema de conductos radiculares, esto se debe, en parte, a la naturaleza de cooperación y antagonismo de las relaciones entre las bacterias. Por su parte, Peters et al.(79) investigaron las combinaciones bacterianas presentes en infecciones primarias con lesiones perirradiculares. Las especies más frecuentemente encontradas fueron Prevotella intermedia, Peptostreptococcus micros y Actinomyces odontolyticus. También se reportaron asociaciones positivas entre P. intermedia y P. micros, entre P. intermedia y Prevotella oralis, A. odontolyticus y P. micros, Bifidobacterium spp. y Veillonella spp. Estos resultados indican que los patógenos endodónticos no se presentan aleatoriamente y pueden estar asociados en combinaciones específicas. Los bacilos anaerobios pigmentados de negro (Porphyromonas spp. y Prevotella spp.) han sido implicados con mucha frecuencia en la etiología de las patologías pulpares y perirradiculares. Es probable que la actividad proteolítica de estas bacterias sea un factor de virulencia altamente significativo debido a que las proteinasas producidas por estos microorganismos tienen efectos sobre las poteínas plasmáticas envueltas en los procesos de defensa.(125) El Género Porphyromonas actualmente incluye doce especies pigmentadas y una no pigmentada. De las cuatro especies aisladas en seres humanos, sólo P. endodontalis y P. gingivalis han sido aisladas consistentemente en infecciones endodónticas, y se ha determinado que juegan un papel importante en la etiología de las diferentes formas de lesiones perirradiculares incluyendo los abscesos perirradiculares agudos.(77,96) Ha sido ampliamente demostrada de igual forma, la presencia de ciertas especies del Género Prevotella en conductos radiculares infectados, entre los cuales se encuentran P. nigrescens, P. intermedia, P. melaninogenica, P. denticola, P. loescheii y P. corporis.(25,45,52,108,125) Sundqvist(125) en 1989, evaluó la microbiota de conductos radiculares infectados y más específicamente la prevalencia de Bacteroides pigmentados de negro, actualmente tipificados como Porphyromonas y Prevotella. En una muestra de 72 conductos se identificaron 173 cepas microbianas. Se identificaron estos microorganismos en un 30% de los conductos radiculares. Las especies más frecuentemente encontradas fueron Fusobacterium nucleatum, Bacteroides intermedius, Peptostreptococcus anaerobius, Eubacterium lentum y E. alactolyticum. En la misma línea de investigación, Fabricius et al.(28) en un estudio realizado en monos, sobre 24 pulpas infectadas con la microbiota bucal y posteriormente selladas, observaron que los microorganismos hallados con mayor frecuencia fueron Bacteroides (Prevotella y Porphyromonas) y bacilos anaerobios Gram positivos, así como se aislaron también pequeñas cantidades de bacterias anaerobias facultativas. Por su parte, Jacinto et al.(45) demostraron la presencia de bacterias pigmentadas de negro en un 34% de los conductos con pulpas necróticas. Dougherty et al.(25) y Siqueira et al.(108) encontraron un 67% y un 59,3% de bacterias pigmentadas de negro respectivamente. Algunos estudios señalan que P. nigrescens es la bacteria pigmentada de negro predominante en cultivos de conductos radiculares infectados.(3,25,31) Sin embargo, otros estudios han demostrado una mayor prevalencia de P. intermedia.(7,125) Las bacterias pigmentadas de negro están siempre asociadas con otras bacterias, confirmando las relaciones sinérgicas entre las bacterias encontradas en infecciones polimicrobianas, especialmente con microorganismos Gram positivos. Estas bacterias poseen requerimientos nutricionales muy específicos los cuales son aportados por bacterias específicas tales como Peptostreptococcus micros, Eubacterium spp. y Campylobacter rectus.(126) Así como la presencia de bacterias pigmentadas de negro ha sido demostrada y se ha determinado su importancia en la patogénesis de la enfermedad pulpar y periapical, otros microorganismos se han podido detectar constantemente en diversos estudios realizados sobre microbiología endodóntica. Peters et al.(79), reportaron que las especies predominantes en 58 dientes con pulpas necróticas y periodontitis apical crónica fueron Prevotella intermedia, Peptostreptococcus micros y Actinomyces odontolyticus. Estos resultados son comparables con los obtenidos por otros estudios(33,124) realizados bajo condiciones similares. Diferentes especies de Peptostreptococcus han sido identificadas en conductos radiculares y en ocasiones asociados a sintomatología (dolor).(45) P. micros es un coco anaerobio Gram positivo, frecuentemente aislado de pulpas necróticas con infección primaria. Siqueira et al.(103) estudiaron la presencia de este microorganismo en infecciones endodónticas primarias arrojando un 28% de prevalencia asociada a diferentes formas de periodontitis apical. Otros microorganismos involucrados en infecciones primarias del sistema de conductos radiculares son los pertenecientes al Género Actinomyces, bacilos Gram positivos anaerobios facultativos. Tang et al.(128) demostraron la presencia del microorganismo en 16 de 32 conductos con infección primaria. La tasa de prevalencia de las diferentes especies fue: A. odontolyticus un 31,3%, A. meyeri un 9,4%, A. naeslundii un 9,4%, A. israelii un 6,3% y A. gerencseriae un 3,1%. En los casos con caries o historia de caries, A. odontolyticus fue aislado con mayor frecuencia mientras que en los casos asociados a traumatismo se evidenció la presencia significativa de A. naeslundii. También se han aislado frecuentemente de conductos radiculares infectados diversas especies del género Fusobacterium, bacilo anaerobio estricto, Gram negativo, no formador de esporas, que habitualmente se presenta en cavidad bucal.(45,52,79,109,122,124,125) Fouad et al.(30) en un estudio bajo técnicas de hibridación de ADN demostró la alta frecuencia de Fusobacterium nucleatum, así como de otros patógenos (Peptostreptococcus micros, Streptococcus spp. y Prevotella nigrescens) sobre otros microorganismos involucrados en infecciones primarias. Autores como Sundqvist(122) y Lana et al.(52) reportaron a Fusobacterium nucleatum como la especie encontrada con mayor frecuencia en conductos necróticos. Recientemente, Gomes et al.(34) estudiaron la microbiota de conductos radiculares con infección primaria. Sesenta conductos radiculares, 41 con infección primaria y 19 con infección secundaria arrojaron 56 especies y un máximo de 10 especies por conducto. Un 70% lo constituyeron especies anaerobias estrictas o microaerofílicas. Las especies más frecuentemente aisladas fueron: Peptostreptococcus micros (35%), Fusobacterium necrophorum (23.3%), Fusobacterium nucleatum (11.7%), Prevotella intermedia (16.7%), Porphyromonas gingivalis (6.7%) y Porphyromonas endodontalis (5%). La microflora aisada de las infecciones primarias con periodontitis apical fue de carácter mixto, comprendiendo bacterias Gram negativas y Gram positivas, principalmente microorganismos anaerobios y conteniendo al menos tres especies por conducto. Streptococcus spp. ha sido identificado igualmente en infecciones de origen odontogénico.(30) Especies como S. anginosus. S. constellatus, S. gordonii, S. intermedius, S. milleri, S. mitis, S. mutans, S. oralis y S. sanguis han sido reportadas en numerosas investigaciones de carácter microbiológico.(8,33,34,45,52,69,77,79,84b,98,99,102,109,125) Este Género bacteriano se ha asociado a sintomatología en las infecciones endodónticas(30) y al dolor a la percusión.(45) Pocos estudios han reportado la presencia de hongos en infecciones primarias endodónticas. Sen et al.(91) evidenciaron hongos en las paredes de conductos radiculares de dientes infectados. En cuatro de las muestras se presentaron en forma de levaduras y en una se presentaron en forma de hifas. Sin embargo, ha sido señalado que la presencia de hongos en conductos radiculares es básicamente infrecuente (10%) y podría estar asociado a la presencia de estos microorganismos en saliva.(41) Recientemente, han sido reportados nuevos patógenos en infecciones endodónticas, posterior a la introducción de los métodos de genética molecular. En un estudio(99) publicado en 2003, se demostró en conductos radiculares infectados, la presencia de una especie no descrita anteriormente, Filifactor alocis. Este microorganismo, detectado bajo técnicas de identificación PCR (Reacción en Cadena de la Polimerasa), fue aislado en el 46% de las muestras estudiadas. Esta frecuencia relativamente alta de detección de Filifactor alocis asociada a infecciones endodónticas, implica la posibilidad de estar involucrada en la patogénesis y mantenimiento de las lesiones perirradiculares. Debido a su alta prevalencia y su relación con otras patologías bucales, particularmente con periodontitis marginal, es una especie potencial para formar parte del restringido grupo de patógenos endodónticos. Otro microorganismo últimamente reportado, Bacteroides forsythus, recientemente reclasificado como Tannerella forsythensis, es un bacilo anaerobio estricto Gram negativo, altamente pleomórfico, el cual fue identificado en un 52% del total de casos estudiados en pulpa necrótica. En los casos asintomáticos se presentó en un 59,1%, un 40% en periodontitis apical aguda y un 50% en abscesos periapicales agudos. Estos resultados sugieren una asociación de este microorganismo con la patogénesis de diferentes formas de patología perirradicular.(84b) Otros estudios han determinado la presencia de espiroquetas en conductos radiculares infectados. Baumgartner et al.(8) en un estudio publicado en 2003 demostró la presencia de Treponema en 20 de 54 (37%) muestras. T. socranskii fue la especie más frecuentemente detectada (44,9%), seguida por T. maltophilum (29,7%), T. denticola (28,9%), T. pectinovorum (13,7%), y T. vincentii (5,1%). Se presentaron asociaciones importantes entre T. maltophilum y T. socranskii, así como entre T. maltophilum y T. denticola. La información obtenida por las múltiples investigaciones llevadas a cabo en infecciones primarias de conductos radiculares conlleva a señalar el carácter mixto y complejo de la microbiota del sistema de conductos radiculares. Con el continuo avance en las técnicas microbiológicas se hace inminente la identificación de cada vez más especies involucradas en las infecciones pulpares y perirradiculares, así como su repercusión en el perfeccionamiento de la terapéutica endodóntica.
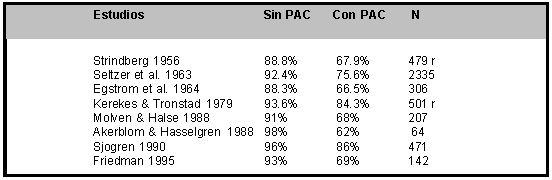
Aspectos microbiológicos de la Periodontitis Apical Crónica Persistente Periodontitis apical crónica persistente. Definición. La resorción ósea apical, identificada radiográficamente como una imagen radiolúcida, es una característica diagnóstica importante de la periodontitis apical. Tal como se ha descrito anteriormente, las bacterias y sus productos son considerados el principal agente etiológico de la necrosis pulpar y las lesiones periapicales.(47,51,63,123) Por lo tanto, el objetivo del tratamiento endodóntico es eliminar los microorganismos del sistema de conductos radiculares y prevenir la sobreinfección del mismo. Cuando el tratamiento es capaz de realizar esta desinfección de forma apropiada, usualmente cicatriza la lesión periapical por regeneración ósea; proceso que se caracteriza por una reducción gradual y finalmente la resolución de la imagen radiolúcida periapical, observada en las subsecuentes radiografías de control del tratamiento.(118) La periodontitis apical constituye un factor de gran influencia en el pronóstico del diente endodónticamente tratado, estableciéndose su tasa de éxito entre 62-86%, disminuyendo su tasa de éxito entre 10-25% en comparación al diente sin periodontitis apical.(17,49,56,88,89,90,112,118) En la tabla III se pueden observar los resultados de algunos de los estudios de pronóstico del diente endodónticamente tratado, que comparan la tasa de éxito entre dientes sin periodontitis apical y con periodontitis apical. De los resultados de estas investigaciones se desprende la consistente demostración del compromiso de reparación que muestran los dientes con lesiones perirradiculares.
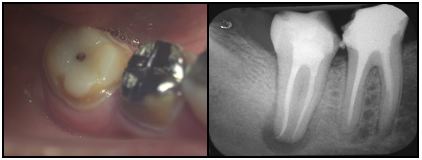
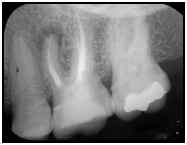
Ese 10-25% de lesiones periapicales que no responden a la terapia endodóntica local, corresponden a las periodontitis apicales crónicas persistentes. En la mayoría de los casos, el fracaso endodóntico es atribuido a la persistencia de infección intrarradicular(62,69), cuando los procedimientos del tratamiento no cumplen con los estándares satisfactorios para el control y eliminación de esta microbiota, o se suscita la recontaminación del sistema de conductos radiculares por vía coronaria.(84a) Los microorganismos persistentes en los conductos radiculares pueden haber estado presentes originalmente en la pulpa necrótica y sobrevivir a los procedimientos de limpieza químico-mecánica. Estos pudiesen estar localizados en conductos no tratados, ramificaciones y áreas no instrumentadas del sistema de conductos radiculares.(94,111) En la mayoría de los casos, el fracaso del tratamiento endodóntico es el resultado de la persistencia de microorganismos en la porción apical del sistema de conductos radiculares.(94) Sjogren et al.(111) estudiaron el papel de los microorganismos persistentes en el resultado y pronóstico del tratamiento endodóntico no quirúrgico. Este trabajo reveló que el estado microbiológico del sistema de conductos radiculares al momento de la obturación es un factor crítico en la determinación del resultado del tratamiento. El porcentaje de éxito en casos de obturación con cultivos negativos fue de un 94%, lo que se consideró estadísticamente significativo en comparación con un 68% de éxito en casos con cultivos positivos. Las influencias ambientales que operan en los conductos radiculares durante el tratamiento permiten que ciertos microorganismos sobrevivan, y dependiendo de diversos factores, induzcan al fracaso del mismo. Para sobrevivir al tratamiento de conductos, los microorganismos deben soportar las medidas de desinfección y adaptarse a un ambiente con pocos nutrientes disponibles. Por lo tanto, las pocas especies que tienen esta capacidad pueden estar involucradas en el fracaso del tratamiento de conductos.(94) Las bacterias localizadas en áreas tales como istmos, ramificaciones, deltas, irregularidades y túbulos dentinarios pueden a veces no ser afectadas por los procedimientos de desinfección endodóntica.(93) Es probable que el suministro de nutrientes a las bacterias ubicadas en las ramificaciones y deltas apicales se mantenga inalterado después del tratamiento endodóntico. Sin embargo, las bacterias presentes en los túbulos dentinarios e istmos pueden sufrir una drástica reducción del sustrato. En algunas regiones anatómicas, las bacterias quedan atrapadas por el material de obturación y generalmente mueren o se evita que proliferen hacia los tejidos periapicales. Por otra parte, las bacterias provenientes de la cavidad bucal pueden contaminar el sistema de conductos radiculares durante el tratamiento debido a un control inadecuado de la asepsia.(85) Un estudio realizado por Siren et al.(93) analizaron la relación entre los resultados microbiológicos y los procedimientos clínicos del tratamiento. Los hallazgos de esta investigación demostraron que en aquellos casos donde hubo ausencia de sellado coronario en algún momento del tratamiento fueron encontradas bacterias entéricas con más frecuencia que en casos con sellado adecuado entre citas. De los casos con bacterias entéricas, el 55% había estado en comunicación con el medio bucal durante el tratamiento. Así mismo, este tipo de bacterias se aisló con más frecuencia en casos con un alto número de citas antes de la toma de las muestras. De estos resultados se deriva la importancia de la asepsia controlada a lo largo del tratamiento de conductos no quirúrgico. Otra forma de infección por vía coronaria, es la que se suscita posterior al tratamiento endodóntico. Ray y Trope(84a) en 1995 estudiaron la relación de la calidad de la restauración coronaria y de la obturación endodóntica con el estatus periapical de dientes tratados endodónticamente. Los resultados de este trabajo señalan un 91,4% de éxito en casos de obturación y restauración adecuadas, un 44,1% en casos de obturación adecuada con restauración defectuosa, un 67,6% en casos de obturación defectuosa con restauración adecuada, y, un 18,1% en casos de obturación y restauración defectuosas. Sus resultados indican la importancia crítica de la restauración coronaria sobre el éxito del tratamiento de conductos y provee evidencia clínica de que la obturación radicular no es una barrera adecuada ante la microfiltración. Así mismo, ha sido afirmado, que el riesgo a sobreinfección es dependiente de la calidad de la obturación radicular y coronaria en conjunto.(87) El gráfico 3, muestra un caso de periodontitis apical crónica persistente de un segundo molar inferior derecho, el cual, veinte meses posteriores a la realización del tratamiento endodóntico, se presenta sin una adecuada restauración coronaria.
Han sido reportados igualmente, factores no microbiológicos, intrínsecos y extrínsecos, que pueden estar implicados en el fracaso del tratamiento de conductos. En estos casos, no se han encontrado microorganismos en las muestras, y el fracaso ha sido atribuido a reacciones de cuerpo extraño en los tejidos periapicales.(94) Sin embargo, la literatura sugiere que la infección persistente intrarradicular y la infección secundaria son las causas principales del fracaso endodóntico no dando mayor importancia a este tipo de factores.
Consideraciones clínicas y radiográficas de la periodontitis apical crónica persistente La periodontitis apical es la inflamación del periodonto en los portales de entrada del sistema de conductos radiculares. Típicamente, la lesión se localiza a nivel del ápice radicular, pero las comunicaciones existentes a todo lo largo de la superficie radicular con el periodonto pueden permitir el desarrollo de lesiones laterales y furcales. Estas lesiones muestras características clásicas de inflamación.(43) Para realizar un adecuado diagnóstico de periodontitis apical crónica persistente debe realizarse la evaluación clínica y radiográfica del caso. Crump y Natkin(20) consideran que la evaluación del resultado del tratamiento debe constar de varias etapas: un examen visual de tejidos blandos, seguido por la palpación de tejidos alrededor del diente tratado y/o adyacentes, percusión del diente tratado y/o adyacentes, medición de surcos gingivales y el interrogatorio al paciente. En 1994, la Sociedad Europea de Endodontología, en cooperación con la Sociedad Británica de Endodoncistas publicaron los criterios a tomar en cuenta para evaluar los dientes tratados endodónticamente. Los criterios a evaluar consisten en: sensibilidad a la palpación, movilidad dentaria, presencia o no de enfermedad periodontal, trayecto fistuloso, función del diente tratado, signos de infección o inflamación y síntomas subjetivos.(114) Según estos criterios, el tratamiento se considera inaceptable si presenta síntomas subjetivos persistentes, trayecto fistuloso recurrente o inflamación, incomodidad reproducible después de percusión, palpación o masticación, movilidad excesiva o deterioro periodontal progresivo o imposibilidad de masticación con el diente afectado. Clínicamente los casos de periodontitis apical crónica persistente pueden presentarse tanto asintomáticos como sintomáticos. Pinheiro et al.(80) analizaron la relación existente entre los microorganismos involucrados en esta patología y la sintomatología asociada. Estos autores apuntan que de un total de 60 casos, sólo cinco refirieron dolor agudo. El resto no manifestó dolor espontáneo, sin embargo, veinte de estos reseñó historia de dolor. De igual forma, otro factor evaluado fue el dolor a la percusión, donde veinte casos respondieron positivo. Del total de dientes estudiados, cinco casos presentaron trayecto fistuloso. Otro signo evaluado por los autores antes referidos fue la presencia de restauración coronaria definitiva. De los sesenta dientes evaluados, 37 presentaron restauraciones permanentes de las cuales 22 estaban defectuosas y 15 aceptables. Diez dientes presentaron restauración provisional defectuosa fisurada o fracturada y 13 no presentaron ningún tipo de restauración coronaria. Desde el punto de vista radiográfico, para diagnosticar esta patología, se debe estar en presencia de un diente tratado endodónticamente, cuyo material de obturación pueda ser evidenciado en el espacio de los conductos radiculares radiográficamente. Esta obturación puede ser aceptable o inaceptable, lo que indica que no es indispensable que el tratamiento se aprecie defectuoso para presentar una periodontitis apical crónica persistente.
Los cambios en la mineralización y estructura del hueso adyacente al sitio de inflamación constituye la base de los procedimientos diagnósticos radiográficos para la detección y monitorización de la periodontitis apical crónica.(43) Las etapas en el desarrollo y la cicatrización de la periodontitis apical crónica, granulomas o quistes, son reflejadas por cambios radiográficos en el área periapical. Estos cambios son importantes a la hora de establecer el diagnóstico y plan de tratamiento de estas lesiones. Por lo tanto, el diagnóstico radiográfico de la periodontitis apical se basa en las desviaciones desde la anatomía periapical normal.(43) Las actividades biológicas de la periodontitis apical crónica pueden afectar ligamento periodontal, lámina dura, hueso esponjoso, hueso cortical y estructura radicular.(1,4,43,117) El ligamento periodontal provee el espacio para el infiltrado celular inicial. Este sirve como punto de partida de los procesos resortivos así como de punto final de los procesos de cicatrización. Un ligamento periodontal ensanchado está asociado con inflamación inicial o residual, y aparece como signo de inflamación crónica.(43) Andreasen y Rud(1) apuntan que si el grosor del ligamento periodontal es más del doble de su espesor original, esta presente una inflamación moderada o severa. En caso de la periodontitis apical, el ensanchamiento del ligamento se limita al área periapical. Este ensanchamiento puede estar, en ocasiones, asociado a un ligero exceso de material de obturación en casos de dientes endodónticamente tratados donde persiste la toxicidad o la colonización microbiana.(82) Los cambios en la integridad de la lámina dura también son indicativos tempranos de lesión periapical y estos pueden ser visibles radiográficamente.(4) Sin embargo, ninguno de estos cambios son patognomónicos de las etapas iniciales o de cicatrización de la periodontitis apical crónica.(43) El hueso esponjoso y cortical, al sufrir cambios en su estructura, puede ser un signo de periodontitis apical. Se puede observar radiográficamente una rarefacción radiolúcida, indicativo de inflamación de moderada a severa. En inflamación leve se aprecian alteraciones menores en la estructura ósea. En otros casos, también con inflamación leve, el proceso inflamatorio puede manifestarse como periodontitis apical condensante u osteitis condensante, donde radiográficamente se aprecia una imagen radioopaca rodeada de hueso normal, en la región apical del diente.(117) La superficie radicular también puede ser afectada por resorción consecuente a la lesión al cemento. Esto puede ocasionarse tras periodontitis apicales de larga data, tanto en dientes tratados endodónticamente como no tratados. La forma del ápice radicular quedará permanentemente alterada.(43) El tiempo de desarrollo de la necrosis, la infección y los cambios radiográficos pueden, sin embargo, variar ampliamente de un caso a otro, lo que se traduce en que el punto de partida de la periodontits apical crónica es imposible de definir.(43) En los dientes tratados endodónticamente que no presentan lesión alguna al momento de la obturación, pero se desarrollan posterior al tratamiento, ésta se presenta generalmente después del primer año.(43) La cicatriz apical también puede desarrollarse después del tratamiento de conductos no quirúrgico así como después de la cirugía endodóntica, causando problemas en el diagnóstico de la periodontitis apical.(43,68) En el caso de la cicatrices post-quirúrgicas, estas pueden disminuir en tamaño su apariencia, y presentar una o más de las siguientes características: identificación de estructura ósea dentro de la rarefacción, la imagen puede ser irregular e inclusive estar rodeada por un borde de hueso compacto, la lesión puede estar localizada asimétricamente alrededor del ápice, y la conexión de la lesión con respecto al ligamento periodontal puede ser angulada.(43) En 1999, Nair et al.(68) publicaron seis casos con diagnósticos presuntivos de periodontitis apical crónica persistente, de los cuales, tras la evaluación histológica, fueron evidenciados dos ellos como cicatriz apical. El tiempo de evaluación para la determinación de la cicatrización de la periodontitis apical crónica es definitivo ya que la cicatrización es un proceso dinámico.(72,118) Consecuentemente el resultado del tratamiento observado después de un período de tiempo corto, difiere del observado en períodos de tiempo más largos.(55,118) Diversos estudios incluyen casos observados alrededor de seis meses post-operatorios, este período corto de observación no refleja los resultados a largo plazo.(118) La evaluación a un año aporta información significativa.(72) A los dos años de evaluación, período utilizado en la mayoría de los estudios, se reflejan los resultados del tratamiento endodóntico con suficiente precisión.(13) Sin embargo, se requieren entre 3-4 años para registrar un resultado estable del tratamiento.(13,49,72,118)
Microbiota involucrada en la periodontitis apical crónica persistente Características de la microbiota La mayoría de las bacterias y restos necróticos pulpares pueden ser removidos por los procedimientos endodónticos de rutina, que corresponden a la limpieza y conformación del sistema de conductos radiculares. Sin embargo, esto no siempre se logra en la práctica clínica. Las estrategias para combatir la infección se deben basar en un amplio conocimiento de la microflora endodóntica. Sin embargo, mientras la microbiota de pulpas necróticas ha sido estudiada exhaustivamente, la microbiología relacionada con el fracaso endodóntico esta escasamente documentada. La microbiota detectada en dientes con tratamiento de conducto con periodontitis apical crónica persistente varía sustancialmente de la identificada en dientes con pulpa necrótica con periodontitis apical crónica. (15,16,39,46,70,81,133,136) Desde los primeros estudios, tales como el de Bender y Seltzer(9) en 1952, se ha reportado la presencia de microorganismos resistentes a la terapia endodóntica. En esta investigación se evidenció la presencia de crecimiento microbiano, el cual consistía básicamente en hongos y bacterias tales como Enterococcus spp. y Streptococcus spp. Doce años más tarde, Engstrom y Frostell(26) reportaron crecimiento microbiano en dientes tratados endodónticamente en un porcentaje de un 38%. En el mismo se demostró que la microbiota predominante era básicamente anaerobios facultativos y anaerobios estrictos. Estos resultados son confirmados posteriormente por estudios como el realizado por Goldman y Pearson(35) en 1.969 donde fue evaluada la microbiota intrarradicular posterior a la limpieza endodóntica en 563 casos dando como resultado que un 23,6% presentó cultivos positivos. Sin embargo, los avances en las técnicas de toma de muestras y cultivos permitieron la realización de estudios posteriores en los cuales se determinó, más específicamente, la composición de la microbiota involucrada en casos de fracaso endodóntico. Nair et al.(69) en 1990 publican el primer trabajo de análisis de la microbiota de dientes con periodontitis apical crónica persistente a través de biopsia, uso de microscopio de luz y microscopio electrónico. En esta investigación, fueron evaluados nueve casos, los cuales presentaban lesiones periapicales entre 4 y 10 años posteriores al tratamiento de conductos. En seis de ellos se observó presencia de microorganismos en la porción apical del conducto. Cuatro de los casos presentaron bacterias y en dos se evidenciaron organismos similares a hongos. Uno de los casos presentó características histopatológicas sugerentes de una respuesta de cuerpo extraño a nivel del periápice. Sin embargo, en este estudio no se identificaron por género y especie los microorganismos detectados. Mas recientemente, Ferreira et al.(29b) en 2004 reportaron un caso de periodontitis apical crónica persistente tratado a través de cirugía apical, el cual fue analizado microbiológicamente a través del microscopio electrónico de barrido. Los resultados arrojaron presencia de cocos, bacilos y levaduras adheridas a la superficie radicular seccionada.
Sundqvist et al.(127) en 1998 evaluaron 54 dientes con tratamiento de conducto y lesión periapical persistente, los cuales fueron seleccionados para repetición de tratamiento cinco años después de haber sido tratados. Los resultados de este trabajo apuntaron que la microflora en la mayoría de los casos consistió en una sola especie, así como señalaron microorganismos predominantemente Gram positivos con aproximadamente igual proporción de anaerobios facultativos y estrictos. Los autores concluyen que la microbiota en los conductos radiculares después del fracaso endodóntico se diferencia drásticamente de la microbiota detectada en dientes no tratados. Por su parte, Molander et al.(62) en 1998, analizaron el estatus microbiológico de 100 dientes con periodontitis apical crónica persistente. Los autores reportaron microorganismos en 68 de los casos. En la mayoría de los conductos se aislaron una o dos especies microbianas (85%), y se evodenció un predominio de organismos Gram positivos anaerobios facultativos (69%). Estudios realizados por diversos autores,(15,16,39,70,75,76,81,101,119) posteriormente confirman los resultados obtenidos por investigaciones previas, concluyendo que la microbiota asociada a lesiones periapicales persistentes esta caracterizada por estar limitada a un pequeño número de especies microbianas, generalmente una sóla especie, con predominio de microorganismos Gram positivos anaerobios facultativos.
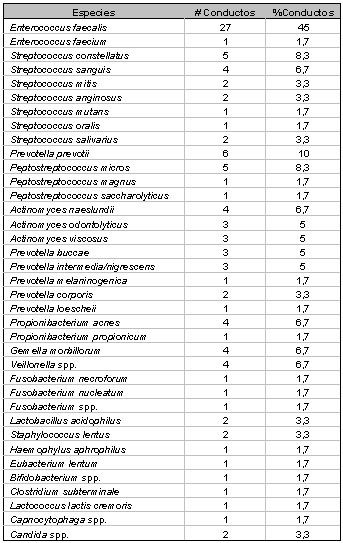
Tipos de microorganismos y especies involucradas Los primeros estudios realizados por Bender y Seltzer,(9) Éngstrom y Frostell(26), Goldman y Pearson(35), reportaron la presencia de microorganismos en conductos endodónticamente tratados y la prevalencia de Enterococcus faecalis en este tipo de patologías persistentes. Sin embargo, no es sino hasta las últimas dos décadas del siglo XX cuando se empiezan a desarrollar amplias líneas de investigación en este respecto. La microbiología de las lesiones periapicales persistentes se ha investigado de manera general por diversos estudios, analizando la composición de la microbiota de casos seleccionados con diagnóstico de periodontitis apical crónica persistente, evaluando tanto la microbiota intrarradicular(9,15,33,35,62,69,80,81) como la extrarradicular.(68,119) Así mismo ha sido estudiada en regiones geográficas específicas(39), incluso diferenciando casos sintomáticos de asintomáticos.(16,35) Del mismo modo, y más específicamente, ha sido estudiada la prevalencia de ciertos microorganismos en este tipo de patologías, tal es el caso de Enterococcus spp.,(37,75,76,93) Candida spp. (27,76,104,133,136) y Actinomyces spp. (46) entre otros, así como la susceptibilidad de ciertos microorganismos a los procedimientos de limpieza del sistema de conductos radiculares(15,33,58,81) y a medicamentos específicos.(2,9,32,35,38,54,60,83,71,86,115) Una de las primeras investigaciones bacteriológicas en esta área tras la introducción de las técnicas de anaerobiosis, fue llevada a cabo por Haapasalo et al.(37) en 1983, en la cual fueron evaluados dos casos de infecciones periapicales persistentes. Ninguno había respondido a la terapia endodóntica incluyendo antibioticoterapia. Las muestras fueron cultivadas e incubadas en condiciones aeróbicas y anaeróbicas arrojando como resultado la presencia de Enterobacter cloacae como única especie en el caso 1 y, Klebsiella pneumoniae y Enterococcus spp. en el caso 2. No se evidenció la presencia de bacterias anaerobias estrictas. Estudios previos a esta investigación,(48,57) reportaron una frecuencia de aparición de bacilos entéricos Gram negativos no mayor de un 5% en lesiones periapicales persistentes. Posteriormente, Siren et al.(93) analizaron la relación entre los procedimientos endodónticos y la presencia de microorganismos específicos en conductos radiculares infectados. En este trabajo se estudiaron ochenta casos de los cuales el 33% mostró presencia de Enterococcus faecalis como única especie. Otras bacterias entéricas anaerobias facultativas fueron identificadas, entre las cuales se encuentran Enterobacter sakazakii, Enterobacter agglomerans, Klebsiella oxytoga, Acinetobacter spp. y Pseudomonas aeruginosa, en los cuales, cuatro de diez casos correspondieron a infecciones producidas por una sola especie. Estas bacterias entéricas fueron encontradas con mayor frecuencia en casos de citas múltiples. Algunas especies frecuentemente asociadas a las bacterias entéricas que se encontraron en este estudio fueron Streptococcus spp., Fusobacterium nucleatum, Prevotella intermedia y Prevotella nigrescens. En 1996, Gomes et al.(33) investigaron la sensibilidad de la microflora endodóntica a los procedimientos biomecánicos del tratamiento de conductos. Para ello, fueron evaluados 42 conductos radiculares tomándose muestras en todos los casos antes de la limpieza y conformación y, entre siete y diez días posteriores a dicho procedimiento. En las primeras muestras, fueron aisladas 51 especies bacterianas diferentes. Posterior a la terapia endodóntica el micro-ambiente cambia de diversas formas. El principal efecto puede ser el cambio en la anaerobiosis. En este estudio se determinó un significativo descenso entre las especies anaerobias de la primera y segunda evaluación. En la segunda evaluación, se detectaron microorganismos tales como Enterococcus faecalis, Propionibacterium acnes, Veillonella parvula, Streptococcus parasanguis, Streptococcus gordonii, Streptococcus intermedius, entre otros. Se observaron especies individuales de un mismo grupo presentándose en un mismo caso entre la muestra 1 y 2, por ejemplo, Streptococcus intermedius, así como especies que disminuyen y otras que aumentan entre la primera y segunda muestra. En algunos casos, las especies detectadas se mantuvieron al mismo nivel en la muestra 2, es el caso de Bacteroides ureolyticus, Eubacterium alactolyticum, Haemophillus parainfluenzae, Fusobacterium necrophorum, Propionibacterium -propionicus, Staphylococcus epidermidis y E. faecalis. Este estudio confirmó la susceptibilidad de bacterias específicas a los procedimientos biomecánicos de la terapia endodóntica. Los autores concluyeron que ciertas especies son menos resistentes que otras a estos procedimientos. Un estudio de gran relevancia en la microbiología de dientes tratados endodónticamente con lesiones periapicales, fue publicado por Molander et al.(62) en 1998. Los autores evaluaron el estado de la microbiota intrarradicular de 100 casos de periodontitis apical crónica persistente. Todos los dientes presentaron tratamiento de conducto con no menos de cuatro años postoperatorios. Los fracasos fueron clasificados según el criterio de Strindberg, y todos se presentaron asintomáticos. El tamaño de las lesiones fue establecido radiográficamente y fue de 2 mm. en 14 casos, entre 3 y 5 mm. en 56 casos y 5 mm. en 30 casos. Los conductos fueron desobturados con instrumental rotatorio y manual, mientras en 21 casos se incluyó el uso de cloroformo como solvente. Las muestras fueron sembradas en agar Brucella para la incubación aerobia y en medio semi-líquido (HCMG-Sula) con el método de combustión de Hidrógeno para la incubación anaerobia. Los resultados demostraron la presencia de microbiota dentro del conducto en 68 de los 100 casos estudiados, detectando 117 especies microbianas. En la mayoría de los conductos, fueron aisladas de 1-2 especies (85%) con predominio de anaerobios facultativos Gram positivos (69%). El microorganismo detectada con mayor frecuencia fue Enterococcus spp., en 32 dientes. En 20 de los casos el crecimiento fue muy abundante. También fueron aisladas en cantidades importantes Lactobacillus spp., Escherichia coli, Streptococcus spp., Staphylococcus spp. Fusobacterium spp., Prevotella spp. y Candida albicans. (Tabla IV ). Concluyen estos autores que generalmente las bacterias anaerobias facultativas son menos sensibles a la actividad antimicrobiana que los anaerobios estrictos y, por lo tanto, es de esperarse que persistan más frecuentemente en conductos radiculares después de un tratamiento endodóntico inadecuado. Cuando los microorganismos anaerobios facultativos han estado en una fase latente con baja actividad metabólica por un período de tiempo, los cambios en las condiciones nutricionales desencadenan su crecimiento.(62)
Un estudio reportado por Cheung y Ho(16) realiza un interesante análisis microbiológico de dientes tratados endodónticamente con lesiones periapicales asintomáticas. Con una muestra de 18 casos, de más de cuatro años posteriores a la terapia endodóntica inicial, investigaron la microbiota intrarradicular relacionada. Los autores señalaron la presencia de microorganismos en el 67% de los casos, con prevalencia de cocos Gram positivos anaerobios facultativos. No observaron asociación entre el tamaño de la lesión periapical y el número de colonias aisladas. Se aislaron un total de 22 especies microbianas, entre cero y seis por conducto. Esto corrobora los resultados de estudios anteriores, acerca de la importante diferencia entre la microbiota de conductos tratados y no tratados endodónticamente. Los microorganismos más frecuentemente encontrados en este estudio correspondieron a Streptococcus spp., Pseudomonas spp. y Staphylococcus (coagulasa-negativa). Así mismo, no se detectó la presencia de espiroquetas. Un aspecto interesante de esta investigación fue la correlación entre la evaluación de la calidad radiográfica de la obturación endodóntica y la cantidad de microorganismos, existiendo mayor número de especies en obturaciones deficientes, similar a la reportada en conductos necróticos sin tratar, sugiriendo por lo tanto, fallas en el procedimiento de limpieza y conformación del sistema de conductos radiculares en estos casos. En cuanto a la presencia de Pseudomonas spp. en las muestras de este trabajo, los resultados contrastan con los de estudios previos(33,62) Estos son bacilos aerobios Gram negativos, no formadores de esporas, los cuales están ampliamente distribuidos en grifos de agua, comestibles, tierra. Específicamente P. aeruginosa es un conocido contaminante de las tuberías de agua de las unidades odontológicas. El hecho de que este microorganismo no se haya demostrado como integrante de la microbiota de pulpas necróticas, hace pensar que su presencia en el conducto radicular es producto de la contaminación durante el procedimiento endodóntico por falla en la cadena aséptica.(16) La presencia de especies de Staphylococcus tales como S. epidermidis, S. saprophyticus y S. haemolyticus también fue analizada en esta investigación. Estos microorganismos generalmente son considerados no patogénicos y su presencia es común en piel y mucosa, por lo que se infirió la posible contaminación en el procedimiento de la toma de muestras. La presencia escasa de Enterococcus faecalis, en contraste con estudios previos, no representó valores significativos. Sin embargo, los autores finalmente sugieren mejorar las técnicas microbiológicas para la obtención de resultados más específicos y claros. En la misma línea de investigación, en 2001 es publicado por Hancock et al.(39) un estudio sobre la microbiota presente en tratamientos endodónticos fracasados específicamente en la población norteamericana. Estos autores diseñaron la metodología a fin de evaluar la microbiota en dos muestras, la primera después de desobturar el conducto, realizado con un cono de papel, y la segunda, posterior al limado de las paredes del conducto. En la primera muestra se evidenció crecimiento microbiano en 33 de 54 muestras, un 61,1%, y en su mayoría entre una y dos especies por conducto. Los microorganismos predominantes fueron E. faecalis (10 de 33 muestras), Peptostreptococcus spp, Actinomyces spp. y Streptococcus spp. En la segunda muestra se evidenciaron microorganismos en 28 de 54 muestras (51,9%), entre 1 y 2 especies por conductos predominantemente. Las bacterias más frecuentes las representaron E. faecalis (9 de 28 muestras), Actinomyces spp. y Streptococcus spp. Curiosamente, no fue detectada Candida albicans. Se demostró así mismo que en más de un tercio de los casos las infecciones fueron producias por una sola especie. Este estudio confirmó lo planteado por Cheung y Ho(16) con respecto a la asociación entre la calidad de obturación endodóntica y el número de especies aisladas. Del mismo modo, este trabajo señaló la influencia significativa del nivel apical de obturación, donde al ser mayor de 2 mm. se presentó mayor cantidad de especies en el conducto, lo que fue asociado a fallas en el procedimiento de limpieza y conformación. Otro aspecto en el cual coinciden estos autores con estudios previos es en el papel de bacterias anaerobias facultativas Gram positivas en el fracaso del tratamiento endodóntico y la persistencia de lesiones periapicales, por lo que consideran que estas son menos susceptibles a las sustancias antimicrobianas que los anaerobios estrictos. En el año 2003, fue llevado a cabo por Pinheiro et al.,(80) un estudio enfocado a la identificación de la microbiota del sistema de conductos radiculares de dientes tratados endodónticamente con periodontitis apical crónica persistente. Para este estudio fueron analizados 60 casos bajo técnicas microbiológicas avanzadas en los cuales se evidenció crecimiento microbiano en 51 de las muestras. Se demostró la presencia de infección producida por una sola especie en 28 casos, ocho casos presentaron dos especies y 15 casos presentaron infección polimicrobiana (3 especies o más). Así mismo fueron relacionadas las especies aisladas a diversas variables, tales como, tipo de diente, tiempo del tratamiento (años), calidad de restauración coronaria, presencia de dolor, inflamación, dolor a la percusión, trayecto fistuloso y calidad de la obturación endodóntica. Este estudio involucró dientes con buena y pobre calidad de obturación endodóntica, mostrando una asociación significativa entre los conductos obturados deficientemente y las infecciones polimicrobianas. Así mismo, asociados a este tipo de infecciones se evidenciaron aquellos casos con dolor espontáneo o historia de dolor.(80) Del total de bacterias aisladas, un 57,4% correspondieron a anaerobios facultativos y un 83,3% a especies Gram positivas. El género más frecuentemente aislado fue Enterococcus spp., seguido de Streptococcus spp. y Actinomyces spp. coincidiendo estos resultados con estudios previos. Los microorganismos anaerobios estrictos detectados en este estudio correspondieron al 42,6% de los casos, siendo los más frecuentes Peptostreptococcus spp. asociadas frecuentemente a síntomas clínicos. Prevotella spp. y Fusobacterium spp. estuvieron asociadas a dolor espontáneo o historia de dolor. Prevotella intermedia/nigrescens estuvo asociada a dolor a la percusión (Tabla V). La presencia de trayectos fistulosos en este estudio estuvo asociada tanto a Streptococcus spp. como a Actinomyces spp. especialmente, A. naeslundii. En todos excepto un caso, la microbiota tuvo carácter mixto, aislándose también Prevotella spp., Peptostreptococcus, Fusobacterium spp. y E. faecalis.
La especie bacteriana aislada más frecuentemente fue E. faecalis, evidenciándose en un 52,94% de los casos, estando presente como único microorganismo en 18 de 27 muestras.(80) Afirman estos autores, corroborando anteriores planteamientos, que los microorganismos anaerobios facultativos Gram positivos, tales como Enterococcus spp., Streptococcus spp. y Actinomyces spp. son más resistentes a la instrumentación y a los agentes antisépticos, y por lo tanto, es de esperarse que se presenten en lesiones persistentes posteriores a tratamientos endodónticos inadecuados. En la misma línea de investigación, estos autores realizaron un segundo estudio(81) donde analizaron a profundidad, los microorganismos asociados al fracaso endodóntico, y específicamente, su sensibilidad a ciertos antibióticos. De los 30 casos examinados, lograron aislar 29 especies bacterianas. Seis de las muestras no arrojaron cultivos positivos, trece casos correspondieron a infecciones producidas por una sola especie, dos casos presentaron dos especies, y nueve casos correspondieron a infecciones polimicrobianas. Los géneros bacterianos más frecuentemente aislados estuvieron representados por Enterococcus (36,7%), Streptococcus (30%), Peptostreptococcus (23,3%), Actinomyces (13,3%), Prevotella (10%), Staphylococcus (10%), Gemella (10%), Fusobacterium (6,7%), Lactobacillus (6,7%), Propionibacterium (3,3%) y Haemophilus (3,3%).(81) La especie más prevalente fue Enterococcus faecalis, siendo aislada en 11 de 24 muestras. Así mismo se demostró la sensibilidad de este microorganismo a bencilpenicilina, amoxicilina y amoxicilina mas ácido clavulánico, siendo más débiles las reacciones ante los dos últimos antimicrobianos. Peptostreptococcus prevotii fue la segunda especie más frecuentemente aislada en este estudio, y fue sensible a bencilpenicilina, amoxicilina, amoxicilina con ácido clavulánico, y clindamicina. Otro estudio reciente, fue realizado por Chávez de Paz et al.(15) en 2003. El objetivo del mismo fue determinar la existencia o no de un patrón para que ciertas bacterias permanezcan después del tratamiento químico-mecánico de los conductos radiculares en dientes con periodontitis apical. Un análisis prospectivo evaluó muestras consecutivas de 200 dientes con tratamiento de conductos, referidas por odontólogos generales y especialistas en endodoncia para analizar los microorganismos cultivables. Para ser incluidas en el estudio en cuestión, las muestras debieron ser tomadas en una sesión del tratamiento subsiguiente a la sesión inicial de la terapia endodóntica. Todos los dientes presentaron evidencia clínica y/o radiográfica del periodontitis apical. Los resultados bacteriológicos fueron relacionados a los parámetros clínicos y radiográficos, incluyendo el estado del conducto antes del tratamiento, a saber, pulpa vital, pulpa necrótica o conducto obturado.(15) Un total de 248 cepas fueron aisladas a partir de 107 dientes que mostraron crecimiento bacteriano. Predominaron los microorganismos Gram positivos (85%). Lactobacillus spp. (22%), Streptococcus spp. (no-mutans) (18%), y Enterococcus spp. (el 12%). Las bacterias anaerobias Gram negativos fueron aisladas esporádicamente. Así mismo, se correlacionaron las lesiones radiográficas de gran tamaño, el dolor persistente y el uso de la medicación dentro del conducto con hidróxido de calcio (Ca(OH)2) con presencia bacteriana. Un estudio publicado en 2004 por Siqueira y Rocas(101) destacó la prevalencia de varias especies microbianas en casos de terapia endodónticas fracasadas, por medio de la prueba de Reacción en Cadena de la Polimerasa (PCR). En esta investigación fueron evaluados 22 dientes tratados endodónticamente con lesiones perirradiculares persistentes. Todas las muestras resultaron positivas para por lo menos una de las especies microbianas evaluadas. E. faecalis se detectó en un 77% de los casos, siendo el microorganismo más frecuentemente aislado. Otras de las especies de mayor prevalencia fueron Pseudoramibacter alactolyticus (52%), Propionibacterium propionicus (5%), Dialister pneumosintes (48%), y Filifactor alocis (48%). C. albicans estuvo presente en un 9% de las muestras. Los autores observaron que en aquellos casos obturados hasta 2 mm. del ápice radiográfico el número promedio de especies fue de 3, mientras los casos en los cuales la obturación se ubica a más de 2 mm. del ápice, el promedio fue de 5 especies. Esta diferencia fue estadísticamente significativa. Esta investigación arrojó como conclusión que los microorganismos presentes en los casos de fracasos endodónticos, presentan una fuerte relación con la etiología de la persistencia infecciosa. Debido a la alta incidencia observada de determinados microorganismos asociados a la periodontitis apical crónica persistente, diversas investigaciones se han enfocado a evaluar más específicamente las características, metabolismo y posibles causas de resistencia a la terapia endodóntica de las especies más prevalentes. Dentro de estos microorganismos que presentan una alta incidencia de detección en periodontitis apical crónica persistente, como se ha podido observar en los estudios anteriormente citados, E. faecalis es el más frecuentemente aislado dentro del sistema de conductos radiculares asociados a este tipo de lesiones. Los enterococos son patógenos humanos importantes, cada vez más resistentes a los agentes antimicrobianos. Estos microoorganismos previamente fueron considerados parte del Género Streptococcus pero se han reclasificado recientemente en su propio Género, llamado Enterococcus.(66) Hasta la fecha, se han descrito 12 especies patógenas para los seres humanos, dentro de los cuales los más comúnmente aislados han sido E. faecalis y E. faecium. Los enterococos causan entre un 5% y un 15% de los casos de endocarditis bacteriana. Así mismo, pueden causar infecciones de la zona urinaria, intraabdominal, pélvica, e infecciones de heridas; superinfecciones, particularmente en los pacientes que reciben cefalosporinas de amplio-espectro; y bacteriemias, a menudo junto a otros microorganismos.(66) Enterococcus spp. son cocos Gram positivos que se presentan en solitario, en pares y en cadenas cortas. Son microorganismos anaerobios facultativos capaces de crecer y sobrevivir en ambientes difíciles, por lo que pueden subsistir practicamente en cualquier ecosistema.(66) En los seres humanos, estos microorganismos son habitantes comunes del tracto gastrointestinal y del aparato genito-urinario. E. faecalis es una de las bacterias más comúnmente aisladas en el tracto gastrointestinal humano, constituyendo el 80-90% de las especies de Enterococcus aisladas en estudios recientes.(66)
Enterococcus spp. presentan una resistencia innata a la mayoría de los antibióticos, mostrando apenas una mínima sensibilidad a algunas de las sustancias mayormente activas.(66) Desde el punto de vista odontológico, E. faecalis ha comenzado a tomar importancia en la literatura endodóntica, debido a que esta bacteria es difícil de controlar con los medicamentos que se utilizan dentro del conducto actualmente. La instrumentación mecánica, sola o en combinación con agentes de irrigación antimicrobianos, ha mostrado ser insuficiente para la completa eliminación de microorganismos.(14) Este microorganismo ha demostrado su habilidad para sobrevivir en el sistema de conductos radiculares sólo, sin el soporte de otras bacterias.(28,93) Sin embargo la información acerca de la eficacia de medicamentos endodónticos sobre E. faecalis es limitada. E. faecalis se encuentra como parte integrante de la microbiota de dientes con pulpa necrótica sin tratar en proporciones muy bajas, por lo que algunos investigadores sugieren que su alta incidencia en casos de repeticiones de tratamiento se debe a entrada de microorganismos durante la terapia endodóntica, por una técnica de asepcia inadecuada, o entre citas, debido a un sellado coronario inadecuado.(39) Tal como se citó anteriormente, el estudio de Molander et al.(62) arrojó un 54% de cultivos positivos para E. faecalis en 100 dientes con periodontitis apical crónica persistente. Así mismo, un estudio específico sobre el aislamiento de E. faecalis en dientes con fracasos endodónticos, llevado a cabo por Peciuliene et al.(75) demostró la presencia del microorganismo en 14 de 25 muestras, y en cinco de ellas se presentó como única especie detectada. Los resultados de este estudio demostraron que E. faecalis es el microorganismo de mayor predominio (70%) en dientes endodónticamente tratados con periodontitis apical crónica persistente en pacientes de Lituania. Hancock et al.(39) determinaron la composición de la microbiota presente en dientes tratados endodónticamente con lesiones periapicales persistentes en Norteamérica, obteniendo en sus resultados, crecimiento bacteriano en 34 de 54 dientes, correspondiendo en un 30% de las bacterias aisladas a E. faecalis. También señalaron que el hidróxido de calcio no parece incrementar el crecimiento de este microorganismo en periodontitis apicales persistentes. En la búsqueda del mecanismo de resistencia de E. faecalis a la terapia endodóntica no quirúrgica, se han llevado a cabo diversos estudios, los cuales han tratado de comprobar diferentes hipótesis en cuanto a los factores de virulencia del microorganismo.(24,27,42,54,58,83) Un importante estudio, realizado en el año 2001 por Love(58) permitió comprobar que la virulencia de este microorganismo se relaciona con su capacidad para invadir los túbulos dentinarios y permanecer viable dentro de los mismos, adhiriéndose al colágeno tipo I presente en el suero humano.
Fue comprobado igualmente por estos autores, que para otros microorganismos, tales como S. gordonii y S. mutans, el suero humano actúa inhibiendo su capacidad de invadir la dentina, no así sobre E. faecalis donde se mantuvo la invasión aún cuando fue reducida escasamente. Posteriormente, Hubble et al.(42) en 2.003 analizaron la hipótesis de la participación de las proteasas (Spr) de E. faecalis, y de la proteína vinculada al colágeno (Ace) en la adhesión a la dentina por parte de este microorganismo, como mecanismo de resistencia al tratamiento de conductos. En este interesante estudio se evaluó la manera como estos factores contribuyen en la adhesión a la estructura dentinaria del conducto radicular. Se probaron cuatro cepas de E. faecalis; una cepa no alterada, en su forma común, y 3 grupos donde fueron suprimidos uno o dos de los factores de virulencia anteriormente mencionados (Spr y Ace). La información obtenida en esta investigación demostró la participación significativa de estos factores en la resistencia del microorganismo, observando un número de colonias formadas significativamente menor en los grupos donde fueron sustraídos dichos factores de virulencia. Por su parte, Evans et al.(27) estudiaron los mecanismos involucrados en la resistencia de E. faecalis al hidróxido de calcio. Este estudio confirmó la supervivencia del microorganismo a dicho medicamento a un pH de 11,1. Una respuesta adaptativa en un pH alcalino y una síntesis de proteínas inducidas por la tensión superficial parecen jugar un papel menor en la persistencia de E. faecalis. Sin embargo, el hallazgo de una bomba de protones con capacidad de acidificar el citoplasma fue un factor crítico en la supervivencia de esta bacteria en altos niveles de pH. Así mismo se concluyó, que el hipoclorito de sodio (NaOCl) es efectivo para la eliminación del microorganismo, según los hallazgos de estos investigadores. Otro de los mecanismos de resistencia sugeridos por algunos autores en relación a E. faecalis esta relacionado con la formación de biopelículas. Un estudio publicado en 2002 por Noiri et al.(70) comprobó, a través del microscopio electrónico de barrido, la colonización del microorganismo en 46 dientes medicados con hidróxido de calcio y del mismo modo, fue evidenciada la presencia de biopelículas bacterianas en la pared de los conductos radiculares medicados con hidróxido de calcio. Una biopelícula es definida como una población microbiana adherida a un sustrato orgánico o inorgánico rodeada de productos extracelulares la cual forma una matriz intermicrobiana.(19)
Lima et al.(54) evaluaron in vitro la sensibilidad de biopelículas de Enterococcus faecalis a ciertas medicaciones antimicrobianas tales como clorhexidina (CHX) 2%, clindamicina y metronidazol. Se concluyó en esta investigación que la combinación de metronidazol con clindamicina reduce significativamente las biopelículas formadas de un día, mientras la clorhexidina fue el único medicamento capaz de eliminar las biopelículas de 1-3 días de formación. Existen otros factores que han sido investigados, a fin de analizar su posible relación con la persistencia de E. faecalis en estas lesiones. Un estudio llevado a cabo por Portenier et al.(83) evaluó los efectos de elementos tales como dentina, matriz de dentina tratada con ácido etilendiamino tetraacético (EDTA) o ácido cítrico, colágeno tipo I y células muertas (E. faecalis) sobre la inactivación de la actividad antimicrobiana de yoduro de potasio yodado y digluconato de clorhexidina contra E. faecalis. La matriz de dentina y las células muertas fueron los inhibidores más potentes de la clorhexidina, mientras que la dentina tratada mostró una muy leve inhibición. El yoduro de potasio mostró ser inhibido por todos los componentes evaluados excepto EDTA y ácido cítrico.(83) Los autores concluyen que los diversos componentes de la dentina son responsables de patrones divergentes de inhibición de la actividad antimicrobiana de estas dos sustancias, así como el tratamiento químico de la dentina, previo a la medicación, puede alterar el efecto antimicrobiano de las sustancias.(83) En la búsqueda de alternativas de tratamiento para la eliminación efectiva de E. faecalis, ha sido evaluada la acción de diversas soluciones antisépticas, medicaciones e inclusive materiales de obturación sobre el microorganismo. Ha sido comprobado por múltiples estudios la eficacia del hipoclorito de sodio y el digluconato de clorhexidina en la eliminación de E. faecalis.(2,32,33,115) Sin embargo, se ha señalado también, que es el microorganismo de mayor superviviencia ante la preparación química y mecánica del sistema de conductos radiculares, con el uso de irrigación con hipoclorito de sodio al 2,5%.(33) Del mismo modo, ha sido evidenciada la influencia significativa del factor tiempo en la efectividad de estos agentes antimicrobianos sobre E. faecalis, así como este dependerá del tipo de agente irrigante y la concentración del mismo.(32) Por otra parte, fue demostrada en un estudio publicado en 2003 por Oncag et al.(71) la efectividad superior del digluconato de clorhexidina al 2% sobre el hipoclorito de sodio al 5,25% en períodos de tiempo iguales contra E. faecalis, así como sus mayores efectos residuales y menor toxicidad. Así mismo, un estudio reportado en 2004 por Vianna et al.(132) investigó in vitro la actividad antimicrobiana de clorhexidina en gel y líquida al 0,2%, 1%, y 2% sobre E. faecalis comparándola con hipoclorito de sodio al 0,5%, 1%, 2,5%, 4%, y 5,25%. Los autores demostraron que la clorhexidina en gel elimina al microorganismo en 1 minuto mientras las concentraciones al 1% y 2% líquidas requieren exactamente el mismo tiempo que el NaOCl al 5,25% para ejercer su acción antimicrobiana sobre E. faecalis. En vías de evaluar la efectividad de medicaciones intrarradiculares sobre E. faecalis. y C. albicans, un estudio realizado por Haenni et al.(38) en 2.003 analizó la actividad antimicrobiana de mezclas de hidróxido de calcio con diferentes soluciones desinfectantes tales como clorhexidina, hipoclorito de sodio , yoduro de potasio yodado (YPY) y solución salina. Los resultados de esta investigación señalaron que el pH alcalino del Ca(OH)2 no se ve alterado por las soluciones utilizadas. La CHX reduce su eficacia sobre los microorganismos estudiados y no se evidenciaron efectos sinérgicos entre NaOCl, YPY y Ca(OH)2. Los autores concluyen en que las soluciones irrigadoras analizadas no proveen un incremento en el efecto antimicrobiano del Ca(OH)2 sobre E. faecalis. y C. albicans. En cuanto al efecto de materiales de obturación, un estudio llevado a cabo por Saleh et al.(86) en 2004 evaluó in vitro la supervivencia de E. faecalis. en túbulos dentinarios infectados después de la obturación con diferentes cementos selladores. En este estudio fueron evaluados 56 segmentos radiculares humanos, infectados con E. faecalis e incubados durantre 3 semanas. Posteriormente las muestras fueron divididas en ocho grupos y obturados con gutapercha y los siguientes cementos selladores: AH Plus, cemento de Grossman, Ketac-Endo, Apexit, RoekoSeal Automix, RoekoSeal Automix con imprimador, hidróxido de calcio únicamente, y un grupo control. Los resultados de este estudio demostraron que aquellas obturaciones de gutapercha con cementos AH Plus y cemento de Grossman eliminaron a todas las bacterias presentes en los túbulos dentinarios, no así se evidenció en los otros 6 grupos. Del mismo modo, este estudio confirmó el hecho de que la medicación con hidróxido de calcio no es efectiva en la eliminación deE. faecalis. Por su parte, un estudio publicado por Lui et al.(60) en 2004 analizó el efecto antimicrobiano de las puntas de gutapercha impregnadas en clorhexidina sobre E. faecalis. Esta investigación apuntó que estas puntas no poseen efecto inhibitorio in vitro sobre este microorganismo en túbulos dentinarios infectados. Otros microorganismos reportados específicamente en casos de dientes tratados endodónticamente con periodontitis apical crónica persistente, son los hongos, primordialmente la especie C. albicans. El estudio de Molander et al.(62) evidenció este microorganismo en 3 de 68 muestras, Pinheiro et al.(15) en 2 de 60 casos, y Cheung et al.(16) demostró C. albicans en 2 de 18 muestras. Los microorganismos del Género Candida colonizan las superficies mucosas humanas durante el nacimiento o poco después del mismo, siendo parte de la flora bucal normal, existiendo, por lo tanto, riesgo de infección endógena constante.(137) Las especies de Candida crecen como levaduras en gemación (3-6 µm de tamaño). También forman pseudohifas cuando las levaduras continúan su crecimiento. Dos pruebas rápidas de identificación diferencian a C. albicans de las demás especies de Candida. Después de la incubación del inóculo conteniendo el microorganismo en suero durante 2 a 3 horas a 37 °C, las células de esta especie empiezan a formar tubos germinales, que constituyen el inicio de la transformación de la forma levaduriforme al de hifas verdaderas; y en un medio nutricionalmente insuficiente como Bilis Agar, C. albicans produce clamidosporas grandes y esféricas.(12)
Dentro de esta línea de investigación, Waltimo et al.(136) realizaron un importante estudio sobre la presencia de hongos en 967 casos de periodontitis apical crónica persistente. De los hongos aislados en este estudio el 80% fue representado por la especie C. albicans. Así mismo, fueron identificadas Candida galabrata, Candida guilliermondii, Candida incopiscua y Geotrichum candidum. Un total de 48 cepas de hongos fueron aisladas en 47 muestras (7%) de las cuales seis fueron infecciones producidas por un solo microorganismo (C. albicans).
Así mismo, se evidenció crecimiento microbiano en 692 casos (72%). En los casos de infecciones mixtas se demostró la presencia de Streptococcus spp., P. micros y F. nucleatum. Años más tarde, estos investigadores, llevaron a cabo un estudio(133) aún más específico donde examinaron la frecuencia de aparición de Candida spp. en 103 granulomas periapicales persistentes utilizando en método de hibridación ADN-ADN. En 68 de las muestras fue posible la extracción de ADN de los cuales 18 evidenciaron la presencia de Candida spp. Sin embargo, al comparar los resultados con los obtenidos con el uso de otra técnica dentro del mismo estudio (coloración PAS) se determinó que eran falsos positivos, concluyendo que no se evidenció presencia de este microorganismo dentro de este tipo de lesiones. Por su parte, un estudio llevado a cabo por Peciuliene et al.(76) corrobora los resultados obtenidos por investigaciones previas que reportan la presencia de Candida spp. en 6 de 33 dientes tratados endodónticamente con periodontitis apical crónica persistente. Esta investigación determinó la aparición y el papel de levaduras, bacilos Gram negativos y E. faecalis en estas patologías. La muestra consistió en 40 casos asintomáticos. Se aislaron microorganismos en 33 de las muestras. Fueron detectados hongos en un 18% de los casos, siendo es su totalidad identificadas como C. albicans. E. faecalis fue la única especie de su género en ser aislada (64% de las muestras). Los bacilos Gram negativos aislados consistieron en Proteus mirabilis, Klebsiella pneumoniae y Escherichia coli, siempre en asociación con E. faecalis.(76) Coincidiendo con otros estudios, no se evidenció relación directa entre el tamaño de la lesión y los diferentes grupos microbianos.(76) En vías de evaluar y determinar mecanismos de eliminación de estos patógenos, se han realizado diversos estudios sobre la sensibilidad de Candida spp. a ciertas soluciones antisépticas y medicamentos endodónticos. Es así como Waltimo et al.(135) realizaron un estudio enfocado a evaluar la sensibilidad de Candida spp. al hidróxido de calcio, medicación de amplio uso en endodoncia, dado su alto grado de alcalinidad. Todas las especies de Candida evaluadas en este estudio, presentaron alta resistencia a solución saturada de hidróxido de calcio. Se requirió de 16 horas de incubación para eliminar el 99,9% de las unidades de colonias formadas. La sensibilidad de Candida spp. fue comparable a la de E. faecalis.(135) También ha sido probada, la sensibilidad de Candida spp. a ciertas soluciones desinfectantes, tales como yoduro de potasio yodado, acetato de clorhexidina, hipoclorito de sodio e hidróxido de calcio. Los resultados señalan una mayor efectividad de los tres primeros agentes antimicrobianos sobre Candida spp. en comparación con el hidróxido de calcio. Sin embargo, apuntan los autores, que el uso combinado de estos desinfectantes con este medicamento, puede proveer una preparación antimicrobiana de amplio espectro con efectos a largo plazo.(134) Un estudio, realizado por Siqueira et al.(106) investigó la acción de medicaciones utilizadas dentro del conducto sobre C. albicans. En este estudio in vitro fueron probados hidróxido de calcio/glicerina, hidróxido de calcio/gluconato de clorhexidina al 0,12%, hidróxido de calcio/paramonoclorofenol alcanforado/glicerina y oxido de zinc/ gluconato de corhexidina al 0,12%. Los resultados obtenidos mostraron que las dos últimas mezclas fueron las más efectivas en la eliminación de C. albicans sobre muestras de dentina infectada. Un estudio in vitro fue llevado a cabo por Fergusson et al.(29a) para determinar la sensibilidad de los C. albicans a varios irrigantes y medicaciones utilizados dentro del conducto. Se determinó la concentración inhibitoria mínima (MIC) requerida para eliminar el microorganismo por parte de hipoclorito del sodio, peróxido de hidrógeno, digluconato de clorhexidina e hidróxido de calcio acuoso. Se determinó que el hipoclorito del sodio, el peróxido de hidrógeno, y la clorhexidina fueron agentes antifúngicos eficaces con MIC de <10 µg/ml, 234 µg/ml, y <0.63 µg/ml, respectivamente. El hidróxido de calcio acuoso no presentó ninguna actividad contra el microorganismo. Así mismo fue probado paramonoclorofenol alcanforado y pasta de hidróxido de calcio, los cuales mantenidos en contacto directo con C. albicans, fueron agentes antimicrobianos eficaces en contra del microorganismo. Según los resultados obtenidos por el estudio de Vianna et al.(132), donde fue evaluado in vitro la actividad antimicrobiana de clorhexidina e hipoclorito de sodio a diferentes concentraciones sobre diversos microorganismos entre los cuales se encontraba C. albicans, fue demostrado que la CHX al 2% en gel y líquida es capaz de eliminar a C. albicans en 15 segundos. Por su parte, Valera et al.(131) realizaron un estudio con el fin de evaluar el efecto del hipoclorito del sodio al 1% y de cinco medicaciones endodónticas en conductos infectados con C. albicans. Los conductos, posterior a la infección, fueron irrigados con solución salina estéril y tratados con: (a) pasta Calen (hidróxido de calcio); (b) paramonoclorofenol alcanforado (PMFA), (c) solución de yoduro yodado al 2%; (d) formalina del tricresol; (e) pasta Calen y PMFA; (f) irrigación con el hipoclorito del sodio del 1% sin medicación, y (g) ninguna medicación. Los resultados de este estudio demostraron la eficacia en un 100% del PMCA, seguida por la mezcla de hidróxido de calcio con CPMC (70%), hipoclorito del sodio al 1% (70%), tricresol (60%), yoduro yodado al 2% (50%), e hidróxido de calcio (30%). Otro de los microorganismos aislados con frecuencia en dientes tratados endodónticamente con lesiones periapicales persistentes, es el género Actinomyces.(5,39,46,62,80,81) El género Actinomyces abarca un grupo heterogéneo de bacilos anaerobios estrictos y anaerobios facultativos, Gram positivos, muchos de los cuales son habitantes de la mucosa bucal de seres humanos y otros animales.(73) Una de las especies descritas recientemente, y reportadas en casos de periodontitis apical crónica persistente es Actinomyces radicidentis. Esta especie fue descrita inicialmente por Collins et al.(18) en 2001, donde fue detectada en conductos radiculares necróticos. Casi simultáneamente, Kalfas et al.(46) reportaron dos casos de lesiones persistentes asociados a la presencia de A. radicidentis. Los autores reportan desconocer el haber sido detectado este microorganismo en infecciones primarias por lo que sugieren, que a pesar de desconocer el medio de entrada al sistema de conductos, se pudiese pensar en el posible ingreso del microorganismo en la fase de tratamiento, en ausencia de técnicas asépticas adecuadas. En el mismo estudio, fue probada in vitro la sensibilidad de dicho microorganimo al NaOCl al 0,5%, donde se evidenció la rápida eliminación del mismo, no así en presencia de hidróxido de calcio, donde se manifestó una tolerancia relativamente alta a tal medicamento. Otra hipótesis sostenida por estos investigadores fue la posible ubicación extrarradicular de A. radicidentis como explicación de la resistencia del microorganismo a la terapia endodóntica. Así mismo, en un estudio realizado por Siqueira y Rocas(100) en 2003, se detectó a través de pruebas de reacción en cadena de polimerasa, A. radicidentis tanto en infecciones endodónticas primarias como persistentes, observándose en estas últimas un 8% de prevalencia. Del mismo modo, otras especies de Actinomyces han sido aisladas de conductos radiculares con lesiones persistentes,(15,39,68,80,81,93,138) tal es el caso de A. naeslundii,(80,81), A. odontolyticus,(68,80,138) A. viscosus,(80,138) y A. israelii.(68) Otros microorganismos tales como Streptococcus spp. y Lactobacillus spp. han sido reportados en números importantes en conductos radiculares de dientes con periodontitis apical crónica persistente.(15,16,33,39,68,80,81) Estos dos géneros se presentan en sus diferentes especies, como microorganismos comunes en pulpa necrótica radicular. Sin embargo, su persistencia en fracasos endodónticos no ha sido explicada suficientemente. Se maneja la hipótesis que la alta resistencia de bacterias Gram positivas puede deberse a sus características estructurales, tales como pared celular, productos metabólicos secretados y resistencia a ciertos medicamentos. Así mismo se evidencia que estos géneros son capaces de sobrevivir en ambientes restringidos nutricionalmente. (62,127)
Microbiota de las lesiones perirradiculares crónicas El desarrollo de lesiones perirradiculares establece una barrera a fin de evitar la diseminación de microorganismos a los tejidos circundantes. El tejido óseo es resorbido y sustituido por tejido granulomatoso, el cual contiene elementos del sistema inmunológico, tales como células de defensa, macrófagos y moléculas como anticuerpos y sistema de complemento.(41) Una densa pared de leucocitos polimorfonucleares, o menos frecuentemente, de tejido epitelial, se presenta a nivel del foramen apical, bloqueando el egreso de microorganismos del conducto radicular hacia los tejidos periapicales.(67) A través de los años han existido diferencias de opinión con respecto a la presencia de microorganismos en el tejido periapical. Autores como Hedman(41) en 1951, sustentaron el concepto de la presencia de microorganismos en estos tejidos, en estudios realizados utilizando técnicas aeróbicas. En dicho estudio se reportó la presencia de bacterias en el 68% de 82 lesiones periapicales. Por su parte, Winkler et al.(140) utilizando una técnica de tinción de Gram modificada, fue capaz de demostrar la presencia de bacterias en 87% de lesiones periapicales analizadas bajo microscopio de luz. Recientemente, se ha generado un gran interés en el papel potencial de los microorganismos perirradiculares persistentes en el fracaso del tratamiento de conductos no quirúrgico. Con los avances en las técnicas microbiológicas, han podido aislarse microorganismos anaerobios estrictos y anaerobios facultativos de lesiones perirradiculares. Langeland et al.(53) no alcanzaron demostrar consistentemente la presencia de microorganismos en granulomas periapicales. En su estudio, fueron examinados histológicamente 35 lesiones con el fin de identificar colonias bacterianas. En cinco especimenes se observaron bacterias pero tan sólo en una de las lesiones las bacterias estaban localizadas en la "porción desintegrada del conducto radicular y tejido periapical". Tronstad et al.(130) investigaron la presencia de microflora bacteriana periapical en ocho casos cuyos tratamientos endodónticos no quirúrgicos fracasaron. En todos los casos se evidenció crecimiento microbiano. Fueron comúnmente identificadas Prevotella spp. y Porphyromonas spp., cocos y bacilos anaerobios Gram positivos, así como Pseudomonas aeruginosa. También se observó menos frecuentemente hongos y otros microorganismos como Bacteroides fragilis. Este estudio demostró que las bacterias anaerobias estrictas y anaerobias facultativas son capaces de sobrevivir y mantener los procesos infecciosos en el tejido periapical. Otro importante estudio que sustentó los resultados anteriores fue realizado por Iwu et al.(44) Estos investigadores analizaron el contenido microbiológico de 16 lesiones periapicales obteniendo crecimiento positivo en el 88% de los casos. El 55% de los microorganismos aislados fueron anaerobios facultativos y el 45% anaerobios estrictos. Los microorganismos más frecuentemente encontrados fueron Veillonella spp. (15%), Streptococcus milleri (11%), Streptococcus sanguis (11%), Actinomyces naeslundii (11%), Propionibacterium acnes (11%) y Bacteroides spp. (10%). Wayman et al.(137) también sustentaron estos resultados analizando 58 lesiones periapicales a través de cultivo y examen histológico y evidenciando crecimiento bacteriano en 51 de las muestras, un total de 50 especies diferentes en su mayoría anaerobios facultativos. Bacteroides spp. fue la bacteria más frecuentemente observada en este estudio. En un estudio de data reciente, Sunde et al.(119), estudiaron la microbiota periapical de 36 lesiones perirradiculares persistentes a través de cultivos anaeróbicos y análisis al microscopio electrónico. En este trabajo se detectaron un total de 148 colonias microbianas, y 67 especies (tabla VI). El 51% de las bacterias encontradas en este estudio fueron anaerobias estrictas. Las especies Gram positivas constituyeron un 79.5% de la flora. Fueron aislados microorganismos aerobios y anaerobios facultativos, tales como Staphylococcus spp., Enterococcus spp., Enterobacter spp., Pseudomonas spp., Stenotrophomonas spp., Sphingomonas spp., Bacillus spp., y Candida spp. en un 75% de las lesiones.
De igual forma, se evidenciaron gránulos de sulfuro en nueve lesiones (25%). En esos gránulos se identificaron especies de Actinomyces tales como A. israelii, A. viscosus, A. naeslundii, y A. meyeri, así como otras especies Gram positivas y Gram negativas. La presencia de estos gránulos sugiere su posible relación con el mantenimiento de la periodontitis apical crónica. Este estudio demostró una amplia variedad de microorganismos, particularmente anaerobios facultativos y estrictos Gram positivos, en las lesiones periapicales de dientes con periodontitis apical persistente posteriores a tratamientos utilizando inclusive terapias de hidróxido de calcio. Otros estudios realizados empleando técnicas de genética molecular, han proporcionado igualmente evidencia sólida de la invasión microbiana de los tejidos perirradiculares.(120,121) Esta infección extrarradicular, ha sido sugerida por diversos autores como fuente de persistencia de la periodontitis apical crónica persistente, dada la inaccesibilidad de los procedimientos de desinfección endodóntica y el desarrollo de mecanismos de supervivencia en ambientes inhóspitos por parte de ciertos microorganismos patógenos.(94,97,119,130) Probablemente unos de los mecanismos más significativos en la evasión del sistema de defensa del hospedero radican en la formación de biopelículas.(19) Los microorganismos, organizados en biopelículas muestran una alta resistencia tanto a los agentes antimicrobianos como a los mecanismos de defensa del hospedero. Tronstad et al.(129) en 1990 demostró la presencia de estas biopelículas en lesiones perirradiculares adyacentes al foramen apical y en colonias bacterianas dentro de granulomas periapicales. Los resultados de este estudio sugieren la posibilidad de que este mecanismo facilite la persistencia de la periodontitis apical crónica. Sin embargo, el porcentaje de biopelículas en lesiones perirradiculares de dientes no tratados endodónticamente es bastante bajo (4%), por lo que constituyen un mínimo porcentaje de los casos fracasados.(97) Noiri et al.(70) en 2003 investigaron la participación de biopelículas bacterianas en once casos de periodontitis apical crónica persistente bajo MEB. En nueve de las muestras se observaron biopelículas bacterianas en el área extrarradicular. Se demostró la presencia de espiroquetas y la baja frecuencia de cocos y bacilos en los casos relacionados con estos mecanismos. Así mismo, fue determinada la posibilidad de infección por parte de la biopelícula, tanto en la fase aguda como en la fase crónica de la periodontitis apical, y su resistencia a las respuestas inmunitarias del hospedero.
Discusión El papel fundamental de los microorganismos en la etiopatogenia de las patologías pulpares y periapicales esta claramente establecido desde mediados del siglo XX, cuando fue demostrado por los estudios de Kakehashi et al.,(47) Moller et al.(63) y Sundqvist(123) que la presencia de bacterias dentro de los conductos radiculares era determinante para el desarrollo de las lesiones endodónticas. Estos planteamientos han sido confirmados y expandidos por diversas investigaciones posteriores.(6,28,51,78,124,125) Debido a los recientes avances en las técnicas microbiológicas, se ha evidenciado un mayor interés y relevancia en relación a la microbiota endodóntica en los últimos años, dada la necesidad de su control en los procedimientos de limpieza y conformación del sistema de conductos radiculares para lograr el éxito de la terapia endodóntica. La mayoría de los microorganismos patógenos, así como su principal sustrato, la pulpa necrótica, pueden ser removidos durante los procedimientos endodónticos, sin embargo, esto no siempre se logra completamente en la práctica clínica debido a las limitaciones que ofrece la compleja anatomía radicular, donde estos pueden estar alojados en túbulos dentinarios, ramificaciones, delta apical, istmos, y de esta manera reestablecer la infección.(11,93,94,111) Existe un consenso entre los diferentes estudios, realizados con diversas técnicas de identificación microbiana, en que las pulpas necróticas en infecciones primarias presentan una flora polimicrobiana caracterizada por una amplia variedad de combinaciones de bacterias, un promedio de 4-7 especies por conducto, predominantemente anaerobias estrictas y aproximadamente igual proporción de bacterias Gram positivas y Gram negativas.(6,7,39,79,124,125) Dados los resultados de múltiples investigaciones se puede afirmar que el sistema de conductos radiculares puede ser infectado en proporciones muy elevadas, y las especies más frecuentes en infecciones primarias pertenecen usualmente a los Géneros Fusobacterium, Prevotella, Porphyromonas, Treponema, Peptostreptococcus, Eubacterium, Actinomyces y Streptococcus.(45,52,79,109,122,124,125) Así mismo, evidencias científicas sugieren que un restringido grupo de especies microbianas presenta mayor prevalencia en las diferentes formas de lesiones perirradiculares tomando estas infecciones un carácter de semi-específicas.(7,33,62,84b,123,124,125,136) Cuando en el tratamiento de conductos se logra la desinfección de forma apropiada, usualmente la periodontitis apical crónica cicatriza por regeneración ósea; proceso que se caracteriza por una reducción gradual y final resolución de la imagen radiolúcida periapical.(118) Cuando este proceso de cicatrización no se evidencia estamos en presencia de una periodontitis apical crónica persistente. La microbiota detectada en dientes tratados endodónticamente con periodontitis apical crónica persistente no ha sido tan ampliamente estudiada como la relacionada con infecciones primarias, sin embargo, se ha establecido que varía sustancialmente de la identificada en dientes no tratados.(15,16,39,46,70,81,101,133,136) Los microorganismos asociados a lesiones periapicales persistentes esta caracterizada por estar limitada a un pequeño número de especies microbianas (generalmente una sola especie), con predominio de microorganismos Gram positivos anaerobios facultativos.(15,16,39,70,75,76,81,119) La microbiota aislada en casos de periodontitis apical crónica persistente es generalmente similar en los diferentes estudios realizados. Sin embargo, existen variaciones en la detección de ciertas especies las cuales pueden ser causadas por las diferentes técnicas de toma de muestra y los procedimientos de laboratorio empleados en cada investigación. Los diferentes estudios en el área reportan el uso único o combinado de diversas técnicas de identificación microbiológica tales como la tinción de Gram(15,16,33,35,37,39,62,68,75,81,136) y de PAS,(133) morfología de colonias,(15,16,35,37,39,62,136,138) aerotolerancia,(15,33,37,76,75,81,136,138) pruebas físicas(62,39) y bioquímicas,(15,16,33,39,62,75,76,81,93,138) tales como producción de catalasa,(33,75,76,81,136) indol,(75,76,136) ureasa,(136) fosfatasa alcalina,(136) empleo de medios selectivos,(15,39,62,93) hemaglutinación,(81,93) actividad tipo tripsina,(75,81) fermentación de carbohidratos,(37,76,81,136,138) detección de enzimas,(76) cromatografía de gas,(15,62,138) microscopía electrónica de barrido,(46,70) microscopía electrónica de transmisión,(68,69) microscopía de contraste de fases,(16) fluorescencia con luz UV,(81,133) Reacción en Cadena de la Polimerasa (PCR).(98,133) Esta diversidad de métodos supone justificar las variaciones presentadas en la microbiota aislada en los diferentes estudios. A pesar de haberse utilizado metodologías altamente efectivas, es posible que algunos microorganismos no puedan ser cultivados, debido a su localización en el sistema de conductos radiculares, su presencia en bajo número, o simplemente se pierdan en los procedimientos microbiológicos.(80) Inclusive, ciertos microorganismos pueden ser removidos durante la desobturación de los conductos y ser excluidos de la muestra junto a este material.(68) No todos los microorganismos están en capacidad de sobrevivir a un microambiente con nutrientes restringidos, tal como lo ofrece un diente tratado endodónticamente, para ello se requieren factores de virulencia específicos que parecen poseer microorganismos tales como Enterococcus faecalis, Candida albicans, Actinomyces spp, Propionibacterium spp., Streptococcus spp., que son los más frecuentemente aislados en este tipo de patologías.(15,16,39,70,75,76,81) Todos los estudios en esta área coinciden en afirmar que el microorganismo de mayor prevalencia en este tipo de lesiones es E. faecalis.(9,15,16,27,33,35,39,62,69,70,75,76, 80,81) Diversas investigaciones han tratado de establecer y comprobar el mecanismo de resistencia de E. faecalis a la terapia endodóntica no quirúrgica,(24,27,42,54,58,83) sin embargo, hasta la fecha, no se ha logrado establecer claramente. Han sido planteadas diversas teorías de resistencia de este microorganismo tales como su capacidad de invadir los túbulos dentinarios por adhesión al colágeno,(58) la influencia de otros factores de virulencia, como proteasas y proteína vinculada al colágeno(42), su capacidad de acidificación del pH de medicamentos como hidróxido de calcio(27), y formación de biopelículas bacterianas(24,54), las cuales siguen sometidas a investigación en busca del verdadero mecanismo de resistencia. Otro microorganismo aislado en periodontitis apical crónica persistente es C. albicans.(15,16,46,62,76,80,136) Sin embargo, una reciente investigación(133) llevada a cabo por métodos de PCR no evidenció la presencia específica de esta especie, poniendo en tela de juicio los resultados anteriormente obtenidos con otras técnicas de identificación microbiológica. Así mismo, su mecanismo de resistencia no ha sido dilucidado. En cuanto a la susceptibilidad de estos microorganismos, E. faecalis y C. albicans, a determinados agentes antimicrobianos para uso dentro del conducto, diversas investigaciones han coincidido en sus resultados evidenciándose la baja susceptibilidad de los mismos al hidróxido de calcio.(27,29a,38,54,132), y por otra parte la acción efectiva del digluconato de clorhexidina al 2%,el hipoclorito de sodio a diferentes concentraciones(2,32,33,29a,71,115,132) y el paramonoclorofenol alcanforado(29a,106,132) sobre los mismos. Sin embargo, se ha señalado que E. faecalis es el microorganismo con mayor capacidad de superviviencia ante la preparación química y mecánica del sistema de conductos radiculares, con el uso de irrigación con hipoclorito de sodio al 2,5%.(33) Otros mecanismos que han tratado de explicar la persistencia de lesiones periapicales crónicas, se basan en la presencia de microorganismos en el espacio extrarradicular específicamente en los tejidos periapicales,(19,41,44,53,97,119-121,129,130,137,140) donde la limpieza y conformación del sistema de conductos radiculares no alcanza a ejercer sus efectos antimicrobianos. Los microorganismos al permanecer en los tejidos, perpetúan las respuestas inmunológicas evitando la cicatrización de las lesiones(94,97,119,130), donde uno de los principales mecanismos descritos esta constituído por la formación de biopelículas microbianas.(19,70,97,129)
Conclusiones
Referencias 1.- Andreasen J, Rud J. Correlation between histology and radiography in the assessment of healing after endodontic surgery. Int J Oral Surg. 1972;1(3):161-73. 2.- Ayhan H, Sultan N, Cirak M, Ruhi M, Bodur H. Antimicrobial effects of various endodontic irrigants on selected microorganisms. Int Endod J. 1999;32(2):99-102. 3.- Bae K, Baumgartner J, Shearer T, David L. Occurrence of Prevotella nigrescens and Prevotella intermedia in infections of endodontic origin. J Endod. 1997;23(10):620-3. 4.- Barbat J, Messer H. Detectability of artificial periapical lesions using direct digital and conventional radiography. J Endod. 1998;24(12):837-42. 5.- Barnard D, Davies J, Figdor D. Susceptibility of Actinomyces israelii to antibiotics, sodium hypochlorite and calcium hydroxide. Int Endod J. 1996;29(5):320-6. 6.- Baumgartner J, Watkins B, Bae K, Xia T. Association of black-pigmented bacteria with endodontic infections. J Endod. 1999;25(6):413-5. 7.- Baumgartner J, Falkler W Jr. Bacteria in the apical 5 mm of infected root canals. J Endod. 1991;17(8):380-3. 8.- Baumgartner J, Khemaleelakul S, Xia T. Identification of spirochetes (treponemes) in endodontic infections. J Endod. 2003;29(12):794-7. 9.- Bender I, Seltzer S. Combination of antibiotics and fungicides used in treatment of the infected pulpless tooth. J Am Dent Assoc. 1952;45(3):293-300. 10.- Bergenholtz G. Pathogenic mechanisms in pulpal disease. J Endod 1990;16(2):98-101 11.- Bergenholtz G, Crawford J. Microbiología endodóntica. En: Walton R, Torabinejad M. Endodoncia, principios y práctica clínica. Editorial Interamericana McGraw-Hill. México 1991. pp. 287-302 12.- Brooks G, Butel J, Morse S. Microbiología médica de Jawetz, Melnick y Adelberg. Editorial El Manual Moderno s.a. Mexico D.F. 2002. pag. 683. 13.- Bystrom A, Happonen R, Sjogren U, Sundqvist G. Healing of periapical lesions of pulpless teeth after endodontic treatment with controlled asepsis. Endod Dent Traumatol. 1987;3(2):58-63. 14.- Bystrom A, Sundqvist G. Bacteriologic evaluation of the effect of 0.5 percent sodium hypochlorite in endodontic therapy. Oral Surg Oral Med Oral Pathol. 1983;55(3):307-12. 15.- Chavez De Paz L, Dahlen G, Molander A, Moller A, Bergenholtz G. Bacteria recovered from teeth with apical periodontitis after antimicrobial endodontic treatment. Int Endod J. 2003;36(7):500-8. 16. Cheung G, Ho M. Microbial flora of root canal-treated teeth associated with asymptomatic periapical radiolucent lesions. Oral Microbiol Immunol. 2001;16(6):332-7. 17.- Chugal NM, Clive JM, Spångberg LSW. A prognostic model for assessment of the outcome of endodontic treatment: Effect of biologic and diagnostic variables. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001 Mar; 91(3):342-52. 18.- Collins M, Hoyles L, Kalfas S, Sundquist G, Monsen T, Nikolaitchouk N, Falsen E. Characterization of Actinomyces isolates from infected root canals of teeth: description of Actinomyces radicidentis sp. nov. J Clin Microbiol. 2000;38(9):3399-403. 19.- Costerton J, Stewart P, Greenberg E. Bacterial biofilms: a common cause of persistent infections. Science. 1999 May 21;284(5418):1318-22. 20.- Crump MC, Natkin E. Relationship of brooken root canal instruments to endodontic case prognosis: a clinical investigation. J Am Dent Assoc 1970; 80(6):1341-7. 21.- Dahlen G, Fabricius L, Heyden G, Holm S, Moller A. Apical periodontitis induced by selected bacterial strains in root canals of immunized and nonimmunized monkeys. Scand J Dent Res. 1982;90(3):207-16. 22.- Dahlen G, Haapasalo M. Microbiology of apical periodontitis. En: Essential endodontology, prevention and treatment of apical periodontitis. Orstavik D, Pitt Ford T, editors. Blackwell Science. USA 1998. pp. 106-130 23.- Delivanis P, Fan V. The localization of blood-borne bacteria in instrumented unfilled and overinstrumented canals. J Endod 1984;10(11):521-4. 24.- Distel J, Hatton J, Gillespie M. Biofilm formation in medicated root canals. J Endod. 2002;28(10):689-93. 25.- Dougherty W, Bae K, Watkins B, Baumgartner J. Black-pigmented bacteria in coronal and apical segments of infected root canals. J Endod. 1998;24(5):356-8. 26.- Engstrom B, Frostell G. Experiences of bacteriological root canal control. Acta Odontol Scand. 1964 Feb;22:43-69. 27.- Evans M, Davies J, Sundqvist G, Figdor D. Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide. Int Endod J. 2002;35(3):221-8. 28.- Fabricius L, Dahlen G, Ohman A, Moller A. Predominant indigenous oral bacteria isolated from infected root canals after varied times of closure. Scand J Dent Res. 1982;90(2):134-44. 29a.- Ferguson J, Hatton J, Gillespie M. Effectiveness of intracanal irrigants and medications against the yeast Candida albicans. J Endod. 2002;28(2):68-71. 29b.- Ferreira F, Ferreira A, Gomes B, Souza-Filho F. Resolution of persistent periapical infection by endodontic surgery. Int Endod J. 2004;37(1):61-9. 30.- Fouad A, Barry J, Caimano M, Clawson M, Zhu Q, Carver R, Hazlett K, Radolf J. PCR-based identification of bacteria associated with endodontic infections. J Clin Microbiol. 2002;40(9):3223-31. 31.- Gharbia S, Haapasalo M, Shah H, Kotiranta A, Lounatmaa K, Pearce M, Devine D. Characterization of Prevotella intermedia and Prevotella nigrescens isolates from periodontic and endodontic infections. J Periodontol. 1994;65(1):56-61. 32.- Gomes B, Ferraz C, Vianna M, Berber V, Teixeira F, Souza-Filho F. In vitro antimicrobial activity of several concentrations of sodium hypochlorite and chlorhexidine gluconate in the elimination of Enterococcus faecalis. Int Endod J. 2001;34(6):424-8. 33.- Gomes B, Lilley J, Drucker D. Variations in the susceptibilities of components of the endodontic microflora to biomechanical procedures. Int Endod J. 1996;29(4):235-41. 34.- Gomes B, Pinheiro E, Gade-Neto C, Sousa E, Ferraz C, Zaia A, Teixeira F, Souza-Filho F. Microbiological examination of infected dental root canals. Oral Microbiol Immunol. 2004;19(2):71-6. 35.- Goldman M, Pearson A. Postdebridement bacterial flora and antibiotic sensitivity. Oral Surg Oral Med Oral Pathol. 1969;28(6):897-905. 36.- Gutierrez J, Jofre A, Villena F. Scanning electron microscope study on the action of endodontic irrigants on bacteria invading the dentinal tubules. Oral Surg Oral Med Oral Pathol. 1990;69(4):491-501. 37.- Haapasalo M, Ranta H, Ranta K. Facultative gram-negative enteric rods in persistent periapical infections. Acta Odontol Scand. 1983;41(1):19-22. 38.- Haenni S, Schmidlin P, Mueller B, Sener B, Zehnder M. Chemical and antimicrobial properties of calcium hydroxide mixed with irrigating solutions. Int Endod J. 2003;36(2):100-5. 39.- Hancock H, Sigurdsson A, Trope M, Moiseiwitsch J. Bacteria isolated after unsuccessful endodontic treatment in a North American population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;91(5):579-86. 40.- Happonen R, Soderling E, Viander M, Linko-Kettunen L, Pelliniemi L. Immunocytochemical demonstration of Actinomyces species and Arachnia propionica in periapical infections. J Oral Pathol. 1985;14(5):405-13. 41.- Hedman W. An investigation into residual periapical infection after pulp canal therapy. J Oral Surg (Chic). 1951;4(9):1173-9. 42.- Hubble T, Hatton J, Nallapareddy S, Murray B, Gillespie M. Influence of Enterococcus faecalis proteases and the collagen-binding protein, Ace, on adhesion to dentin. Oral Microbiol Immunol. 2003;18(2):121-6. 43.- Huumonen S, Orstavik D. Radiological aspects of apical periodontitis. Endod Topics 2002;1:3-25 44.- Iwu C, MacFarlane T, MacKenzie D, Stenhouse D. The microbiology of periapical granulomas. Oral Surg Oral Med Oral Pathol. 1990;69(4):502-5. 45.- Jacinto RC, Gomes BP, Ferraz CC, Zaia AA, Filho FJ. Microbiological analysis of infected root canals from symptomatic and asymptomatic teeth with periapical periodontitis and the antimicrobial susceptibility of some isolated anaerobic bacteria. Oral Microbiol Immunol. 2003;18(5):285-92. 46.- Kalfas S, Figdor D, Sundqvist G. A new bacterial species associated with failed endodontic treatment: identification and description of Actinomyces radicidentis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001 Aug;92(2):208-14. 47.- Kakehashi S, Stanley H, Fitzgerald R. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965;20:340-9. 48.- Kaufman A, Henig E. The microbiologic approach in endodontics. Oral Surg Oral Med Oral Pathol. 1976;42(6):810-6. 49.- Kerekes K, Tronstad L. Long-term results of endodontic treatment performed with a standardized technique. J Endod 1979;5:83-90 50.- Kettering J, Torabinejad M. Microbiología e inmunología. En: Cohen S, Burns R, Vías de la pulpa. 7ma edición. Editorial Harcourt. Madrid 1999. pp. 439-451 51.- Korzen B, Krakow A, Green D. Pulpal and periapical tissue responses in conventional and monoinfected gnotobiotic rats. Oral Surg Oral Med Oral Pathol. 1974;37(5):783-802. 52.- Lana M, Ribeiro-Sobrinho A, Stehling R, Garcia G, Silva B, Hamdan J, Nicoli J, Carvalho M, Farias L. Microorganisms isolated from root canals presenting necrotic pulp and their drug susceptibility in vitro. Oral Microbiol Immunol. 2001;16(2):100-5. 53.- Langeland K, Block R, Grossman L. A histopathologic and histobacteriologic study of 35 periapical endodontic surgical specimens. J Endod. 1977;3(1):8-23. 54.- Lima K, Fava L, Siqueira J. Susceptibilities of Enterococcus faecalis biofilms to some antimicrobial medications. J Endod. 2001;27(10):616-9. 55.- Lin L, Pascon E, Skribner J, Gangler P, Langeland K. Clinical, radiographic, and histologic study of endodontic treatment failures. Oral Surg Oral Med Oral Pathol. 1991;71(5):603-11. 56.- Lin L, Skribner J, Gaengler P. Factors associated with endodontic treatment failures. J Endod 1992; 18(12):625-27. 57.- Little J. Klebsiella pneumoniae in endodontic therapy. Report of a case. Oral Surg Oral Med Oral Pathol. 1975;40(2):278-81. 58.- Love R. Enterococcus faecalis - a mechanism for its role in endodontic failure. Int Endod J. 2001;34(5):399-405. 59.- Love R, Jenkinson H. Invasion of dentinal tubules by oral bacteria. Crit Rev Oral Biol Med 2002; 13(2):171-183 60.- Lui J, Sae-Lim V, Song K, Chen N. In vitro antimicrobial effect of chlorhexidine-impregnated gutta percha points on Enterococcus faecalis. Int Endod J 2004;37(2):105-13. 61.- Melville T, Birch R. Root canal and periapical floras of infected teeth. Oral Surg Oral Med Oral Pathol. 1967;23(1):93-8. 62.- Molander A, Reit C, Dahlen G, Kvist T. Microbiological status of root-filled teeth with apical periodontitis. Int Endod J. 1998;31(1):1-7. 63.- Moller A, Fabricius L, Dahlen G, Ohman A, Heyden G. Influence on periapical tissues of indigenous oral bacteria and necrotic pulp tissue in monkeys. Scand J Dent Res. 1981;89(6):475-84. 64.- Molven O, Olsen I, Kerekes K. Scanning electron microscopy of bacteria in the apical part of root canals in permanent teeth with periapical lesions. Endod Dent Traumatol. 1991;7(5):226-9. 65.- Moore W, Moore L. The bacteria of periodontal diseases. Periodontol 2000. 1994;5:66-77. 66.- Murray B. The life and times of the Enterococcus. Clin Microbiol Rev. 1990;3(1):46-65. 67.- Nair P. Light and electron microscopic studies of root canal flora and periapical lesions. J Endod. 1987;13(1):29-39. 68.- Nair P, Sjogren U, Figdor D, Sundqvist G. Persistent periapical radiolucencies of root-filled human teeth, failed endodontic treatments, and periapical scars. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;87(5):617-27. 69.- Nair P, Sjogren U, Krey G, Kahnberg K, Sundqvist G. Intraradicular bacteria and fungi in root-filled, asymptomatic human teeth with therapy-resistant periapical lesions: a long-term light and electron microscopic follow-up study. J Endod. 1990; 16(12): 580-8. 70.- Noiri Y, Ehara A, Kawahara T, Takemura N, Ebisu S. Participacion de biopelículas bacterianas en la periodontitis periapical refractaria y crónica. Endodoncia 2003;21(1):50-56. 71.- Oncag O, Hosgor M, Hilmioglu S, Zekioglu O, Eronat C, Burhanoglu D. Comparison of antibacterial and toxic effects of various root canal irrigants. Int Endod J. 2003;36(6):423-32. 72.- Orstavik D. Time-course and risk analyses of the development and healing of chronic apical periodontitis in man. Int Endod J. 1996;29(3):150-5. 73.- Pascual, C, Falsen E, Akervall E, Sjoden B, Collins M. Actinomyces graevenitzii sp. nov., isolated from human clinical specimens. Int. J. Syst. Bacteriol. 1997;47:885-888 74.- Pashley D. Clinical considerations in microleakage. J Endod 1990;16:70-77 75.- Peciuliene V, Balciuniene I, Eriksen HM, Haapasalo M. Isolation of Enterococcus faecalis in previously root-filled canals in a Lithuanian population. J Endod. 2000;26(10):593-5. 76.- Peciuliene V, Reynaud A, Balciuniene I, Haapasalo M. Isolation of yeasts and enteric bacteria in root-filled teeth with chronic apical periodontitis. Int Endod J. 2001;34(6):429-34. 77.- Peters L, Wesselink P, Buijs J, van Winkelhoff A. Viable bacteria in root dentinal tubules of teeth with apical periodontitis. J Endod. 2001;27(2):76-81. 78.- Peters L, Wesselink P, Moorer W. The fate and the role of bacteria left in root dentinal tubules. Int Endod J. 1995;28(2):95-9. 79.- Peters L, Wesselink P, van Winkelhoff A. Combinations of bacterial species in endodontic infections. Int Endod J 2002;35:698-702. 80.- Pinheiro E, Gomes B, Ferraz C, Sousa E, Teixeira F, Souza-Filho F. Microorganisms from canals of root-filled teeth with periapical lesions. Int Endod J. 2003;36(1):1-11. 81.- Pinheiro E, Gomes B, Ferraz C, Teixeira F, Zaia A, Souza Filho F. Evaluation of root canal microorganisms isolated from teeth with endodontic failure and their antimicrobial susceptibility. Oral Microbiol Immunol. 2003;18(2):100-3. 82.- Pitt Ford T. The effects on the periapical tissues of bacterial contamination of the filled root canal. Int Endod J. 1982;15(1):16-22. 83.- Portenier I, Haapasalo H, Orstavik D, Yamauchi M, Haapasalo M. Inactivation of the antibacterial activity of iodine potassium iodide and chlorhexidine digluconate against Enterococcus faecalis by dentin, dentin matrix, type-I collagen, and heat-killed microbial whole cells. J Endod. 2002;28(9):634-7. 84a.- Ray H, Trope M. Periapical status of endodontically treated teeth in relation to the technical quality of the root filling and the coronal restoration. Int Endod J. 1995;28(1):12-8. 84b.- Rocas I, Siqueira J, Santos K, Coelho A. "Red complex" (Bacteroides forsythus, Porphyromonas gingivalis, and Treponema denticola) in endodontic infections: a molecular approach. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001 Apr;91(4):468-71. 85.- Sabeti M, Valles Y, Nowzari H, Simon J, Kermani-Arab V, Slots J. Cytomegalovirus and Epstein-Barr virus DNA transcription in endodontic symptomatic lesions. Oral Microbiol Immunol. 2003;18(2):104-8. 86.- Saleh I, Ruyter I, Haapasalo M, Orstavik D. Survival of Enterococcus faecalis in infected dentinal tubules after root canal filling with different root canal sealers in vitro. Int Endod J 2004;37(3):193-8. 87.- Saunders W, Saunders E. Coronal leakage as a cause of failure in root-canal therapy: a review. Endod Dent Traumatol. 1994;10(3):105-8. 88.- Seltzer S, Bender I, Smith J, Freedman I, Nazimov H. Endodontic failures &endash; An analysis based on clinical, roentgenographic, and histologic findings. Part I. Oral Surg Oral Med Oral Path 1967;23(4):500-15 89.- Seltzer S, Bender I, Smith J, Freedman I, Nazimov H. Endodontic failures&endash; An analysis based on clinical, roentgenographic, and histologic findings. Part II. Oral Surg Oral Med Oral Path 1967;23(4):517-30 90.- Seltzer S, Bender I, Turkenkopf S. Factors affecting successful repair after root canal therapy. J Amer Dent Assoc 1963; 67:650-61 91.- Sen B, Piskin B, Demirci T. Observation of bacteria and fungi in infected root canals and dentinal tubules by SEM. Endod Dent Traumatol. 1995;11(1):6-9. 92.- Sen B, Safavi K, Spangberg L. Growth patterns of Candida albicans in relation to radicular dentin. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997;84(1):68-73. 93.- Siren E, Haapasalo M, Ranta K, Salmi P, Kerosuo E. Microbiological findings and clinical treatment procedures in endodontic cases selected for microbiological investigation. Int Endod J. 1997;30(2):91-5. 94.- Siqueira J. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J 2001;34:1-10. 95.- Siqueira J. Endodontic infections: concepts, paradigms, and perspectives. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;94(3):281-93. 96.- Siqueira J. Taxonomic changes of bacteria associated with endodontic infections. J Endod. 2003;29(10):619-23. 97.- Siqueira J Jr, Lopes H. Bacteria on the apical root surfaces of untreated teeth with perirradicular lesions: a scanning electron microscopy study. Int Endod J. 2001;34(3):216-20. 98.- Siqueira J, Rocas I. Bacteroides forsythus in primary endodontic infections as detected by nested PCR. J Endod. 2003;29(6):390-3. 99.- Siqueira J, RoVas I. Detection of Filifactor alocis in endodontic infections associated with different forms of periradicular diseases. Oral Microbiol Immunol 2003;18:263-65 100.- Siqueira J Jr, Rocas I. Polymerase chain reaction detection of Propionibacterium propionicus and Actinomyces radicidentis in primary and persistent endodontic infections. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003;96(2):215-22. 101.- Siqueira J Jr, Rocas I. Polymerase chain reaction-based analysis of microorganisms associated with failed endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;97(1):85-94. 102.- Siqueira J, Rocas I. Positive and negative bacterial associations involving Dialister pneumosintes in primary endodontic infections. J Endod. 2003;29(7):438-41. 103.- Siqueira J, Rocas I, Andrade A, de Uzeda M. Peptostreptococcus micros in primary endodontic infections as detected by 16S rDNA-based polymerase chain reaction. J Endod. 2003;29(2):111-3. 104.- Siqueira J Jr, Rocas I, Lopes H, Magalhaes F, de Uzeda M. Elimination of Candida albicans infection of the radicular dentin by intracanal medications. J Endod. 2003;29(8):501-4. 105.- Siqueira J Jr, Rocas I, Lopes H, Elias C, de Uzeda M. Fungal infection of the radicular dentin. J Endod. 2002;28(11):770-3. 106.- Siqueira J Jr, Rocas I, Lopes H, Magalhaes F, de Uzeda M. Elimination of Candida albicans infection of the radicular dentin by intracanal medications. J Endod. 2003;29(8):501-4. 107.- Siqueira J, Rocas I, Oliveira J, Santos K. Detection of putative oral pathogens in acute periradicular abscesses by 16S rDNA-directed polymerase chain reaction. J Endod. 2001;27(3):164-7. 108.- Siqueira J, Rocas I, Oliveira J, Santos K. Molecular detection of black-pigmented bacteria in infections of endodontic origin. J Endod. 2001;27(9):563-6. 109.- Siqueira JF, Rocas I, Souto R, de Uzeda M, Colombo A. Actinomyces species, streptococci, and Enterococcus faecalis in primary root canal infections. J Endod. 2002;28(3):168-72. 110.- Siqueira J, Rocas I, Souto R, Uzeda M, Colombo A. Microbiological evaluation of acute periradicular abscesses by DNA-DNA hybridization. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;92(4):451-7. 111.- Sjogren U, Figdor D, Persson S, Sundqvist G. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with apical periodontitis. Int Endod J. 1997;30(5):297-306. 112.- Sjögren U, Hägglund B, Sundqvist G, Wing K. Factors affecting the long term results of endodontic treatment. J Endod 1990 Oct; 16(10):498-503. 113.- Slots J, Taubman M. Contemporary Oral Microbiology and inmunology. Ed. Mosby Year book inc. Missouri 1992. 114.- Sociedad Europea de Endodontología. Consensus report of the European Society of Endodontology on quality guidelinesfor endodontic treatment. Int Endod J 1994; 27(3):115-24. 115.- Spratt D, Pratten J, Wilson M, Gulabivala K. An in vitro evaluation of the antimicrobial efficacy of irrigants on biofilms of root canal isolates. Int Endod J. 2001;34(4):300-7. 116.- Stashenko P. Etiology and pathogenesis of pulpitis and apical periodontitis. En: Essential endodontology, prevention and treatment of apical periodontitis. Orstavik D, Pitt Ford T, editors. Blackwell Science. USA 1998. pp. 42-67 117.- Stheeman S, Mileman P, Van 't Hof M, Van der Stelt P. Diagnostic confidence and the accuracy of treatment decisions for radiopaque periapical lesions. Int Endod J 1995;28:121-28 118.- Strindberg LZ. The dependence of the results of pulp therapy on certain factors. Acta Odontol Scand 1956; 14(21 Suppl):1-175. 119.- Sunde P, Olsen I, Debelian G, Tronstad L. Microbiota of periapical lesions refractory to endodontic therapy. J Endod. 2002;28(4):304-10. 120.- Sunde P, Olsen I, Lind PO, Tronstad L. Extraradicular infection: a methodological study. Endod Dent Traumatol. 2000;16(2):84-90. 121.- Sunde P, Tronstad L, Eribe E, Lind P, Olsen I. Assessment of periradicular microbiota by DNA-DNA hybridization. Endod Dent Traumatol. 2000 Oct;16(5):191-6. 122.- Sundqvist G. Associations between microbial species in dental root canal infections. Oral Microbiol Immunol. 1992;7(5):257-62. 123.- Sundqvist G. Bacteriological studies of necrotic dental pulps. Umeå University Odontological Dissertation, Umeå, Suecia. 1976 124.- Sundqvist G. Ecology of the root canal flora. J Endod. 1992;18(9):427-30. 125.- Sundqvist G, Johansson E, Sjogren U. Prevalence of black-pigmented bacteroides species in root canal infections. J Endod. 1989;15(1):13-9. 126.- Sundqvist G. Taxonomy, ecology, and pathogenicity of the root canal flora. Oral Surg Oral Med Oral Pathol. 1994;78(4):522-30. 127.- Sundqvist G, Figdor D, Persson S, Sjogren U. Microbiologic analysis of teeth with failed endodontic treatment and the outcome of conservative re-treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(1):86-93. 128.- Tang G, Samaranayake L, Yip H, Chu F, Tsang P, Cheung B. Direct detection of Actinomyces spp. from infected root canals in a Chinese population: a study using PCR-based, oligonucleotide-DNA hybridization technique. J Dent. 2003;31(8):559-68. 129.- Tronstad L, Barnett F, Cervone F. Periapical bacterial plaque in teeth refractory to endodontic treatment. Endod Dent Traumatol. 1990;6(2):73-7. 130.- Tronstad L, Barnett F, Riso K, Slots J. Extraradicular endodontic infections. Endod Dent Traumatol. 1987;3(2):86-90. 131.- Valera M, de Moraes Rego J, Jorge A. Effect of sodium hypochlorite and five intracanal medications on Candida albicans in root canals. J Endod. 2001;27(6):401-3. 132.- Vianna M, Gomes B, Berber V, Zaia A, Ferraz C, de Souza-Filho F. In vitro evaluation of the antimicrobial activity of chlorhexidine and sodium hypochlorite. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;97(1):79-84. 133.- Waltimo T, Kuusinen M, Jarvensivu A, Nyberg P, Vaananen A, Richardson M, Salo T, Tjaderhane L. Examination on Candida spp. in refractory periapical granulomas. Int Endod J. 2003;36(9):643-7. 134.- Waltimo T, Orstavik D, Siren E, Haapasalo M. In vitro susceptibility of Candida albicans to four disinfectants and their combinations. Int Endod J. 1999;32(6):421-9. 135.- Waltimo T, Siren E, Orstavik D, Haapasalo M. Susceptibility of oral Candida species to calcium hydroxide in vitro. Int Endod J. 1999;32(2):94-8. 136.- Waltimo T, Siren E, Torkko H, Olsen I, Haapasalo M. Fungi in therapy-resistant apical periodontitis. Int Endod J. 1997;30(2):96-101. 137.- Wayman B, Murata S, Almeida R, Fowler C. A bacteriological and histological evaluation of 58 periapical lesions. J Endod. 1992;18(4):152-5. 138.- Weiger R, Manncke B, Werner H, Lost C. Microbial flora of sinus tracts and root canals of non-vital teeth. Endod Dent Traumatol. 1995;11(1):15-9. 139.- Winkler K, Van Amerongen J. Bacteriologic results from 4,000 root canal cultures. J Oral Surg 1959;12(7):857-75. 140.- Winkler T, Mitchell D, Healey H. A bacterial study of human periapical pathosis employing a modified Gram tissue stain. Oral Surg Oral Med Oral Pathol. 1972;34(1):109-16.
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||