![]()
![]()
![]()
![]()
![]()
|
|
|
Invitado # 22 (Abril 2002) :
"Cambios Histológicos Inducidos por la Edad
en la Pulpa, Dentina y Cemento Dental"
por Sandra Sansano Magnani
Odontólogo, Universidad Central de Venezuela, 1996
Especialista en Endodoncia, U.C.V., Venezuela, 2000-2001
e-mail: ccsansansano@hotmail.com
Introducción
Todos los seres vivientes envejecen cada minuto, cada día, cada año. El envejecimiento es un fenómeno natural que puede ser definido como la suma de alteraciones morfológicas y funcionales que ocurren en el organismo y que conllevan a la disminución de su función y de su habilidad para soportar estrés.
En las últimas décadas debido a la gran cantidad de información científica se ha acumulado un conocimiento considerable sobre la biología del envejecimiento, entendiendo que envejecer no es una enfermedad sino un fenómeno natural.
Debido a que la población anciana crece insistentemente en el mundo, las disciplinas médicas se han visto presionadas a comprender la fisiología del envejecimiento y enfrentar los cambios inevitables que ocurren con el paso del tiempo.
La odontología no escapa de esta realidad, hoy en día, hay una tendencia a la disminución del número de pacientes edéntulos, lo que significa que aumentan las demandas de atención odontológica en este segmento de la población.
Se ha descrito que los tejidos dentales sufren cambios estructurales continuos durante la vida, entre ellos, la reducción del número de fibroblastos, de odontoblastos, de vasos sanguíneos y de fibras nerviosas; el aumento de fibras colágenas, de masas calcificadas, aposición de cemento, de dentina secundaria y de dentina de reparación principalmente.
Si se suman entonces, el aumento de las expectativas de vida de la población mundial, la disminución del número de pacientes edéntulos y los cambios que presentan las estructuras dentarias a consecuencia de la edad, se podrá inferir que la práctica endodóntica en estos pacientes diferirá con respecto a los pacientes jóvenes.
El objetivo de esta monografía es revisar la literatura en relación a los cambios que se presentan a nivel histológico en la pulpa, la dentina y el cemento relacionados con el proceso de envejecimiento y sus posibles consecuencias en el tratamiento endodóntico.
Proceso de Envejecimiento
Definición : El envejecimiento se puede definir como la decadencia de la eficiencia del cuerpo después de la madurez. Es un proceso inevitable y una parte intrínseca de la naturaleza de todas las formas de vida 4 (Figura 1).
 ccccc ccccc |
Figura 1. El envejecimiento. Tomado de De Crecenzo, 1994 19. |
El envejecimiento no se considera una enfermedad, no presenta signos ni síntomas y es generalmente benigno. La característica principal del proceso normal de envejecimiento es la pérdida de las reservas fisiológicas de los órganos lo que coloca al individuo anciano en riesgo de desarrollar enfermedades y síndromes. Este riesgo puede ser modificado significativamente por el comportamiento y el estilo de vida del individuo a cualquier edad 70.
Jazwinski y Rothschild 30 definen el proceso de envejecimiento como la suma de todas las alteraciones morfológicas y funcionales que ocurren en el organismo y que llevan al cese de las funciones del mismo. Sobre estos cambios biológicos básicos que ocurren con la edad se suma el aumento de la vulnerabilidad a las enfermedades, por lo que delimitar donde terminan los procesos normales que se presentan en el envejecimiento y donde comienzan los cambios patológicos, es un asunto difícil.
En muchos individuos, ciertos procesos fisiológicos decaen con la edad, como el riego sanguíneo renal, la velocidad de filtración glomerular y la inmunidad celular. Sin embargo, otros procesos fisiológicos permanecen sin cambios, como la mayoría de las funciones del hígado y la capacidad total de los pulmones. Estas sorprendentes diferencias deben tomarse en cuenta cuando se comparan individuos jóvenes con individuos ancianos 1.
Las alteraciones de un sistema o de una estructura no siempre significan el envejecimiento de todo el organismo, pero el deterioro de cualquier órgano puede producir cambios en otros órganos 47.
Algunos de los cambios que suceden con la edad son naturales, sin embargo, otros cambios son consecuencia de enfermedades, de drogas y de ciertos efectos que la sociedad ejerce sobre la persona anciana. Lo más importante es entender que envejecer por sí mismo no es una enfermedad 47.
Entre los individuos varía considerablemente tanto la velocidad como la magnitud en que los cambios relacionados con la edad se presentan en sus células, tejidos y órganos 47.
Una observación común es que algunas personas envejecen rápidamente mientras que otras se conservan muy bien. Esta observación, junto con las diferencias individuales de longevidad y las amplias variaciones en el rendimiento de personas de la misma edad cronológica, han llevado al concepto funcional o fisiológico del envejecimiento que se debe diferenciar del concepto cronológico de envejecimiento 47.
Bates y col 4 consideran al individuo anciano aquel que tiene 65 años o más. Ellos representan un grupo especial para el cual se requiere experiencia en su manejo y así poder lograr los mejores resultados posibles en su tratamiento.
Factores que influyen en el envejecimiento:
Existen 2 hipótesis que tratan de explicar la naturaleza del envejecimiento. La primera propone que envejecer es el resultado de un daño al azar y la segunda señala que envejecer es el resultado de una degeneración programada, controlada del organismo 47.
Envejecer, en esencia, refleja una interacción de factores genéticos, hereditarios y ambientales 47.
Factores genéticos y hereditarios : Existe evidencia sustancial de que la genética juega un papel importante en el envejecimiento. Muchos de los genes que se encuentran diferencialmente expresados durante el tiempo de vida pueden probablemente jugar un papel en el envejecimiento a nivel celular. De una forma indirecta, estos genes pueden influir en el envejecimiento del organismo. Aunque una célula no haya agotado su tiempo de vida, las deficiencias incrementales en su función, que ocurren durante el envejecimiento, jugarán un papel indiscutible en la senilidad. La principal evidencia de que el envejecimiento, expresado como el lapso de vida, está genéticamente determinado se deriva de las siguientes observaciones: las mutaciones, el tiempo específico de vida para cada especie, el vigor híbrido, el sexo, la edad de los padres, los estudios en gemelos, el síndrome de envejecimiento prematuro y el cultivo de células 47.
Factores ambientales : No ha sido posible documentar convincentemente la acción de algún factor ambiental en la velocidad de envejecimiento. Sin embargo, se ha sugerido que existen cuatro tipos de factores ambientales que producen diferencias en la velocidad de envejecimiento en humanos como lo son: ciertos componentes físicos y químicos del ambiente como la radiación, factores biológicos como la nutrición, agentes patógenos y parásitos y factores socio-económicos 47.
Teorías Biológicas del Envejecimiento :
Cohen 17 refiere que hay una gran parte de fantasía relacionada con el envejecimiento y muy pocos hechos demostrados. Aunque existen muchas investigaciones que se realizan alrededor del mundo, la causa del envejecimiento no ha sido aún determinada.
Se han propuesto numerosos modelos moleculares para explicar los mecanismos del envejecimiento. La abundancia de teorías indica la multitud de interpretaciones posibles que pueden hacerse a partir de la información que se tiene y lo reciente del desarrollo en este campo 17.
Muchas teorías suponen que un solo mecanismo es el responsable de todos los cambios característicos que suceden con la edad. Más aún, muchas de ellas se centran en los trastornos que ocurren en una molécula blanco, e ignoran la posibilidad de que envejecer puede ser el resultado de muchos eventos independientes incluyendo el deterioro genéticamente programado, los cambios genéticos al azar y los insultos ambientales 47.
Morse 38 explica que muchos de los conceptos de estas teorías pueden ser aplicadas a la pulpa dental, por lo que los aspectos más importantes de ellas serán examinados.
Teorías genéticas :
Diferentes autores han investigado sobre los aspectos genéticos del ser humano y han propuesto distintas teorías que intentan explicar el proceso de envejecimiento que se produce en todos los individuos.
- Teoría del error: esta teoría propone que la senilidad se debe a una acumulación progresiva de errores metabólicos en las macromoléculas 47.
De acuerdo con Morse 38 los desperfectos en la formación de proteínas, incluyendo enzimas y hormonas, producen defectos en una o más de las sustancias intermediarias involucradas en la elaboración de proteínas. Estos errores pueden ocurrir en el ADN, ARN mensajero y ARN de transferencia. Estas enzimas defectuosas pueden conllevar a errores en la síntesis de proteínas y ser la base para el envejecimiento.
Debido a que el metabolismo celular, las interacciones celulares y tisulares y muchas de las funciones vitales dependen de la calidad de las proteínas que se sintetizan, la acumulación de errores en la producción de estas macromoléculas eventualmente será tan grande que impedirá la función de ese sistema particular 47.
- Teoría de las mutaciones somáticas: esta teoría propone que deben ocurrir mutaciones en células somáticas. Debido a que las mutaciones deben producir cambios en las funciones de células o tejidos, un número suficiente de células con mutaciones puede afectar la función de un tejido u órgano 47.
Si las estructuras de personas de edad contienen un número apreciable de células con mutaciones, las estructuras en cuestión deben funcionar de manera menos eficiente que si estuvieran normales. Cuando las células somáticas acumulan un número específico de mutaciones, debe sobrevenir la senilidad 38. Sin embargo Curtis 18 señala que un número de mutaciones somáticas en el organismo en un momento dado es inadecuado para explicar el envejecimiento y la muerte.
- Teoría de la redundancia: esta teoría propone que el envejecimiento es atribuible a la pérdida única y no repetida de información genética del genoma. Aunque muchos genes se presentan en múltiples copias, estas copias son frecuentemente genes que no pueden ser expresados o son variantes que juegan un papel específico durante el desarrollo y en ciertas condiciones específicas. Papas y col 47 señalan que esta teoría posee valor histórico únicamente.
Morse 38 por su parte refiere que existe una redundancia de genes que lleva a una capacidad de reserva que asegura que los sistemas del organismo funcionen adecuadamente por períodos de tiempo extensos.
- Teoría de la senilidad genéticamente programada: esta teoría es la más general y amplia de todas y se corresponde con la naturaleza probabilística del proceso de envejecimiento y puede acomodar en ella componentes fortuitos. Esta teoría compara el proceso de envejecimiento con el desarrollo del organismo y considera de alguna manera al envejecimiento como una extensión del desarrollo. La senilidad programada no necesariamente implica que todas las manifestaciones del proceso de envejecimiento son parte del programa 4.
Las células del cuerpo tienen un tiempo de vida programada genéticamente. Para que ciertos eventos tomen lugar en el organismo, es necesario que algunas células mueran. Esta teoría sugiere que todas las células somáticas tienen una vida finita y morirán sin importar el ambiente que las rodee. Esta teoría tiende a explicar el proceso de envejecimiento, sin embargo no explica como una célula puede ser programada para morir 4.
- Teoría del soma desechable: esta teoría está basada en el concepto de que los genes pleitrópicos permiten que haya una cantidad de energía óptima durante la juventud del individuo para maximizar su capacidad reproductiva. Una vez que el período reproductivo se termina, estos genes causan senilidad de manera rápida porque la energía ya no es necesaria para asegurar un desempeño óptimo 38.
Teorías no genéticas
Diferentes autores 4,17,25,35,38,47 han propuesto teorías que toman en cuenta distintos aspectos no genéticos para explicar el proceso de envejecimiento.
-Teoría inmunológica: con la edad, el sistema inmune tiende a ser menos capaz de distinguir entre moléculas normales y anormales, de manera que las células anormales pueden proliferar y se pueden desencadenar reacciones de autoinmunidad 17.
Morse 38 sugiere que con la edad se disminuyen el número de linfocitos T y de anticuerpos y su capacidad de realizar sus funciones. Por lo tanto, las infecciones y las enfermedades malignas prevalecen en los individuos ancianos con respecto a los individuos jóvenes.
Levy 35 señala que la teoría más importante para entender la patología bucal en el anciano es la teoría inmunológica. Esta teoría postula que la disminución en la función inmune y la activa destrucción de órganos vitales por el sistema inmune causa envejecimiento. El envejecimiento también está asociado con la disminución de la magnitud de la respuesta inmune.
Todo lo anteriormente expuesto hace pensar que existe una aparente inmunodeficiencia relacionada con la edad, pero las relaciones entre la disminución de la respuesta inmune con la edad y la susceptibilidad a las infecciones y la aparición de enfermedades malignas no ha podido ser comprobada 38.
- Teoría de los radicales libres: los radicales libres son químicos altamente reactivos, de corta vida que son producidos durante las reacciones metabólicas normales del organismo. Esta teoría postula que los radicales libres combinados con moléculas esenciales causan daño en el ADN o en otras estructuras celulares. Estas reacciones contribuyen al proceso de envejecimiento y en las enfermedades relacionadas con este proceso. La teoría de los radicales libres en su forma original es difícil de mantener. Ella se ha modificado para postular que estos radicales libres están implicados en procesos que acortan la vida por debajo del máximo posible de vida en un organismo determinado 47.
La evidencia para esta teoría yace en experimentos donde se administran antioxidantes a animales para bloquear los radicales libres, lo que resulta en que los animales viven más, ya que tanto el ADN como el ARN permanecen normales 4.
El cuerpo contiene mecanismos antioxidantes naturales que contrarrestan los radicales libres. Con la edad, estos mecanismos son menos eficientes y se producen más radicales libres 38.
Los radicales libres son capaces de destruir células del sistema inmune. Como resultado de este suceso, el daño que ellos producen se ha relacionado con un número de enfermedades crónicas que prevalecen en las personas de edad 38.
- Teoría de la asociación cruzada: esta teoría explica que el envejecimiento es causado por moléculas que son inmovilizadas irreversiblemente por la acción cruzada de sustancias, teniendo un efecto profundo en la función fisiológica 47.
Según Cohen 17, el envejecimiento se produce como el resultado de un proceso continuo de asociación cruzada entre proteínas y moléculas del ácido nucleico. Como resultado de los cambios químicos que ocurren, el comportamiento químico de la molécula original se altera y frecuentemente, la molécula original no es capaz de realizar sus funciones lo que conlleva a la eventual muerte del organismo.
Morse 38 señala que la cadena de eventos conocidos como envejecimiento empieza con la formación de asociaciones cruzadas entre proteínas y ácidos nucleicos. Esta asociación cruzada también puede darse entre moléculas de colágeno, lo cual explica el envejecimiento de la piel, tendones, hueso, pulpa dental, vasos sanguíneos, tejido pulmonar y otros componentes del cuerpo.
- Teoría de la velocidad del metabolismo o teoría del desgaste y daño: se ha propuesto que una velocidad mayor en el metabolismo presumiblemente resultará en un mayor desgaste y daño del organismo, lo que a su vez resultará en un acortamiento del tiempo de vida. Esta simple teoría declara que el envejecimiento puede resultar de la acumulación de daños a niveles celulares o intracelulares, lo que conlleva a la pérdida de la célula o la pérdida de su función. La inhabilidad de reparación es un signo del proceso de envejecimiento. En otras palabras, el envejecimiento y la muerte ocurren por el desgaste y daño por el uso diario del organismo, como eventualmente ocurre con cualquier máquina 47.
Morse 38 sugiere que el envejecimiento es debido a algún tipo de daño en los componentes del cuerpo, ya sea por el uso de sus partes, como por daños en la genética o en los mecanismos de formación de proteínas (insultos biológicos). Esto puede suceder a través de factores físicos estresantes como el calor, la luz, la oxidación, la radiación, los químicos, las drogas, los traumas, la presión, las infecciones, la dieta y el ruido entre otros.
Probablemente la única área del cuerpo humano donde se aplica esta teoría es en los dientes, produciéndose atrición. Los cambios en la pulpa asociados con la edad no encajan dentro de esta teoría 47.
Otras teorías biológicas
- Teoría del colágeno: esta teoría se basa en los experimentos realizados por Verzar´s, en 1956. Él postula que con la edad la cantidad de colágeno aumenta y se reduce de tamaño, lo que resulta en arrugas y anoxia de los tejidos. Esta teoría solo explica uno de los síntomas del envejecimiento que es el arrugamiento de la piel 17.
- Teoría de los productos de desecho: si los productos de desecho del metabolismo no se excretan tan rápido como se forman, pueden acumularse y lentamente envenenar al organismo 17.
Morse 38 se refiere a esta teoría como la teoría del tinte, en la cual explica que hay sustancias marrones, inertes y fluorescentes que se acumulan lentamente en las células que no tienen capacidad para dividirse como las células del corazón, del cerebro, los nervios y otros órganos. Estas sustancias interfieren con la actividad de las células involucradas.
- Teoría de la difusión: Carpenter 15, en 1965, postuló que el envejecimiento puede ser tratado como un fenómeno de difusión en el cual algunas moléculas grandes y complejas en el organismo tienden a ser producidas a una velocidad mayor que la velocidad en la cual pueden ser removidas .
- Teoría del estrés: el estrés de todos los días resulta en el desgaste y en el daño del organismo. La suma total del daño producido por el estrés se traduce en envejecimiento. Esta teoría enfatiza que la excesiva presión puede terminar con la vida. También hace notar que mientras más viejo es el organismo, menos capacidad tiene para soportar estrés antes de que aparezcan enfermedades o muerte 17,38.
- Teoría cibernética: esta teoría señala que un organismo representa un sistema integrado y que células esenciales están usualmente vivas por un período de tiempo después de que el organismo muere. El envejecimiento, por lo tanto, es la pérdida gradual de control del sistema nervioso sobre las células del organismo y la muerte es la etapa final de este proceso 17.
- Teoría integrada: Carpenter y loynd 16, en 1968, proponen una teoría integrada de envejecimiento que asume que la mayor causa de envejecimiento es la asociación cruzada de todos los tipos de moléculas, que la velocidad de esta asociación es proporcional a la velocidad del metabolismo y que a su vez es dependiente de la densidad de los radicales libres dentro del sistema y que el aumento de estrés resulta en cambios biomecánicos que incrementan la velocidad de la asociación cruzada.
- Teoría dominó: Morse 38 describe esta teoría y explica que existen sustancias tóxicas que se acumulan dentro de las células. Cuando una estructura celular se inhibe, otras estructuras dentro de la célula se inhiben también, lo que resulta en un debilitamiento en la habilidad de funcionar normalmente. Conforme una persona envejece, la cantidad de sustancias inhibitorias dentro de la célula y en los espacios intercelulares aumenta. La inhibición de la síntesis de proteínas durante el envejecimiento es seguida de una disminución gradual de todos los procesos metabólicos y biosintéticos.
- Teoría de la desnaturalización térmica: la desnaturalización térmica que ocurre lentamente inmoviliza las proteínas. Esto a la vez produce daño en la integridad de la célula y su eventual muerte 38.
- Teoría de la pérdida celular: considera que la pérdida celular es una de las causas fundamentales del envejecimiento humano. Las células con capacidad para dividirse que se encuentran en la piel, en las membranas mucosas y en el tracto gastrointestinal tienen el potencial biológico de dividirse en un máximo de 50 veces antes de morir. Las células que tienen capacidad parcial para dividirse tienen una reducción aún mayor en su división en edad avanzada. Aquellas células que no pueden dividirse se encuentran ausentes en un 40% a los 75 años de edad. La pérdida de células resulta en una disminución de la función y disminución de tamaño de las estructuras involucradas 38.
- Teoría de la radiación: considera que el envejecimiento es causado en parte por las radiaciones ionizantes dañinas que provienen del espacio, de las rocas y del suelo. Las radiaciones ionizantes producen ciertos cambios comparables con aquellos que se producen durante el envejecimiento normal. Después de la exposición a las radiaciones, un número viable de células y de tejidos se reduce. Las radiaciones también pueden producir daños en el ADN y en las células somáticas 38.
- Teoría nutricional: esta teoría considera que el envejecimiento resulta de la acumulación de minerales como cobre, hierro, manganeso, zinc y calcio, que provienen de la nutrición. También se acumulan otros metales tóxicos como plomo, aluminio, cadmio y titanio 38.
- Teoría del macrófago: esta teoría señala que el envejecimiento está relacionado con un aumento en la actividad de los macrófagos en el colon, debido a que se ha postulado que los desechos tóxicos del colon pasan al torrente sanguíneo y finalmente debilitan al organismo. Posteriormente, los macrófagos atacan a las células debilitadas, produciéndose aún más daño 38.
- Teoría de la hipoxia: señala que el envejecimiento es causado por un descenso en la tensión de oxígeno en áreas críticas del cuerpo como lo es el cerebro. Este descenso puede estar relacionado con factores genéticos, traumas del ambiente o ambos 38.
A pesar de las numerosas teorías que han sido propuestas para explicar el proceso de envejecimiento, la causa de este fenómeno es aún desconocida y no existe hasta ahora la forma de detener los cambios que se producen por el aumento de la edad.
Histología Dental
Pulpa Dental
La pulpa es un tejido conectivo especializado, de origen mesenquimático, ricamente inervado y vascularizado que se encuentra contenido dentro del espacio central del diente y rodeado por dentina. Tiene funciones formativas, nutritivas, sensitivas y de protección 22.
La formación de la dentina es la primera función de la pulpa tanto en secuencia como en importancia. De la papila dental surge la capa celular de odontoblastos adyacente y medial a la capa interna del órgano del esmalte ectodérmico. El ectodermo interactúa con el mesodermo y los odontoblastos inician el proceso de formación de dentina 48.
La nutrición de la dentina es función de las células odontoblásticas y de los vasos sanguíneos adyacentes. Los nutrientes se desplazan por los capilares pulpares hacia el líquido intersticial, de allí viajan hacia la dentina a través de la red de túbulos creados por los odontoblastos para dar cabida a sus prolongaciones 48.
La pulpa tiene una función sensitiva ya que es un órgano sensorial único. A pesar de estar contenida dentro de la dentina, la pulpa es indiscutiblemente sensible a estímulos térmicos, a pesar de la baja conductividad térmica de la dentina 67.
Se ha especulado que la protección del diente y de la pulpa se realiza mediante la formación de dentina nueva en presencia de irritantes, sin embargo, la pulpa puede proporcionar esta defensa de manera intencional o accidental. De cualquier modo, la formación de capas de dentina puede reducir el ingreso de irritantes o evitar y retardar la penetración de la caries dental 48.
La pulpa está conformada por una población heterogénea de células, incluyendo odontoblastos, fibroblastos, células del estroma, células vasculares, células endoteliales y perivasculares, células nerviosas, células mastoides, linfocitos T y macrófagos principalmente. Estas células están presentes en una matriz extracelular rica en colágeno. La mayoría de estas células son posmitóticas, sin embargo, las células del estroma pueden dividirse en la pulpa y originar nuevos componentes celulares 23.
Elementos celulares
-Odontoblastos: son las células características de la pulpa que se encargan de la dentinogénesis tanto durante el desarrollo del diente como en etapas maduras del mismo 67.
Butler 12 señala que los odontoblastos se originan de células ectomesenquimáticas derivadas de la cresta neural durante la formación embrionaria. Al ellas diferenciarse, los odontoblastos dejan de dividirse y producen la matriz extracelular, la cual se secreta de manera unidireccional formando un tejido no mineralizado que corresponde a la predentina. Esta predentina se transforma en dentina cuando se mineraliza. Mientras se va formando esta matriz no mineralizada, los odontoblastos se retiran en dirección pulpar, dejando sus prolongaciones odontoblásticas.
Al microscopio electrónico de barrido, los odontoblastos se presentan como capas múltiples de células grandes, alineadas muy cerca unas de otras. Su tamaño varía de 3 a 4 um de ancho y de 8 a 10 um de largo 55.
Las actividades de síntesis y de secreción hacen que el odontoblasto sea muy polarizado; la síntesis tiene lugar en el cuerpo celular y la secreción en la proyección o proceso odontoblástico. El cuerpo celular tiene organelas que representan diferentes etapas en la secreción de colágeno, glucoproteínas y sales de calcio 48.
Aparentemente, los odontoblastos secretan solo colágeno tipo I, sin embargo, pequeñas cantidades de colágeno tipo V han sido observadas a través del microscopio electrónico. Además de secretar glucoproteínas y colágeno, los odontoblastos son capaces de secretar sialoproteinas, fosfatasa alcalina y fosfoforinas. Esta última es exclusiva de la dentina y se encuentra involucrada en los procesos de mineralización extracelular. La fosfatasa alcalina es una enzima que está relacionada con la mineralización, sin embargo su rol principal no ha sido aún determinado 67.
Durante la formación de la dentina en la corona, los odontoblastos son impulsados hacia adentro para formar la periferia de la cámara pulpar, cuya circunferencia es cada vez mayor que la original a nivel de la unión de la dentina con el esmalte. Esto explica porqué las células se encuentran condensadas y formando una empalizada que da un aspecto pseudoestratificado a los odontoblastos coronarios. Por el contrario, como el espacio no es tan limitado en la pulpa radicular, los odontoblastos conservan una forma cilíndrica, cuboide o escamosa 48.
Ultraestructuralmente los odontoblastos exhiben retículos endoplasmáticos rugosos ordenados, aparatos de Golgi prominentes, gránulos secretorios y numerosas mitocondrias. Son además ricos en ARN y sus núcleos contienen uno o más nucleolos 67 (Figura 2).
|
|
Figura 2. Diagrama de un odontoblasto completamente diferenciado. Tomado de Trowbridge y Kim, 1998 67. |
Un odontoblasto completamente desarrollado en la pulpa coronal es una célula columnar alta que presenta procesos celulares que se encargan de la formación de túbulos dentinarios. Las ramas laterales de estos procesos se interconectan entre sí a través de canales, lo cual permite la comunicación intercelular y la circulación de metabolitos y fluidos a través de la matriz mineralizada 67.
Los procesos odontoblásticos han sido descritos de manera clásica como una prolongación del cuerpo celular cuya extensión dentro de los túbulos dentinarios sigue siendo motivo de controversia 48.
Los microtúbulos y los microfilamentos son los principales componentes ultraestructurales de los procesos odontoblásticos y de sus ramas laterales. Los microtúbulos se originan en el cuerpo celular y siguen su curso paralelo al eje largo de la célula. La función de estos microtúbulos es aún incierta, sin embargo, se especula que ellos pueden ser una extensión del citoplasma que sirve para el transporte de materiales. Otra función puede ser la de servir como esqueleto que le proporcione rigidez al proceso odontoblástico 67.
- Fibroblastos: los fibroblastos son células de forma fusiforme con núcleos ovoides, que sintetizan y secretan la mayor parte de los componentes extracelulares, es decir, el colágeno y la sustancia fundamental. Ellos no solo son los principales productores de colágeno, sino que también participan en su eliminación y en su recambio, lo cual ocurre en el interior de la célula por la acción de enzimas lisosómicas, que digieren los componentes del colágeno 48.
Las microradiografías electrónicas sugieren que estas células son productoras activas de colágeno, presentan organelas bien desarrolladas y particularmente su retículo endoplásmico rugoso es extenso, denso y muy desarrollado. Los ribosomas se encuentran en hileras o racimos y el aparato de Golgi presenta una extensa pila de vacuolas y vesículas. Las mitocondrias son grandes. El citoplasma de estas células es denso y contiene un número variable de fibrillas intracelulares. Es frecuente encontrar un cilio cerca del núcleo y un centríolo adicional se puede localizar perpendicular al eje largo del cilio 55.
Se ha demostrado que estas células sintetizan al menos seis tipos de glucoproteínas, de las cuales la más importante es la fibronectina, ya que la asociación de esta enzima con el colágeno pulpar tipo III puede dar como resultado las fibras de reticulina que se encuentran en la pulpa 55.
De acuerdo con Pashley y Walton 48, estas células tienen una amplia variación en su grado de diferenciación. Se puede referir a ellas como células mesenquimatosas, pulpoblastos o pulpocitos, en orden progresivo de maduración.
Goldberg y Lasfargues 23 señalan que estas células son altamente diferenciadas y es poco probable que ellas se diferencien en neo-odontoblastos. Sin embargo, como se ha podido demostrar a través de cultivos de células pulpares, ellas tienen cierto potencial para formar nódulos de osteodentina que luego se mineralizan.
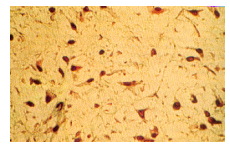
Aunque los fibroblastos pueden verse distribuidos en toda la pulpa, (Figura 3) ellos son particularmente abundantes en la zona rica en células 67.
 cccc cccc |
Figura 3. Fibroblastos pulpares al microscopio óptico. Hematoxilina férrica 100X. Tomado de Gómez y Campos, 1999 24 |
- Macrófagos: los macrófagos o histiocitos son monocitos que han dejado el torrente sanguíneo para penetrar en los tejidos y diferenciarse en macrófagos. Ellos se encuentran usualmente cerca de los vasos sanguíneos y son activos en las labores de fagocitosis y endocitosis. Debido a su capacidad de movilidad y su actividad fagocítica, ellos actúan removiendo glóbulos rojos extravasados, células muertas y cuerpos extraños del tejido. Este material ingerido es destruido por la acción de enzimas lisosomales 67.
De forma característica, los macrófagos tiene numerosas vacuolas, vesículas y cuerpos rodeados por membranas, llamados lisosomas. Los lisosomas tienen varias enzimas hidrolíticas que ayudan en la descomposición del material digerido 55.
Trowbridge y Kim 67 señalan que una proporción de macrófagos, cuando son activados por las citoquinas, participa en las reacciones inmunológicas procesando los antígenos y presentándoselos a los linfocitos. Cuando estas células son activadas por los estímulos inflamatorios apropiados, los macrófagos son capaces de producir una variedad de factores solubles como la interleucina-I, el factor de necrosis tumoral, factores de crecimiento y otras citocinas.
- Células dendríticas: estas células, así como los macrófagos, son células accesorias del sistema inmune. Se consideran las equivalentes a las células de Langerhans que se encuentran en la epidermis y en las membranas mucosas. Ellas se encuentran ampliamente distribuidas en el tejido conectivo incluyendo el tejido pulpar 67.
Trowbridge y Kim 67 señalan que estas células son presentadoras de antígenos y se caracterizan por prolongaciones citoplasmáticas dendríticas y un antígeno de superficie clase II del complejo de histocompatibilidad.
Al igual que los macrófagos, estas células fagocitan y procesan los antígenos. Ellas, junto con los macrófagos y los linfocitos participan en la vigilancia inmunológica de la pulpa 67.
- Linfocitos: se ha reportado la presencia de linfocitos T en pulpas normales de dientes humanos, siendo los más frecuentes, los linfocitos T supresores. La presencia de estas células, de macrófagos y de células dendríticas indica que la pulpa se encuentra equipada con las células requeridas para iniciar respuestas inmunológicas 67.
Por el contrario, algunos autores 48,55 señalan que estas células aparecen tras la invasión de neutrófilos en un área de la pulpa que ha sido lesionada, describiendo que los linfocitos no suelen encontrarse en tejido pulpar sano y se asocian a lesiones y reacciones inmunitarias resultantes, como en intentos de destruir, dañar o neutralizar sustancias extrañas. Su presencia indica, por lo tanto, que hay algún irritante persistente.
- Células mesenquimatosas: la pulpa contiene un reservorio de células descendientes de células indiferenciadas en la papila dental primitiva. Estas células multipotenciales conservan la capacidad de desdiferenciarse y rediferenciarse según sea necesario en muchos tipos de células maduras. Se encuentran en gran concentración por debajo de la zona rica en células 48. Seltzer y Bender 55 describen que estas células se encuentran usualmente en la parte exterior de los vasos sanguíneos.
Al morirse o lesionarse los odontoblastos, ellos envían señales a través de conexiones citoplasmáticas a estas células indiferenciadas, lo que hace que ellas se dividan y se diferencien, formando odontoblastos o células similares según sea el requerimiento 48.
Seltzer y Bender 55 afirman que las células mesenquimatosas indiferenciadas están presentes en la pulpa como lo están en todos los tejidos conectivos del cuerpo. Ellas son capaces de convertirse en macrófagos durante alguna injuria a la pulpa. También pueden diferenciarse en odontoblastos, fibroblastos y osteoclastos.
- Células cebadas: este tipo de células se encuentra ampliamente distribuido en los tejidos conectivos del cuerpo humano, en forma de pequeños grupos en relación con los vasos sanguíneos. Su presencia en la pulpa sana ha sido motivo de controversia, sin embargo es un hallazgo frecuente en pulpas inflamadas. Su presencia es de importancia por que estas células contienen gránulos de heparina y de histamina, relevantes en los procesos inflamatorios 48, 67.
Sustancia fundamental
La sustancia fundamental es una masa de consistencia gelatinosa que constituye la mayor parte del órgano pulpar y ocupa el espacio entre los elementos formados. Esta compuesta básicamente por complejos de proteínas, carbohidratos y agua. Específicamente, estos complejos están formados por combinaciones de glucosaminoglicanos, es decir, ácido hialurónico, condrointinsulfato y otras glucoproteínas 48,67.
La mayoría de las proteínas que se encuentran en la matriz extracelular son glucoproteínas, entre ellas la fibronectina que en unión con el colágeno forma una red fibrilar que determina en algún grado, la motilidad, adhesión, crecimiento y diferenciación de las células 67.
El ácido hialurónico tiene una gran afinidad por el agua y representa el mayor componente de la sustancia fundamental de tejidos con un gran porcentaje de agua. El contenido de agua en la pulpa es muy alto, acercándose a un 90%, por lo tanto, la sustancia fundamental forma un amortiguador capaz de proteger a las células y a los componentes vasculares de los dientes 67.
La sustancia fundamental rodea y da apoyo a las estructuras, constituyendo el medio a través del cual los metabolitos y productos de desecho son transportados hacia las células y vasos 48.
No existe otra forma para que los nutrientes pasen desde los vasos sanguíneos hacia las células que no sea por medio de la sustancia fundamental. Para que esto suceda, los nutrientes deben disolverse en esta sustancia. Lo mismo ocurre con los productos excretados por las células para que puedan alcanzar la circulación eferente 55.
Esta sustancia es capaz de tener efecto sobre la diseminación de la infección, sobre el intercambio de metabolitos, sobre la estabilidad de los cristaloides y además, afecta las hormonas, vitaminas y otras sustancias metabólicas de la pulpa 55.
Trowbridge y Kim 67 señalan que la sustancia fundamental se puede degradar en presencia de lesiones inflamatorias, donde hay gran concentración de enzimas lisosomales, como lo son las enzimas proteolíticas, hialuronidasa y condroitinsulfatasa.
Fibras pulpares.
En la pulpa se encuentran dos tipos de proteínas estructurales, el colágeno y la elastina. La elastina se encuentra confinada a las paredes de las arteriolas y no se considera parte de la matriz extracelular de la pulpa 48,67.
Una molécula de colágeno sencilla se denomina tropocolágeno y consiste en 3 cadenas de polipéptidos. Las diferentes combinaciones de estas cadenas permiten que las fibras de colágeno y las fibrillas puedan ser clasificadas en los siguientes tipos: el colágeno tipo I, que se encuentra en la piel, en los tendones, en el hueso, en la dentina y en la pulpa. El colágeno tipo II, que se encuentra en los cartílagos. El colágeno tipo III, que se encuentra en la mayor parte del tejido conectivo no mineralizado como la papila dental y la pulpa madura 48, 67.
Según Seltzer y Bender 55, el colágeno tipo III constituye entre un 28% y un 45% del colágeno pulpar total. Es probable que este tipo de colágeno junto a los proteoglicanos actúen como amortiguador para proteger el plexo arterial y la capa odontoblástica de las presiones ejercidas sobre el diente.
El colágeno tipo IV es el esqueleto de todas las membranas basales, mientras que el colágeno tipo VI es un constituyente menor de la pulpa formando las microfibrillas de la matriz extracelular, sirviendo como anclaje flexible que interconecta las fibras colágenas entre sí, y ellas con las células 26.
El colágeno tipo I es sintetizado por los odontoblastos y osteoblastos, mientras que los fibroblastos sintetizan el colágeno tipo I, III, V y VI 48, 67.
Hillmann y Guertsen 26 clasifican histológicamente a las fibras pulpares en fibras reticulares, fibras colágenas y fibras de Von Korff. Esta clasificación se basa en las características morfológicas y de tinción.
Seltzer y Bender 55 señalan que las fibras reticulares se ubican alrededor de los vasos sanguíneos y de los odontoblastos. Los espacios intercelulares contienen finas redes de fibras reticulares que pueden transformarse en colágeno. Las fibras colágenas son sintetizadas por los fibroblastos pulpares. El precursor de este colágeno se forma en el retículo endoplásmico rugoso, desde donde se excreta al exterior de la célula para madurar en fibras colágenas.
A nivel ultraestructural, las fibras colágenas se identifican por la presencia de bandas típicas de 640 Å. Estas bandas colágenas forman una estructura reticular laxa que sirve para sostener otros elementos estructurales de la pulpa 48.
Los paquetes de fibras colágenas grandes son mucho más numerosos en la pulpa radicular que en la pulpa coronaria. La mayor concentración de estos paquetes se encuentra usualmente cerca del ápice, dándole a esta zona una apariencia blanquecina 55,67.
Las fibras de Von Korff consisten en disposiciones únicas de haces de colágeno en la pulpa periférica, los cuales tienen forma de sacacorcho y se originan entre los odontoblastos y pasan hacia la matriz de la dentina 48, 67.
Elementos vasculares.
El suministro arterial de la pulpa se origina de las ramas alveolar posterior superior, infraorbital y alveolar inferior de la arteria maxilar interna 55.
La sangre entra a la pulpa a través de arteriolas de 100 um de diámetro o menores. Estos vasos atraviesan el foramen apical y las foraminas en compañía de haces nerviosos 55,67. Los vasos más pequeños pueden entran en la pulpa a través de conductos accesorios y laterales. Una vez dentro de la pulpa, estos vasos corren centralmente despidiendo ramas laterales hacia la capa odontoblástica, debajo de la cual se ramifican dando lugar al plexo capilar 67.
En la pulpa coronaria, las arteriolas se ramifican hacia la dentina, disminuyen de tamaño y dan lugar a la red capilar en la región subodontoblástica. Los capilares de esta zona están rodeados por membranas basales que ocasionalmente tienen fenestraciones que permiten el rápido transporte de fluidos y metabolitos desde los capilares hasta los odontoblastos adyacentes 67.
El riego sanguíneo en la región de la pulpa coronaria es aproximadamente el doble que en la región radicular, siendo la parte de mayor riego sanguíneo, los cuernos pulpares 67.
De regreso, la sangre pasa desde los capilares a las vénulas pequeñas y luego a las más grandes. Estos vasos en la pulpa tienen paredes inusualmente finas, lo cual facilita el movimiento de fluido a través de ellas. A medida que las vénulas toman la parte central de la pulpa se hacen más grandes, alcanzando un máximo de 200 um 67.
Las anastomosis arteriovenosas pueden existir tanto en la parte coronaria como en la parte radicular y proveen una comunicación directa entre arteriolas y vénulas. Estas anastomosis consisten en vénulas de aproximadamente 10 um de diámetro, que eliminan sangre en los sitios de daño donde ha ocurrido trombosis y hemorragia 67.
En el ápice radicular se encuentran múltiples vénulas que salen de la pulpa. Estas vénulas se comunican con vasos que drenan al ligamento periodontal y al hueso alveolar adyacente 48.
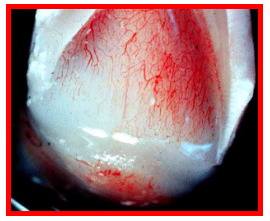
La arquitectura vascular anteriormente descrita se encuentra presente en todos los conductos de todos los dientes. Se cuenta con un riego sanguíneo alterno con las ricas anastomosis en la cámara pulpar para los dientes con múltiples conductos 48 (Figura 4).
 ccccc ccccc |
Figura 4. Corte longitudinal de un diente fresco. Se evidencia el suministro vascular de una pulpa joven. Tomado de www.usd.uchc.edu, 2001. 68 |
Elementos linfáticos.
El sistema linfático es un sistema circulatorio secundario cuya principal función es la de recircular el fluido intersticial al torrente sanguíneo, así como también de transportar los productos de las células a la circulación 55.
La linfa y el fluido de los dientes y de los tejidos subcutáneos drenan en las glándulas submaxilares, submentonianas y eventualmente en las glándulas cervicales superficiales y profundas que se distribuyen a lo largo de las venas yugulares internas y externas 55.
La existencia de vasos linfáticos en la pulpa es motivo de controversia debido a que es difícil distinguirlos de los capilares bajo el microscopio de luz 55,67.
Pashley y Walton 48 señalan que a nivel histológico, los vasos linfáticos se pueden distinguir de los capilares por la ausencia de eritrocitos en sus luces, la falta de imbricación de los márgenes endoteliales y la ausencia de láminas basales.
Los vasos linfáticos se originan como capilares linfáticos en la zona periférica de la pulpa y se unen a otros capilares linfáticos para formar vasos colectores. Estos vasos se unen con conductos linfáticos de diámetro creciente que pasan a través del ápice con el resto de la vasculatura 48.
Bernick9 señala que la función de los vasos linfáticos en la pulpa consiste en retirar el exceso de líquido y residuos que acompañan a la inflamación.
Elementos nerviosos.
Los dientes están inervados por un gran número de fibras nerviosas mielinizadas y no mielinizadas. Sin tomar en cuenta la naturaleza de los estímulos sensitivos, todos los impulsos aferentes de la pulpa resultan en sensación de dolor 67.
La inervación de la pulpa incluye neuronas aferentes que conducen los impulsos sensitivos y fibras autónomas que proveen la modulación neurogénica de la microcirculación y es posible que también intervengan en la dentinogénesis 67.
Las fibras nerviosas se clasifican de acuerdo a su velocidad de conducción, su diámetro y su función. Siguiendo esta clasificación, en la pulpa existen dos tipos de fibras nerviosas sensitivas: las mielínicas ( tipo A) y las no mielínicas ( tipo C). Las fibras A incluyen las beta y las delta. Aproximadamente el 90% de las fibras A en la pulpa son del tipo delta, que se encuentran principalmente en la región de la unión pulpo-dentinaria, producen un dolor agudo y tienen un umbral de estimulación relativamente bajo. Por su parte, las fibras tipo C se distribuyen en toda la pulpa, producen un dolor quemante, menos tolerable y el umbral de estimulación es alto 67,32.
Las fibras A delta son las más pequeñas del grupo de fibras mielinizadas. Sus diámetros varían entre 1 y 5 um y llevan los impulsos dolorosos a una velocidad de aproximadamente 12 a 20 metros por segundo. Las fibras C tienen un diámetro menor que las anteriores que varía entre 0,3 y 1 um. Ellas llevan las sensaciones dolorosas a una velocidad de aproximadamente 0,6 a 1 metro por segundo 55.
Los nervios sensitivos de la pulpa se originan en el nervio trigémino y pasan hacia la pulpa radicular en paquetes a través del foramen en estrecha relación con las arteriolas y vénulas. Cada uno de los nervios que entra a la pulpa posee una célula de Schwann. Las fibras tipo A adquieren su mielina a partir de estas células. Cuando se completa el desarrollo de la raíz, las fibras mielínicas se presentan en paquetes en la región central de la pulpa. La mayoría de las fibras C, no mielínicas, entran a la pulpa y se localizan entre estos paquetes. El resto se sitúa hacia la periferia de la pulpa 67.
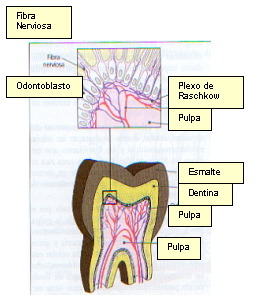
Los paquetes nerviosos se dirigen hacia arriba a través de la pulpa radicular junto a los vasos sanguíneos. Una vez que ellos alcanzan la pulpa coronaria, se ramifican por debajo de la zona rica en células, conformando paquetes más pequeños que finalmente se ramifican en un plexo de axones nerviosos únicos conocido como plexo de Raschkow (Figura 5).
 cccc cccc |
Figura 5. Inervación pulpar. Plexo de Raschkow. Tomado de Gómez y Campos, 1999 24. |
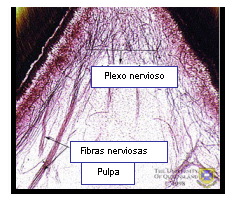
Es en este plexo que las fibras A emergen de su vaina de mielina y se ramifican repetidas veces para formar el plexo subodontoblástico. Finalmente, los axones terminales salen de las células de Schwann y pasan entre los odontoblastos como terminaciones nerviosas libres. Todas las terminaciones nerviosas libres de la pulpa son axones no mielinizados que se superponen sin fusionarse 48,55,67 (Figuras 6 y 7).
 ccc ccc |
Figura 6. Inervación dental normal en la zona de un cuerno pulpar de un diente joven. Tomado de www.anatomy.uq.edu.au, 2001 69 |
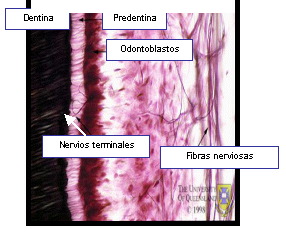 |
Figura 7. Inervación pulpar a mayor magnificación. Se puede apreciar la extensión de los nervios terminales pulpares. Tomado de www.anatomy.uq.edu.au, 2001 69 |
Dentina.
La dentina es el eje estructural del diente y constituye el tejido mineralizado que conforma el mayor volumen de la pieza dentaria. El espesor en cada diente en particular, es mayor en los bordes incisales o cuspídeos y menor en la raíz 24.
En su estructura podemos distinguir dos componentes básicos: la matriz mineralizada y los conductos o túbulos dentinarios que la atraviesan en todo su espesor y que alojan a los procesos odontoblásticos 24,67.
Composición química:
La dentina está compuesta por aproximadamente 70% de materia inorgánica, 18% de materia orgánica y 12 % de agua 24,38, 55,67.
La dentina también contiene una pequeña cantidad de citrato ( menor del 1%), que es una unión orgánica que está ampliamente distribuida en los tejidos mineralizados. La albúmina y los componentes lípidos representan una pequeña fracción de la dentina y han sido demostrados por medio de reacciones histoquímicas 55.
La matriz inorgánica está compuesta principalmente por cristales de hidroxiapatita, los cuales son más pequeños y delgados comparados con los cristales de hidroxiapatita del esmalte. Ellos se orientan de forma paralela a las fibras de colágeno de la matriz dentinaria, disponiéndose entre las fibras y también dentro de las mismas. Esta fracción mineral contiene además de los cristales de hidroxiapatita, cierta cantidad de fosfatos amorfos, carbonatos, sulfatos y oligoelementos como fluoruro, cobre, zinc, hierro y magnesio 24.
La matriz orgánica está constituida por varios componentes entre los que destaca el colágeno tipo I que representa el 90% de dicha matriz 11,27 . Una vez que el colágeno se ha segregado en la unión de la predentina, se forman, a partir de él, las fibras 24.
En la matriz orgánica de la dentina se han detectado proteínas semejantes a las existentes en la matriz ósea tales como la osteonectina, la osteopontina y la proteína GLA que es una proteína similar a la osteocalcina. Existen también tres proteínas que se encuentran exclusivamente en la dentina como lo son la fosfoforina dentinaria, la proteína de la matriz dentinaria I y la sialoproteína dentinaria. Las dos primeras son segregadas por los odontoblastos y participan en el proceso de mineralización y la última, segregada por los odontoblastos jóvenes y por los preameloblastos, participan de algún modo en el desarrollo de los dientes 24.
Estructura histológica.
Las unidades estructurales básicas que constituyen la dentina son los túbulos dentinarios y la matriz intertubular.
Los túbulos dentinarios son estructuras cilíndricas delgadas que se extienden por todo el espesor de la dentina desde la pulpa hasta la unión amelodentinaria o cementodentinaria. En su interior, el túbulo contiene líquido tisular y la prolongación odontoblástica principal, también llamada fibrilla de Tomes 24.
Trowbridge y Kim 67 refieren que el fluido dentinario ocupa el 22% del volumen total de la dentina. Este líquido es un filtrado de sangre y su composición se asemeja al plasma.
Pashley y Walton 48 señalan que la densidad de los túbulos dentinarios varía de 40.000 a 70.000 túbulos por mm2. El área ocupada por los túbulos es de 1% en la unión de la dentina con el esmalte y aumenta hasta 45% a nivel de la cámara pulpar. Trowbridge y Kim 65 afirman que los túbulos dentinarios ocupan del 20% al 30% del volumen total de la dentina intacta.
En la dentina coronaria, los túbulos siguen un trayecto doblemente curvo en forma de "S" itálica, sin embargo, en las zonas cuspídeas o incisales el trayecto es prácticamente rectilíneo 13,26. En la zona radicular, los túbulos exhiben una curvatura poco pronunciada. Todas estas trayectorias se originan como consecuencia del apiñamiento progresivo de los odontoblastos durante la formación de la dentina. Como resultado de ese apiñamiento, hay muchos más túbulos dentinarios por unidad de superficie en las capas de dentina próximas a la pulpa ( aproximadamente 45.000 por mm2), que en las regiones más externas de la dentina (aproximadamente de 15.000 a 20.000 por mm2) 24.
El grosor de los túbulos también varía siendo más anchos en la proximidad de la pulpa (4um de diámetro) y más estrechos en la zona periférica (1,7 um de diámetro)24.
Cada túbulo dentinario está rodeado por un anillo o pared denominado dentina peritubular altamente mineralizada y carente de colágeno. La alta mineralización le proporciona dureza lo que refuerza al diente. La formación de esta dentina se produce cuando se termina de completar la mineralización de la dentina intertubular, se deposita en forma centrípeta, lenta y gradual 24,67 (Figura 8).
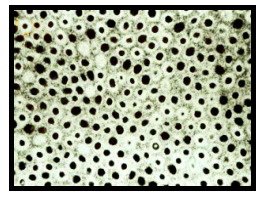 ccccc ccccc |
Figura. 8 Corte transversal de la dentina que muestra la luz de los túbulos dentinarios. Los espacios oscuros más pequeños corresponden a aquellos túbulos en los que se ha depositado mayor cantidad de dentina peritubular. Tomado de www.usd.uchc.edu, 2001 68. |
La formación de este tipo de dentina se produce solamente en presencia de los procesos odontoblásticos quienes secretan la matriz dentro del lumen de los túbulos 23.
Se ha demostrado que en dientes jóvenes el espesor de dentina peritubular es de 400 nm en la proximidad pulpar, mientras que en la vecindad de la conexión amelodentinaria es de 750 nm 24.
La matriz intertubular se distribuye entre las paredes de los túbulos dentinarios y su componente fundamental son las fibras de colágeno que constituyen una malla fibrilar entre la cual y sobre la cual se depositan los cristales de hidroxiapatita. Estas fibrillas colágenas tienen un diámetro de 500 a 1000 nm y se originan en ángulos rectos desde los túbulos dentinarios 24,67.
Butler 12 señala que la matriz de dentina consiste en proteínas y proteoglicanos. La proteína principal es el colágeno que constituye la matriz fibrilar sobre la cual otras moléculas orgánicas son secretadas y sobre la cual los cristales de apatita son depositados de una manera regular.
Tidmarsh 65 estudió la matriz orgánica de 86 dientes humanos y encontró que la matriz de la predentina consiste en fibras relativamente sueltas. La matriz asociada con la dentina atubular consiste en paquetes de fibras densamente empaquetadas sin una aparente organización.
Gómez y Campos 24 describen que la dentina presenta también unidades estructurales secundarias como lo son las líneas incrementales o de crecimiento, la zona granulosa de Tomes, las líneas o bandas de Schreger, la zona de conexión amelodentinaria y cementodentinaria y la dentina interglobular o espacios de Czermarck.
Clasificación histogenética.
Desde el punto de vista de su formación la dentina puede clasificarse en primaria, secundaria y terciaria.
La dentina primaria es la primera que se forma, delimitando la cámara pulpar de los dientes ya formados. Desde el punto de vista funcional se considera a este tipo de dentina aquella que se deposita desde que comienzan las primeras etapas de formación del diente hasta que éste entra en oclusión 24.
Weine 74 señala que esta dentina inicial es de tipo tubular y presenta una disposición regular, ya que los odontoblastos no están apiñados y el diente apenas soporta fuerzas funcionales.
La dentina secundaria es la que se produce después que se ha completado la formación de la raíz del diente. Su deposición es mucho más lenta que la deposición de la dentina primaria, pero su producción continúa durante toda la vida del diente. La distribución de los túbulos en esta dentina es ligeramente menos regular que en la dentina primaria y el límite entre ambas se manifiesta por un cambio en la dirección de los túbulos dentinarios 24,55 (Figura 9).
|
|
Figura 9. Cambio de dirección de los túbulos dentinarios en dentina secundaria. Tomado de www.anatomy.uq.edu.au, 2001 69. |
La dentina secundaria se forma al aumentar las tensiones funcionales sobre el diente 74. La formación de esta dentina determina una progresiva disminución de la cámara pulpar y como consecuencia una disminución del número de odontoblastos 27. Se estima que en el hombre se depositan diariamente 4 um de dentina secundaria disminuyendo progresivamente el volumen de la pulpa 55.
La dentina terciaria también se conoce como dentina reparativa, reaccional, irregular o patológica. Ella puede deformar la cámara pulpar en los sitios donde existe una noxa o estímulo localizado en un intento por aislar la pulpa de la zona afectada 24.
Weine 74 señala que estos estímulos pueden ser las preparaciones cavitarias, la caries, la atrición intensa y la erosión, entre otros. La formación de este tipo de dentina es un mecanismo de defensa para compensar la pérdida regional de dentina superficial.
La cantidad y calidad de la dentina terciaria que se forma se encuentra relacionada con la duración e intensidad del estímulo. Si la dentina terciaria se forma rápidamente, el patrón tubular será irregular y con frecuencia pueden quedar odontoblastos incluidos 24.
Tidmarsh 65 afirma que la variabilidad en la dentina irregular o atubular no tiene relación con el tipo de estímulo nocivo o del proceso destructivo del diente.
Cemento.
El cemento es un tejido conectivo mineralizado derivado de la capa celular ectomesenquimática del saco dentinario que rodea al germen dentario 24.
El cemento cubre y protege la totalidad de la superficie radicular del diente desde el cuello anatómico hasta el ápice, aunque en ocasiones puede extenderse sobre el esmalte en la región cervical (Figura 10). Este tejido no está vascularizado y carece de inervación propia 24,53.
En los dientes jóvenes el cemento forma una capa relativamente fina. El menor espesor se encuentra en el cuello del diente, donde tiene aproximadamente 20 um de ancho y por lo general termina en bisel, extendiéndose un breve trecho sobre el esmalte. En la región media de la raíz el espesor de cemento suele oscilar entre 50 y 80 um. En la zona apical el cemento puede alcanzar un espesor de 2 a 4 mm, debido a que es la zona más afectada por la deposición secundaria de cemento 24.
 cccc cccc |
Figura. 10 Corte longitudinal de la dentina en la zona cervical. Se puede apreciar que el cemento cubre el esmalte. Tomado de www.usm.uchc.edu, 2001 68 |
Kuttler 33 señala que el espesor de cemento disminuye de apical a coronal, que aumenta con la edad y que este aumento depende más de las fuerzas de masticación que del tiempo que el diente ha estado en oclusión.
El cemento proporciona un medio de retención por anclaje de las fibras colágenas del ligamento periodontal que fijan el diente al hueso alveolar, controla el ancho del espacio periodontal, permite la reorientación de fibras periodontales y conserva la inserción de dichas fibras durante el movimiento dentario, transmite las fuerzas oclusales a la membrana periodontal, repara la superficie radicular cuando se presentan fracturas o resorciones y compensa el desgaste del diente por atrición 24.
Componentes estructurales.
El cemento está formado por células y por una matriz extracelular calcificada. Las principales células son los cementoblastos y los cementocitos. Los cementoblastos se encargan de sintetizar tropocolágeno que formará las fibras colágenas intrínsecas y los proteoglicanos o glucosaminoglicanos que formarán la matriz extracelular 24,67.
Los cementoblastos se encuentran adosados a la superficie del cemento del lado del ligamento periodontal. Si se presentan activos, se observan como células cúbicas muy basófilas. Por el contrario, si se encuentran inactivos, se observan aplanados con núcleos de heterocromatina 24.
En los dientes con raíces completamente formadas, los cementoblastos activos se encuentran solo a partir del tercio medio de la raíz o solo en el tercio apical, es decir, en las zonas donde hay deposición de cemento secundario. Entre los cementoblastos activos y el cemento mineralizado, existe una delgada capa de sustancia cementoide o cemento inmaduro, que representa la deposición más reciente de matriz orgánica donde aún no se han precipitado sales minerales 24.
Los cementocitos son aquellos cementoblastos que quedan incluidos en lagunas en el cemento mineralizado. Estas células presentan entre 10 y 20 prolongaciones citoplasmáticas que emergen del cuerpo celular y se extienden hacia la superficie externa en dirección al periodonto, que representa su fuente de nutrición 24, 54.
La matriz extracelular del cemento contiene aproximadamente de 46 a 50% de material inorgánico, 22% de material orgánico y 32% de agua. El principal componente inorgánico está representado por fosfato de calcio en forma de cristales de hidroxiapatita, los cuales se alojan entre las fibras colágenas y dentro de ellas. Además del fosfato de calcio, también se presenta carbonato de calcio y oligoelementos entre los que se pueden mencionar sodio, potasio, hierro, magnesio, azufre y fluoruro 24.
La matriz orgánica del cemento está formada por fibras de colágeno principalmente tipo I, que constituye el 90% de la fracción protéica de este tejido. Existen dos clases de fibras, las intrínsecas que están formadas por los cementoblastos y las extrínsecas que son haces de fibras del ligamento periodontal 24.
La sustancia fundamental está integrada por proteoglicanos, glucosaminoglicanos y glucoproteínas 24.
Tipos de cemento.
Estructuralmente, el cemento puede dividirse en cemento acelular o primario, cemento celular o secundario y cemento afibrilar 24.
El cemento primario comienza a formarse antes de que el diente erupcione, se deposita lentamente de manera que los cementoblastos que lo forman retroceden a medida que secretan. De esta menara no quedan células dentro del tejido 24.
En un estudio realizado con ratas, se demostró que la mitad coronaria de la superficie radicular estaba recubierta de cemento acelular 49.
Este cemento consiste principalmente en haces de fibras altamente mineralizadas, predominantemente las fibras extrínsecas cuya proporción aumenta con respecto a la matriz amorfa de cervical a apical 24.
El cemento celular o secundario comienza a depositarse cuando el diente entra en oclusión. Debido a que se forma con mayor rapidez, algunos cementoblastos quedan incluidos en la matriz, transformándose en cementocitos. Por lo general se presenta a partir del tercio medio o apical de la raíz. En el tercio apical suele ser el único tipo de cemento presente 24,49 (Figura 11).
El cemento secundario continúa depositándose durante toda la vida, lo cual constituye un mecanismo de compensación del desgaste oclusal de los dientes 24.
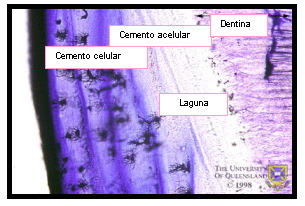 ccccc ccccc |
Figura 11. Imagen histológica del cemento dentario, donde se puede apreciar el cemento celular, el cemento acelular y las lagunas en las que quedan atrapados los cementoblastos. Tomado de www.anatomy.uq.edu.au,2001 69. |
El cemento afibrilar corresponde a una variedad que carece de las fibras típicas de colágeno y que se presenta con cierta frecuencia en el cuello. Se especula que se forma por una degeneración precoz del órgano del esmalte en esa región 24.
Cambios de la Pulpa con el Envejecimiento
El tejido pulpar y la cavidad que lo aloja experimentan variaciones estructurales y funcionales en relación con la edad, al igual que otros tejidos del organismo. Estos cambios ocasionan una disminución en la capacidad de respuesta biológica. En el caso del tejido pulpar envejecido, la respuesta a los estímulos externos no es igual a la de la pulpa joven 24.
Como en otros tejidos del organismo, los cambios producidos por la edad son difíciles de separar de los cambios que se producen fisiológicamente por acciones de defensa y de los cambios patológicos inducidos por irritantes. Es por eso que cuando se realizan diferentes estudios, se utilizan tanto dientes impactados, no funcionales como dientes erupcionados, funcionales 38,39.
Ketterl 31 destaca la importancia que tiene la dificultad en diferenciar los cambios pulpares debidos al proceso natural de envejecimiento de los cambios regresivos funcionales o patológicos.
Cambios dimensionales del tejido pulpar
El volumen pulpar disminuye por efecto del tiempo, por efecto de lesiones o por ambos factores, con la formación de tejido calcificado adicional sobre las paredes. En situaciones normales la formación de la dentina suele continuar a través del tiempo y es mayor sobre el piso de la cámara de los dientes posteriores y en la superficie incisal de los dientes anteriores 48.
Humphreys y col 27 destacan la aparición de alteraciones dimensionales en las pulpas de ratas utilizando el isótopo radioactivo del radio llamado 224Ra, tomando en consideración que el radio es un elemento óseo. Los resultados de este estudio revelan la presencia en las ratas más ancianas estudiadas de obliteración de la cavidad pulpar o estrechamiento de la misma con contenido necrótico.
La aparición de centros irregulares de mineralización, especialmente en la región de la pulpa central también produce alteraciones dimensionales. Este fenómeno de calcificación o litiasis es relativamente común en las pulpas adultas y se incrementa con la edad o en presencia de agentes irritantes 24.
Trowbridge y Kim 67 señalan que las fibras colágenas engrosadas con el envejecimiento pueden servir como foco para las calcificaciones pulpares.
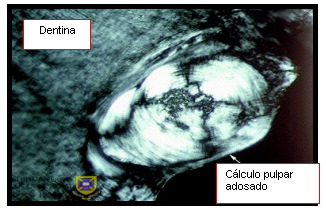
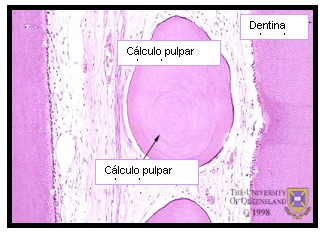
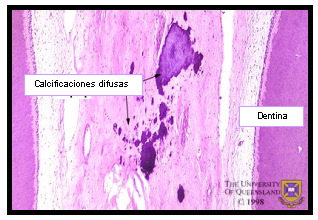
Estas calcificaciones son de dos tipos: cálculos pulpares o dentículos y calcificaciones difusas 24,38,67. Los cálculos pulpares están formados por la precipitación de sales minerales sobre un centro de matriz fundamentalmente colágena. De acuerdo a su estructura pueden ser verdaderos si poseen túbulos dentinarios y falsos si solo muestran capas concéntricas de tejido mineralizado. Estos últimos pueden estar libres o adheridos (Figuras 12 y 13). Las calcificaciones difusas, generalmente tienen una orientación longitudinal, aparecen en especial en los conductos radiculares en una disposición perivascular y se considera que aumentan en frecuencia invariablemente con la edad 24 (Figura 14)
Morse 38 señala que los dentículos verdaderos están compuestos por dentina irregular con trazos de túbulos dentinarios y odontoblastos. Usualmente se encuentran cerca del foramen apical. Se ha sugerido que estos dentículos se forman a partir de los remanentes de la vaina epitelial de Hertwig.
 cccc cccc |
Figura 12. Cálculo pulpar adosado a la superficie dentinaria de la cámara pulpar. Tomado de www.anatomy.uq.edu.au, 2001 69 |
 cccc cccc |
Figura 13. Presencia de cálculo pulpar libre rodeado de tejido blando. Tomado de www.anatomy.uq.edu.au, 2001 69. |
 cccc cccc |
Figura 14. Presencia de calcificaciones difusas Tomado de www.anatomy.uq.edu.au, 2001 69. |
Los dentículos falsos no tienen estructura dentinaria y consisten en capas concéntricas de material calcificado sobre un centro de células necróticas o calcificadas. Estas células se derivan del tejido pulpar hialino degenerado 38.
Con el avance de la edad, los dentículos usualmente aumentan en tamaño y en número. Ellos pueden también encontrarse en dientes no funcionales, dientes erupcionados y dientes retenidos 38.
En un estudio de 52 caninos retenidos de pacientes de edades comprendidas entre 11 y 76 años, Nitzan 45 encontró que en todos los grupos se hallaron dentículos concéntricos, indicando que no existe una relación entre la edad y este tipo de calcificaciones, sin embargo, las calcificaciones difusas aumentaron en incidencia en los dientes de los pacientes de 25 años de edad en adelante.
Piatelli 51 señala que en ausencia de anomalías dentarias como dentinogénesis imperfecta, displasia dentinaria y el síndrome de Ehlers-Danlos, la forma generalizada de calcificaciones pulpares probablemente forma parte del proceso de envejecimiento. La cámara pulpar puede llegar a obliterarse completamente en la mayoría de los dientes. Este fenómeno generalmente se acompaña de atrición.
Morse y col 40 realizaron un estudio donde evaluaron 500 incisivos mandibulares de pacientes de edades comprendidas entre 17 y 79 años. Las variables que se tomaron en cuenta fueron seis: longitud coronal, longitud apical, longitud del conducto, ancho cervical, ancho del tercio medio de la raíz y ancho apical. Los resultados arrojaron que todas las variables estudiadas mostraron cambios estadísticamente significativos en los pacientes de mayor edad, siendo estos cambios más notables en la longitud del conducto y en el ancho cervical.
Bernick 10 realizó un estudio en el que observó que los cambios vasculares y nerviosos asociados con la cicatrización de la pulpa en dientes de edades comprendidas entre los 25 y los 40 años, presentaban calcificaciones tanto en la porción coronaria como en la porción radicular del 90% de todos los dientes obtenidos de personas mayores de 40 años. Este estudio sugiere que en el proceso de envejecimiento hay un estrechamiento gradual del espacio pulpar debido a la continua aposición de dentina.
Cambios Estructurales
Odontoblastos : Se ha podido demostrar que el número de células disminuye y el componente fibroso aumenta con el envejecimiento de la pulpa 8,31,48,52,67. Las células restantes parecen estar casi inactivas. Estas células revelan un menor número de organelas relacionadas con los procesos de síntesis y de secreción 48.
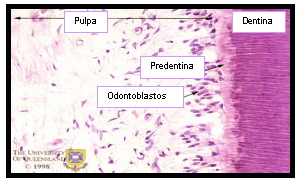
Ketterl 31 señala que la densidad celular de la pulpa disminuye a la mitad entre los 20 años y los 70 años de edad. El número de células por unidad de área se reduce del 100% en los dientes que no han erupcionado a un 33% en los dientes de individuos ancianos (Figura 15).
 cccc cccc |
Figura 15. Esta figura muestra la densidad celular disminuida en un diente envejecido. Tomado de www.anatomy.uq.edu.au, 2001 69. |
Lavelle 34 realizó un estudio con ratas de edades comprendidas entre los 10 y 751 días de vida y no encontró cambios consistentes ni en el número de células pulpares ni en las dimensiones de las pulpas estudiadas en edades avanzadas.
Trowbridge y Kim 67 afirman que los odontoblastos disminuyen en tamaño y en número y pueden incluso desaparecer totalmente en ciertas áreas como en el piso pulpar sobre las bifurcaciones o trifurcaciones de los dientes multiradiculares.
Moxham y col 41 realizaron un estudio en ratas de distintas edades, 12 y 104 semanas de vida, para comprobar la hipótesis de que las células del ligamento periodontal y las de la pulpa no sufren cambios con la edad. Para ello estudiaron el citoesqueleto de los fibroblastos del ligamento periodontal y de los odontoblastos de la pulpa, analizando específicamente la presencia de las siguientes proteínas fibrosas, vimentin, actina-F y citoqueratinas. Los resultados de este estudio indican que los odontoblastos sí sufren cambios con el envejecimiento al presentarse el marcador celular vimentin reducido y redistribuido en los polos apicales de las células.
Varios autores 38,39 señalan que el primer cambio observable debido a la edad es la aparición de depósitos lípidos dentro de los odontoblastos, en los núcleos de otras células pulpares y en las paredes de los capilares. El siguiente cambio es la vacuolización de los odontoblastos. Esto ocurre cuando las células son empujadas y separadas de las paredes dentinarias debido a la presión producida por la acumulación intercelular de fluido tisular.
Tanto la presencia de depósitos lípidos como la vacuolización de los odontoblastos y la atrofia reticular son cambios que se citan en la literatura como controversiales, debido a que pueden ser artefactos de los cortes histológicos de los tejidos estudiados 38.
Algunos autores 38,39 han descrito el remplazo de los elementos normales de la pulpa por componentes grasos como un cambio asociado con el paso del tiempo. En las pulpas envejecidas se han podido aislar monoglicéridos, diglicéridos, fosfolípidos, lipoproteínas, colesterol y ésteres de colesterol, las cuales son sustancias que se calcifican, lo que puede dar paso a la formación de dentículos.
Fibroblastos : Para Quigley 52 es un enigma el hecho de que el número de fibroblastos disminuya a la vez que la cantidad de fibrosis aumenta. El autor explica este hecho por la polimerización de los paquetes fibrosos y por la agregación de unidades pequeñas de colágeno ya existentes. Es posible que los fibroblastos remanentes aumenten su actividad y produzcan más colágeno, sin embargo, microscópicamente, en las pulpas que muestran fibrosis no existen signos de una actividad metabólica aumentada de los fibroblastos.
Morse 38 señala que conforme la pulpa va envejeciendo se produce un gran descenso en el número de fibroblastos. Este fenómeno se acompaña de un aparente aumento en el número de fibras colágenas, sin embargo, debido a que el número de fibroblastos se encuentra notoriamente disminuido, no se pueden producir más fibras colágenas, por lo que la fibrosis de las pulpas envejecidas es un fenómeno producido por la reducción de las dimensiones de la pulpa y el descenso en el número de células.
Sustancia fundamental : Stanley y Ranney 58 estudiaron 169 dientes de edades comprendidas entre los 10 y 50 años, encontrando que los paquetes de colágeno aumentaron en las pulpas radiculares de individuos hasta los 39 años de edad, mientras que el colágeno de las pulpas coronarias no aumentó después de los 20 años de edad. Para ellos fue sorprendente encontrar muy poco colágeno en las pulpas coronarias de los dientes posteriores viejos. La cantidad de colágeno difuso disminuyó en las raíces en los dientes de edades comprendidas entre los 10 y los 49 años, lo cual es atribuido a que este tipo de colágeno quizás contribuye a la formación de paquetes de colágeno.
Nielsen y col 44 estudiaron la síntesis de colágeno en terceros molares humanos extraídos, libres de caries, restauraciones o enfermedad periodontal, coincidiendo con Stanley y Ranney 58 en que el contenido de colágeno no aumenta después de los 20 años de edad en las pulpas coronarias. De hecho, sus resultados indicaron una reducción en el contenido de colágeno después de los 17 años de edad. Esto se explica probablemente porque a esta edad la degradación del colágeno excede su síntesis. Los autores concluyeron que el aumento en la biosíntesis de colágeno y la consecuente fibrosis pulpar no es un hallazgo normal en el envejecimiento además señalan que después de que el ápice se ha cerrado no hay variaciones en la cantidad de colágeno pulpar por el resto de la vida.
Hillmann y col 26 investigaron los cambios en la distribución del colágeno tipo I, III, IV, V y VI y la presencia de calcificaciones en el tejido pulpar de dientes humanos no cariados con respecto a la edad. Los dientes estudiados varían entre los 11 y los 72 años. La inmunofluorescencia microscópica reveló que el colágeno tipo I, III, V y VI se encontró presente en todos los especímenes examinados. Con el avance de la edad los paquetes fibrosos gruesos de colágeno tipo I aumentaron en frecuencia y en grosor. El patrón reticulado de fibrillas finas de colágeno tipo III, V y VI desapareció y fue suplantado por paquetes fibrosos gruesos. Por lo tanto, la matriz de tejido conectivo se condensó y se tiñó homogéneamente a medida que se avanzaba en edad. Por otra parte, las calcificaciones difusas y los pulpolitos aumentaron de tamaño con el tiempo.
Otro cambio citado por distintos autores 31,38,39 es la atrofia reticular del tejido pulpar, el cual adquiere una apariencia de red debido a la acumulación de fluido intercelular y a la reducción en el número de células.
La formación de quistes pulpares también se relaciona con la edad. Aparentemente ellos están llenos de fluidos y rodeados por tejido conectivo fibroso. Se han considerado como el resultado de una atrofia pulpar localizada acompañada del encogimiento del tejido pulpar 31,38,39.
Con la edad el componente mucoide de la pulpa, alojado normalmente en los espacios intersticiales de la misma, aumenta y simultáneamente el nivel de ácidos polisacáridos disminuye. Otros cambios degenerativos como la pérdida completa del tejido conectivo embriónico acompañan a la degeneración mucoide 31,38,39.
El tejido mesenquimático gelatinoso rico en células se convierte en un tejido endurecido, fibrilar pobre en células, donde predominan los ácidos mucoides y disminuyen los ácidos polisacáridos 38.
Fibras pulpares : Las pulpas envejecidas presentan una transformación progresiva de tejido conectivo laxo a tejido conectivo semidenso. Ello se debe al aumento de las fibras colágenas y a la consiguiente disminución de la sustancia fundamental amorfa 24.
La degeneración hialina es un cambio que se produce en la pulpa asociado con la edad y que tiene lugar en las fibras intercelulares. Generalmente es una secuela de la degeneración fibrosa constante y se le considera como una etapa intermedia en la formación de las calcificaciones pulpares. Los desordenes circulatorios menores pueden resultar en hialinización de ciertas áreas de la pulpa 38,39.
Avellaneda y col 2 realizaron un estudio en el que utilizaron 200 piezas dentarias distribuidas en 3 grupos según la edad de los pacientes: de 15 a 29 años; de 30 a 49 años y de más de 50 años de edad. De la comparación de las lesiones degenerativas en cada grupo etario, se encontró una asociación estadísticamente significativa de la presencia de fibrosis en relación con la edad. Por otra parte, la degeneración hialina y cálcica mostraron una tendencia a aumentar con la edad aunque la relación no fue estadísticamente significativa. La degeneración hialina se presentó como masas rodeadas frecuentemente por sectores de fibrosis formando un anillo o herradura, en algunos casos de aspecto homogéneo y en otros de aspecto reticulado.
El aumento de las fibras puede ser un fenómeno más aparente que real, ya que al disminuirse el tamaño de la pulpa como resultado de la aposición de dentina secundaria y la disminución del número de células, el espacio pulpar remanente es ocupado en su mayoría por fibras. A esto se suma el hecho de que al disminuir el número de vasos sanguíneos y nervios, éstos dejan atrás sus cubiertas de tejido conectivo que pasan a ser parte de la pulpa fibrosa remanente 38 (Figura 16).
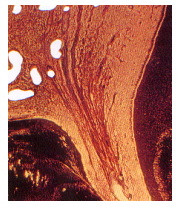 cccc cccc |
Figura 16. Aumento de fibras. Zona de conductos radiculares. Impregnación argéntica, X 40. Tomado de Gómez y Campos, 1999 24. |
Toto y col 66 estudiaron la densidad celular del ligamento periodontal y de la pulpa en ratas de 1 mes y de 15 meses de edad, encontrando un descenso significativo en el número de células en las pulpas de las ratas de mayor edad. Los cambios asociados con el envejecimiento reportados en este estudio parecen estar en concordancia con lo que sucede en humanos. En esta investigación también se destaca el aumento en la fibrosis de las pulpas ancianas y un descenso en la celularidad, lo cual se explica por que aunque hay menos células y por lo tanto una disminución en la producción de colágeno, el colágeno insoluble ya se ha acumulado sustancialmente con la edad.
Elementos vasculares y nerviosos : Gómez y Campos 24 señalan que en las pulpas envejecidas se produce una disminución gradual de la irrigación y de la inervación como resultado de la reducción del volumen del órgano pulpar. Se producen obliteraciones de vasos sanguíneos en estas pulpas.
Con el paso de los años, aumenta la aposición de dentina y de cemento en el ápice, lo que tiende a estrechar el foramen apical original. Debido a que el suplemento sanguíneo, linfático y nervioso penetra a la pulpa a través de este foramen, es lógico pensar que con la edad, este suministro se comprometa. En dientes extremadamente envejecidos, es posible que la aposición de dentina y cemento cierren completamente la entrada de este suministro 31,38.
Diferentes autores 7,8,31,38 han observado una disminución en el número de vasos sanguíneos y nervios que penetran a la pulpa envejecida, notando que muchas de las arterias presentan cambios arteroscleróticos similares a los observados en otros tejidos, entre los que se encuentran la disminución en el tamaño de la luz, engrosamiento de la túnica íntima e hiperplasia de las fibras elásticas de la túnica media. También es frecuente la calcificación de las arteriolas y precapilares.
Se ha sugerido, pero no se ha podido demostrar que los cambios circulatorios y de la inervación de la pulpa pueden representar el primer paso en el proceso de envejecimiento dentario 38.
Bennett y col 5 estudiaron dientes monoradiculares humanos de pacientes de edades comprendidas entre 10 y 70 años para detectar cambios en la arquitectura vascular en la pulpa. Los resultados arrojados indican que la arquitectura vascular cambia con el progreso de la edad. En los dientes de pacientes de edades comprendidas entre los 10 y 20 años, usualmente se encontraron de 3 a 4 ramas arteriales que entraban por el foramen apical o foraminas, mientras que en el grupo de dientes de pacientes entre 40 y 60 años de edad, solo se presentaba una arteria primaria entrando por el foramen apical y el número de ramificaciones secundarias estaban reducidas significativamente y limitadas casi por completo al área coronaria de la pulpa.
Bernick 6 realizó un estudio usando 150 dientes extraídos, no cariados de pacientes con tensión arterial normal de edades comprendidas entre 40 y 60 años, y encontró 3 cambios arteriolares principales: hialinización de las paredes arteriolares, proliferación endotelial e hiperplasia. También pudo demostrar la aposición de un material positivo a la coloración del ácido periódico de Schiff ( PAS ) en la región subendotelial. Con el paso del tiempo ese material depositado incluyó la túnica media, la túnica íntima y el lumen de los vasos. Las calcificaciones difusas fibrilares fueron observadas en más del 90% de los dientes de los individuos de 40 años o más, siendo más frecuentes en la mitad inferior de las raíces.
Bernick y Nedelman 8 estudiaron 100 dientes divididos en dos grupos: aquellos pertenecientes a pacientes de 15 a 40 años y aquellos pertenecientes a pacientes de 40 a 65 años de edad. Ellos encontraron un aumento en la cantidad de paquetes de fibras colágenas asociadas con los envoltorios de tejido conectivo de los vasos sanguíneos y de los nervios. Para estos investigadores, la fibrosis pulpar que se produce con el envejecimiento no es el resultado de una continua formación o reorganización de las fibras colágenas, sino que atribuyen este fenómeno a la persistencia de los envoltorios de tejido conectivo de los vasos sanguíneos y nervios cuando estas estructuras se reducen en la pulpa. Por otro lado, estos autores detectaron que estos envoltorios fueron los centros donde se iniciaron las calcificaciones.
Avellaneda y col 2 observaron cortes dentales coloreados con hematoxilina y eosina y notaron la presencia de depósitos de calcio en los vasos sanguíneos y también en las fibras nerviosas. Se ha visto calcificación únicamente en el axón y otras veces en el axón, endoneuro y perineuro.
Fried y Erdely 20 estudiaron dientes sanos de 5 gatos de diferentes edades y encontraron en los animales de 10 años de edad que las pulpas se encontraban completamente sustituidas por dentina secundaria. En los dientes de los gatos más envejecidos encontraron cambios en el diámetro de las fibras nerviosas, siendo más estrechas que las fibras de los dientes jóvenes. Esto puede explicarse por la pérdida selectiva de axones grandes o por su atrofia como resultado de la edad. También pudieron observar cambios en las vainas de mielina lo que puede representar reacciones de los axones terminales o posiblemente sea una consecuencia de la atrofia de los mismos.
En un estudio realizado por Bernick 10, se encontró que en dientes de pacientes de más de 40 años de edad, los nervios de los cuernos pulpares estaban ausentes. Los fascículos nerviosos que persistieron en las pulpas de estos dientes envejecidos mostraron cambios de degeneración, tales como la fragmentación. Únicamente los vasos sanguíneos grandes persistieron y presentaron calcificaciones en sus paredes. Además pudo notar una marcada disminución de los capilares que se encontraron entre los odontoblastos.
Cambios Funcionales : Con la edad, la pulpa experimenta una disminución de su capacidad funcional o retorno a un estado más primitivo. Las pulpas envejecidas han sido descritas como regresivas y poseedoras de menor capacidad de defensa y recuperación de lesiones, tomando en cuenta que ellas presentan menor número de células, menor vascularización y mayor cantidad de elementos fibrosos 48.
Ranly y col 53 realizaron una investigación en la cual seleccionaron a la osteocalcina, una proteína no colágena específica de dentina y matriz ósea, como determinante de la función odontoblástica, ya que ella está invariablemente asociada con la actividad de estas células. Para ello utilizaron dientes adultos de pacientes entre 17 y 25 años y de más de 50 años de edad. Ellos encontraron que la osteocalcina se expresaba en las pulpas de los dientes sin importar la edad. Esa continua expresión de osteocalcina en las pulpas envejecidas fue inesperada por los autores y asumen que estas pulpas retienen células capaces de expresar osteocalcina y potencialmente viables para la deposición de matriz dentinaria y formación de dentina reparativa.
Morse 38 señala que con el tiempo, los nervios pulpares se hacen menos sensibles, esto explica porque los dientes envejecidos frecuentemente no experimentan dolor. Con la disminución de todos los elementos pulpares, circulatorios y nerviosos, al final solo queda en la pulpa prácticamente tejido fibroso. Esta etapa es conocida como fibrosis de la pulpa, fibrosis senil, pulpa atrófica, pulposis o atrofia pulpar senil. En este estado, la pulpa puede mostrar una respuesta disminuida a las pruebas de vitalidad y a la vez funcionar normalmente.
Swift y Byers 63 realizaron un estudio en el que evaluaron la respuesta de las fibras nerviosas de la pulpa en cavidades clase V de 15 ratas jóvenes y viejas. Las cavidades se realizaron con refrigeración y se extendieron hasta la mitad del espesor de la dentina, se grabaron con ácido fosfórico al 37% y se dejaron expuestas al medio bucal. A los 4 días los molares fueron extraídos. Los investigadores encontraron cambios pulpares en los dientes de las ratas viejas que consistían en una disminución del volumen pulpar debido al aumento en la deposición de dentina secundaria en el piso de la cámara pulpar y en la superficie interradicular de los molares. Otro hallazgo encontrado fue que las ratas viejas presentaron el mismo patrón de proliferación nerviosa que las ratas jóvenes. Sin embargo, cualitativamente, esta proliferación no fue tan densa o extensa como lo fue en las ratas jóvenes.
Es sabido que los nervios periféricos sensoriales proliferan ante un daño pulpar. Los resultados de este estudio indicaron que esta proliferación también ocurrió en las pulpas envejecidas aunque de manera reducida. Los marcadores que se utilizaron se mostraron en menor cantidad en las ratas viejas debido quizás al mismo proceso de envejecimiento que implica la disminución de las fibras nerviosas o a cambios estructurales en los nervios que suceden normalmente con la edad 63.
Bernick 10 atribuye la disminución en la sensibilidad y en la velocidad del metabolismo en los dientes de personas mayores de cuarenta años a las desviaciones en los patrones vasculares y nerviosos producto del envejecimiento.
Quigley 52 señala que la pulpa sufre cambios con la edad que finalizan con la obliteración del sistema capilar y la degeneración grasa de los nervios, lo cual lleva a que la pulpa se reduzca a una masa marchita insensible.
La capacidad de defensa de una pulpa joven es mayor al contar con un número más elevado de elementos celulares indiferenciados capaces de neoformar odontoblastos frente a una determinada noxa. La capacidad de autodefensa o la posibilidad de regeneración del tejido depende no solo de la edad biológica, sino también del estado general de salud del organismo y de la cuantía del daño tisular 24.
Para Ketterl 31, el rendimiento de la pulpa disminuye con la edad, sin embargo, a pesar de esta condición, la pulpa es perfectamente capaz de llevar a cabo reacciones de defensa.
Byers y col 13 encontraron que adicionalmente a las fibras nerviosas dentales y a las células de Schwann, ciertas células pulpares en las coronas de dientes adultos tienen inmunoreactividad a los factores de crecimiento nervioso que se hace especialmente intensa en células adyacentes a los odontoblastos. Esta expresión de inmunoreactividad puede estar relacionada con ciertas propiedades inusuales de los odontoblastos coronarios, como son, la producción de dentina tubular y su calcificación, formación de una capa de células que proporciona una barrera entre la pulpa y la cavidad oral y la densa inervación sensorial. Los resultados de esta investigación indican que en los molares de ratas ancianas, la inmunoreactividad a los factores de crecimiento nervioso en los fibroblastos pulpares por debajo de la dentina tubular disminuyó o estuvo totalmente ausente. Esto se debió a que en los molares envejecidos hay una reducción en el tamaño y en el número de estas células inmunoreactivas.
Okiji y col 46 señalan que los macrófagos poseen otras propiedades además de la fagocitosis, como lo son la producción de sustancias biológicamente activas y la presentación de antígenos a las células T. Estos autores encontraron que las pulpas de las ratas se hayan equipada de un grupo heterogéneo de células que expresan antígenos asociados con los macrófagos. Este grupo incluye una mezcla de macrófagos clase II del complejo mayor de histocompatibilidad y de células dendríticas. Como es sabido, la madurez y el envejecimiento tienen influencia sobre el sistema inmune en todo el cuerpo, por lo tanto, este estudio examina los antígenos asociados con los macrófagos en cuanto a su morfología, densidad y fenotipo en la pulpa dental de dientes de varias edades.
Los resultados indicaron que en los dientes envejecidos hubo una disminución de las células inmunes de manera más pronunciada en la parte coronaria de la pulpa. Todas las células capaces de expresar antígenos asociados con macrófagos redujeron su densidad, particularmente las células del complejo mayor de histocompatibilidad clase II. Estos resultados pueden significar que la pulpa tiene un potencial de respuesta reducido contra los antígenos, sin embargo, los autores creen que una parte sustancial del potencial de defensa de la pulpa envejecida se mantiene, debido a que la densidad de las células inmunocompetentes se mantuvo relativamente alta 46.
Cambios de la Dentina con el Envejecimiento
La dentina se considera un tejido vivo por contener las prolongaciones citoplasmáticas de los odontoblastos, por lo tanto, durante toda la vida del diente se producirá en ella depósito continuo de dentina ya sea por razones fisiológicas o por estímulos patológicos 24.
Los principales cambios de la dentina asociados con la edad incluyen el aumento de dentina secundaria, el aumento de dentina esclerótica y el aumento del número de tractos desvitalizados 67.
Formación de dentina secundaria : La dentina secundaria es aquella que se forma después que ha concluido la formación de las raíces de los dientes 24,31. Clásicamente se describía como aquella dentina sintetizada a partir de que el diente entraba en oclusión, pero se ha demostrado su presencia en dientes retenidos. Esta dentina se deposita mucho más lentamente que la primaria y su producción continúa durante toda la vida 24.
Ketterl 31 propone las siguientes diferencias entre la dentina primaria y la secundaria: en la secundaria hay reducción en el número de túbulos dentinarios, ondulación de los túbulos, pérdida de las estructuras características de la dentina primaria y pérdida completa de los túbulos dentinarios.
Morse y col 39 señalan que los cambios dentinarios relacionados con la edad han sido observados también en dientes totalmente retenidos, en los cuales la formación de dentina secundaria es encontrada inicialmente en la región apical desde donde continua hacia la región coronaria. Otro cambio encontrado en relación con el envejecimiento en dientes retenidos es un incremento lineal en el grosor de la predentina.
Con la edad, la cavidad pulpar gradualmente se hace más pequeña por la continua aposición de dentina secundaria y como consecuencia, existe una tendencia a la eventual obliteración de la cavidad pulpar 38,39,53.
En un estudio realizado por Moore 37 usando dientes con un mínimo de cambios patológicos para medir el crecimiento de dentina fisiológica desde la madurez del diente (10 años de edad) hasta edades avanzadas (70 años de edad), se encontró que la cámara pulpar disminuye en tamaño conforme se progresa en edad. Ellos observaron, sin embargo, que esto no ocurre siempre y que algunos de los especimenes de 60 años o más tuvieron una cámara pulpar comparativamente más grande que los demás de su grupo.
Morse y col 39 realizaron un estudio donde relacionaron la edad dental con la edad sistémica, y encontraron que la disminución del tamaño de la parte coronaria del conducto radicular es una respuesta a la masticación, y fue más frecuente en los individuos jóvenes debido a los músculos de la masticación más desarrollados que generan fuerzas masticatorias más fuertes. En edades avanzadas, estos músculos usualmente son más débiles y la disminución del tamaño del conducto radicular en la parte apical es una respuesta fisiológica al paso del tiempo que se da más frecuentemente en los individuos de avanzada edad.
Los autores 39 concluyeron que la obliteración del conducto radicular aumenta al aumentar la edad y que alcanza un máximo en los pacientes de edad avanzada entre los 60 y los 80 años. Además destacaron que en los individuos más viejos, este componente estuvo acelerado en la parte apical con respecto a la parte coronaria, mientras que en los individuos jóvenes, la reducción del espacio pulpar radicular fue casi idéntica a nivel apical y a nivel coronario, lo que indica que esta reducción en los ancianos es principalmente fisiológica.
Solheim 57 realiza una investigación en la cual relaciona la cantidad de dentina depositada durante la vida con la edad del individuo. El autor señala que la formación de dentina secundaria empieza en los lugares de la pulpa donde el diente se encuentra con el antagonista durante la masticación. Contrariamente a la opinión general, la formación de dentina secundaria es influenciada de manera mínima por la atrición, sin embargo, estímulos como los cambios en la presión osmótica a lo largo de la sustancia dentinaria si ejerce influencia en la formación de dentina secundaria. Entre las correlaciones más importantes de la dentina secundaria y la edad que describe el autor antes citado se encuentra el ancho pulpar en el área cervical. La relación de formación de dentina secundaria con respecto a la edad fue tan fuerte como la relación entre la edad y otras características del diente, entre las que se citan el color y la translucidez apical.
El patrón de aposición de dentina secundaria varía entre los diferentes grupos de dientes. En los dientes anteriores del maxilar superior, la mayor deposición dentinaria ocurre en las paredes palatinas de la cámara pulpar, como resultado de las fuerzas masticatorias, seguida del borde incisal y las demás paredes de la cámara. En los molares, la mayor deposición dentinaria ocurre en el piso de la cámara pulpar 37,55.
Tidmarsh 65 realizó un estudio en terceros molares entre los 20 y 38 años de edad, libres de caries y de restauraciones y encontró curiosas formaciones de dentina irregular y atubular totalmente desorganizada en el piso de la cámara pulpar. Estas formaciones se ubicaron siempre en el aspecto mesial de las cámaras pulpares de los molares inferiores y en el aspecto mesio-vestibular de los molares superiores. Estas formaciones nunca fueron observadas invadiendo el aspecto distal o palatino de los conductos. Otras observaciones registradas por el autor fueron, cambios abruptos en la orientación de los túbulos dentinarios y líneas similares a las incrementales atravesando a estos nódulos o formaciones descritas anteriormente, lo cual niega cualquier posibilidad de mineralización concéntrica.
Para Burke 11, la dentina secundaria se forma a lo largo de toda la vida principalmente en el piso de la cámara pulpar y en menor cantidad en el techo de la misma. Al no suceder así en las paredes, las cámaras pulpares envejecidas resultan en cavidades más bajas pero no necesariamente más angostas.
Philippas y col 50 realizaron un estudio en 263 incisivos centrales superiores de pacientes de edades comprendidas entre 6 y 71 años de edad, encontrando que la primera localización de la dentina secundaria así como la formación sucesiva de la misma a través del tiempo en estos dientes se observó en la pared lingual. Los autores atribuyen este hecho a las fuerzas masticatorias que reciben estos dientes en esta zona específica cuando están en oclusión.
Frecuentemente en personas de 60 años de edad, el conducto radicular puede encontrarse casi obliterado por completo y la dentina secundaria que se ha formado es altamente irregular con pocos túbulos dentinarios 24,55.
Con el avance de la edad, los túbulos dentinarios se hacen menos regulares, más ondulados y cambian de dirección, lo que indica cambios en los odontoblastos posiblemente como resultado de un intercambio iónico continuo con la saliva. Esta formación de dentina secundaria ocurre en ausencia de inflamación y aumenta cuando el diente se encuentra abrasionado como resultado de la masticación, en donde la dentina se encuentra expuesta 55.
Gómez y Campos 24 describen que la distribución de los túbulos en la dentina secundaria es ligeramente menos regular que en la dentina primaria. El límite entre ambas se manifiesta por un cambio de dirección en los túbulos dentinarios que puede observarse como una línea oscura de demarcación en los preparados por desgaste.
A nivel de la dentina radicular es casi siempre imposible encontrar una línea que divida la dentina primaria de la secundaria y existe una transición continua de esta dentina regular hacia la formación de la dentina irregular o reparativa 31.
Para Ketterl 31 es virtualmente imposible distinguir entre la dentina secundaria formada durante procesos fisiológicos de aquella formada por procesos patológicos. La distinción pudiera hacerse de acuerdo a la diferencia en la estructura de la dentina secundaria regular o irregular.
Stanley 59 refiere que existen datos que demuestran la formación de dentina reparativa bajo condiciones fisiológicas, en ausencia de atrición severa, caries o erosión y que por lo tanto se puede considerar que la formación de dentina reparativa es también el resultado del proceso de envejecimiento del diente.
Radiográficamente la dentina secundaria se puede observar más radiolúcida, debido quizás a los pocos odontoblastos existentes en el lugar, los cuales tienen que cubrir una superficie mayor con la consecuente aposición de dentina irregular 11.
Formación de dentina esclerótica : La dentina primaria también se ve afectada por la edad, aumentando el depósito de apatita en ella, lo cual produce eventualmente la oclusión de los túbulos dentinarios. Esta condición se denomina dentina esclerótica o dentina transparente 38.
Seltzer 55 señala que la dentina esclerótica se puede formar debido a un aumento en la dentina tubular o por un aumento en la deposición de cristales de apatita, y es una condición que ocurre consistentemente en el tercio apical con el avance de la edad. Los odontoblastos que están adyacentes a la dentina esclerótica se reducen en número y eventualmente desaparecen como resultado de cambios celulares mediados por la edad.
La acumulación de dentina transparente empieza en las raíces de los dientes, específicamente en los ápices y gradualmente avanza hacia la corona. Este fenómeno se hace evidente en la tercera década de la vida y está presente incluso en los dientes retenidos 31,38.
Diferentes autores 24,39,47 señalan que en las personas de edad se produce la llamada dentina esclerótica fisiológica, por obliteración y mineralización de los túbulos en la dentina radicular, en especial en la zona apical avanzando hacia la corona.
Según Ketterl 31, con el envejecimiento existe una aumentada mineralización de la dentina primaria, la cual es también denominada esclerosis dentinaria, donde se produce una disminución de los componentes orgánicos de la dentina y un aumento de los componentes inorgánicos, lo cual a su vez se debe al aumento de la dentina peritubular normal, a la formación de cristales romboides del tipo Whitlockite, y a la deposición de dentina intratubular con forma de agujas menos mineralizadas que la dentina peritubular.
Hasta un 50% de los túbulos dentinarios pueden llegar a obliterarse por completo bajo condiciones fisiológicas, esta condición puede incrementarse hasta un 80% en presencia de estímulos patológicos 31.
La esclerosis de la dentina asociada con un aumento en la proporción de sustancia mineralizada, reducción de la luz de los túbulos, disminución de la cantidad de fluido peritubular, cambios de transparencia debido a la mayor homogeneidad óptica y la reducción o la eliminación de la difusión en dirección hacia la pulpa son cambios muy importantes que ocurren en la dentina envejecida 31.
La formación de dentina esclerótica ha sido usada con resultados alentadores para medir la edad sistémica ya que existe una significante reducción de los túbulos dentinarios relacionada con la edad 39.
Para Stanley y col 59, la dentina radicular puede llegar a ser tan esclerótica que asume apariencia de vidrio.
En un estudio realizado por Stanley y col. 59 donde se tomaron dientes de pacientes de edades comprendidas entre 10 y 79 años se encontró esclerosis dentinaria fisiológica en los dientes de todas las edades con una intensidad aumentada con la edad. La esclerosis dentinaria reactiva y la dentina reparativa también tendieron a aumentar con la edad tanto en prevalencia como en intensidad. Las raíces de los dientes estudiados presentaron esclerosis dentinaria progresivamente desde los ápices hacia la porción cervical conforme aumentaba la edad. En general, las respuestas dentinarias presentaron un patrón irregular en los grupos de dientes jóvenes, entre 10 y 39 años, siendo más constante en los grupos de dientes mayores.
Burke 11 refiere que con el avance de la edad, los túbulos dentinarios patentes observados en la interfase entre la dentina primaria y la secundaria en incisivos superiores humanos decrece en todos los niveles desde la corona hasta el ápice. El autor describe que la cantidad de túbulos dentinarios por milímetro cuadrado disminuyó de 49.500 en individuos entre 20 y 34 años de edad a 31.317 en individuos de 80 años de edad.
Haciendo uso del microscopio electrónico para observar dentinas envejecidas, se ha podido evidenciar la aposición de material intratubular resistente al ácido fosfórico. Esta dentina presenta una permeabilidad reducida cuando se compara con la permeabilidad de dentinas jóvenes 11.
En secciones transversales la translucidez de la dentina esclerótica se expande coronariamente desde la región apical con la vejez y desde la unión cemento-dentinaria hacia la pulpa, haciéndose más notoria distal y mesialmente dando una apariencia de mariposa en los cortes histológicos. La oclusión de los túbulos con material mineralizado hace que la dentina se vea translúcida debido a que el material formado tiene el mismo índice de refracción que la dentina peritubular 11.
Por medio de métodos de descalcificación, se puede observar la presencia de una matriz orgánica relativamente homogénea que se piensa que está compuesta por prolongaciones odontoblásticas que han quedado dentro de los túbulos. La etapa final antes de la completa obliteración de los túbulos es la calcificación de las prolongaciones odontoblásticas 11.
Burke 11 habla de tres tipos de mineralización posible dentro de los túbulos:
|
|
- Precipitación localizada de depósitos minerales esféricos pequeños en estrecha relación con los procesos odontoblásticos y con las fibras colágenas. |
|
cccccccc |
- Deposición de cristales minerales dentro de la matriz orgánica. |
|
|
- Deposición centrípeta y uniforme de cristales que obliteran toda la matriz orgánica lo que lleva a la completa oclusión de los túbulos. |
Formación de tractos desvitalizados : La cantidad de tractos desvitalizados aumenta con la edad. Ellos consisten en túbulos dentinarios en los cuales las prolongaciones odontoblásticas se encuentran ausentes 67.
Estos tractos son fácilmente reconocidos en secciones histológicas, debido a que ellos refractan la luz transmitida y se muestran oscuros con respecto al color claro de la dentina normal 67 (Figura 17).
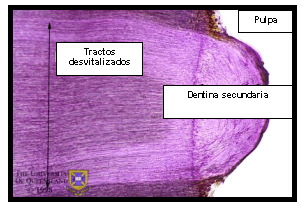 cccc cccc |
Figura 17. Tractos desvitalizados y dentina secundaria tubular irregular. Tomado de www.anatomy.uq.edu.au, 2001 69. |
En un estudio realizado por Stanley y col 59, los tractos desvitalizados fueron más frecuentes bajo lesiones cariosas en dientes jóvenes. En los grupos de dientes entre 10 y 29 años estos tractos estuvieron presentes en un 100% mientras que en los grupos de mayor edad, estuvieron presentes en solo un 30%, de manera que disminuyen con la edad (Figura 18).
 cccc cccc |
Figura 18. Evidencia de la formación de tractos desvitalizados cercanos a la pulpa por debajo de una lesión cariosa. Tomado de www.anatomy.uq.edu.au 2001 69. |
Cambios en el Cemento con el Envejecimiento
El espesor de cemento varía con la edad debido al depósito continuo y progresivo de nuevas capas (Figura 19).
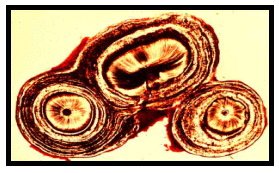 cccc cccc |
Figura 19. Corte transversal a nivel de los ápices de un molar superior. La dentina está rodeada por capas de cemento muy gruesas que se han depositado hasta unir los ápices de las raíces. Tomado de www.sdm.uchc.edu, 2001 68. |
Las zonas más afectadas por la deposición secundaria de cemento son las apicales e interradiculares 24 (Figura 20).
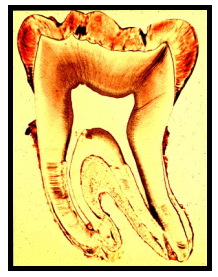 cccc cccc |
Figura 20. Diente humano donde se observa el engrosamiento de cemento que cubre el tercio apical y el área de la furcación. Tomado de www.sdm.uchc.edu,2001 68. |
Con la edad, el diente sufre un desgaste de esmalte e inclusive de dentina, lo que produce un acortamiento de la corona anatómica. Para compensar este desgaste coronario, se produce un aumento del largo radicular por cementogénesis en la zona del ápice de los dientes. En los casos de dientes multiradiculares, se producen también depósitos en las zonas de bifurcación de las raíces 24.
Stein 61 señala que el cemento exhibe un crecimiento progresivo a lo largo de la vida en la dentición humana. El crecimiento de cemento es aproximadamente lineal y su grosor es proporcional con la edad del diente.
La aposición continua de cemento es un fenómeno relacionado con la edad y puede estar influenciado por factores ambientales. El aumento en la aposición de cemento es evidente en el tercio cervical y medio de la raíz, mientras que en el tercio apical, el fenómeno de hipercementosis que es un cambio regresivo de los dientes caracterizado por el desarrollo excesivo de cemento secundario en su superficie 29, ha hecho más difícil su análisis 11.
Según Van Der Velden 70, el cemento aumenta en grosor con la edad y existe una tendencia a que se produzca mayor aposición de cemento en la zona apical y lingual de los dientes, lo cual ha sido comprobado en monos de experimentación y se ha señalado que estas localizaciones de aposición de cemento se producen como respuesta a la erupción pasiva.
Zander y col 75 realizaron un estudio en el cual evaluaron 233 dientes monoradiculares de personas de edades comprendidas entre 11 y 76 años de edad, para comprobar la continua aposición de cemento durante la vida en el tercio medio, apical y en la zona de unión entre el cemento y el esmalte. Los resultados arrojados indicaron que el grosor de cemento en las personas de edades comprendidas entre 51 y 76 años triplicó en milímetros el grosor de cemento en los dientes de personas de 20 años de edad. Por otro lado, también comprobaron que hay una formación mucho mayor de cemento en el tercio apical comparándolo con el formado en la unión cemento-esmalte.
Peli y col 49 estudiaron la aposición de dentina y de cemento en ratas masculinas y determinaron que la aposición de cemento ocurrió en dos direcciones. La primera, paralela a la aposición dentinaria corono-apical, contribuyendo al alargamiento radicular y la segunda ocurrió de manera centrífuga aumentando el diámetro apical de la raíz. El cemento presentó un aspecto más difuso que la dentina, lo que sugiere que éste se deposita a una velocidad mayor, lo cual puede explicar el aumento con los años de los ángulos formados por la unión de las línea dentinarias con sus correspondientes líneas cementarias 49.
La aposición de cemento celular fue significativa pero limitada a la dirección corono-apical. Este periodo corresponde con el comienzo en el que la atrición se acelera y es compensada por la aposición de cemento apical 49.
Louridis y col 36 estudiaron ratas de diferentes edades en bloques mandibulares y midieron las superficies mesiales y distales y los ápices de las raíces de los primeros y segundos molares, observando que el ancho del cemento aumentaba en todas las edades estudiadas, siendo la aposición de cemento más intensa en los dientes jóvenes.
El hecho de que el ancho del cemento en el aspecto mesial de la raíz fue ligeramente menor que en el aspecto distal parece representar el efecto funcional relacionado con la migración mesio-oclusal de los dientes, que se espera que aumente con la edad. Debido a que la superficie distal de los dientes se encuentra bajo tensión, se favorece la aposición de cemento, mientras que la superficie mesial se encuentra bajo presión, lo cual no favorece la aposición del mismo 36.
Kuttler 33 evaluó dientes entre 18 y 55 años de edad y concluyó que el aumento de cemento con la edad se debe más a la fuerza de masticación que al tiempo que el diente ha estado en oclusión.
Azaz y col 3 estudiaron caninos y premolares retenidos de pacientes entre 9 y 70 años de edad y encontraron una correlación estadísticamente significativa entre la edad y el grosor del cemento en el tercio cervical y medio de las raíces de los dientes retenidos. Los resultados indican que el grosor del cemento está directamente relacionado con la edad del diente. Si se asume entonces que el grosor del cemento está directamente asociado con el estrés, el aumento de la aposición de cemento en dientes retenidos no funcionales puede deberse al estrés producido por las fuerzas de erupción impedidas continuamente que pueden actuar como un factor estimulador de aposición cementaria.
Kuttler 33 sugiere que el centro del foramen se desvía más y más del centro apical con el aumento de la edad y resulta en engrosamiento del cemento apical. El diámetro del foramen aumenta con los años debido a la aposición de nuevas capas de cemento (Figura 21). El diámetro promedio en dientes jóvenes y adultos es en cierta medida mayor vestíbulo-lingualmente que mesio-distalmente.
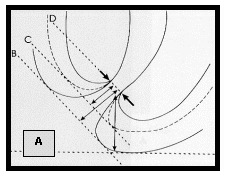 cccc cccc |
Figura 21. La unión cemento dentinaria en el punto D es el diámetro más pequeño del conducto. Con la continua deposición de cemento durante la vida, la distancia al ápice anatómico aumenta de C a B, así como lo hace al ápice radiográfico A. Tomado de Newton y Brown, 1998 42. |
Los dientes envejecidos tienen aspecto de embudo en la parte terminal del conducto de manera más marcada que los dientes jóvenes. Esto se debe al aumentado diámetro del foramen y al disminuido diámetro del conducto 33.
En un estudio realizado por Stein y Corcoran 60 en dientes entre 26 y 77 años de edad para determinar los cambios en la anatomía del ápice radicular con el envejecimiento, se llega a la conclusión de que hay una correlación positiva entre el aumento de edad y el aumento en el ancho del cemento, la desviación del foramen apical y el aumento de la apertura del mismo. Sin embargo, este estudio señala que la unión cemento-dentinaria se mantiene igual con el paso de los años.
Debido a la continua aposición periapical, el cemento puede llegar a depositarse por dentro del conducto radicular y aún obliterar dicho conducto en dientes de avanzada edad 24.
Morse 39 afirma que el ancho del cemento se incrementa con la edad, principalmente en la zona apical y que se puede medir por medio de la acumulación rítmica de tejido cementario o anulación.
Se han realizado varios intentos para estimar la edad cronológica del ser humano analizando las anulaciones del cemento. Las anulaciones son bandas claras y oscuras alternadas en la capa de cemento. Stein 61 estudió el cemento de 52 premolares e incisivos de personas entre 27 y 84 años de edad y encontró una correlación positiva entre la deposición de cemento y la edad del diente. Además observó que esta relación disminuía a medida que se avanzaba en edad a partir de los 55 años (Figura 22).
 cccc cccc |
Figura 22. Sección longitudinal descalcificada a través del ápice, mostrando hueso en la parte izquierda de la fotografía, una capa muy gruesa de cemento en el medio y dentina en la parte superior derecha. Nótense las anulaciones en el cemento. Tomado de www.usm.uchc.edu, 2001 68. |
Ketterl 31 sostiene que el cemento tipo celular-fibrilar es permeable en las dos direcciones en los dientes jóvenes, mientras que en aquellos dientes envejecidos, esta permeabilidad disminuye y se limita a las capas periféricas.
El cemento experimenta solo pequeños cambios de remodelación. Después de la formación del cemento, el envejecimiento y la muerte celular son características normales del ciclo de vida del cementocito, por lo tanto, al avanzar en edad, el cemento es esencialmente acelular 70.
Aunque el remodelado del cemento no sucede como proceso normal, si se puede observar con frecuencia resorción local con deposición de cemento. Estas áreas aumentan con la edad 70.
Los fenómenos de resorción y aposición del cemento pueden ser los responsables de la aumentada irregularidad en la superficie del cemento que se observa en dientes humanos envejecidos 70.
Existe un acuerdo general de que el cemento se deposita continuamente durante la vida, sin embargo, el mecanismo morfogenético de aposición de cemento en áreas de furcación y ápices no está completamente dilucidado. Se sugiere que en estos lugares, la aposición de cemento sucede como mecanismo de compensación por la pérdida de esmalte y dentina debido a la atrición y a los movimientos oclusales de los dientes, de manera de preservar el ancho del ligamento periodontal 3.
Gómez y Campos 24 refieren que con la edad, el cemento también puede quedar expuesto, fenómeno llamado denudación cervical, por migración del epitelio de unión o descenso de las apófisis alveolares. Al quedar el cemento expuesto a la cavidad bucal, pueden producirse sensaciones dolorosas a diferentes estímulos.
Tratamiento endodóntico en pacientes ancianos y su relación con los cambios inducidos por la edad en la pulpa, dentina y cemento.
Consideraciones generales para el tratamiento en pacientes ancianos
El aumento de las patologías y el aumento de las expectativas de vida del paciente han resultado en una mayor demanda de procedimientos endodónticos en la población anciana 72.
Ingle 28 refiere que el éxito de la terapia endodóntica es menor en pacientes ancianos que en pacientes jóvenes, sin embargo, los procedimientos endodónticos no deben ser contraindicados en estos pacientes. Por el contrario, se requiere establecer un adecuado diagnóstico y determinar la necesidad del tratamiento tomando en cuenta que se deben tener consideraciones especiales en estos pacientes, mientras que Burke 11 señala que existe un porcentaje más alto de éxito en la terapia endodóntica en pacientes envejecidos, posiblemente atribuible a la esclerosis de los túbulos en la dentina radicular que conlleva a la disminución de la filtración, especialmente en apical.
Las consideraciones endodónticas en los pacientes geriátricos son las mismas que se deben tener en cuenta en las personas jóvenes con algunas diferencias. Estas diferencias radican en el aspecto biológico, médico y psicológico, así como en las complicaciones del tratamiento endodóntico en sí. Es de esperar que la dentición del paciente geriátrico haya experimentado años de enfermedad dental y de restauraciones. Todo ello tiene un impacto adverso en la pulpa y en los tejidos periradiculares 72.
En el aspecto biológico los tejidos de las personas mayores no necesariamente tienen que responder de manera diferente que los tejidos de los pacientes jóvenes. No existen en el paciente anciano cambios endodónticos específicos que sean diferentes de otros procedimientos dentales. De manera similar, los tejidos locales, pulpa y periápice, no responden de una forma notoriamente diferente a como lo hacen otros tejidos 72.
El aspecto médico abarca los problemas sistémicos del paciente que tienden a producirse con mayor frecuencia y con mayor gravedad. En general, los cuadros médicos no son más importantes para los procedimientos endodónticos en el paciente mayor que para otros tipos de tratamiento dental. Se presume que los cuadros sistémicos como la diabetes o la terapia inmunodepresora predisponen al paciente endodóntico a la infección o al retraso de la cicatrización, sin embargo, no existe ninguna evidencia de que estos cuadros supongan mayores efectos adversos para los ancianos 72.
La osteoporosis resulta especialmente interesante, debido a que es un cuadro frecuente en las mujeres mayores. No existen evidencias de que esta enfermedad altere notoriamente la densidad ósea de los maxilares ni de que los pacientes con osteoporosis sufran alteración de la cicatrización ósea tras un tratamiento de conductos o una cirugía apical 72.
Los pacientes médicamente comprometidos no presentan un riesgo mayor de complicaciones que otros grupos etarios, sin embargo, es importante tener en cuenta que este grupo de pacientes mayores frecuentemente se encuentran tomando más medicamentos, por lo que se requiere precaución 72.
La vejez se encuentra frecuentemente acompañada de alteraciones del aspecto psicológico del paciente. Las funciones sensoriales y cognitivas impiden la habilidad del paciente de realizar las actividades de la vida diaria, lo que puede alterar la autoestima, la confiabilidad y la posibilidad de comunicarse adecuadamente 21,47. Estas características especiales tienen un impacto en la comunicación con el paciente. El equipo de trabajo debe reconocer estas dificultades y asistir al paciente anciano que presente cambios de orden psicológico y cognitivo para que obtenga la atención bucal adecuada 47.
Capacidad de respuesta de la pulpa envejecida a diferentes estímulos
Aunque la respuesta a las pruebas pulpares que se practican en los pacientes de rutina son similares en los pacientes ancianos, existen ciertas diferencias. El suministro nervioso de la pulpa a disminuido y el volumen de la dentina frecuentemente ha aumentado. También han ocurrido cambios en el contenido de la sustancia fundamental y del colágeno. Todo esto tiende a hacer que la pulpa sea menos sensible a los estímulos, por lo que las pruebas diagnósticas deben hacerse cuidadosamente 72.
Es común encontrar una pulpa vital envejecida que no responde a las pruebas eléctricas pero sí lo hace a otras pruebas como la del frío. La prueba cavitaria puede no ser útil en los pacientes ancianos debido a la reducida inervación dentinaria 42,72.
Tenca 64 señala que las pruebas diagnósticas son parte esencial en el diagnóstico endodóntico, sin embargo, debido a los cambios pulpares de los pacientes envejecidos, es posible no encontrar respuesta a los estímulos térmicos y eléctricos. En ausencia de otros signos y síntomas, el fracaso de la pulpa a responder a los estímulos no necesariamente indica que la pulpa no está vital.
Los falsos negativos, es decir, la ausencia de respuesta en dientes vitales, son comunes en estos pacientes, por lo tanto no se debe asumir directamente que el diente se encuentra necrótico 28,72.
Según Newton y Brown 42 la presencia de restauraciones extensas, recesión pulpar y calcificaciones excesivas son limitaciones en la realización e interpretación de resultados de las pruebas pulpares eléctricas y térmicas en pacientes ancianos.
El conocimiento de los aspectos histológicos y la frecuencia de aparición de lesiones degenerativas pulpares son importantes desde el punto de vista clínico, ya que su presencia puede alterar o modificar las reacciones pulpares frente a las diferentes injurias, no obstante sus escasas manifestaciones clínicas 2.
Avellaneda y col 2 atribuyen la disminución en la sensibilidad de los dientes a los focos de calcificación encontrados en los axones y envolturas nerviosas dentro de la pulpa que se fusionaban tomando el aspecto de largas cintas.
Estos autores 2 señalan que el alto porcentaje de procesos degenerativos encontrados en la pulpa radicular da un toque de atención al clínico cuando se encuentra frente a una pieza dentaria que no responde a las pruebas semiológicas. Ello puede deberse a la presencia de estos procesos degenerativos que traen escasas manifestaciones clínicas y desde un punto de vista defensivo crean un terreno propicio o susceptible al avance de injurias de diferente naturaleza.
Hallazgos radiográficos
Es común que en los pacientes ancianos sea dificultosa la colocación de las radiografías intrabucales y el uso de los sujetadores de radiografías se hace necesario 21,42,72.
Las radiografías coronarias son útiles en la terapia endodóntica de estos pacientes, puesto que nos dan un estimado del tamaño de la cámara pulpar con respecto a la localización y profundidad de las restauraciones y de la caries presente 72.
Cantor 14 señala que la formación de tejido duro es más marcada en el piso de la cámara pulpar que en el techo y en las paredes de la misma, por lo tanto, las radiografías coronarias ayudan a definir la dimensión ocluso-apical de la cámara pulpar y deben ser estudiadas muy de cerca antes de penetrar en la corona de estos dientes.
La recesión de los cuernos pulpares y el encogimiento de la cámara pulpar puede progresar a tal punto que no exista evidencia radiográfica de la cavidad pulpar, haciendo más complicado el proceso de diagnóstico 64.
Según Walton 72, la pulpa tiende a apreciarse más pequeña en las radiografías e incluso desaparecer. Es importante tomar en cuenta que la no visualización de la pulpa radiográficamente no necesariamente indica que ella no está presente( Figura 23 y 24).
Tenca 64 señala que frecuentemente los conductos de dientes de ancianos tienden a desaparecer radiográficamente en la zona apical debido al adelgazamiento del conducto o de la aposición incrementada de cemento en esta área. Esto no debe ser confundido con la desaparición del conducto cuando se bifurca.
 cccc cccc |
Figura 23. Radiografía de un primer premolar superior que muestra señales de calcificación pulpar. Tomado de www.endoweb.com, 2001 71. |
 cccc cccc |
Figura 24. A pesar de la imagen radiográfica, los conductos se encontraban presentes. Tomado de www.endoweb.com, 2001 71. |
La continua formación de cemento resulta en un cambio de posición del foramen apical alejándose del ápice radiográfico y la hipercementosis puede oscurecer completamente la anatomía apical 42.
Ingle 28 señala que en las radiografías periapicales de pacientes ancianos se encuentran frecuentemente imágenes radiolúcidas apicales producto de una muerte pulpar que ha pasado inadvertida, así como hallazgos radiográficos de osteitis condensante como resultado de una pulpitis crónica de bajo grado que desaparece con la terapia endodóntica. Otro hallazgo común es la resorción apical de las raíces como fenómeno del envejecimiento.
Tenca 64 también describe la mayor incidencia de osteitis condensante alrededor de las raíces de dientes de pacientes ancianos.
La incidencia de patologías no endodónticas de los maxilares tiende a aumentar con la edad y pueden ser observadas radiográficamente, por lo tanto, la determinación de la condición pulpar es fundamental para el correcto diagnóstico 72.
Newton y Brown 42 señalan que el radiovisiógrafo tiene mayor utilidad sobre las radiografías convencionales para la detección de cambios óseos en pacientes ancianos.
Limpieza y conformación del sistema de conductos radiculares
El adecuado acceso a la cámara pulpar y la identificación de los orificios de los conductos es probablemente el paso más difícil en la realización de tratamientos de conducto en los dientes envejecidos. Aunque los efectos de la edad y de las múltiples restauraciones reducen el volumen y la extensión coronaria de la cámara pulpar, su posición bucolingual y mesiodistal permanece igual y puede ser predecible por medio de radiografías y de la evaluación clínica 42.
Lograr un buen acceso a la cámara pulpar que permita la localización de los conductos es un reto en los dientes envejecidos debido a la anatomía interna. Se sugiere la realización de aperturas de cámara más grandes, particularmente cuando existen grandes restauraciones a través de las cuales hay que lograr el acceso, así como el uso de magnificación por medio del microscopio o de otras ayudas visuales 72.
La presencia de una cámara pulpar pequeña o no visible puede ser una indicación de comenzar el acceso sin la colocación del dique de goma, lo cual ayuda a permanecer en el eje largo del diente 72.
Cantor 14 sugiere que antes de colocar el dique de goma, se dibuje la forma externa y la dirección de las raíces bucal y lingualmente con el dedo o con un explorador para ayudar a dirigir la fresa.
Ingle 28 señala que en el caso de las cámaras pulpares de los molares, hay que prestar especial atención de no perforar la furca en un intento desesperado por encontrar la cámara. Se requiere entonces de tomar mediciones cuidadosas en las radiografías pre-operatorias.
La pulpa dental es propensa a presentar mineralización distrófica que puede ser tan extensa que la totalidad de los conductos se oblitere. Como resultado de ello, el tratamiento de conductos se dificulta considerablemente o se hace imposible 43.
La calcificación de los conductos como resultado del proceso de envejecimiento se presenta como una situación muy diferente a la calcificación que se produce en los dientes jóvenes producto de trauma, pulpotomía, caries o procedimientos restauradores que hayan inducido una obliteración prematura del conducto. Aunque estos dientes jóvenes están aún más comprometidos por la formación de dentina reparativa, el patrón de calcificación de los dientes envejecidos parece ser mucho más concéntrica y lineal, lo cual permite una penetración más fácil una vez que los conductos han sido localizados 42 (Figura 25).
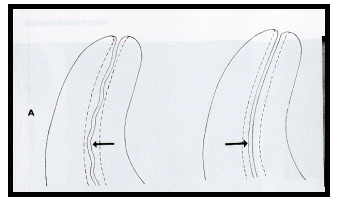 cccc cccc |
Figura 25. La calcificación que se produce con el envejecimiento parece ser lineal, como en la imagen de la derecha, terminando por obliterar el espacio pulpar. La imagen de la izquierda muestra un patrón de calcificación de un diente joven. Tomado de Trowbridge y Kim, 1998 67. |
Newton y Brown 40 sugieren el uso de magnificación para proporcionar una ventaja obvia en tratar conductos pequeños de pacientes ancianos.
El explorador endodóntico afilado, la fibra óptica, la calma y una actitud paciente por parte del operador contribuyen al éxito de la preparación de los conductos 14.
Existen ciertas diferencias en la determinación de la longitud de trabajo en los dientes de pacientes ancianos. Debido a que el foramen apical varía considerablemente de posición en estos pacientes y a que el diámetro del conducto disminuye apicalmente, se hace más difícil determinar la longitud de trabajo 72.
Los conductos calcificados reducen la sensación táctil del operador para identificar la constricción apical clínicamente y reduce la sensación periapical del paciente que podría indicar haber penetrado dentro del foramen 42.
Los cambios con la edad en el periápice complican el tratamiento debido a que el cemento se deposita durante toda la vida en la zona apical moviendo la unión cemento-dentinaria dentro del conducto alejándola del ápice radiográfico 42.
En pacientes ancianos existe una aumentada incidencia de hipercementosis. En estos casos, la constricción apical está aún más alejada del ápice radiográfico causando que la penetración dentro del conducto cementario sea casi imposible. Además, la resorción apical asociada a patologías periapicales aumentan las posibilidades de cambios en el tamaño, forma y posición de la constricción 42.
Si se acepta la premisa que la terapia endodóntica debe terminar en la unión del cemento con la dentina, se debe entonces aceptar también que en los ancianos, este punto se encuentra alejado del ápice radiográfico. En estos casos, el localizador de ápice es un instrumento de mucha utilidad 28.
Cantor 14 señala que la determinación de la unión cemento-dentinaria es una cuestión de conjeturas en los pacientes ancianos. La deducción usual de 0,5 a 1 mm del ápice radiográfico puede tener que aumentarse a 2 mm o más. Se requiere de un estudio cuidadoso de la información radiográfica, de la utilización del localizador de ápice, de la sensación táctil del operador y del reporte de sensación del paciente. Todo ello combinado dará el estimado más preciso.
Tenca 64 señala que aquellos intentos de instrumentar hasta el ápice radiográfico pueden resultar en perforaciones, molestias post-operatorias y posibilidades de fracaso del tratamiento.
La instrumentación de estos conductos representa un reto por cuanto ellos son más estrechos y requieren de mayor tiempo para ser ensanchados. Usualmente se hace necesaria la utilización de lubricantes como la glicerina para facilitar el ensanchamiento y para disminuir el riesgo de doblar o fracturar las limas 72.
Tenca 64 señala que la calcificación de los conductos rara vez es completa y frecuentemente los orificios pueden ser encontrados e instrumentados y propone la terapia endodóntica en una sola cita para estos pacientes basado en los múltiples estudios que afirman que la terapia en una sola cita no necesariamente resulta en mayor incidencia de dolor post-operatorio.
La aumentada aposición de dentina secundaria en los conductos radiculares reduce la cantidad de instrumentación necesaria durante la terapia endodóntica y la aposición de dentina a nivel apical hace que se logre un tope más definido en esta zona 11.
Ingle 28 propone la utilización de quelantes y lubricantes conjuntamente con limas de pequeño calibre n°8 y n°10 precurvadas para alcanzar la unión cemento-dentinaria. De igual manera, señala que ensanchar hasta un instrumento n°25 es suficiente en estos conductos parcialmente calcificados y estrechos.
Ngeow y col 43 reportaron un caso de un incisivo central superior que radiográficamente presentaba la cámara pulpar obliterada con evidencia de conducto radicular en el tercio apical con radiolucencia periradicular. Los autores abrieron la cámara pulpar según los lineamientos sugeridos para este diente y colocaron un agente quelante dentro de ella, sellando el acceso temporalmente.
Los autores 43 sugieren que los agentes quelantes pueden ser útiles en la localización de conductos calcificados sellándolos dentro de la cámara pulpar entre citas. El ácido etilaminotetracético (EDTA) puede permanecer activo dentro del conducto por aproximadamente 5 días, actuando solo en los tejidos calcificados sustituyendo iones de sodio, combinándose con la dentina para producir sales solubles.
Para Newton y Brown 42, muy pocos conductos de dientes envejecidos, incluyendo los dientes anterosuperiores, tienen un diámetro adecuado que permita el uso seguro de los tira nervios, no solo por la estrechez de los conductos sino por el estado calcificado, atrófico y fibroso semejante al de un palillo de dientes humedecido.
En casos de pulpas vitales y dolorosas, Ingle 28 desalienta el uso de tira nervios y propone la instrumentación de los conductos como una manera de realizar la pulpectomía.
Walton 72 propone la técnica del paso atrás o del acceso progresivo al ápice como técnicas de preparación de los conductos ya que permiten una mejor limpieza e irrigación. En cuanto a la obturación señala que no existe una técnica que se prefiera en estos dientes.
Newton y Brown 42 señalan prudente la selección de la gutapercha como material de obturación en estos casos, ya que la técnica empleada no requiere usualmente ensanchar demasiado los tercios medio y coronal y no generan presión en el área que podría traducirse en fracturas.
Estos autores también resaltan la importancia del tapón de dentina y sus efectos sobre el sellado apical. La posibilidad de que el tapón de dentina se forme apicalmente aumenta cuando el foramen apical es más estrecho o cuando la conductometría se establece alejada del ápice radiográfico. Estas características son comunes en los dientes envejecidos. El tapón de dentina puede crear un sellado por sí mismo, contribuyendo a la existencia de una matriz sólida sobre la cual se condense la gutapercha, evitando sobreinstrumentación y sobreobturación 42.
Alternativas de tratamiento para los dientes envejecidos
Frecuentemente el plan de tratamiento original debe ser modificado durante el procedimiento endodóntico, debido a hallazgos inesperados como conductos estrechos no permeabilizables, presencia de resorciones, bloqueos dentro de los conductos, perforaciones durante la apertura de cámara, escalones y fracturas de instrumentos. La cirugía apical se hace entonces necesaria. Estas posibilidades deben ser explicadas al paciente preferiblemente antes de iniciar cualquier procedimiento 72.
Ingle 27 señala que debido a la constricción de los conductos radiculares por la aposición de dentina secundaria, se puede considerar la obturación con puntas de plata. Asimismo, menciona que debido a las expectativas obvias de vida de este grupo de personas, se puede considerar la realización de pulpotomías formocresoladas.
Por medio de las pulpotomías formocresoladas, Ingle 28 afirma que se pueden ganar años de vida de un diente con un consumo de tiempo, dinero y trauma mínimos. Esta es una manera de retener dientes en boca de pacientes muy ancianos, sin embargo, esta terapia requiere de una cuidadosa selección del caso.
Capacidad de cicatrización después de los procedimientos endodónticos
Existe una concepción popular que sugiere que los individuos ancianos tienen impedida, comprometida o retardada la cicatrización en comparación con los individuos jóvenes. Esto no es necesariamente cierto. Existe una marcada similitud en los patrones de reparación de los tejidos bucales de los individuos ancianos con respecto a los jóvenes, pero con un leve retraso en la respuesta de cicatrización 72.
Walton 72 señala que el aspecto crítico en la cicatrización es la vascularización del tejido. Existe especulación acerca de los cambios arterioscleróticos en los vasos sanguíneos así como de la viscosidad alterada de los tejidos conectivos en los individuos ancianos, lo que resultaría en un período más largo de cicatrización. Este hecho no ha sido aún comprobado y es más probable que existan diferencias pequeñas en la velocidad y naturaleza del proceso de cicatrización en hueso y tejidos blandos entre grupos etarios distintos.
La velocidad de formación de hueso y de resorción normal disminuyen con la edad, a la vez que el hueso neoformado en los ancianos es más poroso y menos mineralizado, por lo que el período de evaluación post-tratamiento usual de 6 meses puede no ser adecuado y puede tomar hasta 2 años para que se produzca la cicatrización que ocurriría en 6 meses en los pacientes adolescentes 42.
Burke 11 realizó un estudio en el que comparó la velocidad de cicatrización de las radiolucencias periapicales de pacientes de 30 años o menos y de 50 años o más. Los resultados obtenidos no mostraron diferencias significativas.
Tenca 64 señala que en los ancianos, la reparación de los tejidos se ve retrasada, sin embargo ocurre en la mayoría de los casos después de una terapia endodóntica.
Se ha descrito que la osteoporosis, un desorden en la formación de la matriz ósea que se presenta mayormente en mujeres después de la menopausia, es responsable de algunos casos de resolución incompleta de lesiones endodónticas 21,64.
Discusión
El envejecimiento es un proceso inevitable que sucede en todas las formas de vida y que debe ser considerado como un fenómeno normal y no como una enfermedad, sin embargo, es difícil delimitar donde terminan los procesos normales que se presentan con el envejecimiento y donde comienzan los cambios patológicos, debido a que sobre los cambios biológicos básicos que ocurren con la edad se suma el aumento de la vulnerabilidad a las enfermedades 30.
El proceso de envejecimiento se ha estudiado a través de los años en un intento por encontrar la causa que lo produce. Muchas son las teorías que se han postulado explicando los diferentes factores a los que se pueden atribuir los cambios que se producen en el individuo con el paso de los años. Algunos autores 38,47 sugieren que el envejecimiento tiene una base fundamentalmente genética mientras que otros autores 4,17,25,35. encuentran la explicación del envejecimiento en fenómenos metabólicos e inmunológicos.
Si bien no se ha podido establecer hasta ahora el mecanismo exacto por el cual los seres vivos envejecen, muchos autores 17,47 agrupan factores ambientales, hereditarios y genéticos dentro de las teorías propuestas.
Se han realizado investigaciones 38,39 sobre los efectos que tiene la edad en los tejidos dentales demostrando que ellos envejecen como lo hacen los demás tejidos del cuerpo humano y los cambios que se derivan de este proceso de envejecimiento se observan tanto en dientes erupcionados, sometidos a fuerzas oclusales e irritantes, como en dientes retenidos que se encuentran exentos de la acción de estos factores.
La disminución en la densidad celular, la reducción del suministro nervioso y vascular, el aumento de depósitos cálcicos, la formación de dentina secundaria y esclerótica y las variaciones en el espesor del cemento son fenómenos que se producen de forma continua y progresiva a lo largo de la vida.
El fenómeno de fibrosis pulpar es motivo de controversia debido a que con el paso de los años hay un aparente aumento del número de fibras pulpares, sin embargo, existe una reducción en el número de fibroblastos que son las células encargadas de la formación de estas fibras. Se piensa entonces que la apariencia fibrosa de las pulpas envejecidas se debe al marcado descenso de las células pulpares, elementos sanguíneos y nerviosos que hace que exista un predominio fibroso 38,52.
Estos cambios en los tejidos dentales tienen implicación directa en la terapia endodóntica. Al tratar pacientes ancianos y dientes envejecidos es necesario tomar en cuenta ciertas consideraciones especiales. Este grupo particular de la población presenta condiciones sistémicas, biológicas y psicológicas de especial interés para el odontólogo, así como consideraciones dentales importantes que deben manejarse antes de comenzar la terapia endodóntica 21,72.
Existen diferencias de opinión acerca del éxito que se espera en la terapia endodóntica en los pacientes ancianos. Ingle 28 refiere que el éxito es menor en pacientes ancianos que en pacientes jóvenes, mientras que Burke 11 señala que existe un porcentaje de éxito mayor en la terapia endodóntica en este tipo de pacientes posiblemente atribuible a la formación de dentina esclerótica que conlleva a una disminución de la permeabilidad dentinaria.
Se especula que los cambios arteroescleróticos en los vasos sanguíneos así como las alteraciones de los tejidos conectivos en los individuos ancianos, resultarían en un período más largo de cicatrización. Este hecho no ha podido ser aún comprobado y es más probable que existan diferencias pequeñas en la velocidad y naturaleza del proceso de cicatrización en hueso y en tejidos blandos entre grupos etarios distintos 64,72.
Los dientes envejecidos no presentan las mismas características que los dientes jóvenes, por lo que es indispensable que el operador tenga amplio conocimiento de los cambios que los tejidos dentales sufren con el paso de los años y las implicaciones clínicas que se derivan de ellos. Solo así el operador será capaz de llevar a cabo el tratamiento más acertado para este tipo de dientes.
Conclusiones
1. El envejecimiento es un fenómeno natural que agrupa alteraciones morfológicas y funcionales del organismo, produciendo disminución de la función y de la habilidad para soportar estrés.
2. Se han propuesto numerosas teorías que intentan explicar el fenómeno de envejecimiento, sin embargo su causa es aún desconocida y no existe hasta ahora la forma de detener los cambios que se producen por el aumento de la edad.
3. Con el aumento de la edad, en la pulpa se producen cambios dimensionales, estructurales y funcionales.
4. Los cambios dimensionales de la pulpa se producen por la formación de tejido calcificado adicional sobre las paredes de la dentina o dentro del tejido pulpar, lo que disminuye el volumen original de la cavidad pulpar.
5. Los cambios estructurales de la pulpa incluyen la disminución de la densidad celular, el aparente aumento del componente fibroso, la disminución gradual de la irrigación sanguínea y de la inervación.
6. Los cambios funcionales de la pulpa consisten en la disminución de la capacidad de defensa y recuperación, la reducción en la sensibilidad a diferentes estímulos y la disminución de la actividad inmunitaria.
7. Los principales cambios de la dentina asociados con la edad son el aumento de dentina secundaria, el aumento de dentina esclerótica y el aumento del número de tractos desvitalizados.
8. Con la edad el cemento aumenta en grosor y existe una tendencia a que se produzca mayor aposición de cemento en la zona apical y lingual de los dientes. Estas localizaciones de aposición de cemento se producen como respuesta a la erupción pasiva.
9. En los dientes envejecidos, la presencia de restauraciones, recesión pulpar y calcificaciones excesivas son limitaciones en la realización e interpretación de resultados de las pruebas de vitalidad pulpar.
10. En pacientes ancianos el sistema de conductos radiculares puede no evidenciarse radiográficamente debido al proceso de calcificación pulpar sin que esto indique necesariamente que no esté presente.
11. En la determinación de la longitud de trabajo existen diferencias en los dientes de pacientes ancianos, ya que el foramen apical varía considerablemente de posición en estos pacientes, alejándose del ápice radiográfico, debido a la aposición continua de cemento, a la aumentada incidencia de hipercementosis y a las resorciones apicales asociadas a estos dientes envejecidos.
12. Frecuentemente el plan de tratamiento original puede ser modificado durante el procedimiento endodóntico, debido a hallazgos inesperados. El sistema de conductos radiculares puede no ser localizado o patentizado y la cirugía apical se hace entonces necesaria.
13. Los patrones de reparación de los tejidos bucales de los individuos ancianos tienen una marcada similitud con respecto a los jóvenes, pero con un leve retraso en la respuesta de cicatrización.
14. Hay una mayor demanda de procedimientos endodónticos en la población anciana debido al aumento de las patologías y al aumento de las expectativas de vida del paciente.
Referencias
1. Abrams W, Beers M, Berkow R. The merck manual of geriatrics. 2da ed. Nueva Jersey: Editorial Merck Research Laboratories, 1995.
2. Avellaneda R. Incidencia de lesiones degenerativas pulpares en función con la edad. Revista de la Asociación Odontológica Argentina 1984;72(4): 105-108
3. Azaz B, Ulmanski M, Moshev R, Sela J. Correlation between age and thickness of cementum in impacted teeth. Oral Surgery 1974;38(5): 691-694.
4. Bates J, Adams D, Stafford G. Dental Treatment of the elderly. 1ra. ed. Gran Bretaña: Editorial Bristol, 1984.
5. Bennett C, Kelln W, Biddington W. Age changes of the vascular pattern of the human dental pulp. Archives of Oral Biology 1965;10:995-998.
6. Bernick S. Age changes in the blood supply to human teeth. Journal of Dental Research 1967; 46(3): 544-550.
7. Bernick S. Effects of aging on the nerve supply to human teeth. Journal of Dental Research 1967;46(4):694-699.
8. Bernick S. Effects of aging on the human pulp. Journal of Endodontics 1975;1(3):88-94.
9. Bernick, S. Lymphatic vessels of the human dental pulp. Journal of Dental Reseach 1977; 56(7): 70-7.
10. Bernick S. Vascular and nerve changes associated with the healing of the human pulp. Oral Surgery 1972; 33(6): 983-1000.
11. Burke F, Samarawickrama D. Progressive changes in the pulpo-dentinal complex and their clinical consequences. Gerontology 1995;12(2): 57-66.
12. Butler W. Dentin extracellular matrix and dentinogenesis. Operative Dentistry 1992; (5suppl): 18-23.
13. Byers M, Schatteman G, Bothwell M. Multiple functions for NGF receptor in developing, aging and injured rat teeth are suggested by epithelial, mesenchymal and neural inmunoreactivity. Development 1990;109:461-471.
14. Cantor M. Endodontic consideration in treatment of older adult. New York Science Dental journal1994;(Jun-Jul):34-40.
15. Carpenter DG. Diffusion theory of aging. Journal of Gerontology 1965;20: 191-195.
16. Carpenter DG, Loynd JA. An integrated theory on aging. Journal of the American Geriatric Society 1968;16(12): 1307-1322.
17. Cohen L. The interpretation of age changes in the oral structures. Journal of Oral Medicine 1970;25(4):129-132.
18. Curtis H, Gebhard K. Comparison of life shortening effects of toxic, and radiation stresses. Radiation Research 1958; 9:104-107.
19. De Crecenzo L. La Napoli di Bellavista. 13ava ed. Napoli: Arnoldo Mondadori editor, 1994.
20. Fried K. Erdelyi G. Changes with age in canine tooth pulp-nerve fibers of the cat. Archives of Oral Biology 1984;29(8): 581-585.
21. Galvao S, Tavano R. Consideraciones sobre el tratamiento endodóntico de pacientes geriátricos. Endodoncia 1999;17(3):151-157.
22. Glossary of Contemporary Terminology for Endodontics. American Association of Endodontists. 5th ed. Chicago: 1994.
23. Goldberg M. Lasfargues JJ. Pulpo-dentinal complex revisited. Journal of Dentistry 1995;23(1): 15-20.
24. Gómez de Ferraris M. Campos Muñóz A. Histología y embriología bucodental. 1era. ed. Madrid: Editorial Médica Panamericana, 1999.
25. Harman D. Role of free radicals on mutation, cancer, aging and the maintenance of life. Radiation Research 1962;16: 753-755
26. Hillmann G. Geursten W. Light-microscopical investigation of the distribution of extracellular matrix molecules and calcifications in human dental pulps of various ages. Cell and Tissue Research 1997; 289:145-154.
27. Humphreys M, Robins M, Stones V. Age-related and 224Ra induced abnormalities an the teeth of male mice. Archives of Oral Biology 1985;30(1): 55-64.
28. Ingle J. Geriatric Endodontics. Gerodontics 1986;79: 47-53.
29. Jablonski S. Diccionario Ilustrado de Odontología. 1ra ed.Buenos Aires: Editorial Médica Panamericana, 1992
30. Jazwinski SM, Rothchild H. The biology of aging. En: Papas A, Niessen L, Chauncey H. Geriatric Dentistry. Aging and oral health. 1era ed. Missouri: Editorial Mosby,1991:3-331.
31. Ketterl W. Age induced changes in the teeth and their attachment apparatus. International Dental Journal 1983;33 (3): 262-271.
32. Kim S. Neurovascular interactions in the dental pulp in health and inflammation. Journal of Endodontics 1990;16(2):48-53.
33. Kuttler Y. Microscopic investigation of the root apexes. Journal of the American Dental Association 1955; 50: 544-552.
34. Lavelle C. The effect of age on the pulp tissue of rat incisors. Journal of Gerontology 1969; (4): 155-156.
35. Levy B. Disease-related changes in older adult. En: Papas A, Niessen L, Chauncey H. Geriatric Dentistry. Aging and oral health. 1era ed. Missouri: Editorial Mosby,1991:83-104.
36. Louridis O, Bazopoulou E, Demetriou N. Age effect upon cementum width of albino rat: A histometric study. Journal of Periodontology 1992;43(9): 533-536.
37. Moore GE. The continued apposition of physiological dentin in the mature tooth. Gerontology Clinic, 1970;12:360-365.
38. Morse D. Age related changes of the dental pulp complex and their relationship to systemic aging. Oral Surgery, Oral Medicine, Oral Pathology 1991;72(6):721-745.
39. Morse D, Espósito J, Schoor R, Williams F, Furst L. A review of aging of dental components and a retrospective radiographic study of aging of the dental pulp and dentin in normal teeth. Quintessence International 1991;22 (9): 711-719.
40. Morse D, Espósito J, Schoor R. A radiographic study of aging changes of the dental pulp and dentin in normal teeth. Quintessence International 1993; 24(5): 329-333.
41. Moxham BJ, Webb M. Ralphs B. Changes in the cytoskeleton of cells within the periodontal ligament and dental pulp of the rat first molar tooth during aging. European Journal of Oral Science1998;106 (1 Supp): 376-383.
42. Newton C, Brown C. Geriatric Endodontics. En: Cohen S, Burns R. The pathways of the pulp. 7ma ed. Missouri: Editorial Mosby,1998:759-790.
43. Ngeow W, Thong L. Gaining access through a calcified pulp chamber: a clinical review. International Endodontic Journal 1998;31: 367-371.
44. Nielsen C, Bentley J, Marshall F. Age-related changes in reducible crosslink of human dental pulp collagen. Archives of Oral Biology 1983;28(8): 759-764.
45. Nitzan DW. The effect of aging in tooth morphology: a study on impacted teeth. Oral Surgery, Oral Medicine, Oral Pathology 1986; 61(1):61:54.
46. Okiji T, Kosaka A, Kawashima N, Suda H. Age-related changes in the inmunoreactivity of the monocyte/macrofhage system in rat molar pulp. Archives of Oral Biology 1996; 41(5):453-460.
47. Papas A, Niessen L, Chauncey H. Geriatric Dentistry. Aging and oral health. 1era. ed. Missouri: .Editorial Mosby,1991:3-331.
48. Pashley D, Walton R. Histología y fisiología de la pulpa dental. En: Ingle J, Bakland L. editors. Endodoncia. 4ta ed. Mexico: Editorial Mc Graw Hill, 1997:336-71.
49. Peli JF, Oriez D. Rate and growth pattern of radicular apical third tissue apposition in tetracycline-labeled rats. Journal of Endodontics 1999; 25(4): 251-256.
50. Phillipas G. Applebaum E. Age factor in secondary dentin formation. Journal of Dental Research 1966;45(3):778-938.
51. Piatelli A. Generalized complete calcific degeneration or pulp obliteration. Endodontic Dental Traumatology 1992:8:259-263.
52. Quigley M. Functional and geriatric changes of the human pulp. Oral Surgery 1971;32(5):795-806.
53. Ranly D, Thomas H, Chen J, Mc Dougall M. Osteocalcine expression in young and aged dental pulps as determined by RT-PCR. Journal of Endodontics 1997; 23(6): 374-377.
54. Ross M. Histology, a text and atlas. 3ra. ed. Baltimore: Editorial Williams and Wilkins, 1995.
55. Seltzer S. Bender IB. The dental pulp: Biologic considerations in dental procedures. 3ra.. ed. Missouri: Ishiyaju Euroamericana. Inc, 1990.
56. Sogaard-Pedersen B, Boye H, Ebbe M. Scanning electron microscope observations on collagen fibers in human dentin and pulp. Scandinavian Journal of Dental Research 1990; 98:89-95.
57. Solheim T. Amount of secondary dentin as an indicator of age. Scandinavian Journal of Dental Research 1992;100(4): 193-199
58. Stanley H. Ranney R. Age changes in the human dental pulp. Oral Surgery, Oral Medicine, Oral Pathology 1962; 5(11):1396-1405.
59. Stanley H, Pereira J, Spiegel E, Broom C, Schultz M. The detection and prevalence of reactive and physiologic sclerotic dentin, reparative dentin and dead tracts beneath various types of dental lesions according to tooth surface and age. Journal of Oral Pathology 1983;12(4):257-289.
60. Stein J, Corcoran J. Anatomy of the root apex and its histologic changes with age. Oral Surgery, Oral Medicine, Oral Pathology 1990;69:238-242.
61. Stein T, Corcoran J. Pararadicular cementum deposition as a criterion for age estimation in human beings. Oral Surgery, Oral medicine, Oral Pathology 1994;77(3): 266-270.
62. Strehler B, Mark D, Mildvan A, Gee M. Rate and magnitude of age pigment accumulation in the human myocardium. Journal of Gerontology 1959; 14: 450
63. Swift ML, Byers MR. Effect of ageing on responses of nerve fibers to pulpal inflammation in rat molars analysed by quantitative immunocytochemistry. Archives of Oral Biology 1992; 37(1):901-912.
64. Tenca J. Endodontic considerations for the older adult. En: Papas A, Nilssen L, Chauncey, H. Geriatric Dentistry. Aging and oral health. 1era. ed. Missouri: Editorial Mosby,1991:168-188.
65. Tidmarsh GG. Micromorphology of pulp chambers in human molar teeth. International Endodontic Journal 1980; 13: 69-75.
66. Toto P, Rubinstein A, Gargiulo A. Labeling index and cell density of aging rat tissues. Journal of Dental Research 1975;54(3): 553-556.
67. Trowbridge H, Kim S, Pulp development, structure and function. En: Cohen S, Burns R. The Pathways of the Pulp. 7ma ed. Missouri: Editorial Mosby,1998:386-424.
68. University of Connecticut Health Center. School of Dental Medicine. Oral histology dentin and pulp: URL:http://www.sdm.uchc.edu/administration/curriculum/ds1/99-00/oh/05dentin_&_pulp/index.html ( consulta 22 de octubre de 2001).
69. University of Queensland School of Medicine. Atlas and practical guide-table of contents: URL:http://www.anatomy.uq.edu.au/histology/contents/contents/.html( consulta 22 de octubre de 2001).
70. Van Der Valden U. Effect of age on the periodontium. Journal of Clinical Periodontology 1984; (11): 281-294.
71. Wahl M, Ibarrola J, Corts J, Miles M, Nahmias Y, Bery P. Dentist home page: URL:http://www.endoweb.com ( consulta 18 de Agosto de 2001).
72. Walton R. Endodontic considerations in the geriatric patient. Dental Clinics of North America 1997;41(4):795-815.
73. Webster J, Woodson Ch. Geriatrics resource guide. 3ra. ed. Chicago: Ed. Northwestern University, 1997.
74. Weine F. Tratamiento endodóncico. 5ta ed. Madrid: Editorial Harcourt Brace. 1997.
75. Zander H, Hurzeler B. Continuos cementum apposition. Journal of Dental Research 1958; (11) 1035-1043.
Invitados Anteriores y sus Trabajos
![]()
¿Tiene Ud. algún trabajo que le gustaría compartir con todos los visitantes de estas páginas? Por favor, envíanos un correo a carlosboveda@carlosboveda.com.
![]()
vvvv
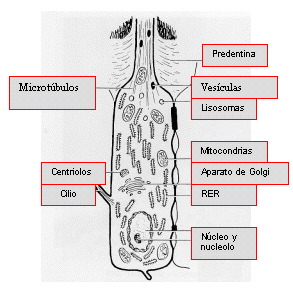 cccc
cccc ccccc
ccccc