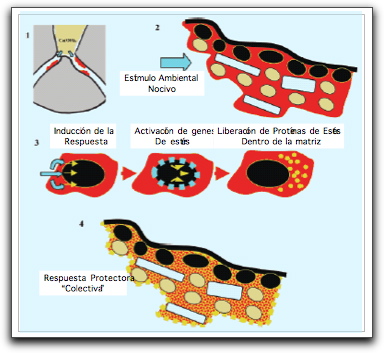
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
" Relevancia y participación de las biopelículas microbianas en las infecciones endodónticas " por Juan Goncalves P. Odontólogo, Universidad Central de Venezuela , 2002 Post Grado en Endodoncia, Universidad Central de Venezuela, 2004-2006 e-mail: goncalves_juan@hotmail.com
La microbiología se ha basado en el estudio de los microorganismos como formas únicas, flotando en un medio líquido, sin embargo, está ampliamente reconocido que la mayoría de los microorganismos encontrados en la naturaleza se encuentran asociados entre ellos, y con la superficie que los rodea, formando organizaciones microbianas denominadas biopelículas (cuyo término en inglés es Biofilm), donde se establecen interacciones activas entre sus habitantes y el medio ambiente circundante. Es por esta razón, que es importante conocer el proceso de formación de la biopelícula, el metabolismo microbiano que se establece en estas agregaciones, y los mecanismos que utilizan sus habitantes para resistir y persistir en ambientes inhóspitos. A pesar de que las biopelículas tienen gran importancia para la salud pública debido a su participación en una gran cantidad de enfermedades infecciosas, su formación y repercusión en el pronóstico del tratamiento endodóntico está siendo actualmente estudiado. En esta revisión se hará una descripción detallada de la evidencia en la formación de las biopelículas en el sistema de conductos radiculares y en el área perirradicular. La agregación de los microorganismos en biopelículas tiene implicaciones clínicas distintas desde el punto de vista del tratamiento, por lo que es importante conocer la susceptibilidad que tiene la misma a las distintas fases de la terapia endodóntica, así como las nuevas estrategias utilizadas para la eliminación de éstas. El objetivo de este trabajo es conocer la participación de las biopelículas en la microbiología endodóntica, para tener un mejor entendimiento del potencial patogénico de la flora del conducto radicular y a su vez, proveer una base para los nuevos enfoques en el control de la infección.
Biopelícula Microbiana Concepto La adaptación genética permite la supervivencia de los microorganismos en ambientes con condiciones rápidamente cambiantes, pudiendo prosperar en casi cualquier nicho ambiental de nuestro planeta como resultado de la flexibilidad de su expresión genética. Un ejemplo importante y clínicamente relevante de la adaptación bacteriana a través de una expresión genética sistematizada, es la habilidad de crecer como parte de una comunidad sésil rodeada de una matriz de exopolímeros; referida en la literatura como una biopelícula microbiana(1). Estas biopelículas microbianas han sido descritas en muchos sistemas desde que Antonie van Leeuwenhoek usando su microscopio simple, examinó los "animalcules" (microorganismos) en la placa dental de sus propios dientes en el siglo XVII(2,3); pero la teoría general de la predominancia de la biopelícula fue promulgada en 1978(4). Esta teoría afirma que la mayoría de las bacterias crecen en un matriz cerrada adherida a las superficies de todos los ecosistemas acuáticos diferenciándose profundamente de sus homólogas que se encuentran suspendidas en un medio líquido, es decir, en su forma planctónica(4). La definición de la biopelícula ha evolucionado en los últimos 25 años. Marshall(5) en 1976 notó la relación de fibrillas de polímeros extracelulares muy delgadas que anclaban las bacterias a la superficie. Costerton(4) observó que estas comunidades ancladas en los sistemas acuáticos estaban encajonadas en una matriz de glicocáliz formada por polisacáridos que mediaban en su adhesión a la superficie. La biopelícula está constituida por células únicas y microcolonias, todas embebidas en una matriz de polímeros extracelulares altamente hidratada y predominantemente aniónica(6). En otras definiciones se ha recalcado la importancia de la asociación funcional de las células microbianas dentro de la matriz de polímeros extracelulares, donde se encuentran productos de su propio metabolismo junto con iones y nutrientes secuestrados del medio ambiente(7). Costerton y col(8) en 1995 enfatizaron que la biopelícula puede adherirse a superficies e interfaces, incluyendo en la definición agregados microbianos y poblaciones adherentes con poros. El acoplamiento inicial con la superficie dispara la expresión de genes que controlan la producción de los componentes necesarios para la adhesión y la formación. Este ensamblaje de microorganismos y sus productos extracelulares sobre una superficie biótica o abiótica representa un sistema biológico con un elevado nivel de organización, donde los microorganismos forman comunidades estructuradas, coordinadas y funcionales(9). Es importante destacar que estos agregados de células microbianas están irreversiblemente asociadas con una superficie y encerradas en una matriz principalmente de polisacáridos, dentro de la cual se pueden encontrar materiales no celulares como minerales, partículas de corrosión, arcilla o partículas de cieno, o componentes sanguíneos, dependiendo del ambiente en el cual se desarrolle la biopelícula(3). Donlan y Costerton(2) en el 2002, señalan que una nueva definición de la biopelícula microbiana debería considerar no solo características fácilmente observables como por ejemplo, el acoplamiento celular irreversible a una superficie o interfase, la producción de una matriz de polisacáridos extracelulares por la célula para luego encajarse en ella, sino también otras atribuciones fisiológicas de estos organismos, como la alteración de la tasa de crecimiento y el hecho de que los microorganismos en las biopelículas transcriben genes que los organismos planctónicos no. Estos autores definen la biopelícula como una comunidad microbiana sésil caracterizada por células que están irreversiblemente adheridas a un sustrato, interfase o las unas a las otras, permaneciendo embebidas en una matriz de polisacáridos extracelulares que ellas mismas producen, exhibiendo un fenotipo alterado con respecto a la tasa de crecimiento y la transcripción genética(2). Recientemente se ha señalado que esta organización en comunidades microbianas embebidas y adheridas tanto a una superficie inerte como a un tejido vivo, representa la forma habitual de crecimiento de las bacterias en la naturaleza(10).
Formación de la Biopelícula Recientemente ha surgido mucho interés científico en el proceso de la formación de la biopelícula, debido a que se reconoce que este proceso de formación es un aspecto importante en la mayoría de las enfermedades bacterianas, incluyendo osteomielitis, caries dental y diversas infecciones como aquellas relacionadas con equipos médicos, del oído medio, de implantes oculares y de pulmón en pacientes con fibrosis quística(3). El proceso de regulación para la elaboración de la biopelícula es cíclico y dinámico; donde las condiciones externas van a producir alteraciones en la expresión de los genes requeridos para su formación. Este proceso de formación conlleva a la modificación del microambiente de sus propios habitantes, los cuales deben sufrir alteraciones genéticas adicionales durante el proceso, fomentando la maduración de la biopelícula(1).
Hipótesis de la Formación Existen muchas especulaciones acerca de las ventajas que presentan los microorganismos que viven en biopelículas con respecto a aquellos que viven como células individuales planctónicas; en este sentido, algunos autores han referido algunas razones por las cuales los microorganismos adoptan la estrategia de vivir en este tipo de comunidad. De acuerdo con la teoría de la evolución de Darwin, la única fuerza que conduce el curso de las acciones de cualquier organismo es el buen estado para la reproducción, de manera tal que cualquier acción que incremente la proliferación hará perdurar a la especie; por lo tanto, los microorganismos creciendo en biopelículas pueden otorgar un buen estado para la reproducción a sus habitantes al tener una tasa de crecimiento disminuida en comparación con aquellas bacterias que crecen en forma planctónica(1). La hipótesis de la formación de la biopelícula como respuesta al estrés del medio ambiente es poco clara, ya que, si bien es cierto, los microorganismos experimentan cierto grado de protección y homeostasis cuando residen en biopelículas(9), sin embargo, esto no explica porque las bacterias forman una comunidad inmóvil en un medio tan inhóspito como puede ser el cuerpo humano, por lo que aparentemente el estrés no es la única causa que predispone este modo de crecimiento(1). El cuerpo humano, o al menos, parte de él, es rico en nutrientes y relativamente estable con respecto al contenido de agua, disponibilidad de oxígeno y temperatura, representando un lugar atractivo para las bacterias, por lo que esto podría representar una motivación para la formación de una biopelícula que las mantenga aseguradas en el organismo. No obstante, cuando la fuente de nutrientes es reducida, la bacteria se separa y transforma en planctónica, sugiriendo que la limitación de nutrientes es un estímulo para el progreso hacia un mejor hábitat(1). La formación de la biopelícula también puede ser el resultado de un amplio rango de adaptaciones fisiológicas y morfológicas en respuesta a los cambios ambientales, tales como: diferentes gradientes nutricionales, químicos y de oxígeno, que crean microambientes a los cuales los habitantes se deben adaptar para sobrevivir(11). También se ha sugerido que el estilo de vida comunitario es una motivación importante para la formación de biopelículas, ya que provee grandes beneficios a todos sus miembros; además de la resistencia a los cambios ambientales, se pueden beneficiar de la existencia comunal a través de la división de la carga metabólica y de la transferencia genética(1). Justamente la transferencia genética puede representar una motivación adicional ya que la biopelícula provee un medio ideal para el intercambio de material genético, beneficiando directamente a los microorganismos a través del intercambio de determinantes para la resistencia antibiótica(1,3).
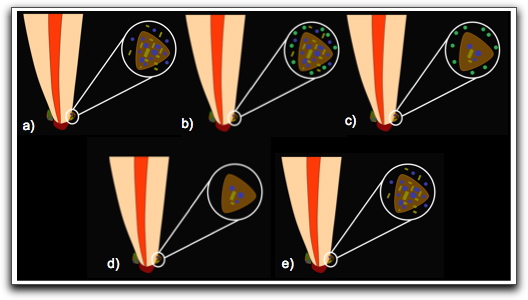
Fases de la Formación La capacidad de formación de las biopelículas no parece estar restringida a ningún grupo específico de microorganismos y en efecto se considera que bajo condiciones ambientales adecuadas todos los microorganismos son capaces de formar biopelículas(10). Estas organizaciones microbianas se pueden formar en una amplia variedad de superficies, incluyendo tejidos vivos, aparatos médicos, sistemas de tuberías de agua potable o sistemas acuáticos naturales(3). Una vez que la superficie ha ser colonizada queda expuesta a un medio acuático; inevitable y casi inmediatamente se condiciona o cubre con polímeros del medio, resultando en una modificación química de dicha superficie. Esta película adquirida o condicionada se forma con sólo minutos de exposición, y continúa creciendo con el paso de las horas, variando su naturaleza dependiendo de la superficie expuesta en el cuerpo humano(3). La película condicionada siempre se forma antes de la llegada de los microorganismos, promoviendo la adhesión selectiva de algunos de ellos y actuando como una fuente de nutrientes(12,13). Numerosos microorganismos en la fase planctónica son transportados a la superficie, pero son las propiedades de la película condicionada las que determinan cuales microorganismos adjunta, y por lo tanto influencia la composición microbial de la biopelícula(13). Una vez que los organismos entran en contacto con la superficie, cualquier posible interacción está gobernada por reglas físico-químicas y biológicas(14), que van a modular la regulación de genes que ocurre en el interior de la célula microbiana(3). Es decir, para que los microorganismos puedan colonizar y asociarse con el sustrato, deben vencer ciertas características del medio como: la velocidad del flujo adyacente a la superficie y la repulsión hidrostática inicial que se establece entre la célula y la superficie(3). Para este fin, los microorganismos se valen de las estructuras celulares superficiales como: fimbrias, los lipopolisacáridos extracelulares (LPS), los polímeros extracelulares (EPS), flagelos y otras proteínas. Los polímeros de superficie con sitios no polares como las fimbrias y componentes de ciertas bacterias Gram negativas (Acido micólico) parecen dominar la adhesión a sustratos hidrofóbicos(3,10), mientras que los polímeros extracelulares (EPS) y los lipopolisacáridos son más importantes en la adhesión a sustratos hidrofílicos(3). Los flagelos son importantes en la adhesión, ya que están encargados de vencer la fuerzas de repulsión inicial entre el microorganismo y el sustrato(3). Sin embargo, aunque la motilidad y la presencia de flagelos ayudan al proceso, esto no parece ser un requisito esencial, pues muchas bacterias Gram positivas inmóviles como estafilococos, estreptococos y micobacterias son capaces de formar biopelículas(3,15). En el caso de las bacterias Gram positivas se ha descrito la participación de proteínas de superficie (AtlE, Bap, Esp) en esta primera etapa de adherencia primaria(15). La formación de la biopelícula ocurre en seis fases:
Durante el transcurso de cada una de estas fases, los microorganismos presentan una expresión de genes bien regulada(11,13).
La etapa inicial del proceso de formación de la biopelícula es la adherencia del microorganismo sobre la superficie(10,11), pero para que esto ocurra debe haber un prerrequisito: la presencia de microorganismos en estado libre flotante en un medio acuoso, llamados microorganismos planctónicos(13). Inicialmente los microorganismos se asocian de manera reversible a la superficie y posteriormente se adhieren de forma irreversible(6). Durante la fase de adhesión se va a regular la expresión genética a través de varios sistemas de transducción por señales, que van a conducir hacia una cascada de diversas reacciones, permitiendo la inducción o inhibición de la trascripción de genes. Las moléculas que causan las señales, pueden ser inherentes al ambiente o ser desconocidas(11). Entre estos sistemas de transducción se encuentran los denominados sistemas de dos componentes y los sistemas que responden a las señales en función de la densidad celular, cuyo término en inglés es quórum sensing. Los sistemas reguladores de dos componentes, frecuentemente están involucrados en el control de la expresión genética en respuesta a un estímulo, transmitiendo la señal ambiental al interior del microorganismo para adecuar la expresión de genes a la nueva situación ambiental(10). Dichos sistemas existen tanto para organismos Gram positivos como Gram negativos participando en la transducción de señales, y por lo tanto son sensores esenciales para la adaptación de la vida en biopelículas(16). El quórum sensing (término en inglés), representa una vía que es activada como respuesta a la densidad celular, y de igual manera son sistemas que se encuentran en microorganismos Gram. positivos como en Gram. negativos(17). El estímulo para la activación del quórum sensing son moléculas llamadas autoinductoras, las cuales son producidas en un nivel basal constante, de esta manera la concentración de moléculas va en función de la densidad microbiana, y por lo tanto, la percepción de la señal, va a ocurrir cuando la concentración de moléculas autoinductoras alcancen el umbral(11,17). Es por esta razón que el término quórum es usado para definir este tipo de sistemas, ya que se necesita que cierto número de microorganismos deben estar presentes para que la señal sea percibida por la población y entonces poder responder a esa señal(11,17). Las bacterias Gram positivas usualmente producen oligopéptidos, los cuales son reconocidos por los sistemas de transducción de dos componentes, en tanto que para los organismos Gram. negativos, las moléculas que disparan la señal pertenecen al grupo de lactones de homoserine. Estas moléculas generalmente difunden dentro de la célula obligando a regular la respuesta(1,3,17,18). Los microorganismos liberan dichas moléculas inductoras cuando se aproximan a la superficie que van a colonizar, aumentando la concentración de las mismas en el área entre el microorganismo y la superficie debido a la difusión limitada; de esta manera los patógenos van a percibir este incremento en la concentración y sentir la presencia de la superficie que están colonizando(11). Las moléculas inductoras para el sistema de quórum sensing son a menudo altamente específicas, por lo tanto, este sistema sirve para comunicaciones intraespecies(11). Más recientemente se ha descrito un segundo sistema de comunicación, denominado sistema autoinductor 2 que permite la comunicación interespecies(11,18,19). Todos estos sistemas de transducción por señales actúan en la regulación de la virulencia, así como de la formación de la biopelícula, sirviendo de conexión entre ambos procesos(10). Una vez que la bacteria se ha adherido a la superficie, comienza a dividirse y las células hijas se extienden alrededor del sitio de unión, formando una microcolonia(10). En una fase posterior, el patógeno comienza a secretar un exopolisacárido que constituye la matriz de la biopelícula y forma unas estructuras similares a setas o champiñones entre las cuales se observa la presencia de canales. La composición del exopolisacárido es diferente en cada bacteria y varía desde alginato en P. aeruginosa, celulosa en S. typhimurium, un exopolisacárido rico en glucosa y galactosa en V. cholerae, poly-N-acetilglucosamina en S. aureus, etc. Incluso una misma bacteria, dependiendo de las condiciones ambientales en las que se encuentre, puede producir distintos exopolisacáridos como componentes de la matriz de la biopelícula(10). Seguidamente, ocurre la co-agregación, que es el reconocimiento entre células, donde los organismos en la biopelícula pueden reconocer y adherirse a bacterias genéticamente distintas a través de adhesinas(19). Estas adhesinas reconocen proteínas, glicoproteínas o receptores de polisacáridos en las superficies, incluyendo otros tipos de células(19), dando como resultado una arquitectura única para cada biopelícula(20). Una etapa posterior implica la multiplicación y el metabolismo de los microorganismos que se unieron, lo cual va a resultar en una comunidad microbiana mixta estructuralmente organizada. Durante esta fase las características inherentes de los microorganismos y la naturaleza del micro ambiente, influencia el crecimiento y sucesión de la población dentro de la biopelícula(13). Finalmente, algunos microorganismos de la matriz de la biopelícula se liberan de la misma para poder colonizar nuevas superficies, cerrando así el proceso de formación de la biopelícula(10,13). La liberación de las bacterias desde la matriz es la fase de la que se tiene menos conocimiento(10). Este proceso de separación parece ser un proceso continuo durante todo el desarrollo de la biopelícula. Es probable que la separación localizada de organismos comience después de la adhesión inicial y se incremente con el tiempo, lo que esta relacionado con el número de microorganismos presentes en la biopelícula(13). La dispersión de células puede ocurrir por diferentes razones: liberación de células hijas debido a un crecimiento celular activo, separación como resultado de los niveles de nutrientes, liberación por señales del quórum sensing o por desprendimiento de agregados de la biopelícula por los efectos del flujo del medio ambiente en el que se desarrolla la biopelícula(3). Una vez que la biopelícula se ha establecido, la expresión de un número de adhesinas y factores de movilidad son suprimidos, sugiriendo que la función principal de las adhesinas, pilis, y flagelos es participar en la adhesión inicial; y una vez que el desarrollo de la biopelícula ha superado esta etapa, estas proteínas no son necesarias y su expresión es inhibida(1). El tipo y disponibilidad de nutrientes va a influenciar la biopelícula a través de su desarrollo, desde la formación inicial de la película adquirida, pasando por la adhesión de bacterias pioneras y la producción de la matriz, hasta la competición bacteriana en las últimas etapas de la acumulación(12). Como resultado final de todo este proceso, la composición de la biopelícula va a reflejar el resultado de la sucesión de microorganismos, resultante de la competición durante la adhesión(12). Cada una de las fases de la formación está expuesta a una variedad de factores físico-químicos como: pH, temperatura, osmolaridad, radiación, luz, tensión de oxígeno y todos los posibles cambios regulares o irregulares que ocurran con estos factores(3,14).
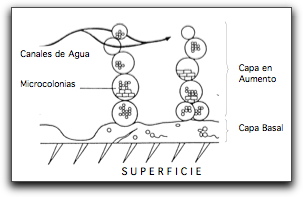
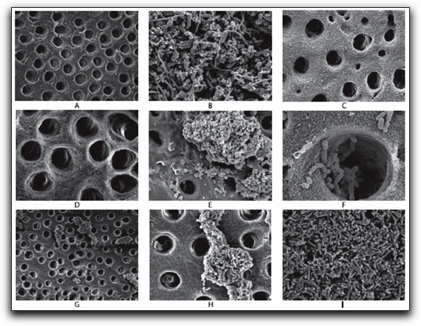
Estructura de la Biopelícula Cada comunidad microbiana en biopelículas es única, aunque algunos atributos estructurales pueden ser generalmente considerados universales. Lo primero que se debe resaltar en este sentido es que la unidad básica estructural de la biopelícula es la microcolonia, la cual facilita la proximidad entre las células, favoreciendo un ambiente ideal para la creación de gradientes de nutrientes, intercambio de genes y quórum sensing(3). Aunque la composición de la biopelícula es variable en función del sistema en estudio, en general, el componente mayoritario es el agua, que puede representar hasta un 97% del contenido total. Además de agua y de las células bacterianas, la matriz de la biopelícula es un complejo formado principalmente por exopolisacáridos(21). En menor cantidad se encuentran otras macromoléculas como proteínas, ADN y diversos productos procedentes de la lisis de las bacterias(10,21,22). Los microorganismos producen cantidades diferentes de polímeros extracelulares, los cuales aumentan con la edad de la biopelícula. Estos polímeros pueden variar en su composición física y química, pero principalmente están compuestos por polisacáridos(3). Para las bacterias Gram negativas estos polímeros son neutrales o polianiónicos, permitiéndole la asociación con cationes divalentes como el calcio o el magnesio, con los cuales se pueden enlazar con otras hebras de polímeros brindando una gran fuerza de unión en el desarrollo de la biopelícula. En el caso de las bacterias Gram positivas, la composición química de los polímeros extracelulares es muy diferente y es principalmente catiónico(3). Una característica importante de los polímeros extracelulares es que son altamente hidratados debido a que pueden incorporar grandes cantidades de agua dentro de su estructura por enlaces de hidrógeno, variando en su solubilidad y previniendo la desecación de la biopelícula(21). De igual manera, los biopolímeros son de suma importancia en las etapas tempranas y tardías de la formación de la biopelícula, así como en la agregación; en contribuir en la estabilidad mecánica de la estructura de la biopelícula y conferirle muchas de sus propiedades físicas, que les permite interactuar con otros polisacáridos, macromoléculas y células, así como con iones y solutos de bajo peso molecular, promoviendo una multitud de microambientes dentro de cualquier biopelícula(21). También se ha señalado, que los polímeros intervienen en la defensa permitiéndole resistir a las fuerzas de corte y a la fagocitosis por parte de las células de defensa(1). Se ha reportado que dichos polímeros podrían funcionar como un mecanismo para almacenar nutrientes durante tiempos de abundancia(1), aunque cuando ocurre un estado de inanición o la supresión de múltiples nutrientes, se pudiera inducir la degradación de las reservas intracelulares; cambios en la composición de los ácidos grasos de la membrana citoplasmática, síntesis de exoenzimas y cambios de baja a alta afinidad por los sistemas de transporte de los aminoácidos(12,23). La producción de polímeros extracelulares esta afectada por el estado de nutrientes del medio de crecimiento y por el crecimiento microbiano; donde un crecimiento lento, conlleva a aumentar la producción de polímeros extracelulares(3). Una vez que la biopelícula ha sido formada y la matriz de exopolisacáridos ha sido secretada por las células, la estructura resultante es altamente viscoelástica y se comporta de manera elástica(14). Un determinante ambiental lo representan las fuerzas mecánicas, en particular las fuerzas de corte; las cuales van a ser producidas por el agua que fluye de un extremo al otro de la superficie, removiendo secciones de la biopelícula y teniendo un efecto profundo sobre la estructura resultante, alisando la superficie. Este proceso está combinado con el desprendimiento activo de células desde la matriz(14). Cuando la biopelícula es formada en ambientes poco cortantes o con un flujo de poco movimiento, ellas tienen una baja resistencia a la tensión y son fácilmente rompibles; a diferencia de aquellas formadas bajo ambientes altamente cortantes que son marcadamente fuertes y resistentes a la ruptura mecánica, como por ejemplo la placa dental(2,9). La estructura de estas comunidades microbianas varía desde monocapas de células dispersas a espesas capas celulares, así como a estructuras mucosas de dimensiones macroscópicas(14). Durante los últimos años la estructura de la biopelícula ha sido documentada y evaluada por el uso de una extensa variedad de microscopios y técnicas físico-químicas y de biología molecular, revelando generalmente una estructura tridimensional compleja(14). Es de esta manera que se han descrito al menos tres tipos de estructuras en las biopelículas; la primera de ellas corresponde a la vista plana y tradicional característica de la estructura homogénea, denominada modelo de la biopelícula densa, la cual fue introducida por los investigadores dentales al estudiar la placa dental con microscopio electrónico de transmisión. Dichas observaciones mostraron numerosas microcolonias de bacterias de forma similar dentro de una estructura densa sin evidencia de canales de agua o poros atravesándola(11,12,24).
El segundo tipo de estructura se definió como el modelo del mosaico heterogéneo y fue descrito al estudiar el interior de las superficies de los sistemas de distribución de agua usando microscopio de contraste diferencial. Este modelo mostraba microcolonias juntándose en pilas sobre el sustrato, pero generalmente bien separada de sus vecinas(14,24).
Por último, el tercer tipo de estructura que tal vez represente el concepto actual de biopelícula, está denominado como el modelo tulipán o champiñón, o también llamado, modelo de los canales de agua; el cual fue descrito usando microscopia confocal con el uso de marcadores fluorescentes. Este modelo revela una estructura común no sólida, en forma de champiñón o tulipán con el tallo mas estrecho que su porción superior. Ésta estructura superior puede frecuentemente fusionarse, dejando galerías o canales a través de los cuales los fluidos ambientales pueden moverse, actuando como transporte de nutrientes, removiendo productos de desecho y actuando como conductos para moléculas mensajeras(3,10,14,24).
La existencia de estos canales no evita sin embargo, que dentro de la biopelícula podamos encontrarnos con ambientes variables en los que la concentración de nutrientes, pH u oxígeno es diferente. Esta circunstancia aumenta la heterogeneidad sobre el estado fisiológico en el que se encuentra la bacteria y dificulta su estudio(10). Es importante mantener una arquitectura para que la biopelícula sea funcional; en este sentido, Davey y col(25) en el 2003, descubrieron que ciertos microorganismos como Pseudomonas aeruginosa mantienen activamente la estructura tridimensional de su biopelícula a través de la liberación de moléculas surfactantes que evitan que otros microorganismos se atasquen en el sistema de canales de la estructura. La arquitectura de la biopelícula es heterogénea tanto en espacio como en tiempo, constantemente es cambiante debido a los procesos externos e internos y estando influenciada por la interacción con partículas del ambiente donde se desarrolle, por ejemplo como ocurre en el cuerpo humano, donde los eritrocitos y la fibrina se pueden acumular en el interior de las biopelículas(3). De la misma manera, la estructura final resultante va a estar influenciada por determinadas condiciones como las propiedades de la superficie y la interfase, la disponibilidad de nutrientes, la composición microbiana de la población y la hidrodinámia(9).
Metabolismo Microbiano en las Biopelículas Las células creciendo en biopelículas pueden ser diferenciadas de su contraparte planctónica por la producción de una matriz de polímeros extracelulares, una tasa de crecimiento disminuida, y una regulación de genes específicos(3). Los habitantes de las biopelículas son heterogéneos ya que lo microorganismos contenidos en el interior de las mismas pueden ser multi-especies o incluso multi-reinos, como por ejemplo aquellos involucrados en la caries dental; o ser de una especie como los involucrados en la endocarditis bacteriana. Incluso, en aquellas biopelículas formadas por una especie, su expresión genética es heterogénea, debido a la difusión limitada impartida por la biopelícula, que resulta en variaciones locales de pH, nutrientes, disponibilidad de oxígeno y concentración de metabolitos bacterianos(1). Estas variaciones locales crean microambientes a los cuales los microorganismos deben adaptarse para optimizar sus propiedades fenotípicas para ese ambiente en particular, difiriendo fenotípicamente de su contraparte planctónica(11); incluso, es probable que en una biopelícula en particular, se abrigue un número de fenotipos diferentes de una misma bacteria(13). No obstante, no se ha probado que la heterogeneidad de la biopelícula resulte en una división de las labores y que esto incremente la eficiencia metabólica de la población como un todo(1); sin embargo, el desarrollo de estos agregados de microorganismos es un proceso complejo que requiere del comportamiento colectivo de sus habitantes(9). Esta división de labores, es regulada a través de las comunicaciones intercelulares(1), que permiten el reconocimiento entre células y el intercambio de metabolitos, genes y diversas moléculas(19). Los miembros de estas comunidades mixtas tienen diferentes requerimientos y realizan diferentes funciones metabólicas pudiendo hacer del comensalismo un fenómeno generalizado en las biopelículas, por ejemplo, mientras los colonizadores tempranos de la cavidad oral son aerobios o anaerobios facultativos, la difusión limitada de oxígeno provee un nicho ambiental para la posterior colonización de los anaerobios obligados(1). La vitalidad de los microorganismos también varía a través de la biopelícula, con las bacterias más viables forrando los canales(13). Estos canales de agua proveen una oportunidad de cooperación metabólica a través del intercambio de nutrientes y metabolitos, mejorando la disponibilidad de los mismos y la remoción de aquellos potencialmente tóxicos(9). A través del trabajo cooperativo, los microorganismos alcanzan ganancias individuales(1), ya que pueden ocurrir interacciones beneficiosas a través de la excreción de metabolitos por parte de un organismo, que posteriormente puede ser usado como nutriente por otro diferente; o a través de la ruptura de un sustrato determinado por la actividad enzimática extracelular de un patógeno, lo que va a crear una disponibilidad biológica de sustratos para diferentes organismos(9,14,19). El comportamiento comunitario de los habitantes de la biopelícula puede incrementar la producción total, y es mucho más eficiente cuando la bacteria existe en pequeños grupos; tal vez explicando la formación de microcolonias característica de la biopelícula(1). En este mismo orden de ideas se ha reportado que un proceso similar a la apoptosis o muerte celular programada ocurre en las bacterias; sugiriendo que la muerte celular programada puede ocurrir dentro de las biopelículas. Este comportamiento conlleva a la reducción de la carga metabólica e incrementa la disponibilidad de nutrientes para los sobrevivientes(1). De acuerdo a lo señalado anteriormente, los microorganismos responden a las condiciones ambientales mediante la adaptación de su expresión genética por sus propias necesidades de supervivencia, por lo que es mucho más preciso referirse a las biopelículas como comunidades interactivas(1).
Mecanismos de Resistencia en las Biopelículas La producción de una enfermedad por parte de un microorganismo, requiere de la expresión temporal y coordinada de una serie de genes que le permiten al patógeno adaptarse al ambiente hostil que representa el hospedero. A través de la expresión de estos genes, se codifican productos frecuentemente denominados factores de virulencia, los cuales van a contribuir en su habilidad para sobrevivir, crecer y propagarse en el sitio de la infección(26). La producción de sus factores de virulencia va a estar controlada por el sistema de quórum sensing(17). La infección exitosa por parte de un microorganismo incluye una cadena de eventos en los cuales los patógenos deben adherirse y/o romper las barreras físicas del organismo, evadir los fagocitos y la respuesta inmune, crecer bajo condiciones donde los nutrientes son limitados y combatir en conjunto el ambiente hostil(26). Es por esta razón que la formación de biopelículas tiene particular relevancia clínica no sólo debido a la supresión de las defensas del hospedero, sino también a los esfuerzos terapéuticos para erradicarlos; incluyendo las medidas químicas y mecánicas de tratamiento(13). La habilidad de persistir por parte de los microorganismos en un medio inhóspito a través de la formación de biopelículas, se debe a su versatilidad metabólica y su plasticidad fenotípica(9). Ciertas bacterias pueden evolucionar y transcribir los genes requeridos para la síntesis de exopolisacaridos en respuesta a determinados estímulos ambientales que son encontrados al entrar en el hospedero, incluso antes de que el sistema inmune ataque específicamente(1). La biopelícula proporciona resistencia a sus habitantes, por ejemplo, los patógenos viviendo en estos agregados microbianos, resisten las fuerzas físicas, como aquellas fuerzas de corte producidas por el flujo de sangre o por la acción de limpieza de la saliva. De igual manera, pueden soportar privaciones de nutrientes, cambios de pH y radicales de oxígeno mejor que los organismos planctónicos; además de resistir a la fagocitosis; incluso, estos fagocitos que intentan atacar, pueden causar mas daño sobre los tejidos circundantes que a la biopelícula como tal(1,6,26). Sin embargo, el principal problema con la biopelícula es su conocida resistencia a los antimicrobianos(1,2,6,7,10,11,27,28). En este sentido, Lewis(27) definió la resistencia como la habilidad que tiene un microorganismo de crecer en la presencia de un nivel elevado de antimicrobiano; incluyendo en este término a los antibióticos, desinfectantes y germicidas(2,7). En este sentido, se ha señalado que la concentración necesaria de un agente antimicrobiano para matar a microorganismos planctónicos, debe ser aumentada de 10 a 1000 veces para tener la misma eficacia sobre los microorganismos dentro de la biopelícula(7,27,28). Agravando aún mas la situación, estas organizaciones microbianas proveen un nicho ideal para el intercambio de ADN extracromosomal (plásmidos), permitiéndole el trueque de determinantes para la resistencia antibiótica. El mecanismo utilizado para la transferencia de plásmidos es la conjugación, la cual ocurre en una frecuencia mucho mayor entre células creciendo en biopelículas que entre células planctónicas, debido a las mínimas fuerzas de corte y la gran cercanía entre las células(1,3). La característica que mejor distingue las infecciones crónicas relacionadas con biopelículas es su respuesta a los tratamientos antibióticos. Mientras que las infecciones agudas pueden ser eliminadas tras un breve tratamiento antibiótico, las infecciones por biopelículas normalmente no consiguen ser completamente eliminadas y producen episodios recurrentes(10,27), siendo menos susceptibles a los antimicrobianos y más resistentes a los mecanismos de defensa(11). Si bien las bases de la resistencia de los microorganismos que habitan en biopelículas se están aún investigando, entre las razones discutidas se incluyen: 1.- La barrera de difusión física y química a la penetración de los antimicrobianos que constituye la matriz de exopolisacáridos, retardando o disminuyendo la penetración dentro de la biopelícula(1,2,6,7,10,11,27,28). Las moléculas de los antimicrobianos deben difundir a través de la matriz de la biopelícula para inactivar o eliminar a las células encajonadas. Los polímeros extracelulares que constituyen ésta matriz, representan una barrera para la difusión de las moléculas a través de dos procesos; influenciando el índice de transporte de las moléculas al interior de la biopelícula o debido a la reacción del agente antimicrobiano con la matriz(2). Esta característica depende de la naturaleza de ambos, del antimicrobiano y de los polisacáridos extracelulares(7,9), así como de la interacción con la matriz, la concentración terapéutica del antimicrobiano y de la tasa de crecimiento de la microcolonia en relación con la tasa de difusión del antibiótico(7). Esto provee una resistencia efectiva contra moléculas de gran tamaño como antimicrobianos (proteínas) y complemento, y probablemente también contra moléculas pequeñas como ciertos antimicrobianos (péptidos) y numerosas defensinas y sus análogos(27). Los polisacáridos extracelulares al tener carga negativa son muy efectivos en proteger a las células de los antibióticos aminoglucósidos que son de carga positiva, restringiendo su penetración, posiblemente al unirse entre ellos. En el caso de las moléculas antimicrobianas pequeñas, la matriz de polisacáridos solo pospondría la muerte de la célula más que proporcionar una protección útil, como por ejemplo el caso de las fluoroquinolonas(27). Sin embargo hay un sinergismo entre difusión, retardo y degradación del antimicrobiano. La difusión restringida puede proteger a la biopelícula de un antimicrobiano degradable; en tanto que la difusión retardada disminuye la concentración de antimicrobiano que penetra, facilitando que enzimas como las B-lactamasas destruyan el antibiótico entrante. Por estas razones es de esperar que las células que habitan en biopelículas sean capaces de crecer en la presencia de antimicrobianos(27). También se ha señalado que los polisacáridos extracelulares no solo protegen a la célula contra la penetración del antimicrobiano, sino también de radiación UV, cambios de pH, células blancas, protozoarios, cambios osmóticos y desecación(6,7,9,29). A pesar de que la gran mayoría de los autores coinciden en que los polisacáridos brindan protección a las células dentro de la biopelícula, Sutherland(21) señala que este es un aspecto en el cual es imposible realizar cualquier generalización. Si bien existen ciertos reportes de que los exopolisacaridos interactúan con los agentes antimicrobianos y protegen a las células, bien sea evitando el acceso del componente o por reducir efectivamente su concentración, sus efectos protectores son probablemente limitados, más bien referidos al mantenimiento de una capa altamente hidratada alrededor de la biopelícula, evitando de esta manera la desecación letal y variaciones de la humedad. 2.- El crecimiento lento de los microorganismos dentro de la biopelícula debido a la limitación de nutrientes(1,2,7,10,11,27,28). Aquellas células que se encuentren en las capas más profundas de la biopelícula, tienen menos acceso a los nutrientes y por lo tanto su crecimiento será mas lento(7). Virtualmente todos los antimicrobianos son mas efectivos en matar rápidamente células en crecimiento, por ejemplo, las penicilinas y ampicilina no actúan sobre células que no estén en crecimiento y la tasa de muerte de microorganismos es proporcional a la tasa de crecimiento. Algunos de los más avanzados ?-lactámicos como cefalosporinas, aminoglucósidos y fluoroquinolonas pueden matar a células que no estén en crecimiento, pero incluso así, siguen siendo mucho más efectivos en eliminar rápidamente células que están en crecimiento(27). Por esta razón indudablemente el crecimiento lento contribuye a la resistencia de la biopelícula y es el principal factor en el incremento de la resistencia en comparación con las bacterias planctónicas(27). 3.- La existencia de microambientes que antagonizen con la acción del antibiótico(10,27,28). 4.- La activación de respuestas de estrés que provocan cambios en la fisiología de la bacteria y la aparición de un fenotipo específico de la biopelícula(1,2,6,7,10,11,27,28). La plasticidad en estructura y fisiología de las células bacterianas, les permite realizar rápidos cambios fenotípicos, no solo en respuesta a su estatus nutricional y tasa de crecimiento, sino también a cambios en la temperatura, pH y a la exposición de concentraciones subefectivas de antibióticos(7). Esta respuesta incluye cambios en una amplia variedad de componentes celulares (incluyendo proteínas, ácidos grasos y fosfolípidos asociados con la pared celular) y la producción de enzimas y polisacáridos extracelulares(7). Los microorganismos en biopelículas podrían no expresar el sitio de unión a la droga o usar una vía de metabolismo distinta a la bacteria planctónica(13). La presencia de concentraciones sub-inhibitorias del agente antibiótico dentro de la biopelícula, provee presiones selectivas para el desarrollo de fenotipos más resistentes y para la selección y expresión de plásmidos de resistencia. Estas concentraciones inefectivas de antibiótico, además de poder ser generadas por la poca penetración del mismo a través de la matriz, también pueden ser causadas por una disminución en la susceptibilidad de la pared celular(7). 5.- Producción de células persistentes(27). La mayoría de las células en la biopelícula, no son necesariamente mas resistentes a los antimicrobianos que las células planctónicas y, pueden morir rápidamente cuando son tratadas con antibióticos bactericidas que atacan a células que crecen lentamente(27). Las células persistentes sobreviven al antimicrobiano, y son de hecho, mantenidas por la presencia del mismo que inhibe su crecimiento; es decir, paradójicamente, el medicamento ayuda a la perseverancia de éstas células persistentes(27). Existe la posibilidad de que las biopelículas produzcan más células persistentes que las poblaciones planctónicas, sin embargo, éste no parece ser el factor principal en la mejor supervivencia de células cuando se compara con células planctónicas en vivo(27). La presencia de las células persistentes, puede explicar la necesidad de terapias combinadas con drogas no relacionadas que juntas probablemente las erradicarían. La aplicación de antibióticos bactericidas erradicarían la mayor parte de la población, dejando solo pequeñas fracciones de sobrevivientes persistentes. Si la concentración del antibiótico temporalmente disminuye, o si los síntomas desaparecen debido a la erradicación de las células planctónicas, y la terapia es descontinuada, las células persistentes se reorganizan en biopelículas, la cual comienza a liberar nuevas células planctónicas. Esta dinámica explica las recaídas en las infecciones por biopelículas y la necesidad de una terapia antibiótica larga(27). Es importante considerar que cualquier agregado de células que potencialmente puedan restringir el acceso a las defensas del hospedero y que produzca al menos algunas células persistentes, pueden ser vistas como un modelo de infección recalcitrante(6,9,27). La terapia antibiótica estándar es solo capaz de eliminar las células planctónicas, dejando las formas sésiles que se propagan en el interior de la biopelícula y continúan la diseminación cuando la terapia es terminada(6,9,27). Además, estas infecciones son difícilmente resueltas por el sistema inmune, ya que los microorganismos dentro de la biopelícula liberan antígenos y estimulan la producción de anticuerpos(6,9). Esta respuesta inmune puede incluso causar daño en los tejidos vecinos debido a que los anticuerpos no pueden penetrar dentro de la biopelícula para resolver la infección, sino que se forman complejos inmunes en la superficie de la misma(6,9). El proceso exacto por el cual los organismos asociados a biopelículas producen enfermedad en el hospedero son pobremente comprendidos(2,3), sin embargo los mecanismos propuestos incluyen:
A pesar de que las biopelículas presentan una resistencia intrínseca a los antimicrobianos(1,27), existe un gran avance en las investigaciones del tratamiento de estas infecciones, ya que el descubrimiento de que un amplio número de organismos utilizan el quórum sensing para controlar la producción de sus factores de virulencia, ha hecho que este proceso sea un blanco atractivo para la terapia antimicrobiana; por lo tanto, al bloquear estas comunicaciones entre células, los organismos patógenos podrían volverse no patógenos al no poder desarrollar sus factores de virulencia(17).
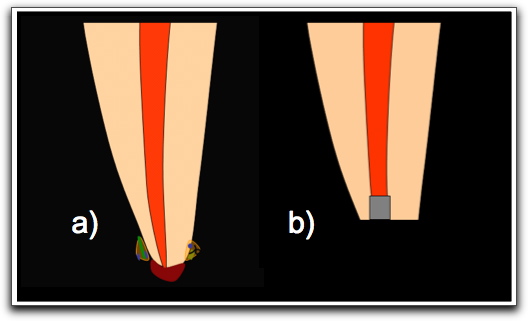
Biopelículas en infecciones endodónticas Formación de las Biopelículas en el Conducto Radicular y Área Perirradicular Los patógenos han desarrollado mecanismos que les permiten sobrevivir en un ambiente inhóspito(30), facilitándoles escapar de la acción de las células de defensa y del sistema del complemento, evitando la destrucción por parte de los fagocitos, causando inmunosupresión e induciendo la proteolísis de los anticuerpos(31). El modo de crecimiento en biopelículas es una estrategia de supervivencia de los microorganismos a las condiciones ambientales adversas(30,32). Sin embargo, en lo que concierne a las infecciones endodónticas, el concepto de la biopelícula microbiana ha ganado atención limitada a pesar de que es probable que tenga implicaciones clínicas importantes; especialmente desde el punto de vista del tratamiento(13). Dichas agregaciones bacterianas han sido observadas sobre las paredes de los conductos infectados(33,34), sugiriendo que los mecanismos de formación de las biopelículas pueden existir dentro del espacio del conducto radicular. En efecto, las biopelículas han sido experimentalmente producidas en el interior de conductos de dientes extraídos con mezclas de bacterias anaerobias o cultivos puros de Enterococcus faecalis(35,36). También han sido señaladas como la causa de periodontitis apical resistente al tratamiento(37,38,39). Es razonable asumir que la precondición para la formación de la biopelícula en el conducto radicular varía dependiendo de la causa de la destrucción de la pulpa. Una isquemia por trauma, que conlleva a una necrosis, es probable que tenga pre-requisitos totalmente diferentes para la fase de colonización que aquellas pulpas expuestas por caries(13). En este último caso, la infección del espacio pulpar puede sobrepasar las defensas y causar pulpitis, necrosis pulpar, e incluso progresar a una enfermedad periapical inflamatoria(40). La necrosis provee un ambiente favorable para la proliferación microbiana debido a la presencia de residuos orgánicos o nutrientes, que van a actuar como sustrato(41), promoviendo un hábitat selectivo para que los microorganismos crezcan en biopelículas sésiles(42). El tipo y concentración de nutrientes, pH y productos tóxicos del metabolismo celular van a influenciar el establecimiento de estas microcolonias dentro del conducto radicular(34). La lesión inflamatoria apical puede proveer el vehículo fluido por el cual los organismos planctónicos invaden y pueden multiplicarse y comenzar la adhesión a las paredes del conducto(13). Esta presencia de suero es esencial para la adhesión de las células bacterianas, así como para la interacción entre las células y la superficie. Además, las propiedades fisicoquímicas de la superficie del microorganismo es otro factor que influencia la adhesión microbiana a la superficie del sustrato(43).
A pesar de que se cree que la fase fluida para la agregación de estos microorganismos en biopelículas, puede ser el exudado derivado de la lesión inflamatoria subyacente; los conductos no siempre se encuentran llenos de fluidos y en los casos de dientes con pulpas necróticas frecuentemente los conductos aparecen secos en la entrada, al menos en su porción coronal. De allí la pregunta de cómo la condensación de bacterias en biopelículas pueden ser desarrolladas en sitios alejados de donde se encuentran las proteínas derivadas del hospedero y las sustancias producidas por bacterias que pueden proveer un adecuado prerrequisito(13). Las bacterias forman biopelículas primero sobre las paredes del conducto radicular, pero también en conjunto con los tejidos remanentes en el conducto(44). No obstante existe poco conocimiento sobre el modelo por el cual se unen a las paredes del conducto y progresan en la destrucción de la pulpa para la formación de biopelículas(13). Sin embargo, se conoce que después de la primera adhesión, se va a formar rápidamente una capa de biopelícula sobre la superficie(45). La capacidad de los patógenos para formar biopelículas depende de los atributos de la superficie y pueden variar de acuerdo a las condiciones ambientales y nutricionales prevalecientes(46). Esta premisa fue soportada por los hallazgos de George y col(32) en el 2005, quienes observaron la formación de biopelículas maduras de E. faecalis con aparentes canales de agua bajo condiciones de anaerobiosis y rico en nutrientes. Cuando este microorganismo crece en condiciones de aerobiosis y en un ambiente rico en nutrientes, se evidenció la formación de una biopelícula amorfa irregular. La examinación de biopelículas formadas bajo un ambiente aerobio y limitado de nutrientes, mostró señales de degradación de la superficie dentinal y calcificación de la biopelícula con células bacterianas viables adheridas a estas estructuras. Lo mas destacado de estos resultados es la capacidad de E. faecalis de resistir largos períodos de inanición y la sugerencia de que la alteración en el microambiente del conducto radicular como sucede en el tratamiento endodóntico, puede estimular la calcificación de las biopelículas, lo que implica que la mineralización de la matriz brinda un refugio a los microorganismos viables(32). Hay muchos beneficios para el estilo de vida comunitario de la bacteria en una biopelícula, por ejemplo, las bacterias funcionando juntas en estas agregaciones son capaces de degradar nutrientes molecularmente complejos que no podrían ser eficientemente degradados por una bacteria individualmente(13). De igual forma, el sinergismo bacteriano es crucial para la adaptación bacteriana al estrés del ambiente. En conductos radiculares, los organismos prevalecientes pueden evitar los efectos letales de la preparación químico-mecánica y de la medicación intraconductos por medio de la adherencia a las superficies disponibles formando biopelículas(13). Si los microorganismos en el sistema de conductos radiculares cooperan como verdaderos compañeros debe ser investigado. Sin embargo, esto explicaría porque la poblaciones de biopelículas en los conductos sobreviven períodos de inanición y se recuperan rápidamente luego del incremento en el suplemento de nutrientes(13). Durante estos períodos de inanición, la bacteria modifica sus demandas nutricionales, por lo que limitará la cantidad de nutrientes que ellos requieren, de manera de guardar la energía usada para el metabolismo(47), facilitándole su supervivencia por largos períodos de tiempo(30,47). Las señales del quórum sensing son conocidas por estar involucradas en la regulación de varias propiedades microbianas, incluyendo la virulencia y la habilidad de formar biopelículas(13,17). Debido a que muchos microorganismos orales encontrados en los conductos radiculares; por ejemplo: S. gordonii, Streptococcus mitis, Porphyromonas gingivalis, Fusobacterium nucleatum y Prevotella intermedia poseen la habilidad de comunicarse a través de quórum sensing, es probable que dichas señales moleculares operan como un factor ambiental adicional que altera la expresión genética para optimizar las propiedades fenotípicas de las bacterias en las biopelículas radiculares(13). La expresión de estas respuestas adaptativas aumentan cuando los microorganismos se establecen en comunidades, haciendo posible que bacterias de rápida adaptación se reproduzcan e inicien la formación de biopelículas. En estos agregados microbianos, aun las bacterias relativamente mas susceptibles, son capaces de sobrevivir y pueden potencialmente participar en los fracasos endodónticos(47). Los eventos que siguen esta penetración inicial de la pulpa pueden ser especulados por el poco conocimiento de cómo los microorganismos se unen y extienden a lo largo del conducto radicular. Posiblemente, lo primero luego de la formación de la biopelícula, es que el proceso infeccioso gane suficiente poder para causar la subsiguiente destrucción de los tejidos pulpares(13,44). En algún punto en el proceso de destrucción, se llega a un estado estable donde la masa de bacterias es contenida por los mecanismos de defensa del hospedero, bien sea dentro del conducto radicular, cerca del foramen, en el propio foramen, o en la superficie radicular externa, incluso, los microorganismos pueden separarse de esta posición y ocasionalmente coagregarse en la lesión per se(13). Con la progresión de la infección pulpar, los microorganismos y sus productos que estaban inicialmente contenidos en el lúmen del conducto, invaden la totalidad del sistema de conductos radiculares(41), incluyendo túbulos dentinarios(39,40), ramificaciones y cemento radicular(39), pudiendo ocasionar la resorción ósea y también la infección extrarradicular(38,39,41,48). Cuando la región periapical es colonizada por los microorganismos, el hospedero trata de eliminar la infección a través del sistema inmune(39). En este punto se pueden ocasionar resorciones en el cemento como producto de la reacción inflamatoria, promoviendo la formación de un nicho microbiano(39,48), donde los microorganismos pueden ordenarse y organizarse ellos mismos en asociaciones y producir una capa de polisacáridos, la cual va a ser la responsable de su resistencia a los medicamentos intraconducto, a las defensa del organismo y a los antibióticos, consolidando de esta manera la placa bacteriana periapical o biopelícula periapical(38,39).
Por otro lado, los microorganismos pueden ser capaces de sobrevivir a los procedimientos de desinfección mecánica, resistir a las medicaciones intraconductos y/o adaptarse a un ambiente en el cual la disponibilidad de nutrientes es limitada o escasa(30,43), pudiendo permanecer remanentes en un conducto adecuadamente obturado(43). No obstante, bajo estas condiciones, es difícil observar síntomas de infección en comparación con un conducto vacío o pobremente obturado; debido a que los microorganismos residuales que habitan los túbulos dentinarios apicales son frecuentemente confinados a un espacio reducido por los materiales de obturación (especialmente el sellador endodóntico) y no pueden crecer dentro del conducto radicular(43). Sin embargo, si el sellador es disuelto como resultado del contacto con fluidos, se van a formar intersticios y a aportar nutrientes para el crecimiento microbiano, favoreciendo la formación de biopelículas(30,43). En dientes sobre-obturados, el sellador alrededor del foramen apical podría no solidificar y por consiguiente disolverse prontamente por el contacto con el fluido periapical. Los microorganismos remanentes pueden colonizar el espacio dejado por el sellador y consecuentemente formar biopelículas extrarradiculares a través de la extrusión de gutapercha(43).
La presencia del fluido intersticial facilita la adherencia de los microorganismos y la subsecuente formación de biopelículas extrarradiculares, favoreciendo la supervivencia de los microorganismos en un ambiente inhóspito y manteniendo la patología periapical(43). De igual forma, la presencia de un tracto fistuloso va a permitir una comunicación entre el ambiente interno y externo; aportando nutrientes y especies mas resistentes al nicho microbiano interno, siendo fundamentales para el mantenimiento de la infección periapical(39).
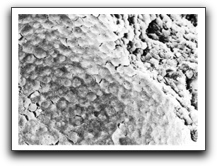
Evidencia de Biopelículas en las Infecciones Endodónticas La cavidad oral es una fuente abundante de microorganismos que pueden colonizar el sistema de conductos radiculares después de la pérdida de la vitalidad pulpar, sin embargo hay poco conocimiento sobre la formación de las biopelículas en las infecciones endodónticas(13). Posiblemente la primera identificación de biopelículas en conductos infectados se deba a Nair(33) en 1987. El examinó con microscopio electrónico de transmisión, los conductos radiculares de 31 dientes no tratados endodónticamente que tenían caries coronal y en los cuales el proceso inflamatorio periapical estaba unido al diente en el momento de la extracción. El notó, que todos los dientes mostraron bacterias en los conductos radiculares, consistiendo dicha microbiota de cocos, bacilos, filamentos y espiroquetas. El mayor número de microorganismos aparecían suspendidos en lo que él sintió que era el conducto húmedo, sin embargo se observaron densos agregados microbianos adheridos a las paredes del conducto, formando una capa delgada de condensaciones de bacterias, dando la estructura en empalizada de las placas de bacterias adheridas a la superficie de los dientes(33). La organización de la flora en este patrón y la relación con las paredes dentinarias, fue interpretado como un fenómeno de adherencia microbiana, en tanto que el material amorfo que se encuentra ocupando el espacio interbacteriano fue interpretado como una matriz extracelular de origen bacteriano(33).
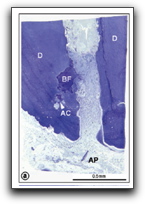
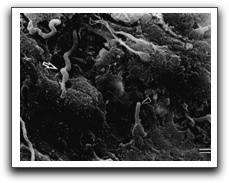
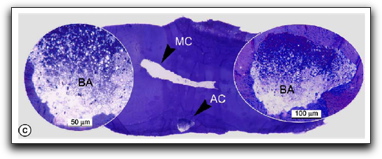
Posteriormente, Tronstad y col(37) en 1990, realizaron el primer reporte de infección extrarradicular al examinar, con microscopio electrónico de barrido (SEM), la superficie de un diente resistente al tratamiento endodóntico. Al mismo, se le realizó la remoción del extremo radicular durante el tratamiento quirúrgico. Los autores notaron una placa bacteriana que se encontraba en áreas aisladas, en las irregularidades de la superficie radicular; entre las fibras y las células, y entre las criptas y los agujeros. Las bacterias estaban embebidas y unidas entre ellas por varias cantidades de material extracelular, lo que hacía difícil distinguir las células individualmente, aunque claramente estaba dominada por cocos y bacilos. En las áreas en las que existía poca cantidad de material extracelular, se pudieron reconocer una gran variedad de formas microbianas, cocos, bacilos y formas fibrilares con cocos adheridos a su superficie(37). La presencia de las bacterias embebidas en esta matriz podría indicar que el origen de este material extracelular es de origen bacteriano; así como también, ser el resultado de una respuesta del hospedero a los organismos invasores; sin embargo, es importante tener en cuenta las similitudes de esta matriz con el material estructural observado en la placa dental(37). Los polisacáridos extracelulares que conforman la matriz, proveen una reserva de sustrato para las bacterias, siendo importante para la supervivencia y el crecimiento continuo fuera del conducto radicular, así como representar una barrera de difusión, lo cual pudiera ser una razón para la difícil erradicación de las bacterias extrarradiculares mediante la antibióticoterapia sistémica(37).
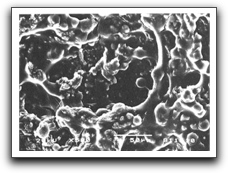
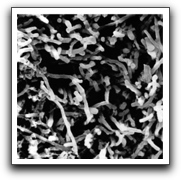
Molven y col(34) en 1991, confirmaron los hallazgos previos de Nair(33), al evaluar los 2 mm más apicales de doce raíces con enfermedad periapical usando SEM. Dentro de dos conductos radiculares observaron un depósito parecido a una placa de bacterias en múltiples capas, embebidos en una matriz de polímeros extracelulares, probablemente de origen bacteriano. También se encontraron múltiples formas microbianas, destacando la asociación entre los cocos y las formas filamentosas, estructuras denominadas mazorca de maíz, las cuales son descritas para la placa dental.
Lomcali y col(48) en 1996, observaron la superficie apical de 17 raíces con lesiones periapicales crónicas, demostrables radiográficamente, con el uso de SEM. Se observaron zonas con lagunas resortivas en donde se encontraban algunas bacterias y levaduras, así como una placa bacteriana con múltiples capas de bacterias, embebidas en una matriz extracelular densa, ubicada principalmente alrededor del foramen apical principal. Los autores sugieren que bajo estas condiciones, las defensas del hospedero son incapaces de mantener a los microorganismos en el espacio del conducto radicular y que esta placa bacteriana con su estructura lisa puede ser un factor importante para el mantenimiento de la inflamación en los tejidos perirradiculares y por esta razón se debe poner especial atención en su eliminación(48).
Siquiera y Lopes(31) en el año 2001, observaron 26 dientes extraídos con lesiones periapicales asintomáticas, con el uso de SEM, evidenciando la presencia de cocos y bacilos suspendidos en el conducto radicular. En un solo caso se observó un denso agregado bacteriano en el foramen apical, compuesto principalmente por bacilos; en este mismo caso, el agregado bacteriano se extendió mas allá del forámen apical, donde se reconocieron otros morfotipos celulares además de los bacilos, incluyendo coagregaciones de cocos y filamentos, caracterizados en una estructura de mazorca de maíz, soportando las evidencias previas reseñadas por Molven y col(34).
La incidencia de biopelículas perirradiculares fue baja para este estudio (4%), concluyendo que la infección extrarradicular no es un hallazgo común en dientes no tratados con pulpas infectadas(31). Similares resultados fueron reportados por Walton y Ardjmand(49), quienes indujeron lesiones periapicales en monos, por exposición pulpar al medio oral. Luego de 7 meses se seccionaron bloques incluyendo los dientes y los tejidos vecinos para ser procesados histológicamente, y en ninguno de los casos observaron bacterias en la lesión per se o en la superficie radicular externa. En contraparte, Noiri y col(38) examinaron la participación de biopelículas extrarradiculares en periodontitis apicales persistente, evaluando seis dientes y cinco puntas de gutapercha extruída en la región periapical con el uso del SEM. En nueve de las once muestras observadas, se encontraron biopelículas bacterianas en la región extrarradicular. La superficie de la gutapercha estaba cubierta con una estructura similar a un glicocáliz, en tanto que formas filamentosas, bacilos alargados y espiroquetas fueron las formas más predominantes en los sitios extrarradiculares. En algunos puntos se observó la emigración de células planctónicas del glicocáliz(38).
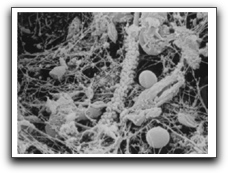
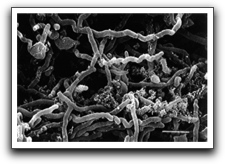
En los dientes extraídos, la biopelícula consistió de bacterias y una estructura similar a glicocáliz sobre la superficie dentaria(38).
Estas estructuras que se encontraron tanto en la gutapercha como en la superficie externa de los dientes, tuvieron que ser formadas con cierto tiempo, lo que sugiere que estas estructuras no son el resultado de contaminación bacteriana durante el proceso de toma de muestra y preparación de los especímenes, soportando que las biopelículas extrarradiculares están relacionadas con la periodontitis apical persistente(38). Similares hallazgos fueron reportados por Leonardo y col(41) en el 2002, quienes evaluaron la presencia de biopelículas bacterianas sobre la superficie externa de los ápices radiculares, en dientes con necrosis pulpar con y sin imagen periapical evidenciable radiográficamente y en dientes con pulpa vital. Las raíces fueron seccionadas y los ápices radiculares (aproximadamente 3 mm) fueron procesados con SEM. No se observó la presencia de microorganismos ni biopelículas en los dientes que presentaban pulpa vital y necrosis pulpar sin periodontitis apical evidenciable radiográficamente, en tanto que en los dientes con necrosis pulpar con lesión periapical evidenciable en la radiografía, las biopelículas apicales estuvieron siempre presentes.
Una nueva forma de colonización microbiana que evidencia la presencia de biopelículas en las infecciones endodónticas, fue reportada por Sunde y col(50) en el año 2002, quienes evaluaron la microbiota periapical de 36 dientes con periodontitis apical refractaria. Ninguno de los dientes respondió al tratamiento endodóntico convencional con medicación intraconducto con hidróxido de calcio por un período de 6 meses; incluso 8 de los pacientes recibieron antibioticoterapia sistémica. Aproximadamente la mitad de las bacterias (51%) fueron anaerobias, donde la flora periapical fue constituida principalmente por especies Gram positivas (79.5%). El hallazgo más sobresaliente de este estudio fue la presencia de los denominados gránulos de azufre, en el tejido de granulación periapical de nueve de las 36 lesiones. En estos gránulos se aislaron distintas especies de Actinomyces: A. israelii, A. viscosus, A. naeslundi y A. meyeri en conjunto con otras especies bacterianas Gram positivas y Gram negativas(50).
El examen con SEM mostró que los gránulos estaban empaquetados con microorganismos, donde las formas bacilares eran predominantes y las espiroquetas eran frecuentemente observadas. En muchos gránulos se observó una matriz extracelular amorfa entre las células, dándole a los gránulos la apariencia de una biopelícula; incluso algunos se sentían duros al tacto y la matriz extracelular estaba parcialmente mineralizada(50). El examen con el microscopio electrónico de transmisión mostró un material extracelular que estaba envolviendo a las células bacterianas. Los autores concluyen que las especies de Actinomyces tienen un papel importante en el desarrollo de los gránulos de azufre en los granulomas periapicales, siendo unas bacterias pioneras para la posterior adhesión y establecimiento de otras bacterias en ese sitio, para formar biopelículas en la forma de gránulos en los tejidos(50).
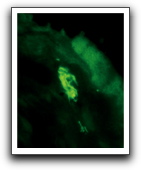
Posteriormente, estos hallazgos fueron soportados por Sunde y col(51) un año después, al evaluar 39 lesiones periapicales usando la hibridización fluorescente in situ (FISH) en combinación con microscopía confocal; evidenciando que frecuentemente los organismos con diferentes morfologías parecían coagregarse, formando pequeños ecosistemas en los tejidos.
Ferreira y col(39) en el 2004, examinaron la superficie del ápice de un diente resistente al tratamiento de conductos, que fue removido durante el tratamiento endodóntico quirúrgico. El diente presentaba fístula y una lesión periapical asociada persistente, luego de un año de tratamiento con medicación intraconducto con hidróxido de calcio, el cual fue recambiado en varias oportunidades. La identificación con SEM mostró cocos y formas fúngicas, y evidenció que alrededor de las resorciones y la dentina del foramen lingual estaban totalmente cubiertas con una sustancia que asemejaba a polímeros extracelulares, la cual enlazaba los microorganismos. Lejos del foramen apical, la dentina tenía una apariencia normal sin evidencia de biopelículas o matriz. La presencia del trayecto fistuloso permite una comunicación entre el ambiente interno y externo; aportando nutrientes y especies mas resistentes al nicho microbiano, siendo fundamentales para el mantenimiento de la infección periapical(39).
Nair y col(42) en el 2005, examinaron histológicamente los 3 milímetros apicales de la raíz mesial de 16 molares mandibulares que presentaban periodontitis apical primaria y que fueron obturados en una sola sesión y posteriormente removidos quirúrgicamente. La evaluación mostró infección residual en el conducto radicular después de la instrumentación, irrigación con antimicrobianos y obturación. Las bacterias se encontraban principalmente formando biopelículas en zonas inaccesibles como los istmos interconductos y conductos laterales y accesorios en 14 de los 16 dientes estudiados.
De acuerdo con estos hallazgos, los microorganismos que habitan en biopelículas en zonas inaccesibles del sistema de conductos radiculares no pueden ser removidas por la instrumentación e irrigación en una sola sesión, demostrando la importancia de la aplicación de todas las medidas químico-mecánicas no antibióticas para tratar con dientes infectados y necróticos, con la finalidad de interrumpir las biopelículas y reducir la carga microbiana intrarradicular al nivel más bajo posible, para esperar un pronóstico favorable del tratamiento de conductos a largo plazo(42). Estos datos sugieren que la frecuencia y las condiciones bajo las cuales las biopelículas ocurren, no son bien entendidas, no obstante, juzgando por los pocos casos publicados, la infección masiva del sistema de conductos radiculares parece ser una pre-condición importante, por ejemplo, después de exposiciones prolongadas por caries, conductos pobremente tratados o tractos fistulosos. Si bien el origen no es claro, el común denominador para estas agregaciones bacterianas, es que ellas probablemente sean un problema clínico significante durante el tratamiento(13).
Microorganismos Implicados Las estrategias para combatir la infección del sistema de conductos radiculares, debe estar basado en el conocimiento de la microflora presente(52), ya que el éxito de la terapia endodóntica depende del control de la infección(53); si los microorganismos son resistentes a la terapia o a los mecanismos de defensa del hospedero y sobreviven dentro del conducto, pueden comprometer la reparación periapical(53). Es importante saber que la composición de la microbiota del conducto radicular encontrada en dientes no tratados, difiere de aquella encontrada después del fracaso del tratamiento(12,54); teniendo repercusión en la tasa de éxito encontrada para ambos casos(55,56,57,58). Las pulpas necróticas presentan una flora polimicrobiana, caracterizada por una amplia variedad de combinaciones bacterianas, promediando entre cuatro a siete especies por conducto, siendo predominantemente anaeróbicos con iguales proporciones de bacterias Gram positivas y Gram negativas(54). En contraste, la microbiota detectada en dientes previamente tratados con periodontitis apical crónica, comprende una o dos especies, con predominancia de microorganismos Gram. positivos como Enterococcus faecalis, Actinomyces spp. Y Propionibacterium spp., con aproximadamente iguales proporciones de facultativos y anerobios estrictos(52). También se ha descrito la presencia de especies fúngicas como Candida albicans(59,60). Esta discrepancia en la composición de la flora puede ser el resultado de las diferencias en la presión selectiva que existe en pulpas necróticas infectadas contra la que existe en conductos previamente tratados(53), además, se considera que las bacterias anaerobias facultativas son consideradas mas difíciles de eliminar del conducto infectado debido a que son menos susceptibles a las medicaciones antimicrobianas que los anaerobios obligados(47,52,53). Si bien es importante conocer la flora del conducto, en vista de su repercusión sobre el éxito del tratamiento, las muestras microbiológicas usualmente solo identifican microorganismos en el conducto principal, siendo improbable la toma de muestras más allá del punto final de la preparación y obturación, conductos laterales, ramificaciones apicales, istmos y túbulos dentinarios. Los microorganismos pueden encontrarse en estas zonas inaccesibles formando biopelículas, lo que puede conllevar a la persistencia o desarrollo de la periodontitis apical(61). En este sentido, se ha señalado que la capacidad de formación de biopelículas no parece estar restringida a ningún grupo específico de microorganismos y se considera que bajo condiciones ambientales adecuadas todos los microorganismos son capaces de formarlas(10). No obstante, existen microorganismos que forman biopelículas con mayor facilidad y por lo tanto, deben ser consideradas más patógenos que aquellos menos capaces(62), debido a que los microorganismos viviendo en biopelículas son más resistentes a la terapia y a los mecanismos de defensa del hospedero(6,27,37,39,42). En los casos resistentes a la terapia endodóntica se han aislado frecuentemente varios microorganismos, siendo Enterococcus faecalis(47,50,63,64) y Candida albicans(60,65,66,67) unos de los más prevalentes. La naturaleza resistente de Enterococcus faecalis en las infecciones endodónticas ha sido bien documentada, ya que una vez establecidos en el conducto radicular son altamente resistentes al ambiente y a los tratamientos que buscan su erradicación(67). Enterococcus faecalis es uno de los organismos más interesantes relacionados a las enfermedades endodónticas postratamiento, gracias a una amplia variedad de factores de virulencia, entre las que se incluyen; la agregación, adhesión a la superficie, hormonas sexuales(68); producción extracelular de superóxido, gelatinasa y citolisinas tóxicas(63); rápidas fluctuaciones, y su capacidad para el intercambio de material genético(50) y de penetrar dentro de los túbulos dentinarios e incluso adherirse al colágeno en la presencia de suero humano(69). Este microorganismo también presenta una tolerancia innata a la alcalinidad que lo hace resistente a los medicamentos intraconductos(47,69); así como tener la capacidad de sobrevivir como un organismo único en el conducto radicular sin el soporte de otras bacterias(69). Sin embargo, una de las características principales que le permiten resistir a la terapia endodóntica es su habilidad para la formación de biopelículas(32,35,70,71). Candida albicans es una levadura oral que puede ser ocasionalmente aislada del conducto radicular, en casos de periodontitis apical persistente, tanto en cultivos puros o en conjunto con bacterias(60), y al igual que E. faecalis posee una variedad de factores de virulencia que le confieren su capacidad de sobrevivir incluso en la región periapical(72). Entre estos factores de virulencia se encuentra su habilidad para producir proteasas, la habilidad de crecer y predominar en un ambiente bajo en nutrientes(73), penetrar dentro de los túbulos dentinarios por adopción de un rango de modos de crecimiento(64), así como la adherencia, la formación de hifas y la producción de cambios fenotípicos cuando sean requeridos por el patógeno(66). Dentro del conducto radicular es probable que las condiciones ecológicas favorezcan el crecimiento y la coexistencia de levaduras y bacterias(66). Este patógeno tiene la capacidad de co-agregarse con una variedad de Streptococcus como S. gordonii, S. mutans y S. sanguis, los cuales pueden facilitar la formación de biopelículas complejas, promoviendo la colonización y supervivencia de ambos(65,66,74).
Susceptibilidad a la terapia endodóntica Los microorganismos han sido reconocidos por diversos autores como el factor etiológico primario en el desarrollo de las lesiones periapicales(38,59,75,76). La evidencia del rol de la infección microbiana data de la década de los años 60, cuando se demostró que la necrosis pulpar y la periodontitis apical no se desarrolla en animales libres de microorganismos; demostrando que la periodontitis apical con resorción ósea solo se desarrollará si la pulpa necrótica es invadida por microorganismos(75). Por esa razón, el propósito del tratamiento endodóntico es la eliminación de la infección del sistema de conductos radiculares y la prevención de la reinfección(59,77,78), sin embargo, bajo ciertas circunstancias el tratamiento endodóntico puede fallar en cumplir su objetivo(59). Existen factores locales y sistémicos que contribuyen al fracaso del tratamiento endodóntico(59). No obstante el factor decisivo que afecta el resultado del tratamiento de conducto a largo plazo, es la persistencia de microorganismos dentro del sistema de conductos radiculares(31,38,55,56,57,58,59,79), ya que van a representar un riesgo latente para que el tratamiento fracase y se perpetúe la inflamación perirradicular(30,55). Las posibilidades de aumentar un resultado favorable con el tratamiento de conductos son altas si se consigue que la infección sea erradicada efectivamente antes de que el sistema de conductos radiculares sea obturado(30,55), en caso contrario, los microorganismos se mantendrán viables en el conducto, existiendo un riesgo constante de que la inflamación perirradicular sea perpetuada(30,55). De acuerdo con esto, un pronóstico favorable para el tratamiento endodóntico depende de la eliminación exitosa de los microorganismos de los conductos radiculares infectados. En este sentido, Byström y Sundqvist(80) señalan que, la reducción de estos microorganismos se logra mediante la desinfección a través de una preparación o limpieza mecánica del conducto, en conjunto con una irrigación adecuada y la colocación de una medicación intraconducto. Si bien la combinación de estas medidas es comúnmente empleada durante el tratamiento de conducto, existe poca información sobre la eficacia individual de cada una de ellas(80,81). Chugal y col(81), añaden que un adecuado desbridamiento químico-mecánico, debe ser seguido por una adecuada obturación del sistema de conductos radiculares y la colocación de una restauración coronal permanente adecuada para evitar el crecimiento de los microorganismos que hayan quedado viables o evitar la reinfección por nuevos patógenos. Existen casos en los que se ejecutan todos los procedimientos a cabalidad, cumpliendo todos los estándares del tratamiento de conducto y todavía el éxito del mismo no se obtiene(30,31,39,60). Se ha sugerido que los resultados poco satisfactorios de los casos aparentemente bien tratados estén asociados con infección intra o extrarradicular, reacciones a cuerpo extraño y quistes verdaderos(30,31,61,82), no obstante, la persistencia de microorganismos parece ser la principal causa de fracaso en la mayoría de los casos(31,38,55,56,57,58,59,79). Estos microorganismos remanentes pueden encontrarse en las complejidades anatómicas de la morfología de los conductos radiculares como ramificaciones apicales, istmos y otras irregularidades, donde las bacterias pueden estar presentes en la forma de biopelículas(42), también pueden ganar acceso a la superficie externa del diente, donde forman biopelículas extrarradiculares para mantenerse viables(37,38,39). La principal consideración en cuanto al tratamiento de las biopelículas radica en que el clínico no puede determinar la presencia de las mismas en ningún caso clínico particular(30), y solo se podría sospechar de su presencia en casos refractarios al tratamiento de conductos(38). A continuación se van a reseñar los estudios que evalúan las posibilidades de eliminación de microorganismos, con cada una de las fases del tratamiento de conductos destinadas a la desinfección del mismo, haciendo hincapié en las posibilidades de erradicación de las biopelículas. Instrumentación Los microorganismos de los conductos infectados pueden estar dentro de los canalículos dentinarios en vecindad al espacio pulpar(83), pudiendo penetrar a una profundidad de 150 a 250 µm(84) y formar biopelículas en estas zonas(40,42), estando protegidos de los irrigantes y medicaciones utilizadas(84). El propósito de la instrumentación es remover esta capa de dentina infectada en conjunto con los microorganismos allí contenidos(61,78). Sólo un ensanchamiento del conducto de 300 a 500 µm más que su diámetro inicial puede remover la dentina infectada(84), no obstante, en algunos casos las bacterias pueden penetrar en zonas muy profundas y no ser removidas mecánicamente(83). Diversos autores han señalado la importancia de la instrumentación en la eliminación efectiva de microorganismos(80,85,86,87). Byström y Sundqvist(80) concluyen que la preparación biomecánica es la fase más importante del tratamiento de conducto ya que logra una reducción considerable de microorganismos sin usar irritantes antisépticos o medicaciones; a pesar de esto, señalan que hasta la limpieza más minuciosa deja bacterias en los conductos; por lo tanto, es necesario el uso de desinfectantes y medicamentos para remover exitosamente los microorganismos. Siqueira y Lima(87) reportan que la preparación biomecánica es capaz de eliminar hasta el 90% de las bacterias presentes en el conducto radicular independientemente de la técnica y del instrumental utilizado; mientras la preparación sea más amplia, se incorporan más irregularidades anatómicas disminuyendo el número de bacterias, no obstante en la práctica clínica la preparación del conducto depende de la dimensión y de la presencia de curvaturas, por lo que es recomendable el uso de irrigantes con propiedades antimicrobianas y medicación intraconducto para controlar la infección(85,87). En contraparte a lo señalado por los anteriores autores, Dalton y col(88), reportan que las posibilidades de obtener cultivos negativos usando una instrumentación con una solución irrigante inactiva, están alrededor del 28%. Las técnicas de instrumentación son efectivas en la remoción de la mayoría de los tejidos presentes en el conducto, pero difícilmente son capaces de limpiar el conducto totalmente. Esta inefectividad está relacionada con las complejidades anatómicas del conducto, tornándose inaccesibles a la preparación biomecánica, permitiendo el crecimiento bacteriano en estas zonas, aumentando así el riesgo de fracaso endodóntico(42,89).
La presencia de biopelículas intrarradiculares son clínicamente importantes porque tienen una resistencia inherente a los agentes antimicrobianos y no pueden ser removidas solo por la preparación biomecánica, causando el fracaso del tratamiento y la persistencia de la infección(41). La instrumentación mecánica de los conductos puede ayudar a interrumpir o desorganizar y exponer los microorganismos de las biopelículas a las soluciones irrigantes, pero al mismo tiempo puede producir una capa de desecho que aumenta el crecimiento de las células sobrevivientes(65). Sin embargo, existen zonas inaccesibles como ramificaciones apicales o conductos accesorios o laterales que van a permanecer no instrumentadas y fuera de la influencia de los irrigantes(61).
Es importante destacar que ninguna técnica de instrumentación disponible es capaz de remover toda la dentina infectada del conducto radicular(61); consecuentemente, es probable que algunos microorganismos permanezcan en los túbulos dentinarios y otras variantes anatómicas después de la instrumentación(61,90).
Soluciones Irrigantes El primer paso importante en la eliminación de los microorganismos en el conducto radicular es la irrigación con soluciones bactericidas efectivas(80). Para este propósito se han utilizado diversas soluciones irrigantes como hipoclorito de sodio, clorhexidina, derivados del yodo, ácido etilenendiaminotetraacetico (EDTA), ácido cítrico, agua oxigenada y MTAD®(77,78). La limpieza químico-mecánica es una estrategia de tratamiento donde el agente irrigante posee una función antimicrobiana y de disolución de tejidos para minimizar la cantidad de dentina infectada, remanente pulpar y el mayor número de microorganismos contenidos dentro del sistema de conducto radicular(66). En este sentido, Shuping y col(91), señalan que la instrumentación en conjunto con una solución bactericida como el hipoclorito de sodio incrementa las posibilidades de obtener un cultivo negativo en un 61.9%; estando en concordancia con los resultados de Waltimo y col(67) quienes reportan que con el uso combinado de ambos procedimientos se obtiene una eliminación de microorganismos entre el 80% y el 67%. Si bien existen múltiples estudios que evalúan la eficacia antimicrobiana de cada uno de los agentes irrigantes; en este capítulo se va a hacer referencia a aquellos estudios que hayan evaluado la actividad de las soluciones irrigantes sobre las biopelículas. En este sentido, Sen y col(45) en 1999 evaluaron las propiedades antifúngicas del hipoclorito de sodio al 1% y 5%, y la clorhexidina al 0,12% en raíces infectadas con densas biopelículas de Candida albicans. Los resultados de este estudio demostraron que en presencia de la capa de desecho, las soluciones mostraron ausencia de crecimiento hasta 1 hora después de tratamiento. Cuando la capa de desecho estaba ausente, los tres irrigantes demostraron una actividad antifúngica total en una hora Spratt y col(92) en el año 2001 evaluaron el efecto bactericida de la plata colidal, hipoclorito de sodio al 2.25%, clorhexidina al 0,2% y yoduro al 10% sobre biopelículas de monoespecies de E. faecalis, P. intermedia, P. micros, S. intermedius y F. nucleatum desarrolladas sobre filtros de membrana. El hipoclorito de sodio demostró ser el agente irrigante mas efectivo seguido del yoduro, siendo ambos 100% efectivos contra todos los microorganismos después de una hora de exposición; sin embargo, a partir de los 15 minutos se evidenciaban efectos bactericidas dependiendo de la bacteria en estudio. Estos autores concluyendo que el efecto bactericida de un agente en particular depende de la naturaleza del microorganismos en la biopelícula y del tiempo de contacto. También es importante destacar que los microorganismos dentro de las biopelículas responden de manera diferente dependiendo de su fase de crecimiento, la dosis y la frecuencia de exposición al agente antimicrobiano(92). Estos resultados fueron confirmados por el estudio de Abdullah y col(71) en el 2005, quienes investigaron la eficacia de ciertos irrigantes y medicamentos sobre Enterococcus faecalis creciendo en biopelícula, sobre filtros de membrana, y en su forma planctónica. Cada presentación de las bacterias fue expuesta a una solución saturada de hidróxido de calcio (pH 12.3), gluconato de clorhexidina al 0,2%, EDTA al 17%, yodo al 10%, e hipoclorito de sodio al 3% por diversos períodos de tiempo (1, 2, 3, 4, 8, 15, 30 y 60 minutos). Cuando las células se encontraban en suspensión planctónica, el 100% de los microorganismos fueron eliminados, luego de 1 minuto de exposición al hipoclorito de sodio, 15 minutos a la clorhexidina y 30 minutos al yodo. Cuando las bacterias crecieron en forma de biopelículas, se obtuvo la eliminación completa de microorganismos luego de la exposición al hipoclorito de sodio durante 2 minutos y al yodo durante 30 minutos. El hidróxido de calcio y la clorhexidina produjeron una reducción significativa de microorganismos luego de 60 minutos de exposición, en tanto que el EDTA produjo una reducción mínima de microorganismos luego de 60 minutos. Los resultados de este estudio demuestran que la eliminación de los microorganismos que crecen bajo la forma de biopelículas es mucho mas difícil que la forma planctónica in Vitro(71). Estos modelos de estudio usando filtros de membrana tienen limitantes debido a que permiten un contacto directo del agente en estudio con la biopelícula(71,92), a diferencia de aquellos que permiten el desarrollo de microoganismos en biopelículas dentro de dientes extraídos, ya que éstos simulan mejor las condiciones clínicas al dificultar el contacto entre el agente y la biopelícula, debido a las complejidades anatómicas(45,92). Clegg y col(36) en el 2006, evaluaron la efectividad antimicrobiana del hipoclorito de sodio a diferentes concentraciones, la clorhexidina y BioPure MTAD®, sobre biopelículas polimicrobianas cultivadas en hemisecciones de apices radiculares. Cada biopelícula fue inmersa separadamente en NaOCl al 6%, NaOCl al 3%, NaOCl al 1%, Clorhexidiona al 2% y NaOCl al 1% seguido de BioPure MTAD®. El análisis con microscopía de escaneado mostró que el hipoclorito de sodio al 6% y 3% fueron efectivos en interrumpir y remover la biopelícula; el NaOCl al 1% y el NaOCl al 1% seguido de MTAD® fueron efectivos en interrumpir la biopelícula pero no de eliminar las bacterias, en tanto que la clorhexidina al 2% no fue efectiva en la interrupción de la biopelícula. Al realizar cultivos de las muestras, solo el hipoclorito de sodio al 6%, la clorhexidina al 2% y el NaOCl al 1% seguido de MTAD® no mostraron bacterias viables; siendo el hipoclorito de sodio al 6% el único agente en remover físicamente la biopelícula y eliminar las bacterias. Este efecto antibiopelícula del hipoclorito puede ser el resultado de la remoción de tejido orgánico, eliminando las bacterias adheridas a la dentina y otros organismos(36). Es importante el uso de un agente que no solo tenga la cualidad de eliminar los microorganismos viables, sino también que sea capaz de eliminar físicamente la biopelícula y por lo tanto eliminar a las bacterias y sus componentes antigénicos como los lipopolisacáridos, peptidoglicanos y ácido lipoteicoico, que a pesar de que no este viable el microorganismo, puede desencadenar y perpetuar un proceso inflamatorio por inducir la liberación de mediadores de la inflamación(36). Incluso, la presencia de biopelículas remanentes no viables, pueden comprometer la obturación tridimensional del conducto, sobretodo si se va a usar un material de obturación a base de resina, ya que la biopelícula va a interferir con la adhesión a las paredes del conducto. Además, si las bacterias o las biopelículas degeneran después de la obturación, los espacios pueden resultar en un fracaso terapéutico(36).
Dunavant y col(93) para el 2006 compararon la eficacia del hipoclorito de sodio en distintas concentraciones (1% y 6%), la clorhexidina (2%), REDTA®, Smear Clear® y BioPure MTAD® contra biopelículas de E. faecalis creciendo sobre un sistema de flujo celular. Estos resultados confirman hallazgos anteriores donde el hipoclorito de sodio en sus dos concentraciones eliminó mas del 90% de E. faecalis creciendo en biopelículas. Un hallazgo interesante fue que SmearClear® demostró una significante actividad antibacteriana, incluso superior a la clorhexidina, REDTA® y BioPure MTAD®. Una posible explicación es que en la composición del SmearClear®, además del EDTA al 17%, contiene surfactantes catiónicos, los cuales potencialmente, podrían interrumpir la biopelícula. Se ha señalado que gracias a la sustantividad, el gluconato de clorhexidina puede inhibir la adherencia inicial y tal vez la fuerte acumulación de levaduras y otros microorganismos para la formación del biopelículas(66). No obstante, en ninguno de los estudios reseñados se demostró que este agente irrigante tuviera una efectividad superior para la eliminación de las mismas. También se ha reportado que la irrigación manual convencional es menos efectiva que la irrigación ultrasónica, al momento de remover detritus y bacterias de las extensiones del sistema de conductos radiculares que permanecen no instrumentadas, como istmos e irregularidades(94). Cualquier régimen de irrigación puede dejar bacterias y detritus en el conducto, sin embargo, con el uso del ultrasonido es mucho más efectivo el desbridamiento(61), ya que la energía ultrasónica vigoriza el agente irrigante(77), sin embargo no hay reportes del uso de vibración ultrasónica en la eliminación de biopelículas. Durante la irrigación de conductos infectados con biopelículas microbianas, la primera capa de microorganismos va ser afectada por las concentraciones relativamente altas de la soluciones irrigantes, ya que la matriz de la biopelícula va a evitar que la solución penetre a las capas profundas con una concentración suficiente; es por esta razón que la instrumentación ciertamente debe desorganizar la biopelícula y exponer los microorganismos a las soluciones irrigantes, no obstante, es bien conocido que los instrumentos endodónticos no tocan todas las áreas de los conductos radiculares, por lo tanto los patógenos pueden permanecer en el conducto y en los túbulos dentinarios(45).
Un punto importante durante la irrigación, es considerar el extender el tiempo de exposición de los agentes antisépticos para aumentar la eficacia antimicrobiana, ya que, por ejemplo, en el caso específico del hipoclorito de sodio, se ha comprobado que se incrementa su eficacia cuando se extiende el tiempo de trabajo dentro del conducto radicular(95). A pesar de los agentes antisépticos utilizados durante la irrigación, los microorganismos en biopelículas, pueden permanecer dentro del sistema de conductos radiculares, haciendo necesario la aplicación de una medicación intraconducto para tratar de reducir la cantidad de microorganismos al nivel más bajo posible(42).
Medicación Intraconducto En infecciones de larga data, los microorganismos invaden los túbulos dentinarios y conductos accesorios, donde se protegen del alcance de la instrumentación e irrigación, que son efectivas únicamente en las paredes del conducto(80); por esta razón es recomendable el uso de una efectiva medicación antibacteriana intraconducto cuando se sospeche la presencia de microorganismos dentro del conducto, para reducir al máximo el número de microorganismos y su sustrato, y evitar de este modo un posible fracaso endodóntico ocasionado por la persistencia de la infección(80,85,86,91). De acuerdo con Shuping y col(91), las posibilidades de obtener cultivos negativos después de una medicación entre citas con hidróxido de calcio por una semana es de alrededor del 92.5%. Una variedad de medicamentos han sido usados para este fin; hidróxido de calcio, glutaraldehido, clorhexidina, formocresol, yoduros de potasio, mezclas de antibióticos con o sin corticoides y componentes del fenol como: eugenol y paramonoclorofenol alcanforado (77,78). El hidróxido de calcio es el medicamento intraconducto de elección debido a que presenta un excelente efecto antibacterial en conductos infectados, disuelve tejidos necróticos remanentes, e inactiva endotoxinas(66,96). El efecto antimicrobial del hidróxido de calcio esta relacionado con su capacidad de liberar iones hidroxilo en un medio acuoso, sin embargo, los radicales libres en raras ocasiones difunden más allá de la masa del material(96). A su vez, la dentina tiene una capacidad buffer inherente que reduce el pH de las pastas de hidróxido de calcio; de esta manera el medicamento tiene un efecto letal limitado sobre las bacterias que se encuentran dentro de los túbulos dentinarios y otras áreas inaccesibles(61). También hay que tomar en cuenta que debido a las complejidades anatómicas de los dientes, existen zonas que permanecen no instrumentadas y ocupadas por detritus(61,94); bajo estas circunstancias, el hidróxido de calcio y otros desinfectantes no van a funcionar, ya que éstos solo actúan cuando están en contacto directo con los patógenos(96), y al no poder ocupar estas zonas, resultaran inefectivos(61). Aunado a esto, tenemos que cuando el hidróxido de calcio es aplicado como medicación de los conductos radiculares ocurre la alcalinización completa de los mismos(47). No obstante, este cambio alcalino no necesariamente es homogéneo a lo largo de la longitud del conducto radicular(97), y la lectura de pH más alto se va a registrar en la porción cervical y la más baja en la región apical(47). Las bacterias son capaces de soportar altos niveles alcalinos y pueden ser divididos en dos grupos: especies alcalofílicos y especies alcalotolerantes. Ambos tipos de microorganismos pueden crecer aun por debajo de un pH 10, pero las especies alcalofílicos son capaces de sostener pH neutros y de crecer en ambientes muy alcalinos, ya que su condición óptima de crecimiento es en un pH de alrededor de 9(47).
A su vez, en una comunidad de biopelícula, la supervivencia y la manera de adaptación a un pH extremo es más factible, ya que los microorganismos cuando son expuestos a un ambiente alcalinizado se coagregarán para alcanzar sus necesidades individuales de supervivencia(47). Chavez de Paz(47), en el año 2004, describe una situación hipotética donde las bacteria en una estructura similar a la biopelícula, podrían responder a un ambiente estresante. El efecto de estrés causado por la alcalinidad, incluye una respuesta de inducción y la activación de genes que codifican proteínas de estrés. Las Proteínas de estrés son multifuncionales y protegen a la célula bacteriana en contra de factores dañinos y favorecen la supervivencia. La respuesta de cada célula bacteriana se suma y provee efectos protectivos de beneficio para la entera comunidad microbiana.
El tratamiento prolongado con medicación intraconducto a base de hidróxido de calcio, es generalmente un método eficiente para obtener la desinfección del conducto radicular; sin embargo Sunde y col(50) reportaron la evaluación microbiológica y microscópica de 36 dientes y sus lesiones periapicales. A cada caso se le realizó un protocolo de irrigación con hipoclorito de sodio y EDTA, y la posterior medicación con hidróxido de calcio por un período de 6 meses. Luego de transcurrido este período de tiempo, no se encontró evidencia clínica y radiográfica de mejoría en ninguno de los casos, por lo que se realizó el tratamiento quirúrgico. La evaluación microscópica demostró la presencia de gránulos de azufre en el 25% de las lesiones, y sobre dichos gránulos se evidenció una matriz extracelular amorfa similar, dando una apariencia de biopelículas microbianas. En este sentido, Ferreira y col(39) reportan un caso de un diente con fístula y lesión periapical resistente al tratamiento. Durante el tratamiento de conductos se realizaron todos los esfuerzos para controlar la infección intraconducto, incluyendo instrumentación del foramen (permeabilización), irrigación con sustancias bactericidas y medicación intraconducto con hidróxido de calcio por tiempo prolongado (1 año). Sin embargo la infección persistió activa, por lo que se recurrió al tratamiento quirúrgico y se evaluó con SEM el ápice del diente, evidenciando que la infección no estaba en un sitio accesible a la preparación químico-mecánica y a los medicamentos intraconducto. Sólo la cirugía apical provee una efectiva desorganización o eliminación de los microorganismos causantes, promoviendo la reparación en casos difíciles, lo cual fue demostrable en el control a los 2 años donde se observó una reparación ósea exitosa(39).
Lima y col(98) en el 2001 evaluaron la efectividad de medicaciones basadas en clorhexidina y antibióticos en la eliminación de biopelículas de Enterococcus faecalis formadas sobre una membrana filtrada de nitrato de celulosa. Las medicaciones que contenían clorhexidina fueron capaces de eliminar mayormente las biopelículas al primer día de exposición, en tanto que para el tercer día mostraron una reducción significativa del número de células bacterianos en las biopelículas. La asociación de clindamicina con metronidazol redujo significativamente el número de células en las biopelículas al primer día, en tanto que la combinación de clindamicina con detergentes y gel no afectó significativamente la biopelícula, e incluso permitieron el crecimiento de bacterias. Los resultados de este estudio indican que la medicación con clorhexidina puede ser de suma importancia en la erradicación de la infección endodóntica asociada a dientes que no responden a la terapia endodóntica convencional(98). Posteriormente, Distel y col(35) en el 2002 pusieron a prueba la hipótesis de que E. faecalis resiste las medicaciones intraconducto utilizadas mediante la formación de biopelículas, infectando crónicamente el sistema de conductos radiculares. Para ello evaluaron con microscopio electrónico de barrido y microscopio láser confocal, dientes infectados con este microorganismo que estaban medicados con hidróxido de calcio. La observación con microscopio de barrido mostró que los dientes medicados con puntas de hidróxido de calcio fueron colonizados a los 2 días de la incubación, en tanto que los dientes medicados con el hidróxido de calcio en pasta mostraron biopelículas en un promedio de 77 días(35).
El análisis de los dientes medicados con pastas de Ca(OH)2 con el microscopio laser confocal, demostró colonización tanto de la superficie de la dentina como de la superficie del hidróxido de calcio. En un caso inoculado por 160 días, se evidenció la formación de las colonias típicas en forma de champiñón, características de una biopelícula bien desarrollada, demostrando un relación entre el tiempo de exposición a los microorganismos y la madurez en la formación de la biopelícula(35). Las estrategias para tratar infecciones por biopelículas dentro de los conductos radiculares incluyen la ruptura mecánica de la estructura multi-celular a través de la instrumentación y la disolución de la matriz de polímeros mediante la irrigación con hipoclorito de sodio y la medicación intraconducto con hidróxido de calcio(71). Sin embargo, es probable que los microorganismos puedan persistir dentro de los túbulos dentinarios y otras áreas inaccesibles luego de la instrumentación, irrigación y medicación intraconducto(61). No obstante, la supervivencia de los mismos sólo ocurre si ellos poseen patogenicidad, suficiente número y ganan acceso al área perirradicular(30).
Nuevas Estrategias en la Desinfección del Conducto Radicular Recientemente se ha introducido un nuevo producto para la irrigación de los conductos radiculares; el agua activada electro-químicamente, la cual surgió de manera prometedora debido a su capacidad de producir una superficie limpia(99,100), sin embargo, su capacidad antimicrobiana es inferior a la del hipoclorito de sodio(101). De igual manera, los efectos antimicrobianos del láser han sido evaluados y demostrados(77), y recientemente se ha utilizado la terapia fotodinámica para la eliminación de biopelículas(102,103,104,105,106,107,108). Esta terapia ha sido usada para el tratamiento del cáncer y otras enfermedades no malignas, y está basada en el concepto que agentes fotosensitivos no tóxicos sean localizados en ciertos tejidos y subsecuentemente activados por luz con una apropiada longitud de onda para generar oxígeno reactivo y radicales libres que son citotóxicos para las células del tejido blanco(109).
Seal y col(102) en el 2002, evaluaron la eficacia de la fotosensibilización letal combinando distintas concentraciones de fotosensibilizadores y dosis de luz láser, en la eliminación de las biopelículas en el conducto radicular. Ellos demostraron que, a pesar de que la terapia fotodinámica tiene un efecto bactericida, cuando es aplicado desde el acceso cavitario, no es tan efectivo como la irrigación con hipoclorito de sodio al 3%. En contraparte, Soukos y col(103) en el 2006, aplicaron azul de metileno seguido de la exposición de luz roja de 665nm durante 5 minutos sobre biopelículas de distintos microorganismos, usando una fibra óptica. Los resultados mostraron que el azul de metileno eliminó todas las bacterias a excepción de E. faecalis (55% de eliminación), sin embargo, cuando se combinó con la luz roja fue capaz de eliminar al 97% de las biopelículas de E. faecalis dentro de los conductos radiculares. Estos autores concluyen que la terapia foto dinámica puede ser desarrollada como un procedimiento adjunto para eliminar los microorganismos residuales luego del tratamiento endodóntico convencional. Estos resultados también fueron corroborados en un estudio in vitro sobre bacterias en estado planctónico, donde se demostró que la desinfección foto-activada tiene una actividad antibacteriana estadísticamente significativa(104). Los hallazgos de estos estudios in vitro han sido soportados por recientes estudios in vivo(106,107,108), en los que se señalan las ventajas de la terapia foto dinámica para la eliminación de bacterias remanentes, luego del uso de los irrigantes convencionales(106), así como en la combinación con agentes quelantes que interrumpan la biopelícula para que la desinfección foto-activada pueda eliminar los microorganismos embebidos(106,107). Esta técnica no invasiva ofrece ciertas ventajas en el caso de su utilización in vivo como son: aplicación rápida de la droga en el conducto radicular y rápida eliminación de las bacterias luego de un corto tiempo de tratamiento; penetración completa del agente fotosensible en las biopelículas y en los túbulos dentinarios; penetración y citotoxicidad limitada del agente fotosensible y de la luz sobre el ligamento periodontal y hueso adyacente, y ausencia de efectos térmicos sobre los tejidos que rodean las raíces(103). La desinfección foto-activada puede ser asumida como parte de la desinfección rutinaria del sistema de conductos radiculares; así como también tener el potencial para ser usada para la erradicación de infecciones endodónticas persistentes en los que los métodos convencionales han sido infructuosos(108). También se ha evaluado el potencial antimicrobiano del ozono en eliminar biopelículas de E. faecalis creciendo sobre un filtro membrana de nitrato de celulosa. El ozono tiene un efecto antibacteriano sobre las bacterias en estado planctónico pero muy poco efecto cuando estas están embebidas en la biopelícula, siendo su eficacia antibacteriana muy inferior a la del hipoclorito de sodio al 2,5%(110).
Discusión La formación de biopelículas en el interior del conducto radicular y en la superficie radicular externa del diente, tiene gran repercusión sobre el pronóstico a largo plazo del tratamiento instaurado(37,38,39,42,48), ya que perpetúan la condición tratada, y su desorganización y eliminación representa un gran reto para el profesional(13). El clínico no puede determinar la presencia de biopelículas en ninguna situación clínica en particular(30); aunque podría sospechar de su presencia en casos que no responden al tratamiento efectuado(38) y donde ha ocurrido una infección masiva del sistema de conductos radiculares, como después de exposiciones prolongadas por caries, conductos pobremente tratados y trayectos fistulosos(13). En vista de esto, cualquier diente a tratar debe ser considerado como potencial portador de biopelículas, y por lo tanto deben ser empleadas todas las medidas terapéuticas necesarias para controlar la infección. La instrumentación mecánica va a permitir la desorganización de la matriz de la biopelícula para la posterior acción de los agentes antimicrobianos(65), no obstante, los patógenos pueden estar en zonas inaccesibles o muy profundas donde no van a ser removidas(41,42,61,83,84,90). Si bien pudiéramos esperar que los irrigantes alcancen aquellas biopelículas ubicadas en zonas inaccesibles, los microorganismos allí embebidos van a estar protegidos por la barrera de difusión que representa la matriz de polisacáridos(1,2,6,7,9,10,11,27,28,37,45,111). Asumiendo que las concentraciones altamente efectivas de la solución irrigante pudieran alcanzar a los microorganismos más externos de la estructura y eliminarlos, probablemente aquellos que se encuentran en las zonas mas profundas seguirán viables(45,111), e incluso pudieran hacerse más resistentes(111). Por otra parte, no solo se requiere de la eliminación de los microorganismos embebidos, sino también de la remoción de las biopelículas, ya que la presencia de células muertas y sus componentes antigénicos pueden desencadenar y perpetuar un proceso inflamatorio(36). En busca de disminuir la cantidad de microorganismos a los niveles más bajos, se requiere de la aplicación de una medicación intraconducto(42,71,80,85,86,91), siendo el hidróxido de calcio el medicamento mayormente utilizado para tal fin(66,91,96). El mecanismo de acción del hidróxido de calcio sobre los microorganismos se debe a la influencia que ejerce el pH sobre el crecimiento, metabolismo y división celular bacteriana(96,112). Se cree que los iones hidroxilos van a actuar sobre la membrana citoplasmática, ya que los sitios enzimáticos están localizados en esta zona(112). Por esto podemos suponer que las biopelículas son resistentes al hidróxido de calcio; ya que no va a existir un contacto directo entre el medicamento y los microorganismos, por la presencia de la matriz de polisacáridos extracelulares. Sumado a esto, tenemos que el pH alcalino no va ser uniforme en toda la longitud del diente(97) y que los microorganismos sobrevivientes pueden estar localizados en zonas distantes del conducto principal(42,61,84,90), haciendo que la elevación del pH en cercanía a estas biopelículas no sea lo suficientemente elevada para ser bactericida. Otro punto en consideración con el uso del hidróxido de calcio, es que las biopelículas pueden estar constituidas por microorganismos que resisten un pH altamente alcalino, como es el caso de E. faecalis(47,69) y C. albicans(72,73) haciendo aún más difícil el control microbiano en estos casos. La introducción de la terapia fotodinámica para la eliminación de biopelículas intrarradiculares parece ser muy prometedora y efectiva(104,106,107,108,109), sin embargo aún no se dispone de suficiente información al respecto, además de tratarse de un tratamiento que no se encuentra masificado y que representaría un alto costo en el equipamiento necesario para implementarla. En vista de lo señalado anteriormente, pareciera inevitable esperar un gran porcentaje de fracasos debido a la perseverancia de infección intrarradicular en la forma de biopelículas, no obstante, esto no ocurre sólo por la persistencia per se de las mismas, sino que se requiere de un número considerable de microorganismos con suficiente potencial patógeno para alcanzar la región periapical(30). Cuando nos referimos a las biopelículas extrarradiculares, las consideraciones son distintas, debido a que éstas no van a ser afectadas por ningún procedimiento intrarradicular que sea realizado(39). Si bien se podría pensar en el uso de antibioticoterapia sistémica para controlarlos o erradicarlos, el principal problema de las biopelículas es su conocida resistencia antibiótica(1,2,6,7,9,10,11,27,28) debido en gran medida a la barrera de difusión que representa la matriz de polisacáridos extracelulares(1,2,6,7,9,10,11,27,28,37) y la tasa de crecimiento disminuida que presentan los habitantes de dichas comunidades(1,2,7,10,11,27,28). Otro punto de gran relevancia clínica en el tratamiento de las biopelículas extrarradiculares, es que dichas infecciones pudieran remitir en sus síntomas agudos para luego producir episodios recurrentes(10,27). Esto ocurre porque la terapia antibiótica solo es capaz de eliminar las células planctónicas, dejando viables las formas sésiles, que se van a propagar en el interior de la biopelícula, continuando su diseminación y liberación de nuevas células planctónicas cuando la terapia antibiótica es descontinuada(6,9,27).
Por otra parte, estas infecciones son difícilmente resueltas por el sistema inmune del hospedero; incluso, dicha respuesta es capaz de ocasionar daños en los tejidos en vecindad a las biopelículas(6,9). En estas situaciones clínicas, la cirugía apical representa una manera eficaz y efectiva de desorganizar o eliminar a los microorganismos contenidos en estas organizaciones microbianas(39).
Conclusiones Los microorganismos han crecido en biopelículas por billones de años como parte de su estrategia exitosa para colonizar la mayor parte del planeta, sin embargo, es ahora cuando han ganado gran importancia en el campo de la medicina debido al descubrimiento de su participación en múltiples enfermedades. A pesar de esto, su repercusión e implicaciones en la terapia endodóntica están aún en investigación, no obstante, de acuerdo a la información disponible en la actualidad, se pueden hacer algunas afirmaciones:
Bibliografía
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||