|
|
|
|
|
|
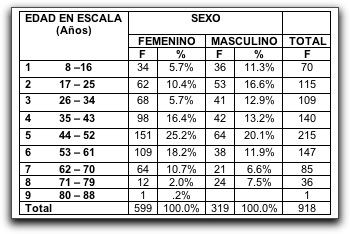
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
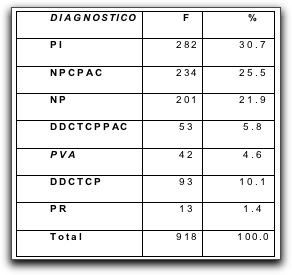
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
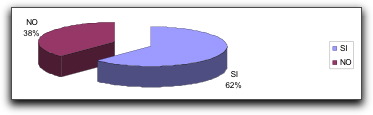
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
Invitado # 47 : (Febrero 2006) " Medicación Intraconducto Empledada en la Terapia Endodóntica de Dientes con Necrosis Pulpar en el Postgrado de Endodoncia de la Universidad Central de Venezuela en el Período Enero 2002 - Abril 2005 " por Martha K. Fereira Belisario Odontólogo, Universidad del Zulia, 1998 Especialista en Endodoncia, Universidad Central de Venezuela, 2005 e-mail: mkfereira@hotmail.com
Introducción Uno de los pasos más importantes de la terapia endodóntica, es la eliminación de las bacterias y sus productos del interior de los conductos radiculares, los cuales son considerados agentes etiológicos principales de los estados de necrosis pulpar y de las lesiones periapicales. La mayoría de las bacterias infectantes pueden ser removidas por los procedimientos endodónticos de rutina, tales como la instrumentación e irrigación del espacio pulpar; sin embargo, en algunos casos la instrumentación químicomecánica sola, es incapaz de desinfectar completamente el sistema de conducto radicular. Las complejidades anatómicas y las condiciones clínicas de los conductos infectados, además de las limitaciones de acceso de los instrumentos e irritantes, comprometen el nivel de desinfección que pueda alcanzarse, por lo cual se requiere la colocación de un medicamento intraconducto con actividad antimicrobiana antes de la obturación del conducto. Una gran variedad de agentes antimicrobianos se han empleado en la terapia endodóntica de dientes con necrosis pulpar, pero algunos de ellos han dejado de utilizarse. El empleo de uno u otro depende de sus características y mecanismo de acción, así como también de las condiciones del diente a tratar y de las especies microbianas presentes. El objetivo de este trabajo es hacer una revisión bibliográfica e investigar el tipo de medicación intraconducto empleada con más frecuencia en la terapia endodóntica de dientes con necrosis pulpar en el Postgrado de Endodoncia de la Universidad Central de Venezuela durante el período comprendido entre enero del 2002 y abril del 2005.
Microbiología del Conducto Radicular Vías de entrada de los microorganismos a la pulpa La enfermedad pulpar y perirradicular en un alto porcentaje está relacionada directa o indirectamente con los microorganismos, los cuales pueden utilizar diversas puertas de entrada. En función de su magnitud y proximidad, la patología se instaura rapidamente o de forma prolongada(1). La importancia de las bacterias en la enfermedad endodóntica se demostró en el estudio clásico realizado por Kakehashi et al.(2), en 1965, cuyo propósito fue observar los cambios patológicos resultantes de exposiciones pulpares no tratadas, en ratas libres de gérmenes cuando se comparaban con ratas convencionales con una microflora normalmente compleja. Estos investigadores encontraron que no ocurrían cambios patológicos en los tejidos pulpares o perirradiculares expuestos al medio ambiente bucal de las ratas libres de gérmenes, conocidas también como ratas gnotobióticas. En estos casos, observaron la cicatrización de la zona de exposición pulpar con la formación de dentina, independientemente de la gravedad de la exposición. En cambio, en animales comunes, las exposiciones de la pulpa al medio bucal, llevaron de una inflamación pulpar inicial severa, a una necrosis completa y/o formación de una lesión perirradicular. Esto indica que la presencia o ausencia de flora microbiana es el principal factor determinante en la destrucción o cicatrización de las pulpas de roedores expuestas.(2). Las fuentes de bacterias infectantes suelen ser caries dental, contaminación salival a través de fracturas, grietas o restauraciones con filtración(3). La caries dental sigue siendo la vía de entrada más común a través de la cual las bacterias y los productos secundarios de éstas llegan al espacio pulpar(3-5). A través de los túbulos dentinarios permeables, los microorganismos invaden y se multiplican dentro de estas estructuras. Los túbulos dentinarios miden, aproximadamente, entre 0,5 y 1? de diámetro en la periferia y hasta 3-5? cerca de la pulpa, un calibre suficiente para permitir el paso de bacterias, si se tiene en cuenta que el tamaño promedio de las mismas es de 1?, y el menor de 0,3?(1). Otra vía de entrada es la enfermedad periodontal debido a la relación anatómica que existe entre el tejido conjuntivo pulpar y periodontal, que permite el paso de bacterias en ambos sentidos a través de conductos laterales, túbulos dentinarios, membrana periodontal, foramen apical, drenaje vasculolinfático común y permeabilidad dentinaria(1,6-10). Los conductos laterales en la zona de furcación y aquellos que se ubican en el tercio apical de las raíces dentales son sitios donde podría originarse la afluencia de bacterias entre el periodonto y la pulpa. En 1973, Lowman, Burke y Pelleu(11) encontraron un 59% de conductos laterales o accesorios en el tercio coronal y medio de los molares y señalan que cuando son expuestos, los fluídos orales pueden penetrar, disolver el cemento de las raíces obturadas y reinfectar el conducto y la región apical. Así mismo, en 1999, Kobayashi et al.(12) encontraron especies de microorganismos comunes en bolsas periodontales y conducto radicular, lo que indica que las bolsas periodontales profundas podrían ser fuente de infección de los conductos radiculares. La evidencia histológica señala que la infección pulpar puede ser causada por periodontitis por vía del foramen apical, a través del cual entran los microorganismos desde la bolsa periodontal. Sin embargo, autores como Langeland, Rodrigues y Dowden(13) plantean que a pesar que la vía de comunicación entre ambos tejidos está establecida, no es totalmente cierto que la afección pulpar total se de, a no ser que el conducto principal esté seriamente involucrado. Si las bacterias penetran a los conductos laterales, conductos de la bifurcación o a la dentina denudada después de la eliminación del cemento durante el tratamiento periodontal, se produce inflamación pulpar. Por estas mismas vías se puede dar el paso de microorganismos y sus productos desde el tejido pulpar inflamado o necrótico hacia el periodonto y desencadenar procesos inflamatorios a este nivel(4,9). Son variadas las opiniones y los resultados obtenidos en diversos estudios acerca del efecto de la enfermedad pulpar sobre los tejidos periapicales y viceversa; la relación anatómica e histológica existe y definitivamente la enfermedad periodontal propicia una vía de entrada para las bacterias. La fractura de la corona que afecta a esmalte y dentina, en las proximidades de la cavidad pulpar, produce la exposición de los túbulos dentinarios y esto puede resultar una vía de entrada de los microorganismos presentes en la cavidad bucal. Esta situación tiene mayor importancia en niños y pacientes jóvenes, puesto que presentan túbulos de mayor calibre que en los adultos y pacientes de edad avanzada(1). También existe la vía hematógena, que favorece la localización electiva de bacterias llevadas por la sangre en áreas circunscritas de inflamación, un proceso denominado anacoresis(14). Las bacteriemias transitorias pueden, mediante este proceso, localizarse en una pulpa lesionada cuya circulación defectuosa no puede luchar contra los microorganismos invasores(1,4,10,14-16). Otra vía de infección que debe considerarse es el bruxismo que representa una condición patológica que con el transcurso de los años puede llevar a la pérdida de esmalte y dentina, acercándose a distancias inferiores a 1mm de la cavidad pulpar, facilitando la invasión bacteriana de la misma(1). Ingle, Stanley y Langeland(17) señalan que la penetración de bacterias puede darse a través de trayectos anómalos presentes en la corona dental tales como: dens invaginatus, dens evaginatus, surco lingual radicular, llamado también surco palatino gingival. A su vez la penetración radicular puede darse a través de caries, por infección retrógrada (a partir de bolsas o abscesos periodontales) o hematógena (anacoresis). Independientemente de la vía de entrada a través de la cual se establece la invasión bacteriana al tejido pulpar, al colonizarlo, se desencadena un estado inflamatorio que puede evolucionar hacia la necrosis total y afectar los tejidos del periápice. Bacterias relacionadas con el conducto radicular infectado La mayor parte de las bacterias en una infección endodóntica son anaerobios estrictos. Estas bacterias proliferan en ausencia de oxígeno pero tienen sensibilidad variable a éste. Funcionan a potenciales de oxidación y reducción bajos y generalmente carecen delas enzimas superóxido dismutasa y catalasa(5). La evidencia científica indica que las infecciones endodónticas son de origen polimicrobiano y mixto, de tal manera que incluyen anaerobios estrictos, anaerobios facultativos o microaerofílicos. Estos últimos y los aerobios estrictos, disminuyen la tensión de oxígeno (O2) y el potencial de oxidorreducción en los tejidos. De este modo, proporcionan las condiciones favorables para que se desarrollen las bacterias estrictamente anaerobias que representan cerca de un 90% de la flora cultivable(4,16,18-21). Por otra parte, los líquidos tisulares y las células desintegradas del tejido necrótico forman un sustrato de nutrientes, en especial polipéptidos y aminoácidos, esenciales para los microorganismos, que junto con la baja presión de 02 y las interacciones bacterianas, son los determinantes ecológicos claves que favorecen el crecimiento de un determinado grupo de bacterias, por lo general anaerobias(4,5,21). La proporción relativa de bacterias anaerobias estrictas respecto de las bacterias facultativas, aumenta con el tiempo al igual que lo hace el número total de bacterias. A pesar de que se han realizado pocas determinaciones cuantitativas de la cantidad de bacterias presentes en un conducto radicular infectado, se estima que pueden alcanzar cifras comprendidas entre los 102 y 108 bacterias por miligramo de contenido radicular. Algunos autores señalan que los conductos infectados contienen de 2 a 10 especies diferentes, con cifras totales que varían de 103 a 107 (1,3). En 1957, MacDonald, Hare y Word(6) evaluaron el estado bacteriológico de las cámaras pulpares de 46 dientes intactos que se encontraban no vitales después de recibir un traumatismo, empleando métodos de cultivo aeróbicos y anaeróbicos. Obtuvieron crecimiento en 38 dientes. El número de bacterias recolectadas varió entre 1 y 6. Un total de 71 fueron aisladas, de las cuales 23 fueron anaerobias. Siqueira et al.(22) estudiaron 28 muestras de conductos radiculares infectados y determinaron que el número de especies bacterianas en el conducto radicular varía de 1 a 17 y que no existe una correlación aparente entre el número de especies bacterianas y los signos y síntomas. En dientes con amplias comunicaciones entre la cavidad bucal y el conducto radicular suelen presentarse entre un 60 y 70% de bacterias estrictamente anaerobias, mientras que en dientes cerrados un 95%(1). La organización de microcolonias dentro de la comunidad microbiológica endodóntica puede ser dictada por los determinantes ecológicos que ocurren en diferentes partes del sistema de conductos radiculares. Por esta razón, tanto la tensión de O2, como el potencial de oxidorreducción del tercio coronal de los conductos, son presumiblemente más altos que en otras partes; los anaerobios facultativos o aerotolerantes pueden predominar en tales regiones. De otro modo, la proporción de anaerobios es significativamente más alta en el tercio apical del conducto radicular, particularmente debido a las condiciones anaeróbicas del ambiente. Esto tiene importancia ecológica y permite el establecimiento y supervivencia de determinadas especies en el sistema de conductos radiculares(23). Lana et al.(21) encontraron un 81.5% de conductos infectados que mostraban una infección polimicrobiana. Un 88.9% eran bacterias anaerobias estrictas, 51.8% anaerobias facultativas, 18.5% microaerofílicas y 7.4% hongos. Las bacterias anaerobias facultativas representaron un grupo importante que actúan sinergísticamente con bacterias anaerobias y juegan un rol fundamental en la colonización de los conductos radiculares. Fabricius et al.(24) realizaron análisis microbiológicos cuantitativos de las pulpas de 24 conductos radiculares de monos, las cuales fueron mecánicamente desvitalizadas y expuestas a la flora bucal por 1 semana y luego selladas. Se realizaron observaciones a los 90, 180 y 1060 días y se tomaron muestras del conducto principal, la dentina y la región apical en la misma sesión. Las muestras de la región apical del conducto mostraron un predominio de bacterias anaerobias estrictas no esporuladas (85-98%). Al transcurrir los días de observación, el número de cepas bacterianas aumentó notablemente; las especies principalmente encontradas fueron Bacteroides y Bacilos anaerobios Gram positivos. De igual manera la proporción de anaerobios y facultativos cambió y se encontró una baja proporción de bacterias anaerobias facultativas.(24). Hasta 1970, los microorganismos facultativos fueron las bacterias predominantemente aisladas de conductos radiculares infectados, esto debido principalmente a las limitaciones en los métodos de cultivo usados hasta el momento. Durante la década de los 70, el mejoramiento en las técnicas de cultivo anaeróbico resultó en el aislamiento y crecimiento de bacterias anaeróbicas en dientes necróticos por lo que estudios posteriores revelan una incidencia de anaerobios tan alta como un 90%(10,25). En 1973, Fulghum, Wiggins y Mullaney(26) señalan que las bacterias anaerobias se encuentran en proporciones que varían ampliamente, lo que sugiere que las condiciones de cultivo en la práctica endodóntica y las investigaciones hasta el momento no eran suficientemente sensibles para detectar todas las bacterias anaerobias en especímenes endodónticos. Estas bacterias requieren condiciones anaeróbicas rigurosas considerando que son patógenos importantes en cultivos puros y mixtos. Tomando en cuenta esta premisa, Kantz y Henry(27) tomaron muestras de 24 dientes necróticos con cámaras pulpares intactas, utilizando un método donde se mantenían las condiciones de anaerobiosis durante la recolección, transporte e identificación y los anaerobios identificados fueron: Actinomyces israelí, Bacteroides fragilis, Bacteroides melaninogenicus, Fusobacterium varium, Peptococcus morbillorum, Propionibacterium acnes, Veillonella parvula y otras especies de Actinomyces. Durante las últimas décadas se han empleado métodos de genética molecular para detectar microorganismos que son imposibles o difíciles de cultivar. Estos métodos se han usado para identificar bacterias en muestras clínicas sin la necesidad de cultivarlos o aislarlos, o sin pruebas bioquímicas para la identificación. Además, es posible que tales métodos moleculares analíticos puedan proveer conocimientos significativos adicionales acerca de la microbiota de conductos radiculares infectados(22). De las diversas especies bacterianas que han sido aisladas de conductos radiculares infectados, los Estreptococos viridans, las especies de los géneros Peptostreptococcus, Fusobacterium, Prevotella y Porphyromonas, representan el grupo de microorganismos más frecuentemente aislados. También se ha establecido la presencia de Veillonella parvula, Actinomyces spp. y Lactobacillus spp.(1,3,22,27). Siqueira et al.(22),en el año 2000, utilizando el análisis de hibridización de ADN, propusieron examinar la microbiota de conductos radiculares infectados y encontraron la prevalencia de las siguientes especies: Bacteroides forsythus (39.3%), Hemophilus aphrophilus (25%), Corynebacterium matruchotii (21.4%), Porphyromona gingivalis (17.9%) y Treponema denticola (17.)%). Enterococcus faecalis, Capnocitophaga gingivalis y Streptococcus intermedius, fueron detectados en un 14.3% de las muestras de dientes infectados. Especies orales inusuales, tales como Ralstonia spp. y Pseudomona aeruginosa fueron aislados en algunos casos. Es de interés, la alta frecuencia de algunas especies bacterianas, tales como B. forsythus, H. aphrophilus, C. matruchotii y T. dentícola, las cuales nunca han sido reportadas como predominantes o que siempre estén presentes en los estudios de cultivo. Por el contrario, especies comúnmente encontradas en infecciones endodónticas por cultivo, tales como especies de Actinomyces, P. anaerobius, P. nigrescens, P. acnes, y algunas especies de Streptococcus no fueron detectadas. Estudios como este, reflejan la gran heterogeneidad entre la microbiota del conducto radicular y soportan el concepto de que las infecciones endodónticas son infecciones mixtas de etiología polimicrobiana(22). Recientemente, con la introducción de la tecnología molecular, se han realizado reorganizaciones importantes entre las taxas bacterianas como resultado de proposiciones taxonómicas filogéneticas. Como consecuencia, especies viejas han sido renombradas y se han propuesto nuevas especies(28). Los cambios taxonómicos más marcados han ocurrido en el género Bacteroides. Este género contiene ahora principalmente bacilos gram negativos biliresistentes. Hasta los años 80 y 90, las especies formalmente conocidas como Bacteroides melaninogenicus no han sido reconocidos más bajo este nombre, sino como especies pigmentadas sacarolíticas y fueron transferidas al género Prevotella y las especies asacarolíticas al género Porphyromonas. Algunas especies no pigmentadas biliresistentes fueron también transferidas al género Prevotella(28,29). El género Bacteroides se divide entonces en tres géneros:
Bacteroides forsythus fue por mucho tiempo miembro del género Bacteroides pero sólo recientemente fue renombrado Tannerella forsythus. Esta especie ha sido detectada en conductos radiculares infectados justo después de la introducción de métodos de genética molecular. Bacteroides gracilis es ahora Campylobacater gracilis(28). Especies de Prevotella, especialmente P. intermedia, P. nigrescens, P. tannerae y P. denticola también han sido comúnmente aisladas en infecciones de origen endodóntico(28). De acuerdo con Berkiten et al.(19), P. intermedia es una bacteria anaeróbia frecuentemente aislada en conductos radiculares infectados y es responsable de síntomas agudos. Bae et al.(29) coinciden con este planteamiento y señalan que cepas identificadas como P. intermedia han sido separadas en 2 cepas distintas: P. intermedia y P. nigrescens. En este estudio de 56 cepas, 41 (73.2%) fueron identificadas como P. nigrescens y 15 (26.8%) como P. intermedia, lo que confirma que son las bacterias pigmentadas de negro aisladas más a menudo en infecciones de origen endodóntico. El género Porphyromonas actualmente incluye doce especies pigmentadas y una no pigmentada. De las cuatro especies de origen humano, solo P. endodontalis y P. gingivalis han sido consistentemente aisladas y detectadas en infecciones endodónticas, y se ha visto que juegan un papel importante en la etiología de diferentes formas de lesiones perirradiculares, incluyendo abscesos periapicales agudos(28). En 1992, Hashioka et al.(30) establecieron la relación entre los síntomas clínicos y las bacterias anaeróbicas de conductos radiculares infectados, indicando que Porphyromonas y Bacteroides estaban significativamente relacionadas con el olor de estos conductos. P. gingivalis estaba relacionada con síntomas clínicos subagudos como dolor a la percusión y exudado. En este sentido, los mismos autores en el año 1994, realizaron un estudio para determinar la correlación entre los síntomas clínicos y la actividad de enzimas como colagenasa, condroitinasa e hialuronidasa producida por bacterias aisladas de conductos radiculares infectados y concluyeron que el género Eubacterium y P. gingivalis con actividad enzimática fueron predominantemente aislados de conductos de pacientes con síntomas clínicos agudos y subagudos(31). Fusobacterium nucleatum es otra especie frecuentemente aislada en conductos radiculares infectados así como también en abscesos endodónticos. F. alocis ha sido reclasificado como Filifactor alocis, un bacilo Gram negativo anaerobio estricto que ha sido ocasionalmente aislado de infecciones de conductos radiculares por cultivo, pero un estudio molecular reciente detectó esta especie en la mitad de los casos de infecciones endodónticas(28). Dentro del género Eubacterium se ha detectado una considerable heterogeneidad entre sus especies, razón por la cual se han propuesto nuevos géneros que incluyen Pseudoramibacter, Eggerthella, Cryptobacterium, Mogibacterium y Slackia. Eggerthella lenta (Eubacterium lentum) y Pseudoramibacter alactolyticus (E. alactolyticum) que han sido aislados en conductos infectados en un tercio de los casos. Otros ejemplos como Slackia exigua (E exiguum) y Mogibacterium timidum ( E. timidum) también han sido detectados con valores relativamente altos(28). En el estudio de Fouad et al.(32), un 73% de los especímenes analizados fueron positivos para Eubacterium spp. Una característica de este estudio es que la mayoría de las especies en los conductos infectados fueron E. infirmum, un organismo que fue frecuentemente aislado de bolsas periodontales humanas y que se caracteriza por ser un bacilo corto Gram positivo anaerobio estricto. Con respecto a las Espiroquetas orales, sólo recientemente han sido identificadas en infecciones endodónticas. Usando métodos genéticos moleculares se encontró que Treponema denticola, Treponema socranskii, y Treponema maltophilum, fueron detectados en valores de alta prevalencia en conductos radiculares infectados(28,33). La "red compleja" definida así por Sokransky et al., en 1998, compuesta por B. forsythus, P. gingivalis y T. denticola está implicada en diversas formas de enfermedad periodontal. Sin embargo, en el año 2001, Roca et al.(20) estudiaron la ocurrencia de esta red en infecciones de conductos radiculares a través de técnicas de PCR y al menos un miembro de esta red se encontró en 33 de los 50 casos estudiados. T. denticola, P. gingivalis y B. forshytus fueron detectados en un 44%, 30% y 26% de los casos, respectivamente. La ocurrencia de esta red sugiere que puede jugar un papel importante en la patogénesis de la enfermedad perirradicular. Por otra parte, especies de Actinomyces que se encuentran en la flora bucal normal pueden infectar un conducto radicular con una pulpa necrótica. También se han asociado con casos de fracasos de la terapia endodóntica(28). En el estudio de Xia y Craig(34), se empleó PCR con un primer universal para Actinomyces y éste fue detectado en 72 (55.8%) de las 129 muestras clínicas, de las cuales 41 de 51 (80.4%) eran conductos radiculares infectados. Este estudio confirma que A. israelí, A. naeslundii y A. viscosus están a menudo involucrados en infecciones de conductos radiculares o infecciones orofaciales de origen endodóntico. Cada una de estas especies de Actinomyces se encontró en un porcentaje mayor en conductos radiculares infectados más que en el aspirado de abscesos o celulitis, lo cual sugiere que el conducto radicular es la puerta de entrada para los organismos en los tejidos periapicales. Aunque son las bacterias las principalmente estudiadas, los hongos también han sido asociados con conductos radiculares infectados. En el estudio de Cray, Watts y Xia(35) se evaluó el contenido de conductos infectados y el aspirado de abscesos y celulitis de origen endodótico para la presencia de Candida albicans usando PCR.C. albicans se detectó en 5 de 24 (21%) de las muestras tomadas de los conductos pero en ninguno de los aspirados perirradiculares. Debido a que el tercio apical del sistema de conductos radiculares puede considerarse como una zona crítica para el éxito de la terapia endodóntica, el conocimiento sobre la microbiota infectante de esta área es de particular importancia. Su anatomía única y la proximidad con tejidos vivos del huésped confiere condiciones ecológicas especiales que seleccionan las especies que colonizan esta región(36). La baja tensión de oxígeno en el tercio apical del conducto conduce al establecimiento de bacterias anaerobias estrictas. Además, las bacterias ubicadas en la parte apical del conducto pueden obtener diversos nutrientes de los fluidos tisulares y el exudado inflamatorio presente en el límite entre los tejidos perirradiculares y el conducto radicular infectado. Esto puede favorecer el establecimiento de bacterias que usan proteínas como principal fuente nutricional en el segmento apical del conducto y ayuda a explicar porqué algunas bacterias, tales como Porphyromonas, Peptostreptococcus, Prevotella y Fusobacterium, han sido reportadas como miembros comunes de la microbiota instalada en esta área(36). Los resultados del trabajo de Siqueira et al.(36), en el año 2004, demostraron que Pseuramibacter alactolyticus se presentó en 10 casos (44%), Treponema denticola en 6 (26%), Fusobacterium nucleatum en 6 (26%), Porphyromona endodontalis en 4 (17%), Filifactor alocis en 2 (9%), Dialister pneumosintes en 1 (4%), Porphyromona gingivalis en 1 (4%) y Tannerella forsythensis en 1 (4%). La identificación exacta de microorganismos involucrados en infecciones endodónticas es necesaria para revelar especies implicadas en la patogénesis de los diferentes tipos de infecciones endodónticas y enfermedades perirradiculares. Además, este tipo de conocimiento tiene importancia clínica incuestionable ya que provee bases para la investigación de sustancias antimicrobianas efectivas, así como también el desarrollo de estrategias apropiadas para alcanzar y eliminar los componentes de la microbiota localizada en todas las irregularidades del sistema de conductos radiculares. Reacción de la pulpa a las bacterias El principal factor etiológico para la inflamación pulpar es la invasión de bacterias o factores derivados de bacterias dentro de la pulpa, los cuales pueden invadirla a partir de una caries o fractura del diente, por vía de tractos anómalos, o después de procedimientos de restauración, entre otras vías que se han mencionado anteriormente(37). Los productos del metabolismo bacteriano, en especial los ácidos orgánicos y enzimas proteolíticas, además de provocar la destrucción del esmalte y la dentina, pueden iniciar una reacción inflamatoria. Eventualmente, la invasión de la dentina dará por resultado la invasión bacteriana de la pulpa. La reacción básica que se da en un intento por proteger a la pulpa comprende: una disminución en la permeabilidad de la dentina, la formación de nueva dentina y reacciones inflamatorias e inmunológicas(4,5,38,39). La permeabilidad dentinaria disminuye debido a la esclerosis dentinaria que es la primera respuesta a este nivel y consiste en un incremento en la dentina peritubular, actuando como una barrera a la penetración de metabolitos bacterianos, isótopos y tintes(40-43). En esta reacción los túbulos dentinarios se llenan parcial o totalmente con depósitos minerales de apatita y otros cristales(39,41). La esclerosis dentinaria resulta un mecanismo de protección a la pulpa pues impide la difusión de sustancias tóxicas que ocurre básicamente a través de los túbulos dentinarios. La evidencia sugiere que para que pueda haber esclerosis, el proceso odontoblástico debe estar presente en los túbulos(4,5,39,41). Otro mecanismo que limita la difusión de sustancias tóxicas hacia la pulpa es la formación de dentina reparadora; la cantidad de dentina reparadora formada es proporcional a la cantidad de dentina primaria destruída. Las investigaciones han demostrado que a lo largo de la zona limítrofe entre dentina primaria y reparadora las paredes de los túbulos dentinarios están engrosados y los túbulos frecuentemente están ocluídos con material parecido a la dentina peritubular. Por ello, la zona limítrofe parece ser considerablemente menos permeable que la dentina común y puede servir como barrera ante el ingreso de bacterias y sus productos(39). A diferencia de la dentina primaria, de aspecto regular, la secundaria muestra menor cantidad de túbulos dentinarios, los cuales son más estrechos, irregulares, con trayectos más curvos y grandes lúmenes, los cuales terminan de manera bien definida en el límite con la dentina primaria(40,41,43). Otra reacción que puede ocurrir ante la invasión bacteriana es la formación de un trayecto no vital o trayecto muerto en la dentina. A diferencia de la esclerosis dentinaria y la formación de dentina reparativa, éste no se considera una reacción defensiva, y la mayoría de los autores coinciden en que resulta de una necrosis temprana de los odontoblastos. Un trayecto muerto es un área dentinaria en la cual los túbulos carecen de procesos odontoblásticos(39). Estos trayectos son altamente permeables si se comparan con la dentina esclerótica, lo que puede alterar potencialmente la integridad pulpar, puesto que la disolución de los procesos odontoblásticos deja caminos virtuales para el paso de los elementos patógenos hacia la cavidad pulpar(4,5,40,41). A nivel del tejido pulpar, los cambios comienzan mucho antes de que las bacterias lo invadan, es decir, desde el mismo momento en que penetran en esmalte y dentina. Quizás la priemera evidencia morfológica de la reacción pulpar se encuentre en la capa odontoblástica subyacente a la lesión. Antes de la aparición de cambios inflamatorios en la pulpa, hay una reducción general del tamaño de los odontoblastos. Los odontoblastos que son normalmente células grandes y columnares, se vuelven planos o cúbicos en la porción coronaria de la pulpa. Presentan signos de daño celular en forma de vacuolización, degeneración mitocondrial y reducción en el número y el tamaño de otras organelas citoplasmáticas, en particular el retículo endoplasmático(37,39,41). A medida que las bacterias avanzan hacia la pulpa, va aumentando el grado de inflamación. La inflamación pulpar comienza como una respuesta inmunológica de bajo grado a los antígenos bacterianos en vez de una reacción inflamatoria aguda. El infiltrado celular inflamatorio inicial consiste casi completamente de linfocitos, macrófagos y células plasmáticas; es el infiltrado típico de una reacción inflamatoria crónica. Adicionalmente, existe una proliferación de pequeños vasos sanguíneos y fibroblastos con depósito de fibras colágenas, razón por la cual no toda reacción inflamatoria resulta en una lesión permanente(37). La inflamación crónica es considerada generalmente como una reacción inflamatoria reparativa, ya que todos los elementos necesarios para la cicatrización están presentes. Cuando las bacterias son eliminadas antes de que alcancen la pulpa, el proceso inflamatorio se resuelve y la cicatrización ocurre(37). La pulpa sufre una inflamación aguda cuando las bacterias invaden la dentina reparativa que se ha formado antes de la lesión. Durante esta respuesta aparecen vasos dilatados y pueden encontrarse algunas células inmunológicamente competentes como diversos subtipos de linfocitos: T4 o ayudadores, T8 o citotóxicos, células B, células dendríticas y macrófagos que progresivamente aumentan en cantidad. Por otra parte, las vénulas se congestionan y existe evidencia de edema(37,40,41,43,44). La reacción inflamatoria en esta etapa está determinada por un aumento del flujo sanguíneo, aumento del volumen de los vasos, de la permeabilidad vascular y exudado. Como consecuencia del extravasamiento de líquidos plasmáticos, hay un aumento de la viscosidad de la sangre y disminución de la velocidad de la corriente circulatoria(42). Así la presión hidrostática disminuye, los leucocitos polimorfonucleares, que son los elementos de la primera línea de defensa orgánica, se dirigen hacia la periferia de los vasos donde el flujo es más lento, lo que se conoce como marginación leucocitaria. A continuación, los neutrófilos atraviesan las paredes de los vasos y pasan a los espacios extravasculares(42). Ante la exposición de la pulpa a las bacterias se produce una acumulación masiva de neutrófilos gracias a sustancias quimioatrayentes liberadas por las propias bacterias y por la activación bacterial del sistema del complemento; esta masa de neutrófilos forma microabscesos o zonas de supuración(37,38). La necrosis del tejido se desarrolla cuando los neutrófilos, al morir, liberan metabolitos activos del oxígeno y proteasas. Los neutrófilos contienen más de 20 proteasas, de las cuales las más importantes son la elastasa, gelatinasa y colagenasa. Esta acción combinada resulta en necrosis por licuefacción. Las enzimas lisosomales tienen un rol importante en la digestión de las bacterias fagocitadas; contribuyen a la destrucción del parénquima pulpar debido a que no discriminan entre el tejido del huésped y agentes extraños(37,40,41). Debido a la falta de circulación colateral y la rigidez de las paredes dentinarias, hay un drenaje insuficiente de los líquidos inflamatorios. Esto ocasiona alzas circunscritas en las presiones de los tejidos y da lugar a la destrucción progresiva e inadvertida hasta que toda la pulpa se necrosa(45). Al incrementarse el número de bacterias que entran a la pulpa, los mecanismos de defensa son eventualmente vencidos. Debe recordarse que la pulpa tiene un aporte sanguíneo relativamente limitado en relación con el volumen de tejido presente en el espacio de la cámara y los conductos radiculares. Entonces, cuando la demanda de elementos inflamatorios es mayor que la posibilidad que tiene el sistema vascular de transportarlos hasta el sitio del daño, la respuesta inflamatoria no puede ser mayor y las bacterias pueden crecer sin oposición dentro de la cámara pulpar. Esto último conlleva a la necrosis pulpar(37). La pulpa puede permanecer inflamada por mucho tiempo o sufrir necrosis rápida; la demanda de la reacción pulpar se relaciona con la virulencia de las bacterias, la respuesta del húesped, la cantidad de circulación pulpar y el grado de drenaje. Como la pulpa está rodeada por tejido duro, la pulpa inflamada se localiza en un ambiente único que no cede; esto último, aumenta la presión intrapulpar cuando se acumulan las células inflamatorias extravasculares y los líquidos. El aumento de la presión interfiere además con la función celular normal, lo que hace a las células más susceptibles a la muerte(4). Después de instalada la necrosis, tarde o temprano se infecta la totalidad del sistema de conductos radiculares. Una infección prolongada no sólo incluirá bacterias en el conducto principal sino también en los accesorios y en un tramo del interior de los túbulos dentinarios(3).
Necrosis Pulpar Definición de Necrosis pulpar La necrosis pulpar significa el cese de los procesos metabólicos de este órgano con la consiguiente pérdida de su vitalidad, de su estructura, así como de sus defensas naturales(42,46). Naidorf(47) y Rodríguez Ponce(43) señalan que la necrosis pulpar se produce cuando hay una interrupción de la vascularización pulpar como consecuencia de un proceso inflamatorio o traumático. La necrosis pulpar es la descomposición séptica o no, del tejido conjuntivo pulpar que cursa con la destrucción del sistema microvascular y linfático de las células y en última instancia de las fibras nerviosas(46). El término necrosis, que significa muerte de la pulpa, se refiere a una condición histológica originada por una pulpitis irreversible no tratada, una lesión traumática o cualquier circunstancia que origine interrupción prolongada del suministro de sangre a la pulpa. Las pulpitis agudas y crónicas, así como los estados degenerativos de acuerdo con las condiciones intrínsecas pulpares y la intensidad del agente agresor, podrían evolucionar, lenta o rápidamente hacia la necrosis pulpar(48). Características clínicas de la necrosis pulpar La necrosis pulpar es totalmente asintomática, siempre y cuando no afecte a los tejidos periapicales. En estos casos, la existencia de sintomatología ya no dependerá propiamente del proceso pulpar, sino del periapical(42,46,48,49). Con respecto a la intensidad y duración de la odontalgia, Seltzer y Bender(44) señalan que cuando ésta no está presente, es probable que exista necrosis del tejido pulpar. Por otra parte, la presencia de tumefacción de la mucosa sobre la región apical del diente y la presencia de una fístula indican que la pulpa ha experimentado una necrosis. Las pruebas térmicas y eléctricas son negativas. Aunque frente a estímulos eléctricos, puede haber una reacción positiva en los casos de necrosis por licuefacción debido a la presencia de electrolitos y a la persistencia de alguna fibra nerviosa. Por otra parte, el calor puede producir dolor al dilatarse el contenido gaseoso del conducto(43,44,48,50). Por lo común, hay una falta de respuesta ante la prueba eléctrica cuando la pulpa está necrótica, pero esto no es infalible. Si además, hay una falta de respuesta a las pruebas térmicas, es muy probable que el diagnóstico sea de necrosis(44). Cierto cambio de color de la corona puede acompañar a la necrosis pulpar en los dientes anteriores pero este signo diagnóstico no es fiable(48). La descomposición del tejido pulpar y la hemólisis condicionan la aparición de este cambio de color(43). Roberto y Comelli(42), afirman que la alteración del color de la corona del diente es un indicativo de la pérdida de vitalidad de la pulpa. A la transiluminación se presenta pérdida de la translucidez y la opacidad se extiende a toda la corona(50). La necrosis pulpar puede ser parcial o total. La necrosis total es asintomática antes de afectar al ligamento periodontal puesto que los nervios de la pulpa carecen de función. La necrosis parcial quizás sea difícil de diagnosticar, dado a que puede provocar alguno de los síntomas asociados con la pulpitis irreversible(48). Características histológicas de la necrosis pulpar El término necrosis se refiere a una condición histológica originada por una pulpitis no tratada, una lesión traumática o cualquier circunstancia que origine interrupción prolongada del suministro de sangre a la pulpa(48). Conforme avanza la inflamación,el tejido sigue desintegrándose en el centro, para formar una región progresiva de necrosis por licuefacción, dada la falta de circulación colateral la rigidez de las paredes de la dentina. Esto ocasiona elevaciones localizadas en las presiones de los tejidos, y da lugar a la destrucción progresiva e inadvertida hasta que toda la pulpa se necrosa(45). La región de necrosis contiene irritantes provenientes de la destrucción de los tejidos y los microorganismos, tanto anaerobios como aerobios. Estos factores irritantes establecen contacto con el tejido vital periférico y continúan ejerciendo daño. Las bacterias penetran hasta los límites de la necrosis, pero no se observan en el tejido inflamado adyacente.Sin embargo,en todo momento sus toxinas y enzimas penetran en los tejidos circundantes y estimulan la inflamación. Donde la necrosis por licuefacción hace contacto con la dentina, se pierde la predentina, tal vez por la acción de la colagenasa(45). Adyacente a la necrosis por licuefacción se encuentra una zona de inflamación crónica. Aunque es invariable la amplitud de ésta, por lo general es bastante estrecha. La inflamación perirradicular tal vez no se desarrolle sino hasta que la pulpa esté casi del todo necrótica(45). Las pulpas de los dientes en los cuales las células pulpares mueren como resultado de coagulación o licuefacción se clasifican como necróticas. En la necrosis por coagulación, el protoplasma de la célula ha quedado fijado y opaco. Histológicamente, es posible reconocer aún una masa celular coagulada, pero ha desaparecido el detalle intracelular. En la necrosis por licuefacción desaparece el contorno íntegro de la célula, y en torno de la zona coagulada hay una zona densa de leucocitos polimorfonucleares muertos y vivos, junto con células de la serie inflamatoria crónica(44). Histológicamente, la necrosis pulpar parcial muestra una zona de licuefacción, rodeada por leucocitos polimorfonucleares vivos y muertos. Las porciones del remanente de tejido pulpar coronal se convierten en tejido de granulación rico en macrófagos, linfocitos y células plasmáticas. Es probable la presencia de linfocitos y células plasmáticas como signo de una reacción antígeno-anticuerpo localizada. En este momento, el tejido pulpar radicular sucumbe y el tejido de granulación se encuentra en la porción apical del conducto radicular y también en el ligamento periodontal(40). En la necrosis por coagulación, las células pulpares se encuentran reducidas y el núcleo está picnótico. Las fibras colágenas persisten, pero pueden estar fuertemente mineralizadas. Los nervios y vasos sanguíneos son también sitios para mineralizaciones distróficas. Los cálculos pulpares son abundantes, y las paredes dentinarias, tanto coronal como radicularmente, están cubiertas con grandes cantidades de dentina reparativa y amorfa, que tiende a la obliteración de la pulpa.(40) Características radiográficas de la necrosis pulpar La necrosis pulpar es una situación indolora que no se acompaña de signos radiográficos. Sin embargo, el examen radiográfico puede evidenciar una cavidad de caries o restauración sin la debida protección del complejo pulpodentinario. En algunos casos puede observarse un aumento del espacio del ligamento periodontal(42,43,48). De acuerdo con Seltzer y Bender(44), a través del examen radiográfico pueden obtenerse datos objetivos que constituyen un auxiliar valioso del diagnóstico del estado pulpar, tales como: la profundidad de la cavidad cariosa, restauraciones extensas y profundas, la presencia de fracturas radiculares, reabsorciones externas e internas, ancho del conducto y de la cámara pulpar.
Medicación Intraconducto Definición de Medicación intraconducto La medicación intraconducto o medicación tópica implica el uso interno de un medicamento con la intención de lograr efectos terapéuticos locales y no sistémicos. En endodoncia, se asocia este concepto al empleo de antisépticos en el tratamiento de conductos infectados, aunque también se emplean antibióticos localmente como alternativa medicamentosa, corticoides para combatir el dolor y la inflamación, hidróxido de calcio o pastas alcalinas para reducir o ayudar a cohibir hemorragias. A todo ello debe agregarse el empleo local de irrigantes y quelantes, coadyuvantes químicos de la instrumentación. De los ejemplos mencionados, los antisépticos constituyen el mayor porcentaje de medicación tópica empleada en endodoncia(51). Si el tratamiento de conductos radiculares no se completa en una sola sesión, se recomiendan agentes antimicrobianos para la antisepsia del interior del conducto a fin de evitar el desarrollo de microorganismos entre las consultas(5). Schilder y Ámsterdam(52) definen los medicamentos endodónticos como agentes usados dentro de la cámara pulpar y los conductos radiculares con los propósitos de irrigación, esterilización y disminución del dolor u otros síntomas. Goldberg y Soares(53) señalan que la medicación intraconducto se caracteriza por la colocación de un fármaco en el interior de la cavidad pulpar entre las sesiones necesarias para la conclusión del tratamiento endodóntico. La literatura médica empleó las expresiones medicación entre sesiones, medicación local y medicación intraconducto para denominar este procedimiento. Chong y Pitt Ford(54) plantean que un medicamento es utilizado como agente antibacteriano para eliminar cualquier bacteria en el conducto radicular después de la instrumentación. También afirman que este medicamento no esteriliza el conducto radicular y no es un substituto de la limpieza y preparación adecuada del conducto. El uso de medicamentos intraconductos entre citas ha sido rutina en la práctica endodóntica por muchos años como coadyuvante en el control de la contaminación bacterial(55). Messer y Chen(55), hacen el siguiente razonamiento: primero el medicamento puede reducir la flora microbiana por debajo de los niveles logrados durante la preparación del conducto, particularmente por penetrar en áreas donde los instrumentos o irrigantes no llegan. Segundo, un agente antimicrobiano al permanecer en el conducto entre citas, puede prevenir la reinfección del conducto radicular o reducir el riesgo de proliferación de bacterias residuales, las cuales pueden alcanzar los mismos niveles que tenían al comienzo de las sesiones previas(56,57). El uso de un medicamento intraconducto se considera uno de los pasos más importantes de la terapia endodóntica para obtener y mantener la desinfección del conducto radicular después de la instrumentación y antes de la obturación, incrementando significativamente las posibilidades de lograr un tratamiento endodóntico exitoso(56,58). Objetivos de la medicación en los casos de pulpa necrótica En los dientes con pulpa necrótica, la medicación intraconducto resulta un auxiliar valioso en la desinfección del sistema de conductos radiculares, sobre todo en lugares inaccesibles a la instrumentación(53). La medicación entre sesiones en el tratamiento de conducto de dientes infectados está indicada cuando se encuentra una anatomía compleja del conducto, en la cual ciertas áreas no son accesibles a la instrumentación, sobre todo, cuando son dientes con necrosis pulpar y lesiones periapicales crónicas en los cuales el sistema de conductos radiculares está infectado, para lograr su desinfección(59,60). Por su parte, Gurney(61), en 1979, señala que los medicamentos en el interior de los conductos radiculares se emplean para:
En conductos radiculares infectados, la medicación intraconducto ha sido indicada para varios propósitos:
Otros objetivos de la medicación durante las sesiones de tratamiento son:
En conclusión, el objetivo principal de la medicación intraconducto es reducir el número de microorganismos, como parte de la asepsia controlada en conductos radiculares infectados y su rol es secundario a la limpieza y conformación del conducto radicular. En este sentido, se plantea que cuando la instrumentación biomecánica es combinada con la colocación de un medicamento por un período de tiempo apropiado antes de la obturación, las bacterias pueden ser eliminadas más efectivamente. La falta de una medicación intraconducto disminuye el porcentaje de éxitos en los dientes con conductos infectados(18,54,56,59-63) Criterios para la selección del medicamento La selección de un medicamento intraconducto requiere de las mismas consideraciones que la aplicación de cualquier fármaco en otra región del organismo. Por lo tanto es necesario considerar:
Chong y Pitt Ford(54) afirman que un medicamento intraconducto antibacterial debe tener un amplio espectro de actividad, una duración de su acción razonable para eliminar todas las bacterias en el conducto radicular y no retardar la cicatrización. Por otra parte, en conductos infectados, un medicamento deberá también alcanzar y ser efectivo contra microorganismos endodónticos seleccionados en el interior de los túbulos dentinarios y ramificaciones del sistema de conductos radiculares. En este sentido, los medicamentos pueden presentar diferentes comportamientos, así como también depende de la vulnerabilidad de las especies involucradas, lo cual puede no ser uniforme(63). Es necesario tener en cuenta que la microflora de los conductos infectados es usualmente mixta y predominantemente anaeróbica, lo cual debe guiar al clínico a seleccionar un agente antimicrobiano de amplio espectro para utilizarlo como medicación entre sesiones. Debe ser efectivo contra los diferentes tipos de bacterias aeróbicas, anaeróbicas y microaerofílicas, así como también ser activa en el proceso de alcalinización de los túbulos dentinarios, que impide la resorción dental mientras favorece el proceso de reparación del tejido periapical(51,64). La selección del medicamento se ha basado en su efectividad, toxicidad, potencial inflamatorio y difusión(65). Con respecto a esta última característica, Coelho et al.(66) señalan que cada medicamento presenta características de difusión diferentes, lo cual estará directamente relacionado con su interacción con la estructura dentaria. La potencial toxicidad en una medicación intraconducto es de extrema importancia, debido al dolor que durante el tratamiento endodóntico puede resultar de la penetración de una medicación tóxica dentro de los tejidos periapicales(67). Pear(68), en 1942, introdujo los siguientes requisitos que debe tener un fármaco que va a ser utilizado como medicamento intraconducto: es necesario que el agente a utilizar mantenga su efecto germicida por 48-60 horas cuando es sellado en el diente; debe esterilizar sin irritación y sin contacto conel microrganismo; sus vapores germicidas deben ser eliminados lentamente para establecer y mantener la esterilidad, y evitar cambios diarios de la aplicación; también estos vapores deben producirse a la temperatura corporal. Los medicamentos colocados dentro de la cámara o el conducto ejercen su actividad antimicrobiana por contacto directo con los microorganismos por vía de la acción de vapores de los componentes volátiles(70). La acción antimicrobiana en la porción apical de la raíz y dentro de los túbulos dentinarios depende de la volatilidad del medicamento. Éste debería vaporizarse y penetrar en el sistema de conductos completo para entrar en contacto directo con las bacterias. Como resultado de su volatilidad, sin embargo, el medicamento se pierde progresivamente de la torunda de algodón; si la pérdida es muy rápida, la duración de la efectividad antimicrobiana podría ser corta(55). Por su parte, Spangberg et al.(70) establecieron que la actividad antimicrobiana se obtiene si el agente está en contacto directo con el microorganismo, y esta consideración debe guiar la evaluación de los medicamentos endodónticos actuales y futuros. El medicamento ideal debe poseer una alta actividad antibacterial combinada con una baja toxicidad tisular(57,69,71).De hecho, un medicamento que posee una baja toxicidad pero por un largo período de tiempo, debe ser tan efectivo en la desinfección del conducto que uno que tiene una actividad antimicrobiana alta pero se disipa rápidamente(70). A esto se le agrega que debe poseer propiedades físico-químicas que permitan su difusión a través de los túbulos dentinarios y ramificaciones laterales del sistema de conductos radiculares y un tiempo suficiente de acción para eliminar bacterias(59). Debido a estudios de toxicidad, se ha demostrado, que la mayoría, sino todas los medicamentos intraconducto son capaces de irritar los tejidos periapicales, por lo que se recomienda que los mismos se limiten a los confines del conducto. La reacción tisular a los medicamentos intraconducto está influenciada por la cantidad de medicamento usado, la manera en la cual es colocado y sellado en el conducto, y el tamaño del foramen apical(71). La base para la elección de un medicamento intraconducto es el conocimiento de su mecanismo de acción sobre la microbiota predominante en conductos radiculares infectados. Por otra parte para lograr la eficacia completa del medicamento debe estar en contacto con la dentina por cierto tiempo; tomando en cuenta la invasión de microorganismos dentro de los túbulos dentinarios; el medicamento intraconducto debe ser capaz de penetrar los túbulos. Debe tener un tiempo de trabajo suficiente que permita su colocación dentro del conducto antes de que endurezca(72). Un medicamento intraconducto ideal debe ser al menos igual de radiopaco que la dentina circundante para permitir la confirmación radiográfica de la obturación del conducto inmediatamente después de ser colocado. Una baja viscosidad y un alto coeficiente de penetración son deseables para permitir el flujo del medicamenteo dentro del conducto. Por último, para que un medicamento tenga aplicación clinica debe ser fácil de introducir en el conducto para lograr un adecuado contacto con los tejidos,y además, debe ser fácil de remover para asegurar un sellado efectivo de la obturación(72).
Medicamentos Empleados Actualmente en la Terapia de Dientes con Pulpas Necróticas Clasificación de los medicamentos intraconductos A lo largo de los años, durante la terapia endodóntica se han utilizado gran variedad de antisépticos y sustancias con acción antimicrobiana en el interior de los conductos radiculares. Los antisépticos son medicamentos inespecíficos que actúan sobre todas las especies bacterianas de diversas maneras: los bactericidas por desnaturalización de las proteínas celulares o disminución de la tensión del medio con lo que se produce la alteración osmótica de la membrana celular; los bacteriostáticos no destruyen a los microorganismos sino que interfieren con sus procesos metabólicos, y reducen su capacidad reproductiva(51,60). Los medicamentos empleados en endodoncia se han clasificados según su composición química de la siguiente manera: 1.Compuestos fenólicos Son el grupo de sustancias más utilizadas en la medicación intraconducto. Los compuestos fenólicos derivados del benceno actúan como venenos protoplasmáticos, y de acuerdo con la concentración y vehículo, su acción puede ser desde antiséptica hasta cáustica(51,60). El fenol como tal, en cristales o licuados no solo es un pobre antiséptico sino que es sumamente cáustico por lo que no debe emplearse dentro de los conductos radiculares. Entre los compuestos fenólicos se encuentran: el eugenol, el paraclorofenol, paraclorofenol alcanforado, la cresatina o acetato de metacresilo, el cresol, la creosota y el timol. Todos son antisépticos potentes en contacto directo con las bacterias(51,60). Si bien en la endodoncia ya no se utiliza el fenol por su alto índice de toxicidad-eficacia, uno de sus derivados, el para-monoclorofenol (PMCP) ha sido muy utilizado como medicamento intraconducto y será descrito de una manera amplia más adelante(3). El eugenol es un alquifenol constituyente principalmente de la esencia de clavos, aunque puede obtenerse también de nuez, canela, alcanfor, etc. Con frecuencia se utiliza como apósito para controlar temporalmente el dolor después de exponer pulpa vital y no poder realizar la biopulpectomia; en estos casos se coloca en la cámara como analgésico(3,51). Tanto el eugenol preparado comercialmente como el químicamente puro difiere en la repuesta que provocan en los tejidos. El primero contiene impurezas que aumenta la reacción inflamatoria o pueden producir necrosis. También puede retardar la reparación apical por inhibir la adhesión de macrófagos. Al eugenol se le atribuye propiedad antinflamatoria por ser capaz de inhibir la síntesis de prostaglandinas(51,60). El eugenol puro es sedativo y antiséptico(50). La cresatina es el acetato de metacresilo. Aunque tiene poca actividad antiséptica, su estabilidad química la hace muy duradera, su baja tensión superficial le permite alcanzar todas las anfractuosidades del conducto, y además, al ser poco irritante, es perfectamente tolerada por los tejidos periapicales. La creosota es un líquido incoloro o amarillo claro con un olor y sabor muy acentuado y característico. Es un buen antiséptico, sedativo, anestésico y fungicida. Es muy irritante(50). El cresol es un líquido cuyo color varía de incoloro a amarillo oscuro, según la luz recibida y el envejecimiento del producto con el frasco abierto. Es cuatro veces más antiséptico que el fenol y mucho menos tóxico. La mayor parte de las veces se le ha utilizado como amortiguador del formol, acompañando a la célebre fórmula de Buckley, denominada formocresol o tricresolformol, y recomendada desde principios del siglo XX en el tratamiento de dientes con pulpa necrótica(50). El timol es un antiséptico sedativo suave, bien tolerado por los tejidos periapicales. Forma parte de numerosas combinaciones de antisépticos usados en la medicación entre sesiones, así como elemento de obturación y pastas como la de Maisto(51). Sus propiedades más valiosas son su extraordinaria estabilidad química y el ser muy bien tolerado tanto por la pulpa viva como por los tejidos periapicales(50). 2. Aldehídos El formaldehído, paraformaldehído o trioximetileno, glutaraldehido y formocresol han sido ampliamente utilizados en odontología y en endodoncia. Son agentes hidrosolubles que desnaturalizan proteínas y se encuentran entre los desinfectantes más potentes. Los aldehídos tienen aplicaciones en la desinfección de superficies y equipos que se puedan esterilizar, pero son muy tóxicos y alergénicos y algunos pueden ser carcinogénicos(3). Son potentes antimicrobianos, pero pueden causar una necrosis de los tejidos periapicales sin ocasionar ningún alivio del dolor. Su principal indicación es el tratamiento de conducto de pulpas expuestas en dientes temporales(59). La propiedad más importante de los aldehídos es su reacción con el material protéico formando compuestos inertes; por eso una indicación para su empleo es la recomendada por Bukley, aplicando el formocresol en la cámara antes de abordar el contenido séptico del conducto, a su vez la unión química con las proteínas de los microorganismo es la base de su acción bactericida(51). El paraformaldehído es la forma en polímero del formaldehído, mejor conocido por su inclusión en materiales de obturación del conducto radicular, como la pasta N2 y endometasona. Se descompone con lentitud para formar un monómero, el formaldehído; su propiedad tóxica, alergénica y genotóxica son iguales que las del formaldehído(3). La solución de formaldehído conocida como formol o formalina al 40%, es una mezcla de 37% de gas formaldehído en agua y 10 % de metanol, este último para prevenir su polimerización. Esta solución es de gran poder bactericida, pero por resultar sumamente irritante se le ha combinado con el cresol para amortiguar su potencial cáustico. El formocresol resultante de esta combinación es un medicamento que se utilizó mucho en procedimientos de pulpotomías, pero del cual preocupan sus propiedades tóxicas y mutagénicas. Sus características y mecanismo de acción se describirán más adelante(3,51). 3. Compuestos Halogenados Se utilizan en endodoncia desde principios de siglo XX. Estas sustancias incluyen el cloro y el yodo que se utilizan en diversas formulaciones. Son eficaces bactericidas aún en presencia de tejido orgánico y su toxicidad es muy baja. Ocasionalmente, pueden provocar reacciones alérgicas, por lo que debe interrogarse al paciente acerca de antecedentes de sensibilidad a dichos compuestos(3,51,60). Los compuestos de cloro más empleados en endodoncia son los hipocloritos debido a su acción antiséptica y disolvente sobre tejido vital, necrótico y fijado(51,73). Pueden destruir rápidamente bacterias vegetativas, bacterias formadoras de esporas, hongos, protozoarios y virus (incluyendo el HIV, retrovirus, y virus de la hepatitis A y B). En altas concentraciones pueden requerirse para destruir bacilos ácido-grasos y esporas bacterianas(74). El hipoclorito de sodio es universalmente utilizado como solución irrigadora en concentraciones que van del 1 al 5,25% y posee las siguientes propiedades: baja tensión superficial, lo que facilita su penetración a traves de las múltiples irregularidades del sistema de conductos radiculares; neutraliza los productos tóxicos en un tiempo breve, durante la preparación del conducto radicular; y acción antibacteriana, ya que libera oxígeno y cloro al entrar en contacto con el tejido pulpar; favorece la instrumentación, pudiendo penetrar los instrumentos con mayor facilidad en un medio húmedo(60). Además, tiene un pH alcalino, alrededor de 11,8, lo que neutraliza el medio ácido presente en los conductos radiculares, dificultando el desarrollo bacteriano; disolvente, porque es la sustancia que más facilita la disolución del tejido pulpar; produce deshidratación y solubilización de las sustancias protéicas, tanto de los restos pulpares como de las bacterias presentes; tiene acción detergente, actuando sobre los ácidos grasos saponificándolos, con lo que se transforman en jabones solubles, de fácil eliminación; acción irritante escasa, siempre que se utilice a concentraciones moderadas(60) La acción antiséptica del hipoclorito de sodio se debe a la liberación de cloro y oxígeno al entrar en contacto con el material orgánico. Su mecanismo de acción no ha sido bien dilucidado. Cuando el hipocloritos adicionado al agua, el ácido hipocloroso se forma, el cual tiene clorina activa, un agente oxidante fuerte. Las evidencias disponibles sugiere que la clorina ejerce su efecto antibacterial por la oxidación irreversible de grupos sulfhidrilos de enzimas esenciales, alterando las funciones metabólicas de la célula bacteriana(74). La irrigación copiosa y frecuente con una solución de hipoclorito débil puede mantener una reserva de clorina suficiente para eliminar un número significativo de células bacterianas(74). Esto ocurre en un breve lapso, agotando así su poder antiséptico, por lo que no puede ser empleado como medicación tópica entre sesiones. Para aprovechar sus propiedades bactericidas y disolventes del tejido pulpar y desechos necróticos, es necesario usar mucho volumen de irrigante y que éste llegue profundamente en el conducto(51). Su toxicidad es directamente proporcional a su concentración; puede causar síntomas graves como dolor, sensación de quemadura, edema, formación de hematoma, sangrado profuso del conducto, entre otros, si se inyecta mas allá del ápice(3,75). Al estudiar los efectos de la variación en las concentraciones y tiempo de reacción de una solución de hipoclorito de sodio al 5% y al 2.5% como solventesde tejido, se determinó que no existe diferencia; que su acción comienza inmediatamente y continúa al menos por una hora y que la dilución del hipoclorito en agua no afecta su acción solvente(76). Huque et al.(77), en 1998, demostraron que la combinación de la irrigación ultrasónica con el hipoclorito de sodio al 12% fue capaz de destruir Actinomyces israelii, Fusobacterium nucleatum, Peptoestreptococcus acnes, Streptococcus mutans y Streptococcus sanguis. Este método elimina eficientemente bacterias de la superficie y de las capas profundas de la dentina radicular.Esto puede deberse a una combinación de factores: el poder ultrasónico para eliminar la capa de desecho y destruir algunas bacterias y un aporte constante de irrigante para eliminar las bacterias. El yodo es otro compuesto halogenado que se utiliza como yoduro de potasio y en yodóforos, que son compuestos orgánicos que contienen yodo y liberan este elemento con el tiempo. También es un potente antibacteriano de baja toxicidad. En la actualidad se emplea como solución para irrigación y en apósitos a corto plazo, en una solución de yodo al 2% en yoduro potásico acuoso al 4%(3). La solución yodo&endash;yodurada de potasio es un antiséptico suave y poco irritante, más efectivo in vitro que in vivo. Puede utilizarse en casos resistentes al tratamiento; y se debe utilizar con precaución en los dientes anteriores por el peligro de causar tinciones(51,60). En pruebas realizadas in vivo e in vitro sobre la toxicidad e irritación del tejido causada por diferentes agentes antimicrobianos endodónticos, el medicamento menos irritante fue la solución yodoyodurada de potasio al 2%; fue el que produjo menos cambios en el tejido y un incremento insignificante de células inflamatorias(70). 4. Clorhexidina Esta sustancia al parecer tiene un gran potencial como medicamento para el interior del conducto, pero en endodoncia se ha utilizado poco con este fin. Su sustantividad, su espectro de actividad relativamente amplio y su baja toxicidad pueden hacerla muy adecuada para irrigación y aplicación de apósitos en endodoncia. Probablemente sería eficaz en concetraciones entre 0.2 y 2%(3,78). El mecanismo antimicrobiano de la clorhexidina se relaciona con su estructura molecular de bisbiguanida catiónica. La molécula catiónica de la membrana celular interna cargada negativamente, causa filtración de componentes intracelulares y muerte celular. En bajas concentraciones es bacteriostática. En altas concentraciones causará la coagulación y precipitación del citoplasma y además es bactericida(79,80) Ercan et al.(73) compararon la actividad antibacterial de soluciones irrigantes del conducto radicular en dientes con necrosis y patologías periapicales. Después de cuantificar las unidades formadoras de colonias, concluyeron que tanto el gluconato de clorhexidina como el hipoclorito de sodio fueron significativamente efectivos para reducir los microorganismos en dientes con pulpa necrótica, patología periapical o ambos, y pueden ser usados exitosamente como una solucion irrigante. También se ha demostrado su efectividad antibacterial cuando se compara con hipoclorito al 5.25%, EDTA 17%, hidróxido de calcio, peróxido de hidrógeno y solución salina. Tanto la clorhexidina al 2% como al 0.12% poseen actividad antimicrobiana residual por 72 horas cuando se usa como irrigante intraconducto. Esto lo demostraron Weber et al.(78), en su estudio donde los grupos experimentales tratados con clorhexidina demostraron actividad antimicrobiana residual después de 168 horas de la instrumentación. Como irrigante y medicamento intraconducto, la clorhexidina tiene una eficacia antibacterial comparable con la del hipoclorito de sodio y es efectiva contra cepas resistentes al hidróxido de calcio. Después de una exposición prolongada, al menos una semana, del conducto radicular a la clorhexidina puede resultar una actividad antimicrobiana residual(72). Estudios recientes sugieren su combinación con el hidróxido de calcio para mejorar la eficacia antimicrobiana contra microorganismos resistentes. La presencia de clorhexidina en gel y en diferentes concentraciones no altera el pH, ni la radiopacidad ni el tiempo de trabajo del hidróxido de calcio(72). En el estudio de Evans et al.(62), la eficacia antimicrobiana de esta mezcla fue mayor que la del hidróxido de calcio solo. Almyroudi et al.(57), en el 2002, estudiaron la clorhexidina en 3 diferentes fórmulas: gel, gel más pasta de hidróxido de calcio en proporciones iguales y dispositivos de liberación lenta. Todas las alternativas fueron efectivas contra Enterococcus faecalis en todos los períodos de tiempo y para todas las profundidades de dentina. La combinación de hidróxido de calcio y clorhexidina fue mejor que los dispositivos pero no fue significativa la diferencia. La dentina medicada con clorhexidina adquiere sustantividad antimicrobiana, pero para ello la medicación debe ser colocada por varios días, razón por la cual debe usarse un vehículo que pueda mantener su concentración por 7 días o más. Bajo esta premisa Lenet et al.(81) evaluaron in vitro la eficacia de 2 vehículos liberadores de clorhexidina: un dispositivo de liberación controlada y un gel. En este estudio E. Faecalis fue incapaz de colonizar los túbulos dentinarios por 21 días después que la dentina bovina fue medicada con clorhexidina al 2% por 7 días. Este hallazgo confirma que el gel es un vehículo efectivo. El dispositivo de liberación controlada no logró una sustantividad notable. Sin embargo, se plantea que la incapacidad de remover completamente el gel del conducto es probablemente el principal obstáculo para su aplicación como medicamento intraconducto, debido a que el gel residual dificulta el sellado durante la obturación(81). Lin et al.(79) evaluaron el efecto antibacteriano de la clorhexidina como una medicación intraconducto y como solución irrigante en los túbulos dentinarios, básicamente empleando dispositivos de liberación lenta en puntas de gutapercha Active Point®(Roeko, Langenau, Germany). Las puntas de clorhexidina se colocaron por 7 días en el conducto, tiempo suficiente para su penetración en los túbulos. No se detectaron bacterias más allá de 500 micrones en los túbulos. Estas puntas vienen estandarizadas y son radiopacas. Después de la preparación, se seleccionaron las puntas y se colocaron a la longitud de trabajo después de irrigar con solución salina. De esta manera se asegura su actividad antibacterial a lo largo del conducto y previene la extrusión a los tejidos periapicales. Su remoción es fácil después de 7-14 días, y no quedan remanentes en las paredes. Con respecto a su uso se requieren más estudios(79). Barthel et al.(82) compararon la efectividad de pastas de hidróxido de calcio recién mezclado, puntas de gutapercha que contienen hidróxido de calcio, un gel de clorhexidina y puntas de gutapercha que contienen clorhexidina, tomando en cuenta su capacidad para reducir la colonización del sistema de conductos radiculares sin el desbridamiento quimicomecánico adicional. Después de una semana con medicación, los grupos con pasta de hidróxido de calcio y con gel de clorhexidina, resultaron en muestras significativamente menores de crecimiento bacterial. El gel fue más efectivo que las puntas con clorhexidina, esto puede deberse al hecho de que el gel se adapta mejor a las irregularidades de las paredes del conducto. 5. MTAD Los métodos actuales de instrumentación endodóntica producen barrillo dentinario que cubre la superficie del conducto radicular. El barrillo dentinario contiene sustancias orgánicas e inorgánicas que incluyen fragmentos de procesos odontoblásticos, microorganismos, sus productos de desecho y materiales necróticos. Debido a su contaminación potencial y al efecto adverso sobre el resultado del tratamiento endodóntico, parece razonable sugerir la eliminación del barrillo dentinario para la desinfección de todo el sistema de conductos radiculares(83). Recientemente, se ha introducido el MTAD, una mezcla de un isómero de tetraciclina, un ácido y un detergente) como lavado final para la desinfección del sistema de conductos radiculares(85). El MTAD es una solución ácida con un pH de 2,15 que es capaz de eliminar sustancias inorgánicas(83). Las tetraciclinas, incluyendo tetraciclina-HCL, minociclina y doxiciclina son antibióticos de amplio espectro que son efectivos contra una gran variedad de microorganismos. Son de naturaleza bacteriostática, esto puede resultar una ventaja, debido a que en ausencia de lisis bacteriana, los productos antigénicos no son liberados(84). También tiene un pH bajo que puede actuar como un quelante del calcio y causa desmineralización del esmalte y la superficie radicular. Esta desmineralización de la superficie de la dentina es comparable con la que se logra con el ácido cítrico. Además se ha demostrado que es una medicación substantiva, se absorbe y es liberada gradualmente de las estructuras dentales tales como dentina y cemento(84). Finalmente, hay estudios que demuestran que la tetraciclina alcanza significativamente la cicatrización después de la terapia quirúrgica peridontal(85). Shabahang, Pouresmail y Torabinejad(86), compararon la capacidad del MTAD en la desinfección del conducto radicular humano infectado con saliva con la del hipoclorito de sodio. La desinfección de las muestras fue determinado basado en la presencia o ausencia de turbidez en los caldos de cultivos empleados durante 96 horas. 23 de 60 dientes tratados con hipoclorito de sodio permanecieron infectados; mientras que uno de 60 dientes dientes tratados con MTAD permanecieron infectados. Un hallazgo importante en esta investigación fue la capacidad del MTAD de ejercer su efecto antimicrobiano durante un tiempo breve. Esta propiedad es deseable en la práctica clínica donde los irrigantes empleados están en contacto con ciertas áreas del sistema de conductos radiculares por corto tiempo. Así, esta propiedad desinfectante obvia la necesidad de colocar un medicamento intraconducto necesitando múltiples sesiones(86). La eficacia del MTAD en la desinfección de la superficie interna y externa de las raíces es un resultado de la presencia del efecto antibacterial de la doxiciclina, su capacidad de remover sustancias orgánicas e inorgánicas de la superficie radicular, lo cual es facilitado por la presencia del ácido cítrico; y la presencia de un detergente que adiciona su capacidad de difundir dentro del conducto y los túbulos dentinarios. La reducción de la tensión superficial por los detergentes ha demostrado que mejora las propiedades(86). Torabinejad et al.(87) evaluaron in vitro el efecto antimicrobiano del MTAD sobre Enterococcus faecalis y compararon su eficacia con el hipoclorito de sodio y el EDTA. La medición de las zonas de inhibición y la determinación de las concentraciones inhibitorias mínimas mostraron que el MTAD es tan efectivo como el hipoclorito al 5,25% y significativamente más efectivo que el EDTA. Una observación significativa fue que el MTAD conserva sus propiedades bactericidas a pesar de ser diluído hasta 200 veces, en contraste con el hipoclorito que cesa su actividad antibacterial antes de la dilución 32. El EDTA no mostró actividad antibacterial. Torabinejad et al. (87) concluyeron en su trabajo que si bien el MTAD elimina gran parte del barrillo dentinario cuando se usa como solución irrigadora intraconducto, quedan algunos restos del componente orgánico del barrillo dentinario esparcidos sobre la superficie de las paredes del conducto radicular. La efectividad del MTAD en la eliminación completa del barrillo dentinario se ve favorecida cuando se emplean concentraciones bajas de hipoclorito de sodio como solución irrigadora intraconducto antes del empleo del MTAD como lavado final. Esta combinación y su secuencia no parecen variar significativamente la estructura de los túbulos. Por otra parte, Shabahang y Torabinejad(84), también compararon el efecto antimicrobiano del hipoclorito de sodio al 1,3% o 5,25% como irrigante intraconducto con y sin EDTA, y el MTAD como lavado final sobre conductos radiculares de dientes humanos extraídos contaminados con E. faecalis. El MTAD es significativamente mas efectivo sobre E. faecalis. Ninguna de las muestras tratadas con MTAD mostraron bacterias en los túbulos. Además es capaz de penetrar los túbulos dentinarios, y la presencia del detergente puede explicar esta última posibilidad. Comparado con el EDTA, el MTAD es una solución efectiva en la remoción de la capa de desecho y no produce cambios significativos sobre la estructura de los túbulos dentinarios cuando los conductos se irrigan con hipoclorito de sodio y luego se hace un lavado final con MTAD. Cuando el EDTA se usa alternado con 5,25% de hipoclorito, se remueve completamente la capa de desecho en el tercio medio y coronario de los conductos preparados, pero esta combinación es menos efectiva en el tercio apical; probablemente debido a un volumen o penetración inadecuada de la solución dentro de la porción apical. La apariencia de los túbulos muestra mayor cantidad de erosión con el EDTA(85). Con respecto al tiempo, un hallazgo significativo del estudio de Torabinejad et al.(87) fue la capacidad del MTAD de destruir E. faecalis después de una exposición de 2 a 5 minutos. Estos hallazgos coinciden con los resultados de pruebas de inhibición y dilución, que demuestran que el MTAD tiene un efecto antibacterial superior comparado con el hipoclorito o EDTA en un corto período de tiempo. De acuerdo con Park et al.(88), se observó que el uso de hipoclorito al 1,3% como irrigante intraconducto y una aplicación de MTAD por 5 minutos como lavado final para remover la capa de desecho, reduce la filtración coronal de dientes obturados con gutapercha y AH-plus. 6. Hidróxido de Calcio A partir de la combustión del carbonato cálcico se obtiene óxido de calcio y anhídrido carbónico. Cuando la primera sustancia se combina con agua se consigue hidróxido de calcio. Entre los antisépticos inespecíficos, el hidróxido de calcio tiene un alto poder bactericida y es tal vez la medicación más empleada en endodoncia. Fue introducido por Hermann en 1920 con la intención de favorecer los procesos de cicatrización, ya que sus principales efectos son su actividad antibacteriana y su capacidad para favorecer la formación de tejido calcificado(51,60). El hidróxido de calcio representa un auxiliar valioso de la terapéutica endodóntica; se utiliza en diversas situaciones clínicas por su función antibacteriana, debido a su alto pH. Posee beneficios adicionales por su actividad cauterizante, y también su consistencia de pasta que restringe físicamente la formación de colonias bacterianas en el espacio del conducto. Se aplica en una suspensión viscosa o cremosa, en agua estéril o soluciones salinas junto con otros aditivos o sin ellos(3). Por ser el medicamento más empleado actualmente en la terapia endodóntica será descrito ampliamente en un punto aparte. 7. Antibióticos El éxito en el uso de diversos antibióticos sistémicos y tópicos en otros campos de la medicina, los convirtió en candidatos probables para llevar su acción antibacteriana al conducto radicular. Pero existen tres preocupaciones principales sobre su uso en el conducto radicular:
Con respecto a la sensibilización, su uso tópico aumenta el riesgo de que el paciente se vuelva alérgico al mismo. Pueden ocurrir reacciones anafilácticas que ponen en peligro la vida por la administración de antibiótico a personas sensibilizadas(3). El espectro limitado se refiere al hecho que ningún antibiótico es eficaz contra todos los microorganismos endodónticos. Tomando en cuenta que la mayor parte de las infecciones endodónticas son causadas por una combinación de especies, es poco probable que un solo antibiótico logre inhibir o eliminar con eficacia todas las bacterias(3). Dentro del arsenal de antibióticos que a lo largo de los años se han empleado como medicamento intraconducto se encuentran:
Desde los años 50 se han propuestos numerosas combinaciones de antibióticos para ser usadas como medicación temporal en los conductos radiculares. Más recientemente se han propuesto combinaciones de ciprofloxacina, metrodinazol y amoxicilina, o sustituyendo la amoxicilina por minociclina y manteniéndolos por un período de 24 horas en el conducto radicular. Su efecto antibacteriano es eficaz, similar al del paraclorofenol alcanforado y con menos efectos citotóxicos(60) Por otra parte, para conseguir un postoperatorio libre de dolor se han combinados antibióticos con corticoides. Los corticoides en su forma natural o sintética son los antinflamatorios eficaces de los que se disponen. Entre las diversas acciones específicas de estas hormonas, que dan lugar a la reducción significativa de la fase aguda del proceso inflamatorio se incluyen: estabilización de la membrana lisosómica, inhibición de la síntesis y de la acción de mediadores químicos y reducción de la permeabilidad vascular(53). La presencia de antibióticos en la fórmula se justifica por la necesidad de combatir una eventual contaminación bacteriana producida durante la preparación, considerando que las defensas están reducidas por acción del corticoide(53). Gran cantidad de efectos colaterales, como la reducción de la actividad metabólica celular, y el retardo de la reparación tisular obligan a tener cuidado al usar estos medicamentos, inclusive en forma local. Se recomienda la permanencia del fármaco en el conducto por períodos breves, inferiores a 7 días; para plazo mayores está indicado la utilización de una pasta con hidróxido de calcio(53).
Medicamentos empleados en los casos de necrosis pulpar en el Postgrado de Endodoncia de la Universidad Central de Venezuela Formocresol Características del formocresol El formocresol es un aldehído que resulta de la combinación de partes iguales de formalina y cresol(51,89). El líquido oleoso tiene un extraño olor picante, atribuible principalmente a la presencia de formalina. Se trata de un antiséptico muy empleado en endodoncia, a pesar de la controversia que ha surgido acerca de su potencial mutagénico y carcinogénico(51). Las apreciaciones de diversos endodoncistas acerca del empleo del formocresol como antiséptico para el tratamiento de conductos radiculares, tiene como base los resultados de múltiples investigaciones. En este sentido, el estudio de Pear(68), determinó si alguna droga o combinación de drogas usadas en la terapia endodóntica podía ayudar en la esterilización de los conductos sin estar en contacto con los microrganismos. Se evalúo en placas de agar la inhibición del crecimiento bacterial, y los resultados demostraron que el formocresol fue la droga más eficiente, seguida del monoclorofenol alcanforado y el merthiolate. Se concluyó que no se necesita gran cantidad de la droga para lograr su efecto durante el tratamiento. El estudio de Wesley et al.(90) demostró que pequeñas dosis de formocresol (0,0025ml) son efectivas para la inhibición de Staphylococcus aureus y Streptoccocus faecalis; y estas pequeñas dosis pueden de hecho, no ser irritantes. Treanor y Goldman(91) demostraron que el formocresol es el medicamento más efectivo a las 72 horas. De igual manera Vander Wal et al.(58) encontraron que es la única droga efectiva sin tener contacto con la pared bacterial y fue la única que inhibió el crecimiento de Staphylococcus aureus alrededor del ápice de los dientes. Ohara et al.(25), en 1993, investigaron el efecto antibacterial de los vapores de varios medicamentos endodónticos sobre 6 bacterias anaeróbicas seleccionadas. Utilizaron placas de agar con las bacterias, y evaluaron las zonas de inhibición: el formocresol produjo zonas de inhibición significativamente mayores que cualquier otro medicamento(58) Con respecto a sus efectos adversos, Thé et al.(92) evaluaron los efectos irritantes de los agentes desinfectantes, tanto en contacto directo como a cierta distancia del tejido subcutáneo de la espalda de conejillos de indias. Se emplearon tubos de polietileno y después de 10 días los animales fueron sacrificados y se hizo la evaluación histológica. Se encontró que el formocresol produjo irritación moderada a cierta distancia e irritación severa y necrosis en contacto directo. Los ingredientes activos del formocresol, son el formaldehído, un clásico fijador histológico, el cual es mutagénico y carcinogénico a grandes dosis; y el tricresol, un compuesto lipofílico el cual disuelve las membranas celulares. Como es de esperarse el formocresol es tóxico a la pulpa y los resultados experimentales sugieren que puede ser tóxico a otros órganos cuando se usa en pulpotomías simultáneamente. La información disponible también sugiere que el nivel de formaldehído que se distribuye sistémicamente después del tratamiento pulpar no es realmente capaz de producir respuestas mutagénicas o carcinogénicas(93). Mecanismo de acción del Formocresol La propiedad más importante de los aldehídos es su reacción con el material protéico formando compuestos inertes. El colocar el formocresol en la cámara pulpar antes de abordar el contenido séptico del conducto, tiene un efecto bactericida debido a la unión química que se produce con las proteínas de los microorganismos(51). El formocresol es un poderoso desinfectante que no sólo irrita, sino también destruye y fija el tejido(89). Pear(68), en 1942, encontró que la inhibición del crecimiento bacterial lograda por el formocresol, se debió completamente a los vapores o gases producidos a la temperatura corporal, pues no estaba en contacto directo con el microorganismo. En el estudio de Ellerbruch y Murphy(69) donde se evaluó in vitro la actividad antimicrobiana de los vapores de seis medicamentos endodónticos, se demostró que la actividad antimicrobial del formocresol fue mayor que la de otros medicamentos, pero su actividad fue más bacteriostática que bactericida y producida por el efecto de sus vapores. De acuerdo con el estudio de Danker y Wemes(94), en 1976, la difusión del medicamento en el conducto radicular es una función de la edad del diente. La penetración del formocresol se encontró en dientes de pacientes menores de 41 años, pero en aquellos menores de 21, los valores de zonas de inhibición fue tres veces mayor que aquellos del grupo entre 31 y 40 años. Si se asume que la difusión en la dentina tiene lugar a través de los túbulos dentinarios, en el caso de pacientes mayores estos canales pueden estar parcial o completamente ocluídos, resultando en una difusión reducida.
Paramonoclorofenol Alcanforado Características del Paramonoclorofenol Alcanforado El paramonoclorofenol alcanforado es un antiséptico intraconducto muy utilizado. Fue introducido en odontología por Walkhoff en 1891. Es un derivado del fenol, sólido a temperatura ambiente. Se obtiene al triturar cristales de paraclorofenol con alcanfor. La proporción aproximada es de dos partes de paraclorofenol por tres de alcanfor (35 y 65 grs. respectivamente). El resultado es un líquido oleoso, color ambar, con un característico olor penetrante(50,53,60,89,95,96). El propósito del alcanfor además de servir como vehículo es reducir su acción irritante, debido a que causa una liberación más lenta del paramonoclorofenol de lo cual resulta un fármaco con bajo poder de agresión a los tejidos. Es un agente altamente efectivo contra la variedad de microorganismo presentes en los conductos radiculares infectados, pero es irritante de los tejidos periapicales(50,53,60,89,95,96). El paramonoclorofenol forma parte de numerosas combinaciones de antiséptico como el Cresophene, Clorotimonol, Cresanol y Neogrove. También es componente de pastas antisépticas como las de Walkhoff y Maisto, así como de pastas alcalinas como las de Frank, Holland o Leonardo, que lo combinan con el hidróxido de calcio; estas pastas son de suma utilidad como medicación tópica de conductos con lesiones periapicales crónicas por su efectividad frente a una flora mixta y fundamentalmente anaeróbica(51). Soekanto et al.(95) evaluaron la genotoxicidad y citotoxicidad de los compuestos fenólicos y señalan que el paramonoclorofenol alcanforado es citotóxico, especialmente sobre los fibroblastos pulpares humanos, y que el alcanfor incrementa su toxicidad más que reducirla. Sin embargo, aunque es un medicamento sumamente tóxico, la evidencia clínica de los efectos tóxicos es rara vez observada. La razón es que no está en contacto directo con tejido vital cuando se aplica en los conductos o en la cámara pulpar. En este sentido, Chang et al.(97) estudiaron los efectos patológicos y biológicos de diversos compuestos fenólicos sobre los fibroblastos de la pulpa dental humana utilizando pruebas de inmunofluorescencia y de precipitación del ADN. Todos los compuestos, que incluían al fenol, guayacol, eugenol y timol, mostraron citotoxicidad por inhibición del ADN celular de una manera dependiente de la concentración. Los resultados indicaron que estos compuestos son citotóxicos pero no tienen efectos genotóxicos sobre los fibroblastos de la pulpa in vivo. Spangber et al.(70) encontraron que el paramonoclorofenol alcanforado es significativamente más tóxico que la Cresatina. La inflamación causada por éste es ligeramente significativa después de 24 horas y excede el daño vascular causado por la cresatina. Demostraron que es el antiséptico más tóxico e irritante de los cinco medicamentos evaluados, seguido por la cresatina, formocresol, fenol alcanforado, yodo-ioduro de potasio. En el estudio de Siqueira et al.(98), sobre la recontaminación de conductos radiculares de conductos medicados con paramonoclorofenol alcanforado o hidróxido de calcio no sellados coronalmente, se encontró que el paramonoclorofenol alcanforado en torundas de algodón fue significativamente menos efectivo en prevenir la recontaminación del conducto radicular más que la pasta de hidróxido de calcio. Cuando actúa como una barrera mecánica puede ser diluído y neutralizado por la saliva, perdiendo su efecto. Harrison y Madonia(99), en 1970, se propusieron determinar la concentración antimicrobiana efectiva de paraclorofenol contra microorganismos comúnmente encontrados en el sistema de conducto radicular. Encontraron que fue efectivo contra los 10 microorganismos evaluados en una concentración que varió entre 1,2 x 10 -3 a 4,0 x 10 -4 gm x ml . Concluyeron que es un agente antimicrobiano efectivo en muy bajas concentraciones y esto tiene la ventaja que reduce su potencial de toxicidad, por lo tanto se cuestiona el uso de concentraciones del 35% Es obvio que la toxicidad del paraclorofenol aumenta con la concentración y que depende del vehículo empleado para disolverlo. Disminuyendo la concentración del paraclorofenol y eligiendo el solvente menos tóxico, pueden hacerse preparaciones atóxicas de paraclorofenol alcanforado(61). Con estas características, se encuentra la solución acuosa de paraclorofenol al 1% con un espectro antibacteriano amplio y eficaz aunado a una baja toxicidad tisular. Esta solución acuosa estable, incolora, fácil de usar, casi inodora, incapaz de manchar, con gran penetración y casi atóxica, se aproxima al antiséptico ideal; sin embargo, su vida terapéutica in situ es de solo tres días, y resulta eficaz contra solamente un 94 a 95% de todas las bacterias endodónticas. La irritación periapical es rara siempre que el antiséptico se encuentre confinado dentro del conducto radicular(61). Con respecto al paraclorofenol al 2% en acetato de metacresil, éste último es un mal antiséptico, aunque posee gran capacidad anodina respecto a los tejidos periapicales. Aunque aumenta la toxicidad, permanece en un nivel bajo(61). El paraclorofenol al 2% en eugenol se emplea como un apósito intermedio en pulpectomías parciales. Las cualidades anodinas y antimicrobianas suelen ser muy deseables, a la vez que la toxicidad resulta un fenómeno de poco importancia(61). También se ha estudiado la combinación del paramonoclorofenol con el hidróxido de calcio, demostrándose que paramonoclorofenol incrementa los efectos antibacteriales del hidróxido. Esta combinación destruye bacterias en los túbulos en un período de 1 hora excepto para el Enterococcus faecalis, para el cual se requiere un día . La combinación del paramonoclorofenol alcanforado e hidróxido produce una sal pesada, paramonoclorofenolato de calcio, la cual en un ambiente acuoso libera lentamente el paramonoclorofenol y el hidróxido de calcio(18). El paramonoclorofenol alcanforado tiene una importante acción sobre los microorganismos aeróbicos más resistente al tratamiento; es comparativamente menos activo sobre anaeróbicos, y es prácticamente no irritante en condiciones de uso clínico(100). Debido a la baja dosis y frecuencia de exposición, su uso clínico es generalmente seguro para los humanos. Sin embargo, en altas concentraciones son altamente citotóxicos, razón por la cual debe reducirse la posibilidad de irritación pulpar y periapical por la extrusión inadvertida de éstos en el tratamiento clínico hasta que sus efectos sean más ampliamente estudiados(97). Como características desfavorables se incluyen su acción básicamente por contacto y la neutralización de su efecto en presencia de materia orgánica. El Paramonoclorofenol alcanforado es una alternativa en conductos estrechos, donde es difícil aplicar la pasta alcalina o cuando la permanencia de la medicación temporaria es inferior a 7días, tiempo en que el hidróxido de calcio no muestra eficiencia total(53). El paramonoclorofenol alcanforado si bien es cierto que aparece como citotóxico, ha demostrado buenas propiedades antimicrobianas y ha sido uno de los antisépticos más empleados en conductos infectados aun cuando su utilización haya disminuído en los últimos años con el incremento del uso del hidróxido de calcio(100). Mecanismo de acción del Paramonoclorofenol Alcanforado El paramonoclorofenol alcanforado es un halofenol cuya acción antiséptica se debe fundamentalmente a la lenta liberación de cloro naciente. Es un efectivo bactericida cuando se pone en contacto directo con las bacterias, pero no produce inhibición del desarrollo bacteriano cuando los vapores son los únicos responsables de su actividad (51). El mecanismo de acción antiséptico se debe a la ruptura de la pared celular bacteriana y precipitaciones de las proteínas celulares; consecuentemente, también ocurre la inactivación del sistema de enzimas esenciales, o filtración del metabolismo esencial. De igual manera se ha reportado que inhibe la biosíntesis de prostaglandinas(101). Llamas et al.(96) señalan que el paramonoclorofenol alcanforado disminuye la capacidad de adherencia de los macrófagos inflamatorios de una manera dosis dependiente; tomando en cuenta que la adhesión es el primer paso en el proceso de fagocitosis de los macrófagos y en la presentación del antígeno, el paraclorofenol y paramonoclorofenol alcanforado, podrían inhibir la función del macrófago y modular reacciones inflamatorias e inmunes en los tejidosperiapicales que conllevan a los procesos reparativos. En este sentido, Barid et al.(102), en el año 2002, encontraron que el paramonoclorofenol alcanforado reduce la capacidad adherente de los macrófagos de murina después del pretratamiento de estas células con el medicamento, lo que puede llevar a una disminución de la función fagocítica de estas células. Una posibilidad que se plantea es que el paramonoclorofenol alcanforado en baja concentración podría desregular las moléculas de adhesión, posiblemente CD11b, CD18 y CD54, sobre la superficie de los macrófagos, las cuales son requeridas para la adherencia de estas células. Este estudio soporta la idea de que el uso de los compuestos fenólicos como parte del tratamiento endodóntico debería evitarse. Por otra parte, Chang et al.(103) estudiaron los efectos del paramonoclorofenol alcanforado sobre las células del ligamento periodontal humano y encontraron que este medicamento inhibe la viabilidad y la proliferación de las células del ligamento periodontal de una manera dosis dependiente, razón por la cual se cree que podría causar daños en el periodonto e impedir la cicatrización y regeneración periodontal. Esto debe considerarse sobre todo en los casos donde se vayan a realizar procedimientos de regeneracion periodontal. Su acción antibacteriana deriva de los dos radicales que lo componen, el fenol y el cloro. Posee un notable efecto antibacteriano, con una toxicidad sobre los tejidos vitales. Aunque este efecto, según parece, es algo menor que el de otros antisépticos, su aplicación puede retardar la reparación apical(60). Su efecto desaparece en un 90% en las primeras 24 horas cuando se coloca impregnado un algodón en la cámara pulpar. Cuando se deposita en el interior de los conductos radiculares, su efecto no se limita a ellos sino que, a través del ápice se ha demostrado su distribución sistémica, detectándose en sangre y orina aunque no se conoce bien la posible repercusión de estos hallazgos(60). Su baja tensión superficial puede facilitar su difusión a través de los túbulos dentinarios y de los conductos secundarios(65,66). De acuerdo con Avny et al.(104),el paramonoclorofenol alcanforado colocado sobre torunda de algodón penetra un máximo de 0,40 milimetros dentro de la dentina del tercio coronal, 0,25 milimetros en el tercio medio y 0,05 milimetros en el tercio apical. Por su parte Vander Wall et al. (71) señalan en relación a los resultados obtenidos para el uso clínico del paramonoclorofenol alcanforado, que la droga debe estar próxima a las bacterias para ser efectiva. Los vapores no inhiben el crecimiento de las bacterias en las placas Petri y tampoco en el área apical simulada, concluyendo que el paramonoclorofenol alcanforado no se difunde a través de los túbulos dentinarios y recomiendan colocarlo con puntas de papel. Los resultados del estudio de Harrison y Madonia(99), demuestran las cualidades de toxicidad severa del paramonoclorofenol alcanforado así como también su habilidad para coagular las proteínas. En las pruebas de toxicidad dérmicas, la necrosis por coagulación fue evidente a las 24 y 72 horas.
Hidróxido de Calcio Características del hidróxido de calcio El hidróxido de calcio es utilizado más comúnmente en el tratamiento de conducto como medicamento intraconducto. Su uso se ha incrementado con respecto a otros medicamentos tradicionales como los compuestos fenólicos y los aldehídos, que han declinado en popularidad por un número de buenas razones. Aunque no existen recomendaciones específicas sobre cuándo debería colocarse hidróxido de calcio, la indicación general es en la necrosis pulpar(105). Introducido por B.W. Herman en 1920, el hidróxido de calcio es un polvo blanco, granular, amorfo y fino, con la fórmula Ca(OH)2 y un peso molecular de 74,08. Se obtiene por calcinación del carbonato cálcico y posee marcadas propiedades básicas, como un pH muy acalino, aproximadamente de 12,4, lo cual le confiere propiedades bactericidas. Su densidad es de 2,1, puede disolverse ligeramente en agua y es insoluble en alcohol con la particularidad de que al aumentar la temperatura disminuye su solubilidad(106,107). Debido a su baja solubilidad, una gran cantidad de hidróxido de calcio puede ser compactado dentro del conducto con poco riesgo de irritación periapical(63). Posee una actividad cauterizante y por su consistencia de pasta restringe físicamente la formación de colonias bacterianas en el espacio del conducto(3). Ha sido utilizado para una amplia variedad de propósitos que incluyen protector de cavidades, recubrimiento pulpar directo e indirecto, pulpotomía vital, medicación del conducto radicular entre citas, prevención de resorción radicular, reparación de perforaciones iatrogénicas, tratamiento de fracturas radiculares horizontales y como constituyente de selladores del conducto radicular. Tiene la capacidad de inducir la formación de tejido duro, causa oclusión intratubular, tiene acción antibacteriana y capacidad de disolver tejidos(79,108-110). Las pastas de hidróxido de calcio actúan como una barrera físicomecánica que retarda significativamente la recontaminación del conducto. Sin embargo, ante la presencia de fluídos biológicos o tejidos que poseen sustancias buffer, los efectos antibacterianos pueden llegar a ser limitados(111). El hidróxido de calcio se utiliza mezclado con diversos vehículos que por lo general no tienen actividad antibacteriana significativa(110). A estas combinaciones se les denominó pastas alcalinas por su elevado pH y se caracterizan por:
El añadido de sustancias al hidróxido de calcio tiene diversas finalidades: facilitar su uso clínico, mantener sus propiedades biológicas (pH elevado, disociación iónica), mejorar su fluidez, incrementar la radiopacidad(66). El vehículo ideal debe: permitir una disociación lenta y gradual de los iones de calcio (Ca) e hidroxilo (OH-); permitir una liberación lenta en los tejidos, con una solubilidad baja en sus fluídos; no tener un efecto adverso en su acción de favorecer la aposición de tejidos calcificados(60). Se utiliza mezclado con 3 tipos principales de vehículos acuosos, viscosos y oleosos. El primer grupo está representado por sustancias solubles en agua, que incluyen agua, solución salina y anestesia dental con o sin vasoconstrictor. También lo son la solución Ringer, suspensión acuosa de metilcelulosa o carboximetilcelulosa y solución detergente aniónica. Cuando el hidróxido de calcio es mezclado con una de estas sustancias se liberan rápidamente iones de Ca e OH-(107). Comúnmente los vehículos acuosos, tales como solución salina, agua destilada o anestesia, no afectan significativamente el pH de las soluciones de hidróxido de calcio. Altas concentraciones de glicerina o propilenglicol reducen la conductividad de las soluciones de hidróxido de calcio, sugiriendo que no se disocia en estos vehículos y por lo tanto disminuyen su efectividad como medicamento intraconducto(112). Dentro de los vehículos viscosos, se han empleado glicerina, polietilenglicol y propilenglicol, con el objetivo de disminuir la solubilidad de la pasta y prolongar la liberación iónica. El alto peso molecular de estos vehículos, minimiza la dispersión del hidróxido de calcio dentro de los tejidos y mantiene la pasta en el área deseada por mayores intervalos. La pasta que contiene estos vehículos puede permanecer en el conducto por 2-4 meses(60,107). Los vehículos oleosos son sustancias no solubles en agua que promueven una difusión y solubilidad de la pasta más baja. Dentro de ellos se encuentran: aceite de oliva, aceite de silicona, y diversos ácidos grasos como el oleico y linoleico. Retardan aun más la liberación iónica y permiten esta acción dentro del conducto durante períodos prolongados sin necesidad de remover la medicación(60,107). Las situaciones clínicas que requieren una rápida liberación iónica en el comienzo del tratamiento requieren una pasta de hidróxido de calcio que contenga un vehículo acuoso; mientras que situaciones clínicas que requieren una liberación uniforme y gradual, una pasta que contiene vehículos oleosos se usa para una disociación iónica muy lenta(60,107). Recientemente se han presentado unas puntas de gutapercha que incorporan hidróxido de calcio en su composición, para ser utilizadas con mayor comodidad como medicación temporal. La punta de gutapercha que libera hidróxido de calcio tiene un potencial de alcalinización no sólo significativamente más bajo comparado con el uso de una suspensión acuosa, y este potencial no puede mantenerse por más de tres días(113). En su fabricación, la cantidad de hidróxido de calcio incorporada en una punta de gutapercha Nº 35 es un 58% del peso; esto fue computado y es 0,7 gramos de polvo de hidróxido de calcio por diente basado en el peso promedio de la punta o probablemente, contiene también un químico que permite que el ambiente intraconducto influya probablemente en la disociación del hidróxido. En este estudio se demostró que las puntas de hidróxido de calcio mantienen unilateralmente un pH de 9,5 x 57 horas, mientras que la solución acuosa lo mantiene por un promedio de 203 horas(113). El estudio de Roach et al.(111) demostró que las puntas de hidróxido de calcio son inefectivas en la prevención de la recontaminación del sistema de conducto, tanto preparados comerciales como el hidróxido de calcio mezclado con solucion salina son altamente efectivos como medicamento intraconducto antimicrobiano(65). Con respecto a los cambios de pH que puedan presentarse con los vehículos empleados, Solak y Oztan(110), utilizando un medidor de pH digital y evaluando vehículos acuosos como agua, dos soluciones anestésicas y solución fisiológica, determinaron con los resultados que los cuatro vehículos demostraron cambios de pH similares que se encuentran entre 11 y 12 Debido también a su alto pH, el hidróxido de calcio como medicamento intraconducto actúa como un agente efectivo en la remoción de detritos tisulares que permanecen en las paredes del conducto radicular , es decir, tiene la capacidad de disolver tejido orgánico. Esto lo demostraron Wadachi et al. (58), quienes con los resultados obtenidos con escaneo con microscopio electrónico demostraron que el tratamiento con hidróxido de calcio a corto plazo podía disolver la mayoría del tejido pulpar sobre la pared del conducto, excepto la predentina. La acción disolvente del hidróxido de calcio puede colaborar en la etapa de desbridamiento y asi favorecer la desinfección del conducto. A la luz de los conocimientos actuales los efectos disolventes del hidróxido de calcio no son tan enérgicos como para solubilizar espesas redes de colágeno o predentina, por lo cual sigue siend más eficaz el hipoclorito de sodio(51). Con respecto Al tiempo en el cual debe ser empleado, en el estudio de Sjögren et al.(114) se demostró que el hidróxido de calcio es altamente efectivo en la destrucción de la flora del conducto radicular persistente, cuando los conductos fueron medicados por 7 días. Su espectro antibacterial limitado no afecta a todos los miembros de la microbiota endodóntica. Además, las propiedades fisicoquímicas de estas sustancias pueden limitar su efectividad en la desinfección del sistema del conducto completa después de su uso por un corto tiempo (114). Una desventaja del hidróxido de calcio es que se asume que pierde el efecto hacia microorganismos específicos del conducto radicular, es difícil de remover del conducto, y a su vez puede disminuir el tiempo de fraguado de los selladores a base de óxido de zinc eugenol(57). Mecanismo de acción del Hidróxido de Calcio El hidróxido de calcio tiene un alto poder bactericida y es tal vez la medicacion más empleada en endodoncia como complemento de la preparación biomecánica. Su acción antiséptica se debe fundamentalmente a su alto pH, que hace incompatible el desarrollo bacteriano en su contacto(51,56). La acción del hidróxido de calcio como medicamento intraconducto puede ser explicada por la difusión de iones hidroxilos a través de la dentina, lo cual influye en el crecimiento y multiplicación bacteriana(115). El efecto de su pH altera el transporte de nutrientes y componentes orgánicos a través de la membrana citoplasmática, inhibiendo las actividades enzimáticas que son esenciales para la vida bacteriana, tales como metabolismo, crecimiento y división celular, y ejerciendo una acción tóxica para la bacteria(115,116). También activa la fosfatasa alcalina, una enzima hidrolítica íntimamente relacionada con el proceso de mineralización del tejido. Por estas razones, se cree que el hidróxido de calcio presenta dos propiedades enzimáticas esenciales: inhibición de las enzimas bacterianas por su efecto antibacterial y activación de las enzimas tisulares, tal como la fosfatasa alcalina, la cual favorece la restauración del tejido a través de la mineralización(115,116). Con respecto a su actividad antimicrobiana, Siqueira y Lopes(108), señalan que está relacionada con la liberación de iones hidroxilos en un ambiente acuoso. Los iones hidroxilos son radicales libres altamente oxidantes que muestran reactividad extrema, reaccionando con diversas biomoléculas. Sus efectos letales sobre las células bacterianas se deben probablemente a los siguientes mecanismos: a) Lesión a la membrana citoplasmática bacteriana Los iones hidroxilos inducen peroxidación de lípidos, resultando en la destrucción de fosfolípidos, componentes estructurales de la membrana celular. Los iones hidroxilos remueven átomos de hidrógeno de los ácidos grasos insaturados generando radicales lipídicos libres. Estos radicales reaccionan con el oxígeno, resultando en la formación de un radical peróxido lipídico, el cual remueve otros átomos de hidrógeno de un ácido graso secundario, generando peróxido lipídico. Así, los peróxidos por si mismo actúan como radicales libres, iniciando una reacción en cadena autocatalítica y resultando en una pérdida de ácidos grasos insaturados y daño extenso a la membrana (56,64). b) Desnaturalización de proteínas La alcalinización provista por el hidróxido de calcio induce la ruptura de puentes iónicos que mantienen la estructura terciaria de las proteínas, como consecuencia la enzima mantiene su estructura covalente pero la cadena polipeptídica se desintegra al azar en conformación espacial variable e irregular. Estos cambios frecuentemente resultan en la pérdida de actividad biológica de la enzima y ruptura del metabolismo celular(56,64). c) Daño al ADN Los iones hidroxilos reaccionan con el ADN bacterial e inducen la división de las cadenas.Como consecuencia, la replicación del ADN se inhibe y la actividad celular se altera. Los radicales libres pueden inducir también mutaciones letales(56,64). El mecanismo de acción de las pastas de hidróxido de calcio no es totalmente conocido y éste se basa principalmente en la disociación de iones de calcio e hidroxilo que aumentan el pH en los tejidos vitales, produciendo los siguientes efectos: - Inhibición del crecimiento bacteriano El incremento del pH producido al liberarse los iones hidroxilos, impiden el crecimiento bacteriano. El hidróxido de calcio también altera las propiedades del lipopolisacárido (LPS) presente en la pared celular de muchas bacterias anaeróbicas, que actúan como mediadores de la inflamación. El hidróxido de calcio hidroliza la fracción lipídica de los LPS, por lo que pueden ser capaces de producir efectos biológicos como toxicidad, pirogenicidad, activación de macrófagos , y activación del complemento(5). - Disolución de tejido pulpar. La pasta de hidróxido de calcio favorece la disolución de los restos de tejido pulpar en condiciones de anaerobiosis(5). - Reparación hística La medicación temporal con pastas de hidróxido de calcio se ha utilizado en el interior de los conductos con la intención de favorecer la aposición de tejido calcificado que oblitere el orificio apical, especialmente cuando el ápice está incompletamente formado, para favorecer la reparación apical en los casos de periodontitis con osteolisis notable, o posibles lesiones quísticas y para prevenir la resorcion inflamatoria radicular(60). El mecanismo por el cual el hidróxido de calcio favorece la reparación hística y la aposición de tejido calcificado no se conoce bien. Por una parte es innegable el efecto de inhibición microbiana, imprescindible para conseguir una reparación de los tejidos. Se cree que los iones de calcio pueden interaccionar con aniones tales como la fosfatasa alcalina, ocasionando diversos efectos favorables a la reparación, como la producción de energia por fosforilación oxidativa(60). Es posible que tenga también un efecto indirecto. El hidróxido de calcio disminuye la producción de prostaglandinas en cultivos de monocitos estimulados por LPS. De este modo, favorece la reparación hística, más que estimulando la osteogénesis y cementogénesis, inhibiendo la lisis ósea y cementaria mediada por las prostaglandinas. Otro mecanismo de acción sugerido incluye la contracción de capilares, la formación dE una barrera fibrosa o de un tapón apicaL(54). Al ser aplicado sobre una pulpa vital, su acción cáustica provoca una zona de necrosis estéril y superficial con hemólisis y coagulación de las albúminas, quedando atenuada por la formación de una capa subyacente compacta, compuesta por carbonato de calcio, debida al CO2 de los tejidos y de las proteínas, producto de la estimulación dentinaria(106). En dientes desvitalizados se le adjudica a su uso el potencial osteogénico u osteoinductor, lo que añade beneficios como la estimulación biológica de deposición de tejidos duros, y en su defecto, estimulación del proceso de reparación(106). Se ha demostrado que los iones hidroxilos del hidróxido de calcio se difunden a través de los túbulos y crean un pH de 9 en la superficie radicular. Este pH es probablemente bactericida, pero también puede ser dañino a las células, de tal manera que el tratamiento con hidróxido de calcio puede ser perjudicial para la adherencia y función vital de las células del ligamento periodontal, e interferir con la cicatrización sobre la superficie radicular(107). La mayoría de los investigadores consideran que la preparación de hidróxido de calcio disminuye la migración celular y la síntesis de ADN de las células del ligamento periodontal, debido a que el punto óptimo para la vitalidad y viabilidad celular esta entre 7,2 y 7,5(110). Coelho et al.(66) empleando la cromatografía líquida de alto perfil, el cual es un método que permite separar los compuestos de soluciones complejas, analizaron medicamentos intraconducto como el hidróxido de calcio empleando cinco vehículos diferentes, y concluyeron que no sólo iones de hidróxido de calcio sino también una considerable cantidad de otros componentes de la pasta se difunden a través de la dentina y alcanzan la superficie radicular exterior. Sugieren realizar futuras investigaciones para determinar cuáles componentes penetran la dentina, en qué cantidad y cómo afectan al ligamento periodontal. En 1995, Kontakiotis et al.(117) estudiaron in vitro la capacidad del hidróxido de calcio de absorber dióxido de carbono del conducto radicular como un mecanismo que contribuye a su actividad antibacterial. El hidróxido de calcio es químicamente una base que puede reaccionar con gases y absorberlos. Si tal reacción puede tener lugar dentro del conducto radicular, éste puede ser otro mecanismo de acción antibacterial, ya que diversos microorganismos anaeróbicos de la flora de la pulpa necrótica requieren dióxido de carbono para su supervivencia Los cambios en el contenido gaseoso del conducto radicular producidos por el hidróxido de calcio pueden eliminar bacterias siempre en ausencia de contacto físico con el material. De acuerdo con lo planteado en el estudio de Kontakiotis et al.(117), los microorganismos que se encuentran en los túbulos dentinarios pueden estar expuestos inicialmente sólo en el orificio del túbulo. Además de estar localizadas dentro de los túbulos, las bacterias pueden también estar atrapadas dentro de las variaciones anatómicas del sistema de conducto radicular. Se evaluó entonces que el hidróxido de calcio ejerce su acción no sólo en contacto directo con la bacteria sino que también individualmente por absorción del dióxido de carbono. Al hidróxido de calcio se le atribuyen acciones antinflamatorias, debido a tres diferentes mecanismos:
Un hallazgo importante del estudio de Walton et al.(105) determinó que el hidróxido de calcio intraconducto, ni disminuye ni incrementa el dolor postratamiento; los iones de calcio disponibles alteran o inhiben la actividad nerviosa. La destrucción de bacterias por el hidróxido de calcio dependerá de la disponibilidad de iones hidroxilos, la cual es más alta donde la pasta es aplicada. Si el hidróxido de calcio necesita difundirse hacia los tejidos y la concentración de hidroxilos es disminuída como resultado de la acción de los sistemas buffer (bicarbonato y fosfato), los ácidos, proteínas y dióxido de calcio, su efectividad antibacterial puede ser reducida o impedida(108). La difusión a través de la dentina es directamente proporcional a la superficie total de los túbulos dentinarios abiertos e indirectamente proporcional al grosor de la dentina. La presencia de una capa residual sobre los túbulos dentinarios reduce la difusión de los iones alrededor de un 30%(60). La difusión de iones hidroxilos a través de la dentina para crear un efecto alcalinizante a distancia depende de varios factores a saber:
Los vehículos tienen diferente solubilidad en agua y no deberían cambiar el pH del hidróxido de calcio significativamente. Por otra parte, la mayoria de estas sustancias no tienen actividad antibacterial significativa(109). Las variaciones en las velocidades de disociación iónica de las pastas de hidróxido de calcio estan influenciadas por sus vehículos y sus características ácido-básicas. En el análisis químico de los iones de calcio liberados de las pastas de hidróxido de calcio obtenidas por determinación conductimétrica del calcio en solución, puede observarse que el vehículo que resultó tener aumentada la liberación en períodos de 6 días, fue la solución anestésica, con estabilización de 45-60 días(64). Los vehículos acuosos que incluyen agua, solución salina, anestésicos y metilcelulosa, promueven una liberación rápida de iones hidroxilos(63). Cuando se emplean estos vehículos tienen mayor difusión en la dentina, aunque se acción es menos perdurable que cuando se le vehiculiza con polietilenglicol, que es viscoso y le confiere al preparado menor solubilidad(51). Se realizó una investigación para determinar si la mezcla de anestésicos locales con hidróxido de calcio tenía consecuencias sobre el pH final de la solución de hidróxido de calcio y los resultados demostraron que no hubo diferencias significativas en el pH del hidróxido mezclado con solución fisiológica, lidocaína o mepivacaína. Una posible explicación al porqué los anestésicos no alteran su pH es que al mezclarlos, éstos tienen un pH ácido, y sólo una pequeña cantidad del vehículo se usa y la concentración de iones hidrógenos disponibles no es suficiente para hacer alguna diferencia apreciable en el pH de la solución(118). En este sentido, Solak y Öztan(109) evaluaron el pH de las combinaciones de hidróxido de calcio con agua destilada, dos soluciones anestésicas o solución fisiológica y demostraron que los cuatro vehículos con base acuosa mostraron cambios similares de pH entre 11 y 12. Una preparación acuosa de hidróxido de calcio puede mantener potencialmente su alto pH por largo tiempo en el conducto radicular(109,112). Al emplear vehículos no acuosos como la glicerina o el propilenglicol puede alterarse la efectividad del hidróxido de calcio, tal como lo señalan Safavi y Nakayama(112), puesto que su acción antimicrobiana depende de la concentración de iones hidroxilos en la solución; las altas concentraciones de glicerina o propilenglicol reducen la conductividad de las soluciones de hidróxido de calcio, sugiriendo que el mismo no se disocia en su presencia. Las evidencias sugieren que la asociación de hidróxido de calcio y paramonoclorofenol alcanforado tiene un espectro antibacterial y un radio de acción más amplio, y destruye bacterias más rápido que las mezclas de hidróxido de calcio con vehículos inertes(18). Además, el paramonoclorofenol alcanforado no puede considerarse un vehículo para el hidróxido de calcio, sino un medicamento adicional. Esta asociación probablemente debe su biocompatibilidad a: -La pequeña concentración de paramonoclorofenol liberado. El hidroxido de calcio más paramonoclorofenol alcanforado produce paramonoclorofenolato, la cual es una sal pesada que libera progresivamente paramonoclorofenol e iones hidroxilos al medio circundante. Es bien conocido que una sustancia puede tener tanto efectos benéficos como deletéreos, dependiendo de su concentración. La poca liberación de paramonoclorofenol de la pasta podría no ser suficiente para tener efectos citotóxicos(18). -El efecto desnaturalizante del hidroxido de calcio sobre el tejido conectivo, puede prevenir la penetración tisular del paramonoclorofenol, reduciendo su toxicidad(106). En el estudio de Sukawat y Srisuwan(119) la combinación de hidróxido de calcio y paramonoclorofenol destruyó toda las especies de E. Faecalis presente en el interior de los túbulos después de 7 dias de medicación. Asi también lo demostraron Siqueira y Uzeda(120), quienes probaron una pasta de hidróxido de calcio/paramonoclorofenol y glicerina, que destruyó rápidamente cepas de Porfiromona endodontalis, Prevotella intermedia, Streptococcus sanguis y Enteroccus faecalis. Esta mezcla también resulta efectiva contra Candida albicans. De acuerdo con Siqueira y Uzeda(18), para destruir E. Faecalis se requiere un período de un día. Como se ha mencionado, el mecanismo de acción de la pasta de hidróxido de calcio depende parcialmente de su alto pH y cuando se emplea paramonoclorofenol alcanforado se obtiene un pH alto(121). Con respecto a la combinación de hidróxido de calcio con clorhexidina se ha demostrado que ésta no afecta el pH, la radiopacidad y el tiempo de trabajo de los medicamentos que contienen hidróxido de calcio. Sin embargo, al adicionar clorhexidina en forma de gel en diferentes concentraciones, disminuye el ángulo de contacto e incrementa la viscosidad del hidróxido de calcio significativamente, pero se obtiene una medicación intraconducto con propiedades fisicoquímicas satisfactorias(72). Podbielski et al.(122) encontraron que el uso combinado de hidróxido de calcio y clorhexidina erradica rápidamente P. Micros y S. Intermedius de conductos radiculares infectados; existe entre ellos un efecto aditivo sobre estos patógenos endodónticos Gram positivo. El hidróxido de calcio no afecta la solubilidad y actividad de la clorhexidina. La combinación de hidróxido de calcio y clorhexidina no es capaz de erradicar Candida albicans después de 7 días de exposición. La actividad antimicrobiana de la clorhexidina es pH dependiente con un rango óptimo de 5,5 a 7. En valores de pH incrementados la efectividad antimicrobiana de esta sustancia es significativamente reducida(63). Cuando el hidróxido de calcio entra en contacto directo con las bacterias (como las que permanecen en la luz de conducto), la acción antimicrobiana de este fármaco es rápida y eficaz. Sin embargo, cuando las bacterias se encuentran en la masa dentinaria se necesita la difusión de los iones hidroxilos a través de los túbulos. De este modo, al alcalinizar con lentitud la dentina, el hidróxido de calcio crea condiciones inapropiadas para la supervivencia de la mayoría de las bacterias(53). La alcalinizacion de la dentina del tercio apical se produce con más lentitud que en la región cervical. En la porción apical hay menor cantidad de túbulos, que además tienen menor diámetro, lo que dificulta la difusión de los iones hidroxilos a través de la dentina(53). Goldberg y Soares(53), recomiendan el uso de la medicación con hidróxido de calcio por un período de 7 días. Como opción, en casos con grandes lesiones periapicales o reabsorciones, este fármaco podria dejarse por 30 días. Si debe permanecer por este tiempo , es conveniente realizar un cambio a los 15 dias después de la colocación inicial. En los casos de exudado persistente, en los que hay mucha dificultad para secar el conducto, se recomienda el cambio de esta sustancia en períodos menores. En el estudio de Sjogren et al.(114), se demostró que el hidróxido de calcio es altamente efectivo en la destrucción de la flora persistente del conducto radicular, cuando fueron medicados por 7 días y se confirmó que las bacterias no sobreviven a este tiempo de aplicación. La ineficiencia de la corta aplicación del hidroxido de calcio puede deberse al fracaso del medicamento en alcanzar determinados sitios. La baja solubilidad y la escasa capacidad de difundir hace difícil que los compuestos basados en hidróxido de calcio alcancen niveles de pH máximo en un corto período de tiempo. Los resultados del estudio in vitro de Pawinska et al.(123), demuestran que estos medicamentos deben ser aplicados en los conductos por un mínimo de 7 días para alcanzar una máxima efectividad terapeutica. Esta opinión es compartida por Law y Mecer (124). Técnicas para la colocación de la medicación intraconducto Para que el medicamento pueda ejercer su acción antiséptica es necesario que el conducto este conformado, vacío, seco y con su permeabilidad dentinaria reestablecida. Para alcanzar esto último es necesario irrigar el conducto con EDTA al 15-17%. Después de dejar que actúe el agente quelante durante 1 a 2 minutos, se seca el conducto con puntas de papel. (3,53) Esta irrigacion tiene por objeto eliminar la capa de desecho formada por restos dentinarios y una sustancia amorfa que queda sobre las paredes del conducto después de la preparacion biomecánica, que obstruye la entrada de los túbulos dentinarios y disminuye la permeabilidad hasta un 49%(53) En el caso del paramonoclorofenol alcanforado o formocresol, el medicamento puede colocarse a nivel de la cámara pulpar con una torunda de algodón, o utilizando una punta de papel humedecida en el fármaco y sobre ella la restauración provisional(53). El polvo de hidróxido de calcio se mezcla con el vehículo para formar una pasta espesa. Esta pasta o la preparación comercial, se coloca en la cámara pulpar con un instrumento plástico, portaamalgama o una jeringa y se lleva hacia abajo en el interior del conducto con un léntulo, o una lima al girarla en sentido contrario a las manecillas del reloj. La pasta se cubre con una torunda de algodón estéril y el acceso se sella con un cemento temporal de por lo menos 3mm de grosor para evitar la filtración; el hidróxido de calcio se elimina con facilidad en la siguiente cita(4). La colocación apropiada del hidróxido de calcio dentro del sistema del conducto radicular puede influir en su efectividad(125). Para la colocación del hidróxido de calcio, se usan diferentes pistolas, compactadores, instrumentos endodónticos, o puntas de papel, usualmente léntulos y con menos frecuencia sistemas de jeringa. Sin embargo, la literatura señala que una pérdida de la calidad con secciones del conducto no obturadas, es más probable que ocurra usando sistemas de jeringa(126). Con respecto a los sistemas de jeringas, algunos autores limitan su uso en conductos extremadamente amplios y rectos, ya que por lo general las cánulas tienen un diámetro externo de 0,8mm que dificulta su uso en conductos estrechos. Se recomienda la colocación de pastas de hidróxido de calcio con sistemas de jeringas en conductos rectos o ligeramente curvos conformados al menos hasta un No 50 si se emplea una cánula con un diámetro de 0,6mm. Esto probablemente, podría permitir la manipulación simple de suspensiones acuosas de hidróxido de calcio comparado con el uso de lentulos(126). Torres et al.(125) realizaron un estudio in vitro para comparar la efectividad de tres diferentes técnicas de colocación de pastas de hidróxido de calcio en conductos curvos: inyección con jeringa, inyección con jeringa combinada con léntulo a la longitud de trabajo, y léntulo a la longitud de trabajo. El léntulo fue significativamente mejor que las otras dos técnicas a 1mm de la longitud de trabajo. El léntulo ofrece quizás el método más conveniente para introducir la pasta disponible comercialmente en el sistema de conductos. Este instrumento de baja velocidad esta disponible en una variedad de tamaños. El clínico debe seleccionar el tamaño que sea fácilmente colocado en la longitud de trabajo sin adherirse a las paredes del conducto; el instrumento debe removerse y reinsertarse a la longitud de trabajo varias veces mientras gira el instrumento. Este procedimiento ayuda a remover cualquier pequeña burbuja de aire atrapada dentro del conducto(125). Al utilizar una jeringa, la aguja debe estar calibrada con topes de goma o silicona, colocados a 3-4mm del límite apical. La aguja se introduce a la profundidad deseada y al presionar con suavidad el émbolo, se retira la jeringa con lentitud, hasta percibir el reflujo de la pasta en la cámara. Al utilizar léntulo, la pasta debe ser un poco más consistente. Se carga el léntulo, se lleva la pasta al interior del conducto y se acciona el motor; al retirarlo, la pasta permanece en el conducto(53). Para conseguir la máxima adaptación de la pasta de hidróxido de calcio a las paredes del conducto, una vez introducida en él, es conveniente colocar una punta de gutapercha del calibre del último instrumento utilizado, de modo que no puedan quedar espacios vacíos entre la medicación y la dentina(60). Después de llenar el conducto con la pasta de hidróxido de calcio, tomar una radiografia del diente para verificar que no hayan áreas radiolúcidas dentro del conducto, luego se limpia la cámara para colocar el cemento provisional(53). Es importante eliminar la pasta del hidróxido de calcio por completo antes de obturar el conducto, ya que si quedan restos de la misma se podría comprometer el sellado del conducto, asi como dificultar la quelación entre el eugenol y el óxido de zinc si se utiliza un sellador con esta composición. La irrigación con una solución de hipoclorito de sodio alternada con EDTA es el mejor procedimiento, probablemente por la quelación de los iones de calcio depositados sobre las paredes del conducto(60).
Materiales y Método Población y Muestra La población para este estudio estuvo constituída por 918 casos que fueron tratados por los estudiantes del Postgrado de Endodoncia de la Facultad de Odontología de la Universidad Central de Venezuela durante el período comprendido entre enero de 2002 y marzo 2005. Se seleccionaron aquellos casos donde se estableció un diagnóstico de necrosis pulpar. Fueron excluídos los casos cuyo diagnóstico correspondía a pulpa vital asintomática, pulpitis reversible, pulpitis irreversible, necrosis pulpar con periodontitis apical crónica, diente despulpado con tratamiento de conducto previo o diente despulpado con tratamiento de conducto previo y periodontitis apical crónica. Técnicas e Instrumentos de Recolección de Datos Se obtuvo de la coordinación del Postgrado de Endodoncia el listado de pacientes atendidos durante el período comprendido entre enero de 2002 y marzo de 2005, con su correspondiente número de historia clínica. En el Departamento de archivo de la Facultad de Odontología, se ubicaron las historias clínicas y de ellas se extrajo la historia de endodoncia de la cual se obtuvo la información requerida para el alcance de los objetivos planteados. Los datos fueron recolectados en un instrumento especialmente diseñado para este fin.
Análisis de los Datos La información que se recolectó en la investigación fue sometida a tratamiento estadístico, para tal fin fue utilizada la base de datos (Microsoft Excel) y sometidos a un análisis estadístico a través del programa SPSS (Statistic Parket for Social Science). En tal sentido, se elaboraron tablas de frecuencia que se tomaron como base para el análisis cuantitativo. Los resultados obtenidos se presentaron en forma de tablas y gráficos.
Resultados Se atendieron un total de novecientos dieciocho casos, durante el período comprendido entre enero de 2002 y marzo de 2005 en el Postgrado de Endodoncia de la Universidad Central de Venezuela. La tabla I muestra la distribución según edad y sexo de la población objeto de estudio.
Fuente: Datos de la investigación Tabla I. Distribución de la población según edad y sexo. Escala de 8 a 88 con su equivalencia del 1 al 9
En la Tabla II, el análisis estadístico de los resultados indica que la mayor frecuencia de diagnóstico fue la pulpitis irreversible (PI), que representa un treinta coma siete (30,7) por ciento del total de la población en estudio, en segundo término se encuentra la necrosisi pulpar con periodontitis apical crónica (NPPAC) (25,5%), y la necrosisi pulpar (NP) ocupa el tercer lugar de ocurrencia con doscientos un casos (201) lo que representa un porcentaje de 21,9%.
Fuente: Datos de la Investigación Tabla II. Distribución porcentual según el diagnóstico de los casos atendidos en el Postgrado de Endodoncia de la UCV. Enero 2002-abril 2005
De los casos tratados con necrosis pulpar el sesenta y dos coma dos (62,2%) por ciento fueron tratados con medicación, mientras que en el restante porcentaje (37,8%) no se utilizó medicación intraconducto.
Gráfico 1. Aplicación o no de medicación intraconducto en los casos de necrosis pulpar atendidos en el Postgrado de Endodoncia de la Universidad Central de Venezuela. Enero 2002- abril 2005.
En la Tabla III, se observan los resultados respecto a la mayor frecuencia de pacientes tratados con un medicamento en particular, donde la mayoría de los casos con necrosis pulpar (NP) fueron tratados con el hidróxido de calcio (68,8%).
Fuente: Datos de la Investigación Tabla III. Frecuencia absoluta y relativa de los tipos de medicamentos empleados en los casos de necrosis pulpar atendidos en el Postgrado de Endodoncia de la Universidad Central de Venezuela. Enero 2002- abril 2005.
Discusión En la presente investigación se diagnosticaron 201 casos con necrosis pulpar, de los cuales en un 62,2% recibió medicación intraconducto. Soares y Goldberg(53) señalan que en los dientes con pulpa necrótica, la medicación intraconducto resulta un auxiliar valioso en la desinfección del sistema de conductos radiculares. En este sentido, Messer y Chen(55), hacen el siguiente razonamiento: primero el medicamento puede reducir la flora microbiana por debajo de los niveles logrados durante la preparación del conducto, particularmente por penetrar en áreas donde los instrumentos o irrigantes no llegan. Segundo, un agente antimicrobiano al permanecer en el conducto entre citas, puede prevenir la reinfección del conducto radicular o reducir el riesgo de proliferación de bacterias residuales. Siqueira y Uzeda(18), Chong y Pitt Ford(54), Behnen et al.(56), entre otros, afirman que la falta de una medicación intraconducto disminuye el porcentaje de éxito en los dientes con conductos infectados. Del arsenal terapéutico disponible en endodoncia, el hidróxido de calcio, el formocresol y el paramonoclorofenol son empleados en los casos de necrosis pulpar. En este estudio, el 68,8% de los casos con necrosis pulpar fueron medicados con hidróxido de calcio; su uso se ha incrementado con respecto a otros medicamentos tradicionales como los compuestos fenólicos y aldehidos debido a sus propiedades y características. Craig et al.(5), Perrone(51), Behnen et al.(56), Verde(106), y Fava y Saunders(107) destacan que el hidróxido de calcio tiene un alto poder bactericida debido a su pH alcalino, de 12,4, y es la medicación más empleada en Endodoncia como complemento de la preparación biomecánica. Aunque no existen recomendaciones específicas sobre cuándo debería colocarse hidróxido de calcio, la indicación general es con la necrosis pulpar(105). El hidróxido de calcio posee la capacidad de disolver tejido orgánico, lo cual favorece la etapa de desbridamiento y desinfección del conducto. También absorbe el dióxido de carbono del conducto radicular, pudiendo ser éste otro mecanismo de acción antibacterial, pues diversos microorganismos anaeróbicos de la flora pulpar necrótica requieren del dióxido de carbono para su supervivencia(117). En los casos estudiados se empleó como vehículo la solución anestésica, la cual de acuerdo con Gómez et al.(63) y Estrela y Pesce(64), es un vehículo acuoso que permite una liberación rápida de iones hidroxilos; y de acuerdo con Solak y Oztan(109), Safavi y Nakayama(112) y Stamos et al.(119) no altera el pH del hidróxido de calcio. También se empleó la combinación de hidróxido de calcio y paramonoclorofenol, la cual alcanzó una aplicación de apenas el 0,8% de los casos. En la literatura las evidencias sugieren que esta asociación tiene un espectro antibacterial y un radio de acción más amplio, y destruye bacterias más rápidamente que las mezclas de hidróxido de calcio con vehículos inertes(18). Esta combinación es efectiva contra microorganismos resistentes como E. faecalis y C. albicans(18,54,57,120,121). Otro medicamento empleado en los casos con necrosis pulpar en el Postgrado de Endodoncia es el formocresol que ocupó el segundo lugar con un 19,2%. Los estudios de Pear(68), Vander Wall(58) y Ohara(25), coinciden en señalar que este medicamento es efectivo contra los microorganismos de los conductos infectados sin estar en contacto con los mismos. La inhibición del crecimiento bacterial lograda por el formocresol, se debe completamente a los vapores o gases producidos a la temperatura corporal(68). Por lo tanto, es necesario considerar que la actividad de sus vapores es más bacteriostática que bactericida(69). El paramonoclorofenol alcanforado fue utilizado en el 4,8% de los casos con necrosis; éste es un agente altamente efectivo contra la variedad de microorganismos presentes en los conductos radiculares infectados, pero es irritante de los tejidos periapicales y retarda el proceso de cicatrización y reparación apical(50,53,60,89,95,96,102). Es una alternativa en conductos estrechos, donde es difícil aplicar la pasta alcalina o cuando la permanencia de la medicación temporaria es inferior a 7 días, tiempo en que el hidróxido de calcio no muestra eficiencia total(53). Sin embargo, su efecto desaparece en un 90% en las primeras 24 horas cuando se coloca impregnado un algodón en la cámara pulpar. El formocresol y el paramonoclorofenol alcanforado forman parte del arsenal terapéutico empleado en los casos de necrosis pulpar, pero cada día se emplean con menos frecuencia debido a que la forma en la que son colocados en el conducto hace que sus propiedades bactericidas se vean disminuídas; al colocar una torunda de algodón en la cámara pulpar, si bien se reducen sus efectos tóxicos e irritantes sobre los tejidos periapicales, el efecto de la volatilización de sus vapores es bacteriostático y se pierde rápidamente. El medicamento a utilizar debe poseer una alta actividad antibacterial combinada con una baja toxicidad tisular; un tiempo suficiente de acción para eliminar todas las bacterias y que no retarde la cicatrización(54). Es necesario tener en cuenta su mecanismo de acción sobre la microbiota predominante en conductos radiculares infectados para determinar la forma apropiada de su colocación, de tal manera que las propiedades físicas y químicas del medicamento tienen un efecto significativo sobre el éxito del tratamiento endodóntico.
Conclusiones
Recomendaciones
Bibliografía
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||