|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
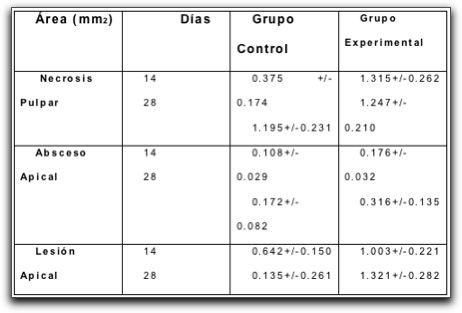
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"PERIODONTITIS APICAL. UNA RESPUESTA DEFENSIVA DEL ORGANISMO " por Ninoska Pérez Enez Odontólogo. Universidad Central de Venezuela 2001 Especialista en Endodoncia. Universidad Central de Venezuela 2008 e-mail: ninosk04@yahoo.com
Resumen: La respuesta defensiva del tejido pulpar frente a un antígeno, no termina en un punto de demarcación, el tejido conectivo pulpar se continúa con el tejido conectivo periodontal hasta los espacios medulares. Por consiguiente, los cambios que se suscitan en la pulpa dental impactan directamente en los tejidos apicales. El sistema inmune reconoce un grupo de patrones moleculares antigénicos mediante mecanismos complejos integrados por la respuesta inmunológica innata seguida de una respuesta específica adquirida, las cuales en conjunto intentan neutralizar y eliminar a los agentes agresores. Como consecuencia se desencadenan una serie de eventos celulares, vasculares y moleculares con el fin de detener el avance de los agentes patógenos, lo que lleva a la resolución de la lesión constituyendo la función principal de la respuesta inmunológica. Sin embargo, en presencia de un gran número de microorganismos con alto potencial de virulencia, enfrentados probablemente a un sistema de defensa circunstancialmente debilitado, se establece una condición de persistencia de la infección que puede conducir a la destrucción de gran parte de los tejidos dando lugar a la periodontitis apical que dependiendo del tiempo de evolución y de la eliminación de los irritantes habrá un mayor o menor daño en los tejidos. La resolución o no del proceso creará una serie de condiciones; desde una periodontitis apical aguda donde interviene primordialmente la inmunidad innata, evidenciada por la presencia de polimorfonucleares y mastocitos que son el primer indicio de defensa de los tejidos apicales hasta una forma más avanzada de periodontitis apical crónica, el quiste apical, producto de la activación de la inmunidad adquirida dominada por células T, B y plasmáticas con la producción de anticuerpos. Entre los mediadores químicos que participan se encuentran: IL-1, IL-2, IL-6, IL-8, FNT, PGE2 y LTB4. Se ha planteado que PVI y FCF, juegan un papel importante dentro de la patogénesis de las lesiones apicales. Actualmente las investigaciones en modelos experimentales, apuntan hacia el desarrollo de moléculas activadoras o inhibidoras que puedan inmunomodular componentes de la respuesta inmunológica que en un futuro cercano podrán ser aplicadas como inmunoterapia en humanos.
INTRODUCCIÓN El estudio de la inmunología es un campo amplio que abarca tanto la investigación básica como las aplicaciones clínicas en lo que se refiere a antígenos, anticuerpos y funciones de defensas del hospedero mediadas por la inmunidad natural, humoral, celular, reacciones biológicas de hipersensibilidad, alergias y rechazos a los tejidos extraños. La inflamación periapical representa una respuesta biológica defensiva inespecífica e innata del organismo a consecuencia de ciertos agentes etiológicos, biológicos o no biológicos, que desencadenan una serie de eventos vasculares y celulares en los tejidos. Los agentes etiológicos, fundamentalmente los de tipo biológico: microorganismos, hongos y virus, son los principales causantes de procesos inflamatorios en la región apical capaces de evolucionar y causar alteraciones locales y daño tisular en los tejidos de soporte. La inmunidad adquirida es el mecanismo defensivo específico fundamental dentro de los tejidos apicales con alteraciones estructurales crónicas, ésta forma parte de la respuesta inmunológica y se establece posterior a la respuesta inflamatoria innata, las cuales en conjunto intentan delimitar a los agentes agresores. Diversos científicos e investigadores se han dado la tarea de estudiar las diferentes células, moléculas, microorganismos, tejidos, órganos y factores en general, que podrían estar involucrados en la respuesta inmunológica defensiva de los tejidos apicales; razón por la cual se han implementado técnicas de inmunohistoquímicas para logar tal fin. En consecuencia, en el campo de la Endodoncia se han usado anticuerpos monoclonales específicos para evaluar, estudiar, analizar y medir los diferentes eventos biológicos que suceden en respuesta a los agentes agresores, estableciendo de ésta manera grandes aportes científicos. El objetivo de esta revisión bibliográfica es describir los diferentes eventos inmunológicos y la reacción defensiva de los tejidos perirradiculares que se desencadenan en respuesta a los antígenos provenientes del sistema de conductos radiculares; así como también revisar la consecuencia biológica de todos los eventos que conllevan a la formación de los diferentes tipos de periodontitis apical.
II.- REVISIÓN DE LA LITERATURA 1.- FUNDAMENTOS DEL SISTEMA INMUNE. La inmunidad es una reacción contra sustancias extrañas que incluye microorganismos y macromoléculas sin que ésta reacción tenga repercusión fisiológica o patológica en el organismo; por lo tanto la inmunología es el estudio de la inmunidad en su sentido más amplio y de los acontecimientos celulares y moleculares que ocurren en el organismo, así mismo las células y moléculas responsables de la inmunidad constituyen al sistema inmune y la respuesta global y coordinada tras la introducción de sustancias extrañas al organismo constituyen la respuesta inmunológica (1, 2). Para eliminar un antígeno y evitar que éste logre establecer una enfermedad lo primero que debe hacer el sistema inmune es reconocerlo como extraño, y a continuación desarrollar una respuesta adecuada para destruirlo; además de extraer y almacenar información específica sobre las características del mismo (1,3,4,5). Para cumplir su función, el sistema inmune ha desarrollado dos tipos de mecanismos: La inmunidad innata, natural o inespecífica y la inmunidad adquirida, adaptativa o específica, la diferencia principal entre ambas reside en las estructura de reconocimiento de los antígenos, ya que los mecanismos efectores de destrucción son similares (1, 4, 5). En el Gráfico 1 se muestra una imagen esquemática ilustrando la respuesta innata y adquirida que forman parte del sistema inmune. 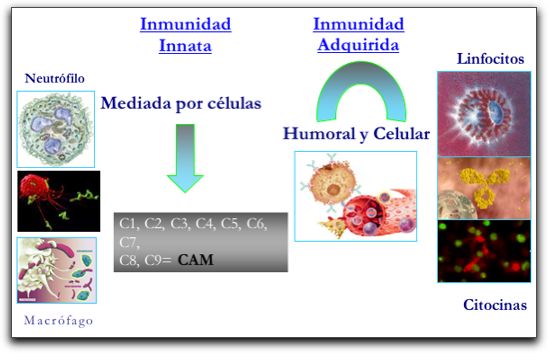
Imagen esquemática sobre el mecanismo inmunológico: Inmunidad innata: sistema del complemento y células fagocíticas. Inmunidad adquirida: humoral y celular. Tomada de Regueiro (4). Para que el organismo desarrolle una respuesta inmunológica tiene que reconocer a través del sistema inmune a los antígenos que entran en contacto con el mismo. Se define como antígeno a cualquier parte de una bacteria, un virus, un parásito, un hongo o alguna sustancia que el cuerpo reconoce como extraño, también se pueden definir como sustancias químicas capaces de inducir una respuesta inmunológica específica. En general los antígenos no poseen una composición química en particular, ni tampoco características que los distingan de las sustancias análogas que no son antigénicas, sin embargo, ciertas moléculas de pequeño tamaño son incapaces de inducir una respuesta inmunológica por sí solas, es por ello que éstas se unen a otra más grande (proteínas de alto peso molecular) y se comportan como antígenos, éstas reciben el nombre de Haptenos (1, 6, 7). La antigenicidad de una molécula, depende del grado de características extrañas, es decir, la relación filogenética entre el hospedero y el antígeno. En esencia la antigenicidad de una sustancia va a depender del equilibrio entre la capacidad del antígeno de estimular a los linfocitos B y T, células del sistema inmune las cuales serán descritas más adelante (6). 1.1.- Inmunidad innata o no adquirida. La inmunidad innata es la resistencia que no se adquiere mediante el contacto con un antígeno. Es inespecífica e incluye las barreras contra los agentes antigénicos. Los elementos constituyentes de la inmunidad innata son las barreras físicas y químicas como: piel, mucosas, epitelios y sustancias antimicrobianas producidas sobre la superficie epitelial, específicamente defensinas y lizosimas, las cuales son péptidos antibacterianos que se expresan en las células y se almacenan en gránulos secretorios en respuesta a un estímulo inflamatorio. Este es el primero y más elemental mecanismo de defensa contra los antígenos, sin embargo, una vez que los antígenos logran atravesar las barreras, se ponen en marcha los otros dos elementos esenciales de la inmunidad innata; las células inmunocompetentes fagocíticas, entre estas: neutrófilos, macrófagos y células dendríticas y las proteínas sanguíneas como: sistema del complemento, proteínas solubles y mediadores químicos inflamatorios (1, 4,5, 8). La estrategia de la inmunidad innata consiste en reconocer a un grupo de patrones moleculares altamente conservados comunes a una familia entera de antígenos; por ello todos los individuos de una misma especie nacen con la capacidad innata e inmediata de reconocer y destruir diferentes antígenos. Dentro de las proteínas sanguíneas que se activan en respuesta a la presencia de un antígeno se encuentran una serie de moléculas preformadas que se conocen con el nombre de sistema del complemento, el cual es un conjunto de proteínas que actúan en cascada para eliminar antígenos y, a su vez inducen Inflamación (4, 9). En el gráfico 2 se muestra una imagen esquemática de las proteínas del complemento. 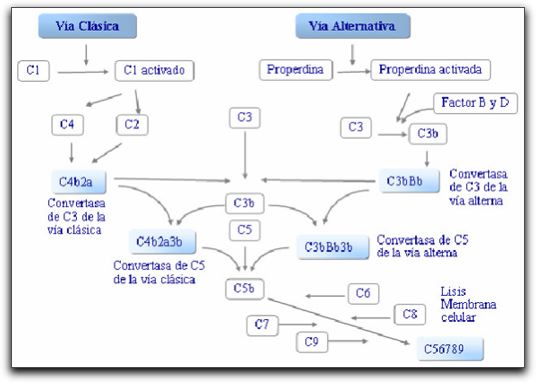 El complemento se llama así, por que complementa la acción de los anticuerpos. Está formado por una serie de proteínas séricas que se activan en respuesta a la presencia de antígenos, la activación del complemento produce una cadena de reacciones en cascada de sus componentes que lleva a la eliminación de los antígenos, tras la formación del Complejo de ataque de membrana; así como también promueve el desarrollo de la inflamación mediante el cual se pretende reclutar un gran número de moléculas y más células inmunológicas en el sitio lesionado, dañado y/o infectado (9). Existen tres formas de activación del sistema del complemento, la vía alterna; la cual se activa espontáneamente por los componentes de las paredes celulares de ciertos microorganismos y constituye una respuesta innata inmediata inespecífica del organismo. La vía de las lectinas; se activa de manera innata inducida tras la síntesis de una proteína capaz de unirse a azúcares de hongos y bacterias. La vía clásica, se activa por anticuerpos unidos a antígenos, lo que indica una respuesta adquirida (la cual será descrita más adelante) (1, 9). En el Gráfico 3 se muestra los tres tipos de vías de activación del complemento. Las proteínas de la vía clásica y lítica se nombran con la letra C, seguidamente de un número: C1 , C1r, C1s, C2, C3, C4, C5, C6, C7, C8 y C9. Los componentes de la vía alterna se representan con una letra, precedida o no por un factor (factor B, D). En la activación del sistema se forman enzimas y complejos enzimáticos, representados con una barra sobre el componente o complejo activo (C4b2b), muchas de estas formas enzimáticas que se originan son proteasa que hidrolizan al siguiente componente de la cascada. Los elementos formados se nombran con el sufijo "a", para identificar a los fragmentos pequeños, y con la letra "b", para identificar a los grandes C3a y C3b, son fragmentos de C3, y C4b y C2a, proceden de la hidrólisis de C2 y C4, algunos de estos elementos sufren hidrólisis posteriores que los inactivan y se designan con el sufijo "i", (iC3b, procede de C3b), finalmente hay un grupo de receptores CR1, CR2, CR3, y CR4 (9, 10). 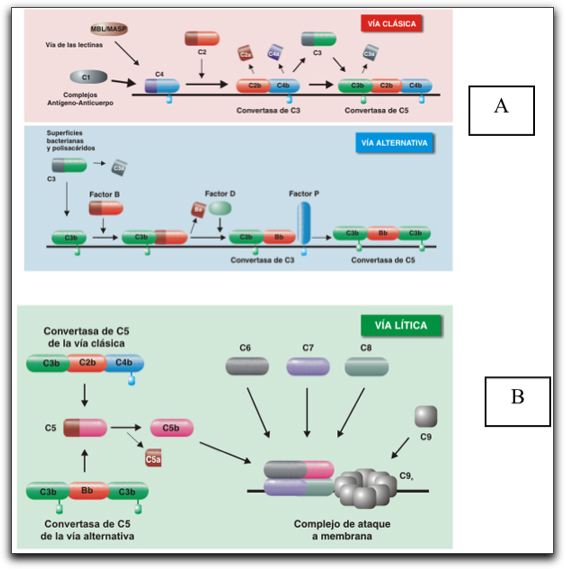
A.Vías Clásica y Alterna. B.Vía Lítica. Tomado de Regueiro (9). El sistema del complemento consta al menos de 18 proteínas séricas y 10 proteínas de membrana que se activan en cascada conduciendo a una amplia variedad de respuestas biológicas, una vez activadas las vías conducen a la formación de C3-convertasa y a la activación del componente mayoritario C3, que finalmente conduce a la formación del complejo del ataque de membrana, que produce la lisis del organismo celular extraño por la formación de poros en su membrana celular; mecanismo conocido como citólisis (9). Dentro de las funciones biológicas del sistema del completo se encuentra la opsonización; es el mecanismo mediante el cual la proteína C3 se deposita sobre la superficie del antígeno de manera específica y gracias a receptores específicos de fragmentos de C3, las células fagocíticas se encargan de digerir y destruir dichas partículas o complejos (9). El efecto combinado de las reacciones que promueven y regulan la activación de C3 es el depósito de C3b en la superficie de las células humanas. Este mecanismo representa una manera eficaz de diferenciar lo propio de lo no propio y de dirigir los mecanismos de muerte y destrucción hacia los antígenos y no hacia las células humanas (4). Otra de las funciones del complemento es la inflamación la cual es producida por las fracciones solubles C5a, C3a y C4a llamadas anafilotoxinas, ya que causan degranulación de mastocitos los cuales son células del sistema inmune que tienen la capacidad de liberar histamina, un potente mediador molecular de los procesos inflamatorios, provocando de esta manera el aumento de la permeabilidad vascular y la contracción del músculo liso. Así mismo el complemento también puede producir quimiotaxis por medio C5a, el cual promueve el movimiento de los fagocitos hacia el lugar de la inflamación. Finalmente, el complemento puede eliminar los inmunocomplejos formados durante el reconocimiento de los antígenos evitando el daño en diversos tejidos y órganos (9, 11). El otro de los elementos constituyentes de la inmunidad innata, son las células inmunocompetentes entre estas, los leucocitos polimorfonucleares tales como: neutrófilos, eosinófilos y basófilos, los neutrófilos son las células más predominantes en las inflamaciones agudas y su función es destruir y fagocitar antígenos, los eosinófilos son abundantes en sitios de inflamación en enfermedades de origen inmunológico o parasitario y los basófilos al igual que los eosinófilos, contienen heparina e histamina en sus gránulos intracitoplasmáticos, entre otras sustancias capaces de inducir la respuesta inflamatoria. Otro tipo de célula fagocítica son los macrófagos, que provienen de los monocitos originados en la médula; los monocitos se encuentran en sangre circulante y cuando pasan a los tejidos se convierten en macrófagos, éstos últimos poseen inclusiones fagocitarias (fagosomas) que rodean a los antígenos para cumplir con su función de fagocitosis; también responden a sustancias quimiotácticas y actúan como células efectoras durante el proceso inflamatorio (4, 12). Los fibroblastos son un tipo de célula residente del tejido conectivo propiamente dicho, estas células proporcionan una estructura de estroma a diversos tejidos y desempeñan una función importante en los procesos de reparación de los tejidos y son las células más predominantes del tejido conectivo. La estimulación de estas células durante los procesos inflamatorios permite la liberación de sus gránulos intracitoplasmáticos con contenido proteico y mediadores moleculares que potencian y modulan el proceso inflamatorio (4, 13). Otras células con funciones fagocíticas son las células dendríticas las cuales también actúan como células presentadoras de antígenos dentro de la respuesta inmunológica (2, 11, 14). En relación al proceso inflamatorio, la inflamación abarca la acumulación local de líquido acompañado de edema, enrojecimiento y dolor, esta sirve para destruir, diluir o aislar a los agentes lesivos y es otro de los mecanismos fundamentales de la inmunidad innata. Puede clasificarse en aguda y crónica, la primera se caracteriza por presentar cambios vasculares y exudativos y la presencia de células como neutrófilos y macrófagos; pero escasos linfocitos y la segunda se caracteriza por haber una respuesta fibroblástica proliferativa y no exudativa con presencia de abundantes células linfocitarias y macrófagos (12, 15). Una vez que se inicia el proceso inflamatorio se producen una serie de cambios inducidos en los capilares sanguíneos locales que conducen a un aumento de su diámetro, proceso llamado dilatación, a una reducción de la velocidad del flujo sanguíneo y a un aumento de la permeabilidad de la pared vascular. El aumento del aporte de sangre a la región causa el enrojecimiento local y el calor asociado con la inflamación. El aumento de la permeabilidad vascular permite el desplazamiento de líquido, proteínas plasmáticas y leucocitos desde los capilares hacia el tejido conectivo inmediato, lo que causa el edema y el dolor, paralelamente ocurren una serie de eventos celulares que traen como consecuencia la salida de los leucocitos de la luz del vaso hasta el espacio extravascular (15, 16). Los eventos celulares que ocurren durante los procesos inflamatorios se pueden dividir en cuatro etapas fundamentales: 1.- Marginación y rodamiento; los leucocitos viajan en el centro y a lo largo del vaso sanguíneo; a medida que avanza el proceso se trasladan a la superficie endotelial del vaso y ruedan sobre ésta de manera transitoria sin adherirse, todo éste proceso está mediado por moléculas de adhesión complementarias; específicamente selectinas que actúan como moléculas que se unen a determinados tipos de hidratos de carbono y por receptores específicos de unión, expresados en las membranas de los leucocitos. 2.- La adhesión y trasmigración ocurre cuando los leucocitos se adhieren de forma firme a las paredes endoteliales del vaso y atraviesan la membrana basal hacia el espacio extravascular; todo esto mediado por moléculas de señalización que permiten la regulación de los cambios vasculares y las interacciones adhesivas entre los leucocitos y el endotelio vascular denominadas integrinas. 3.- Seguidamente ocurre la quimiotaxis y activación; los leucocitos expresan proteasas que degradan las uniones endoteliales y atraviesan la membrana basal para salir al espacio extravascular, una vez en el espacio extravascular los leucocitos se desplazan hacia el sitio de la lesión a favor de un gradiente de concentración químico. Dentro de los agentes quimiotácticos se pueden mencionar: - Componentes del sistema del complemento. - Citocinas inflamatorias o mediadores moleculares. - Metabolitos derivados del ácido araquidónico. - Productos bacterianos. - Factores de crecimiento. Dentro de los mediadores moleculares se pueden destacar principalmente a las citocinas inflamatorias; son mediadores intercelulares producidos por células hematopoyéticas y estructurales, y ejercen efectos pleotrópicos sobre las células diana participantes en la regulación de las defensas inmunológicas, la respuesta inflamatoria, el crecimiento y diferenciación de células, y la remodelación de los tejidos. Son polipéptidos segregados transitoriamente por células activadas bajo diferentes estímulos y pueden regular, aumentar o disminuir la producción de otras citocinas (15, 16, 18). - Interleucinas (IL): son citocinas segregadas por diferentes células; los neutrófilos y macrófagos segregan IL-1, IL-6, IL-8, IL-12, basófilos IL-3, IL-4, IL-5, IL-6 y linfocitos, IL-2, IL-4, IL-5, IL-12; en general, son un conjunto de moléculas reguladoras de células. Se designan con un número después de su nombre, cumplen funciones locales relacionadas con el proceso de extravasación de leucocitos, además de la activación de la producción de mediadores moleculares y enzimas proteolíticas. Participan en procesos inflamatorios y causan vasoconstricción, vasodilatación, aumento de la permeabilidad vascular, quimiotaxis, activan células inmunocompetentes y estimulan a receptores específicos para causar resorción ósea (2, 17, 19). - Factor de necrosis tumoral (FNT): son citocinas proinflamatorias con efectos citotóxicos directos sobre ciertas células diana y tienen efectos debilitantes en las enfermedades crónicas. Se dividen en dos tipos FNT- ? derivados de los macrófagos y neutrófilos, y FNT-? derivado de los linfocitos; ambos tienen efectos sistémicos y locales similares a las Interleucinas (5, 20). - Interferones (IFN): son agentes antivíricos selectivos; son proteínas reguladoras producidas principalmente por linfocitos, existen tres subclases; IFN- ?, IFN-? y IFN-? (21). - Factores de crecimiento: son proteínas que regulan el crecimiento y diferenciación de células no hematopoyéticas, entre estos el factor de crecimiento transformador (TGF), son polipéptidos producidos por diversas células, a su vez existen dos subtipos TGF-? y TGF-?, éste último es sintetizado por células inmunes y plaquetas, y participa en el reclutamiento y activación de macrófagos, la proliferación de los fibroblastos, las síntesis de fibras y matrices de tejido conectivo, la angiogénesis local y en los procesos de reparación y cicatrización de los tejidos. Así mismo, otro factor de crecimiento es el factor de crecimiento fibroblástico (FCF) y el factor de permeabilidad vascular (FPV), participan igualmente en la angiogénesis local y en la estimulación de receptores osteoclásticos (15, 21). - Metabolitos derivados del ácido araquidónico: entre estos prostaglandinas (PG) y leucotrienos (LT); son eicosanoides que se obtienen cuando las células corporales son activadas por diversos estímulos, los lípidos de la membrana experimentan una remodelación para generar compuestos biológicos activos. El ácido araquidónico se libera de los fosfolípidos de la membrana por una gran cantidad de estímulos y se metaboliza con rapidez dando como resultado la formación de metabolitos, los cuales van a participar en los procesos inflamatorios, producen dolor, fiebre, regulan la tensión arterial e inducen coagulación en la sangre (18, 21, 22, 23). Los leucotrienos son mediadores moleculares que se liberan en los tejidos cuando el ácido araquidónico se oxida a través de la vía lipoxigenasa por acción de la fosfolipasa A2, en respuesta a la estimulación mecánica, química e inmunológica en los tejidos, e incluso al aumento de la temperatura local, teniendo funciones quimiotácticas sobre leucocitos polimorfonucleares (15, 24). 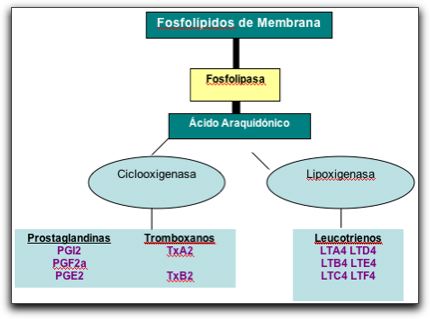
Izquierda, vía de la ciclooxigenasa y síntesis de PG y Tromboxanos. Derecha, vía de la lipoxigenasa y síntesis de LT. Tomada y modificada de Torabinejad (25). En relación a las PG, el ácido araquidónico, a través de la enzima endoperoxidasa, se metaboliza y origina dos endopéptidos cíclicos, PGG2 y PGH2, estos endopéptidos son sintetizados para dar origen a una serie de metabolitos, dentro de los que se encuentran las PGF2, PGI2, PGD2, el Tromboxano A2 y PGH2. En el gráfico 5 se observa una imagen esquemática del metabolismo del ácido araquidónico. En el gráfico 4 y 5 se observa una imagen esquemática del metabolismo del ácido araquidónico. 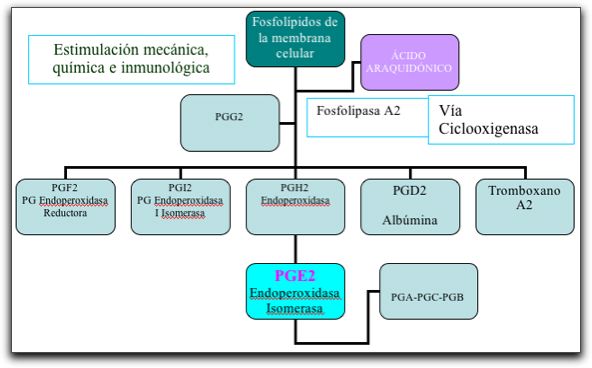
Síntesis de las diferentes clases de PG. Tomado de Torabinejad (22). Todos estos metabolitos biológicos cumplen funciones importantes dentro de los procesos inflamatorios, ya que éstos son capaces de incrementar la permeabilidad vascular, estimulan la liberación de enzimas degradativas, producen fiebre, promueven la quimiotaxis, y pueden sensibilizar a los receptores del dolor a la acción de otros mediadores químicos como la histamina y la bradicinina (15, 22). - Moléculas efectoras: son moléculas que participan en la degradación de las matrices extracelulares en respuesta a un agente irritante. Las metaloproteinasas (MMPs), son las principales moléculas efectoras encargadas de la degradación de las matrices tisulares constituidas por colágeno, fibronectina y diversas proteínas. El sustrato principal de las MMPs es el colágeno junto con otros componentes proteicos de la matriz extracelular. Los factores que pueden activar a las MMPs son diversos, entre ellos; PG, bacterias, lipolisacáridos bacterianos y citocinas inflamatorias (21, 26, 27, 28). 4.- El último de los eventos celulares que ocurre durante el proceso inflamatorio es la fagocitosis y degranulación de los leucocitos en el sitio de la inflamación (11, 15, 16). En el gráfico 6 se muestra una imagen esquemática que resume los eventos vasculares y celulares de los leucocitos. 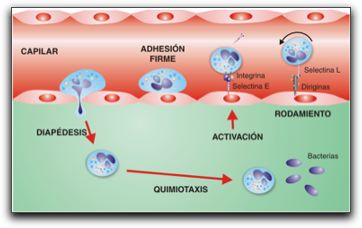
Eventos celulares del proceso inflamatorio. Tomada de Regueiro (4). Dentro de las células del sistema inmune encargadas de destruir a los agentes invasores en la inmunidad innata se encuentran fundamentalmente, los macrófagos y los neutrófilos, los cuales tienen propiedades distintas pero complementarias. Los macrófagos son células de larga vida, residen en los tejidos, y además de su función de fagocitosis también actúan como células efectoras y presentadoras de antígenos. Los neutrófilos, por su parte, son células especializadas de vida breve que circulan en la sangre esperando la activación y señalización de mediadores moleculares, para actuar en el tejido afectado (2, 5, 6, 29). El gráfico 7 muestra una imagen esquemática de un neutrófilo polimorfonuclear. Los neutrófilos constituyen el 90% de los leucocitos, son capaces de fagocitar y destruir directamente diversos patógenos como bacterias, virus y hongos y también pueden liberar al exterior el contenido de sus gránulos y producir inflamación (2, 4, 29). 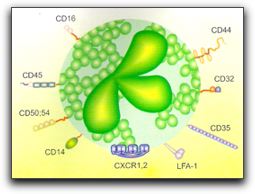
Imagen esquemática de un neutrófilo polimorfonuclear. Tomado de http://biocarampangue.tripod.com/Cuarto-medio.htm 23.10.2007,11:00 am. El contenido de los gránulos intracitoplasmáticos de los neutrófilos son de dos tipos: primarios o azurófilos; que contienen enzimas lizosomales en forma de fosfatasa ácida, hidrolasas ácida, elastasas, colagenasas, proteinasas, fosfolipasas, mieloperoxidasa (MOP), y enzimas antibacterianas (lisozimas y defensinas) y específicos o secundarios; que contienen enzimas como: fosfatasas alcalina, lizosimas, colagenasas y proteínas antibacterianas como el lactoferrín. Aunque los neutrófilos son células especializadas para funcionar en las condiciones de anaerobiosis que prevalecen en los tejidos dañados, de todas maneras mueren pocas horas después de su ingreso y al hacerlo, forman en conjunto con otros factores, el pus espeso característico de las heridas infectadas y de los sitios de infección (2, 29). Una vez que los neutrófilos llegan al sitio de la inflamación realizan el reconocimiento de los antígenos y liberan el contenido de sus gránulos intracitoplasmático. En el gráfico 8 se observa esquemáticamente el proceso de inclusión fagocitaria. 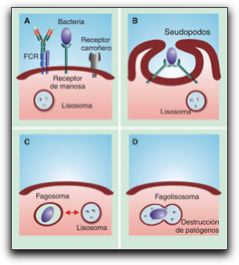
A) Receptores de la membrana celular. B) Reconocimiento del antígeno y englobamiento del mismo. C) Inclusión del antígeno en el interior del neutrófilo, formación del fagosoma. D) Unión del fagosoma con el lisosoma del neutrófilo. Tomada de Regueiro (29). La variedad de materiales digeribles que fagocitan los neutrófilos es mayor que la que incorporan los macrófagos, como también lo es la diversidad de las sustancias microbicidas almacenadas en sus dos tipos de gránulos intracitoplasmáticos. Casi inmediatamente después de que un antígeno es incorporado por un neutrófilo se descarga sobre él, las enzimas degradativas y otras sustancias tóxicas. Los fagosomas que contienen los antígenos recién capturados se fusionan con los gránulos del neutrófilo preformado constituyendo los fagolisosomas para la destrucción del antígeno (7, 29). Por su parte, los macrófagos fagocitan bacterias y otros microorganismos de forma inespecífica, el proceso se torna mas eficiente gracias a la presencia de receptores de la superficie que se unen a ligandos específicos de la superficie del antígeno. La combinación de opsonización por el complemento y fagocitosis por los macrófagos permite el reconocimiento y la destrucción de los patógenos desde el inicio de una infección. 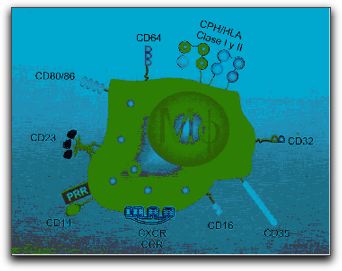
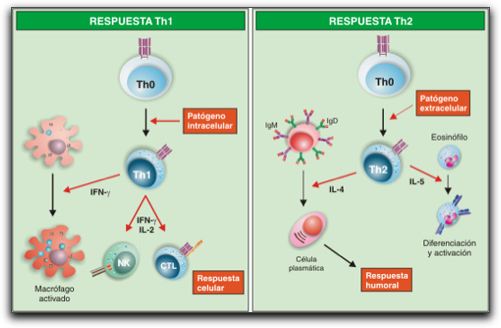
Imagen esquemática de un macrófago y sus diferentes receptores de membrana. Tomada de http://biocarampangue.tripod.com/Cuarto-medio.htm. 23.10.2007,12:10 pm. Además de receptores que facilitan la fagocitosis, los macrófagos también actúan como células presentadoras de antígeno, mediante receptores que envían señales y activan a otras células para que produzcan y secreten citocinas que atraigan a otras células a defender el tejido afectado (29). En el gráfico 9 se muestra una imagen de un macrófago. Por otro lado, también es importante destacar que además del complemento hay otros tipos de proteínas plasmáticas que impiden que los antígenos invadan los tejidos humanos. El daño de los vasos sanguíneos activa el sistema de la coagulación, una cascada de enzimas plasmáticas que forma coágulos sanguíneos que inmovilizan a los antígenos y les impiden ingresar a la sangre y la linfa, además de reducir la pérdida de sangre y líquidos. Por su parte, las plaquetas como componentes básicos de la sangre, representan un factor importante de los coágulos sanguíneos, las cuales liberan una gran variedad de mediadores moleculares muy activos almacenados en sus gránulos. Entre estos, PG, enzimas hidrolíticas, factores de crecimiento, serotonina y otros mediadores que estimulan diversos tipos de células para que contribuyan con las defensas del organismo,con la inflamación y con la cicatrización y reparación de los tejidos (1, 4, 15). Otro mediador, como la bradicinina, es producida por el sistema de las cininas, una segunda cascada enzimática de proteínas plasmáticas que es activada por el daño tisular, por la activación del factor XII o factor Hageman de la coagulación. Al causar vasodilatación la bradicinina aumenta el suministro de los materiales solubles y celulares de la inmunidad innata al sitio lesionado, además induce el incremento de la permeabilidad vascular y dolor (15). También se puede mencionar la presencia de proteínas solubles de fase aguda presentes en plasma las cuales se activan durante la respuesta inflamatoria, entre estas; proteína A amyloide del suero, proteína C reactiva, haptoglobulina, fibrinógeno, glicoproteínas ácidas; las cuales contribuyen con los eventos inflamatorios durante la respuesta inmunológica. Paralelo a todos los eventos celulares y vasculares, ocurre la inducción de proteínas de fase aguda por parte del hígado, que envuelve eventos locales y sistémicos como vasodilatación, infiltración celular y la producción de radicales libre de oxigeno, que posteriormente se traducen en fiebre, dolor y alteraciones metabólicas (30). 1.2.- Inmunidad específica o adquirida. La inmunidad adquirida, que ocurre después de la exposición a un antígeno es específica y está mediada por anticuerpos y células linfoides. Se inicia a partir del reconocimiento de antígenos extraños por linfocitos específicos, los cuales responden proliferando y diferenciándose en células efectoras cuya función es eliminar al antígeno. La fase efectora de la inmunidad específica requiere la participación de varios mecanismos de defensa, incluyendo al sistema del complemento, fagocitosis, células inflamatorias y citocinas, los cuales también participan en la respuesta inmunidad innata (1, 5). La respuesta inmunológica específica amplifica los mecanismos de la inmunidad innata y estimula su función, particularmente tras exposiciones repetidas al mismo antígeno. Es por ello, que el sistema inmune posee varias propiedades que son de importancia fundamental para su función normal. Éstas son: la especificidad por diversos antígenos, la diversidad del reconocimiento del antígeno, memoria de la exposición al antígeno, respuestas especializadas para distintos microorganismos, limitación propia y capacidad para determinar lo propio de lo extraño. Dentro de los mecanismos inmunitarios específicos se pueden destacar dos mecanismos; la inmunidad celular mediada por células específicas y la inmunidad humoral mediada por anticuerpos (1, 31). 1.2.1.- Inmunidad celular. Los responsables principales de la inmunidad adquirida celular son leucocitos denominados linfocitos T y linfocitos B, que tienen receptores de reconocimiento del antígeno extremadamente específico; de tal manera que la base del reconocimiento de los diferentes antígenos, es la gran variabilidad de linfocitos T y B presentes en el organismo y cada uno de ellos porta un receptor específico diferente para cada tipo de antígeno presente. Dentro de los linfocitos, se encuentran los linfocitos T y B; las células T se originan en la médula ósea de donde migran al timo para su maduración; las células B, se diferencian en el hígado durante la vida fetal y en la médula ósea en el adulto; los linfocitos B presentan un receptor de membrana (BCR) específico para reconocer a los antígenos y al ser sensibilizados por un antígeno se diferencian en plasmocitos o células plasmáticas para dar origen a los anticuerpos. Los linfocitos T, también tienen un receptor de membrana (TCR), de estructura similar a las células B; cuya función es reconocer fragmentos de polipéptidos antigénicos (2, 14). Los linfocitos T son células centrales en la función de regulación del sistema inmune; además de tener funciones directas, como la citotoxicidad o citólisis, regulan el funcionamiento de su propio linaje y el de otras células a través de contactos celulares y/o mediadores solubles como lo son las citocinas (14, 10). Pueden dividirse en linfocitos T colaboradores (CD4) y linfocitos T citotóxicos (CD8); los CD4 a su vez se pueden dividir en dos subclases, Th1 y Th2; todos y cada uno de ellos cumplen funciones diferentes dentro del sistema inmunológico; un tercer tipo de célula perteneciente al linaje linfoide son la células naturales asesinas (NK), son fagocitos por excelencia con actividad citotóxica. De los linfocitos Th1 derivan citocinas que van a contribuir a la defensa antibacteriana (IL-2, IL-12, IFN), dando lugar a la activación de la respuesta celular. Por el contrario, los Th2 producen citocinas (IL-4, IL-13) que estimulan la producción de Inmunoglobulinas (Ig) por las células B y, la atracción y activación de los eosinófilos por la IL-5 fundamentalmente. De este modo, los Th2 se encargan de la activación de la respuesta humoral y de la defensa antiparasitaria. La IL-10 se produce en diversas células mononucleares, incluyendo linfocitos Th2, como consecuencia del estímulo antigénico. El exceso de IL-10 inhibe la actividad de los Th2 pero también la de los Th1, dando lugar así a la inactividad celular, al mismo tiempo que potencia la producción de Inmunoglobulina G (IgG). El gráfico 10 muestra esquemáticamente a Th1 y Th2.
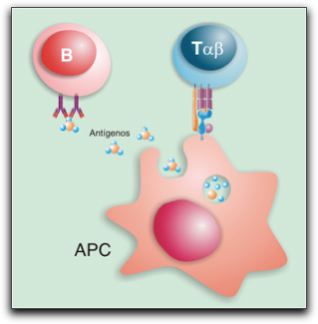
Izquierda; Respuesta de linfocito T CD4 Th1. Derecha; respuesta de linfocito T CD4 Th2. Tomada de Regueiro (14). Sin embargo, al parecer, la actividad de las células Th1 es estimulada por la producción microambiental de IL-2, la cual es un factor de crecimiento y multiplicación para linfocitos T y diferenciación para linfocitos B (2,10, 14). Sin embargo, la generación de tanta variabilidad de linfocitos tiene, una desventaja, y es que en realidad existen muy pocos específicos para cada antígeno. Por ello, es necesario que los linfocitos se multipliquen clonalmente antes de adquirir un número suficiente para combatir al patógeno. Este período de proliferación requiere aproximadamente de una semana para desarrollarse, durante la cual el control de la infección por los mecanismos innatos es esencial para la supervivencia del individuo. Para que se dé la estimulación y diferenciación de los linfocitos, se requiere de un proceso conocido como presentación de antígenos a las células encargadas de reconocerlos, las células encargadas de éste proceso son principalmente los macrófagos y en menor relación las células dendríticas y linfocitos; los cuales presentan el antígeno a los linfocitos T a través de receptores específicos llamados Complejo Mayor de Histocompatibilidad (CMH) situados en su superficie. Los receptores de las células T reconocen al antígeno y se activa una clona específica de células T que comienza a proliferar y a generar la diversidad de los linfocitos T (6, 14). El gráfico 11 muestra una imagen esquemática de una célula presentadora de antígeno. Por lo tanto; los linfocitos T no reconocen antígenos solubles, sino, que reconocen pequeños fragmentos de ellos, asociados a las CMH; expresados en la membrana de las células presentadoras de antígenos. Según la naturaleza del antígeno reconocido se pueden activar las diferentes subpoblaciones de linfocitos T CD4, los cuales ayudan a los linfocitos B a producir anticuerpos y a los macrófagos a destruir antígenos fagocitados por éstos, o linfocitos T CD8, que destruyen células infectadas por virus (5).
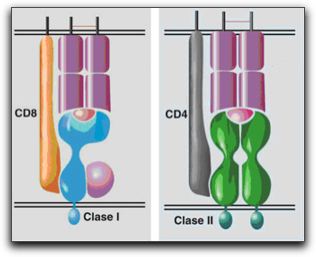
Imagen esquemática que muestra como una célula presentadora de antígeno (APC). Tomado de Regueiro 2002 (14). Estas moléculas de histocompatibilidad, son proteínas de membrana cuya función biológica es la presentación de péptidos derivados de proteínas intracelulares a los linfocitos T; existen dos tipos diferentes de moléculas: clase I y clase II; la clase I se ha designado para presentarle péptidos a las subpoblaciones de linfocitos T CD8 y la clase II se ha especializado en presentárselos a los CD4 (14). En el gráfico 12 se muestra los dos tipos de complejo mayor de histocompatibilidad.
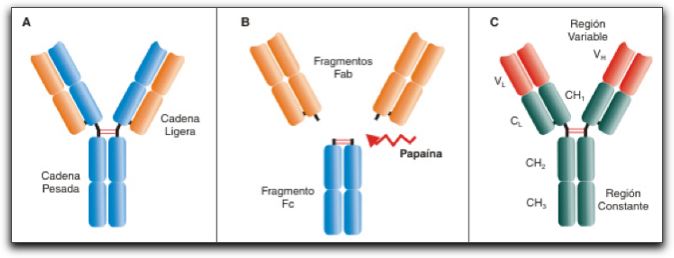
CMH clase I y II. Tomada de Regueiro (14). Posteriormente, una vez activados los linfocitos T, modifican su fenotipo y sus requerimientos funcionales; los linfocitos T activados comienzan a expresar en su superficie marcadores o moléculas de membranas que los identifican como células efectoras y los diferencian entre sí. Los linfocitos CD4 pueden dividirse, atendiendo a la función que realicen y al patrón de citocinas que sintetizan en: Th1 encargadas de coordinar la respuesta celular, mediante la síntesis de IFN) e IL-2, activando macrófagos y células NK, o en Th2, especializadas en coordinar la respuesta humoral, sintetizando IL-4, IL5, IL10 e IL-13. La gran mayoría de los CD8 que se diferencian en células efectoras cumplen funciones citolíticas, eliminando células que se encuentran afectadas por antígenos intracelulares, y para realizar está función necesitan ser estimulados por células presentadoras de antígenos o por algunos linfocitos Th1 (14). Las principales funciones de las NK, son la citólisis y la producción de citocinas. Los mecanismos que utiliza NK para destruir a células diana o antígenos es a través del contenido de sus gránulos intracitoplasmáticos portadores de proteínas y enzimas que una vez liberadas al medio inducen citotoxicidad. El contenido de éstos gránulos esta formado fundamentalmente por perforinas (enzimas que crean poros en las membranas celulares de las células blanco). Cuando las NK, son activadas son capaces de segregar una serie de citocinas y por lo tanto pueden ejercer funciones de activación de otros linajes celulares importantes en la erradicación de tumores o agentes infecciosos; las principales citocinas producidas por las células NK son IFN-?, FNT-? e IL-3; además éstas células también pueden responder a citocinas ya que expresan en su superficie algunos receptores especiales para IL-2, IL-12 y FNT. Las células NK pueden activarse a través de muchas señales, sin embargo existen dos funcionamientos claves; uno la citotoxicidad dependiente del anticuerpo (ADCC); donde NK puede lisar a otras células que han sido reconocidas previamente por un anticuerpo (IgG), NK los identifica por el marcador de superficie que expresa, se activa y ejerce su acción citotóxica a través de la liberación de sus gránulos y/o secreta citocinas al medio. El otro, a través de la citotoxicidad independiente del anticuerpo; las células NK utilizan un complejo sistema de receptores activadores e inhibidores y que contienen como ligandos o marcadores, diferentes moléculas de la familia de complejo mayor de histocompatibilidad clase I, estos median la activación de NK para ejercer su acción citotóxica (4, 5). 1.2.2.- Inmunidad humoral. Para combatir a los antígenos, los linfocitos B secretan una forma soluble del receptor de membrana por el que reconoció al antígeno, llamados anticuerpos, estos son proteínas variables producidas por los linfocitos B, en respuesta a una estimulación del sistema inmune, estos circulan como uno de los componentes principales del plasma en la sangre y en la linfa, su función es captar antígenos cuando estos se encuentran en los espacios extracelulares del organismo (6, 31, 32). Todas las moléculas de anticuerpos están formadas por cuatro cadenas polipeptídicas iguales unidas por puentes disulfuros; uno de los pares de las cadenas se denomina cadena pesada (55 y 77kDa) y el otro cadena liviana (25kDa); todas las cadenas pesadas comparten amplias regiones, y son las responsables de las propiedades físico-químico e inmunológicas de las Ig; sin embargo, poseen regiones únicas en cada isotipo (clase) que le permiten unirse a receptores celulares específicos y a moléculas del complemento y cumplir funciones efectoras (7). En el gráfico 13 se muestra una imagen esquemática de la estructura de un anticuerpo. Los anticuerpos se pueden fragmentar en dos componentes proteícos, funcional y estructuralmente diferentes; uno denominado Fab por donde interacciona específicamente con el antígeno y el otro, Fc por donde realiza funciones efectoras asociadas a cada isotipo en particular (4, 31, 33), antes de encontrar al antígeno la célula B madura expresa la inmunoglobulina en una forma unida a la membrana que funciona como receptor de la célula B para el antígeno. El desarrollo de las células B comprende etapas en las que se ensamblan diferentes componentes del receptor de esas células. En éste proceso cada célula B queda restringida a expresar una sola forma de receptor pero ésta forma varía de una célula a otra.
Imagen que muestra la estructura de las Ig, izquierda: cadenas pesadas y livianas, centro: fragmento Fab y Fc, derecha: región variable y región constante. Tomado de Regueiro 2002 (7).
Los anticuerpos son las formas secretadas de proteínas conocidas generalmente como Inmunoglobulinas (Ig); antes de encontrar al antígeno la célula B madura expresa la inmunoglobulina en una forma unida a la membrana que funciona como receptor de la célula B para el antígeno. El desarrollo de las células B comprende etapas en las que se ensamblan diferentes componentes del receptor de esas células. En éste proceso cada célula B queda restringida a expresar una sola forma de receptor pero ésta forma varía de una célula a otra.
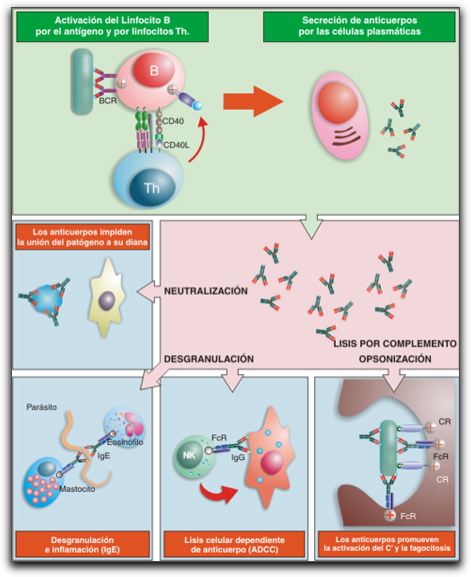
Producción de anticuerpos. Tomada de Abbas (33). Cuando el antígeno se une a éste receptor las células B son estimuladas para que proliferen y se diferencien en células plasmáticas, que entonces secretan anticuerpos de la misma especificidad que tenía la Ig unida a la membrana, la producción de anticuerpos es la única función efectora de los linfocitos B en el sistema inmune. La señal que inicia la proliferación de las células B y la secreción de los anticuerpos es la unión del antígeno a la célula B específica (7, 31, 33). En el gráfico 14, se puede observar una imagen esquemática que muestra la secreción de anticuerpos. Existen cinco clases de Inmunoglobulinas: Inmunoglobulina G (IgG); es la más abundante de todas y está contenida en los líquidos corporales, particularmente los extravasculares; en donde combate microorganismos y sus toxinas, tiene la propiedad de activar la vía clásica del complemento, es trasmitida a través del cruce placentario de la madre al hijo y puede fijarse a macrófagos y a los leucocitos polimorfonucleares. La inmunoglobulina A (IgA); se encuentra principalmente en las secreciones seromucosas, a través de las cuales defiende las superficies corporales en contacto con el exterior, puede activar la vía alternativa del complemento y al igual que IgG se fija a macrófagos y a los leucocitos polimorfonucleares. Otro tipo de Inmunoglobulina es IgM, la cual es una aglutinante muy eficaz, su principal función defensiva es activar la vía clásica del sistema del complemento. A diferencia de inmunoglobulina D (IgD); cuya función es fijarse a la superficie de los linfocitos. La última de las inmunoglobulinas es IgE, tiene la función de proteger las superficies corporales en contacto con el exterior, recluta agentes antimicrobianos, es la Ig que se encuentra en mayor proporción en los procesos parasitarios, es la responsable de los síntomas de alergia atópica y es la única de las inmunoglobulinas que se fija a basófilos y mastocitos homólogos. (6, 33) El sistema de complemento es un mecanismo innato de defensa del organismo que media los efectos inflamatorios y la lisis de los antígenos en la respuesta inmune humoral, IgG, IgM e IgA inducen su activación por la vía clásica a la que prestan su especificidad. Estos mismos isotipos son capaces también de recubrir físicamente al antígeno, neutralizándolo. Por otro lado, el proceso de fagocitosis tanto mediado por macrófagos como por los polimorfonucleares, supone la ingestión del antígeno por la célula efectora y su posterior degradación en el interior de esta e implica la existencia del contacto directo entre la célula efectora y el antígeno. El contacto es más eficaz si la célula fagocítica puede reconocer de forma específica la sustancia a degradar; por ello los fagocitos expresan en sus membranas receptores para IgG e IgA, cuando las inmunoglobulinas recubren la superficie del antígeno para el que son específicas, actúan como potenciadoras de la fagocitosis, esta función se conoce como opsonización o preparación para la fagocitosis. La citólisis no es un mecanismo exclusivo de los linfocitos T, sino, que otras células blancos como los neutrófilos, eosinófilos, macrófagos o NK, pueden destruir distintos tipos celulares e incluso grandes parásitos por éste proceso. La lisis de la célula diana requiere un recubrimiento previo de inmunoglobulina, en un proceso similar a la opsonización que termina con su destrucción, en el que pueden participar anticuerpos IgG en la mayoría de los casos o IgE cuando las células efectoras son eosinófilos. Este es el mecanismo de lisis celular dependiente de anticuerpos (ADCC). (5, 9, 31) El gráfico 15 resume esquemáticamente las funciones de las inmunoglobulinas.
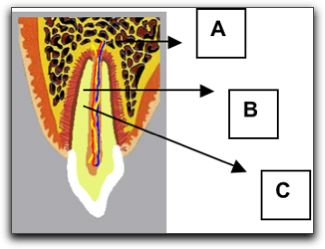
Esquema que ilustra la activación de linfocito B y síntesis de anticuerpos. Tomado de Naim (5). 2.- TEJIDOS PERIAPICALES. Los tejidos periapicales son: cemento radicular, ligamento periodontal y hueso alveolar, estos tejidos originados del mismo componente embrionario, conforman la unidad de desarrollo, biológica y funcional, conocida como periodonto de inserción, la cual experimenta cambios morfológicos relacionados con la edad, con alteraciones funcionales y con el medio bucal. La función principal consiste en unir y mantener el diente al tejido óseo de los maxilares (34, 35,36).
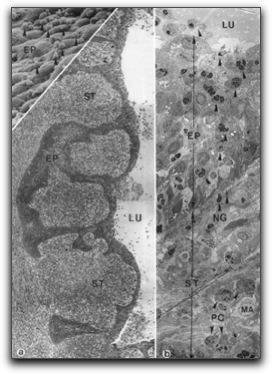
Foto ilustrativa: Periodonto de inserción. A: Hueso alveolar; B: Ligamento periodontal; C: Cemento radicular. Tomado de Soares (34). 2.1.- Cemento radicular. Es un tejido calcificado muy semejante al hueso que recubre la dentina radicular y la protege, lo cual reduce su permeabilidad; así mismo, provee un medio de anclaje a las fibras periodontales conocidas como fibras de Sharpey, en la raíz del diente. Éste tejido está desprovisto de vascularización, es menos dinámico que el hueso; ya que no se remodela, pero crece de manera continúa por aposición de nuevas capas. Existen varios tipos de cemento radicular, el cemento acelular (primario) y el celular (secundario), clasificados dependiendo de la presencia de cementocitos en el cemento. Además también se ha clasificado en cemento fibrilar intrínseco y cemento fibrilar extrínseco; dependiendo del origen de las fibras colágenas presentes, provenientes de los cementoblastos o de los fibroblastos respectivamente (37, 38, 39). En el gráfico 17 se muestra una imagen histológica del cemento radicular.
Imagen histológica del Ligamento periodontal, Cemento y Dentina. Lp: Ligamento periodontal. C: Cemento radicular. D: Dentina. Tomado de Soares 2002 (35). 2.2.- Ligamento periodontal. Es un tejido conjuntivo con fibras colágenas que establece la inserción del diente en la pared alveolar, rico en células como los fibroblastos, vasos y nervios, posee intenso metabolismo y el índice de renovación más rápido de todos los tejidos conectivos del organismo. Nutre al cemento y al hueso alveolar y presenta en su superficie células formadoras y células de reabsorción. Las células epiteliales de Malassez, remanentes de la vaina epitelial de Hertwig, se localizan próximas a la superficie del cemento. En las patologías perirradiculares con destrucción de los tejidos duros (cemento y hueso) y blandos (ligamento y médula ósea) el ligamento periodontal tiene la función de proveer los elementos biológicos, células, vasos y nervios necesarios en la reparación de la región (34, 36). 2.3.- Hueso alveolar. El hueso alveolar está constituido por el hueso alveolar propiamente dicho y por el hueso de soporte. El hueso alveolar es la delgada capa de hueso compacto que recubre al alvéolo llamado también lámina dura, es producido por los osteoblastos del ligamento periodontal y es un tejido especializado que experimenta remodelaciones por resorción y aposición ósea durante toda la vida. El hueso de soporte que circunda y sustenta al hueso alveolar del alveolo dental, está constituido por las placas corticales vestibular y lingual de hueso compacto y por el correspondiente tejido óseo esponjoso o trabecular. La irrigación sanguínea del hueso alveolar proviene de numerosas anastomosis existentes entre las distintas arterias y conforman la unidad funcional que irriga los tejidos duros y blandos de los maxilares (34, 35, 40). En el gráfico 18 se pueden observar los diferentes tipos de tejidos apicales.
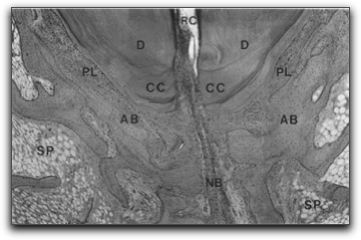
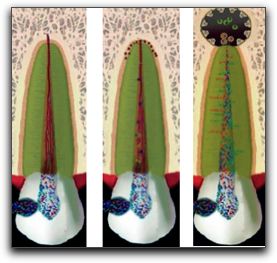
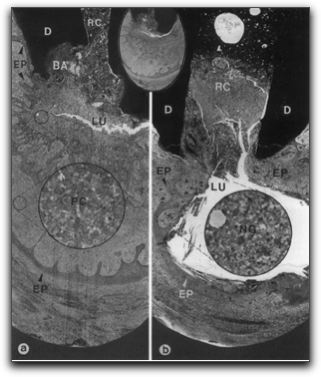
Microfotografia que muestra los diferentes tejidos periapicales sanos. D: dentina, CC: cemento celular, PL: ligamento periodontal, NB: paquete vasculonervioso, SP: hueso esponjoso, AB: hueso alveolar, RC: conducto radicular. Tomada de Nair (41). 3. -PERIODONTITIS APICAL. Esta se origina cuando el proceso inflamatorio y sus productos, los metabolitos provenientes de la degradación del tejido pulpar y/o las bacterias y sus toxinas, se acercan al tejido conjuntivo de la unión pulpoperiapical (40). La periodontitis apical es una reacción inflamatoria y una respuesta inmunológica frente a diferentes agentes agresores biológicos y no biológicos, también puede ser definida como una reacción inflamatoria del periápice del diente, de origen endodóntico (42). Por su parte Morse (3) señala que es una inflamación de los tejidos perirradiculares causada por diferentes agentes etiológicos de origen endodóntico. Así mismo, Torabinejad (43) la define como un desorden inflamatorio de los tejidos perirradiculares causado por la presencia de infección microbiana dentro del sistema de conductos radiculares. Nair (21, 41) afirma que es una respuesta defensiva del organismo que se desarrolla por la presencia de irritantes provenientes del sistema de conductos radiculares frente a la destrucción de la pulpa dental. Las fuerzas microbianas y las defensas del hospedero luchan entre sí y destruyen gran parte del periápice, lo que conlleva la formación de varias clases de lesiones periapicales. 3.1.- Agentes etiológicos de la periodontitis apical. Los agentes etiológicos se dividen en biológicos y no biológicos. Los primeros son diversos microorganismos y virus y los segundos son la irritación mecánica, térmica y química (43). Seltzer (44), señala que la irritación del tejido periapical local puede tener los siguientes factores etiológicos: Inflamación pulpar y necrosis pulpar , infección del sistema conductos radiculares, trauma dentario o por contacto prematuro, enfermedad periodontal y procedimientos endodónticos; bien sea por extirpación pulpar, instrumentación del conducto radicular, instrumentos fracturados en el interior del sistema de conductos, perforación radicular, extrusión de irritantes o sustancias tóxicas hacia los tejidos apicales y sobreobturaciones. Con respecto al trauma dentario puede ocasionar alteraciones en las estructuras de soporte producto del impacto, trayendo como consecuencia la ruptura de las fibras periodontales y con esto el desarrollo de un proceso inflamatorio local. Sin embargo, el daño de las células que envuelve a los tejidos es mínimo, y la rápida curación es favorable si se instaura a tiempo el tratamiento apropiado (43, 45, 46). Con respecto al trauma mecánico durante los procedimientos endodónticos, puede ser ocasionado durante la preparación del sistema de conductos; por sobreinstrumentación, por accidentes endodónticos, por extrusión de sustancias químicas (hipoclorito de sodio, ácido etilendiaminotetracético (EDTA), clorhexidina, entre otros) más allá de los límites anatómicos, o por la sobreobturación de los conductos radiculares. (47, 48) De la misma manera; movimientos de ortodoncia; malaoclusión o contactos prematuros después de la colocación de una restauración, pueden ocasionar respuestas inflamatorias y lesiones hísticas en los tejidos perirradiculares (17, 44). Las temperaturas extremas ocasionadas por el ultrasonido o por instrumentos transportadores de calor durante la obturación del sistema de conductos radiculares pueden originar daños al periodonto desencadenando un proceso inflamatorio en los tejidos. Por su parte, la radiación, bases de cementos o agentes de cementación, y productos corrosivos; también actúan como factores irritantes para los tejidos (3, 43). Autores señalan (41, 49, 50, 51, 52, 53, 54), que los principales agentes etiológicos de las enfermedades pulpares y periapicales son los microorganismos y sus toxinas, que al entrar en contacto con los tejidos pulpares y periapicales actúan como antígenos, desencadenando una reacción inmunológica en el hospedero. Por otro lado; la preparación incompleta del sistema de conductos radiculares puede ser causa de periodontitis apical, el hecho de quedar restos de tejido pulpar en el sistema de conductos o los microorganismos y sus productos en caso de ser una pulpa infectada, pueden desencadenar todos los eventos biológicos que conllevan a su desarrollo; adicional a esto, desechos dentinarios extruídos hacia los tejidos apicales durante la instrumentación del sistema de conductos radiculares, también puede desencadenar cambios inflamatorios y estructurales en los tejidos de soporte del diente (43, 48, 50, 53, 55). Por lo tanto, cualquier situación que acontezca ocasiona en el tejido pulpar una serie de cambios inflamatorios vasculares y celulares, que podrían culminar en la destrucción de los tejidos pulpares y con ello el desarrollo de la periodontitis apical (41, 56). 3.2. - Desarrollo de la periodontitis apical. El sistema de conductos radiculares puede albergar grandes cantidades de irritantes debido a los cambios patológicos de la pulpa dental, la salida de estas sustancias hacia los tejidos perirradiculares trae como consecuencia el desarrollo de la periodontitis apical y su persistencia. Según la índole, cantidad y duración de los irritantes en los tejidos perirradiculares, se presentarán diversos cambios tisulares. Sin embargo, cuando los irritantes son de carácter transitorio, el proceso inflamatorio es breve y cede por sí sólo. En cambio, cuando se presentan en cantidades excesivas o cuando la exposición es persistente, las reacciones inmunitarias específicas e inespecíficas ocasionan la destrucción de los tejidos perirradiculares y el desarrollo de la periodontitis apical (3, 43). Cuando sustancias provenientes de la degradación pulpar, entre estas; moléculas efectoras, MMps, mediadores moleculares como: citocinas, interleucinas, factores de crecimiento, metabolitos derivados del ácido araquidónico, en casos de necrosis pulpar infecciosa, las bacterias y sus toxinas, se aproximan y llegan a los tejidos de soporte del diente y provocan una reacción inflamatoria en el periodonto (17, 22, 23, 26, 49, 57). Esta inflamación conducirá inicialmente a un ensanchamiento del ligamento periodontal, que se manifestará clínicamente con dolor a la percusión y a la masticación, inicialmente va a existir un proceso inflamatorio agudo localizado alrededor del foramen apical, si no se elimina la causa, el proceso puede avanzar y aparecer síntomas adicionales conforme la enfermedad avanza. Al evolucionar el proceso y encontrarse en etapas avanzadas de destrucción ósea, puede observarse, en ocasiones, un trayecto fistuloso, edema en la zona afectada y/o dolor. Radiográficamente, puede observarse un aumento de zonas radiolúcidas alrededor de las vías de salida del conducto principal o de los conductos laterales, accesorios, o de ambos (44, 57). Histológicamente dependiendo de la etapa de desarrollo, las lesiones presentan múltiples células inflamatorias: leucocitos polimorfonucleares neutrófilos, macrófagos, linfocitos, células plasmáticas, células cebadas o mastocitos, eosinófilos, cordones epiteliales y/o restos epiteliales de Malassez (58, 59, 60). La interacción entre los irritantes y los mecanismos de defensa del hospedero dá por resultado la liberación de múltiples mediadores que tratan o intentan detener el avance de la enfermedad y el desarrollo de una infección local grave. Sin embargo, cuando los irritantes se presentan en mínimas cantidades y por poco tiempo, ocasionan daños hísticos reversibles y recuperación de los tejidos. Por el contrario, cuando los irritantes se presentan en grandes cantidades y permanecen en los tejidos por largos períodos de tiempo, por lo general conducen a cambios irreversibles en la pulpa y en consecuencia, el desarrollo de lesiones perirradiculares (37, 44). En el gráfico 19 se muestra esquemáticamente el desarrollo evolutivo de la periodontitis apical.
De izquierda a derecha, ilustración esquemática del desarrollo de la periodontitis apical. Tomada y modificada de Siquiera 2005 (48).
3.3.- Clasificación de la periodontitis apical. Los cambios tisulares ocurridos como respuesta a los agentes irritantes contenidos en el sistema de conductos radiculares, trae como consecuencia el desarrollo de los diferentes tipos de periodontitis apical; ésta puede ser clasificada según diversos puntos de vista: La organización mundial de la salud clasifica a la periodontitis apical en cinco categorías (21): 1.- Periodontitis apical aguda. 2.- Periodontitis apical crónica. 3.- Absceso periapical con fístula. 4.- Absceso periapical sin fístula. 5.- Quiste radicular. Smulson (40), cita la clasificación utilizada por la universidad de Loyola: 1.- Patosis pulpoperiapicales dolorosas. a.- Periodontitis periapical aguda incipiente. b.- Periodontitis apical aguda avanzada. b.1.- Absceso periapical agudo. b.2.- Absceso recrusdecente (exacerbación aguda de una periodontitis apical crónica avanzada preexistente) b.3.- Absceso periapical subagudo (fase dolorosa del ciclo del absceso periapical crónico) 2.- Patosis pulpoperiapicales indoloras. a.- Osteosclerosis pulpoperiapical. b.- Periodontitis periapical crónica incipiente. c.- Periodontitis periapical crónica avanzada. c.1.- Granuloma periapical. c.2.- Quiste periapical. c.3.- Absceso periapical crónico.
Torabinejad (43), quien la propone en Ingle, se basa en las manifestaciones clínicas y radiográficas, y dividen a las lesiones perirradiculares en tres grupos clínicos: 1.- Periodontitis apical sintomática (aguda). 2.- Periododontitis apical asintomática. 2.-1.- Granuloma periapical. 2.2.- Quiste radicular. 2.3.- Osteítis condensante. 3.- Abscesos apicales. 3.1.- Absceso apical sintomático. 3.2.- Absceso apical asintomático.
Morse et al. (61), propusieron una clasificación de la condición pulpar y periapical, basándose en los síntomas clínicos y radiográficos: 1.- Vital asintomática. 2.- Dentina hipersensible. 3.- Inflamada-reversible. 4.- Inflamada &endash;irreversible. 5.- Inflamada/degenerativa sin área radiolúcida apical. irreversible. 6.- Inflamada/degenerativa con área radiolúcida apical. irreversible. 7.- Necrosis pulpar sin área radiolúcida apical. 8.- Necrosis pulpar con área radiolúcida apical. Nair (21, 41), propuso una alternativa de clasificación basada en la histopatología y en la dinámica de éstas lesiones. El criterio expresado por este autor incluye la distribución y el tipo de célula dentro de la lesión, la presencia de absceso y de células epiteliales, si la lesión ha tenido transformación quística y la relación de la cavidad quística con el foramen del diente involucrado. Este autor la clasifica de la siguiente manera: 1.- Periodontitis apical aguda. 1.1.- Primaria 1.2.- Secundaria (aguda por exacerbación). 2.- Periodontitis apical crónica. Granuloma apical. Osteítis condensante. 3.- Absceso periapical. 3.1.- Agudo. 3.2.- Crónico. 4.- Quiste periapical. 4.1.- Verdadero. 4.2.- Falso. A continuación se describirán los diferentes tipos de periodontitis apical. 1.- Periodontitis apical aguda. 1.1.- Periodontitis apical aguda primaria. Éste tipo de respuesta suele ser causada por microorganismos que invaden el tejido periapical desde el conducto radicular, también puede ser inducida por un traumatismo dentario o por una lesión debida a la instrumentación del sistema de conductos radiculares o a la irritación por sustancias químicas o por materiales endodónticos, que pueden provocar una respuesta intensa y de corta duración en el hospedero, que pueden originar una reacción inflamatoria incipiente exudativa y levemente sintomática de los tejidos conjuntivos periapicales que provoca vasodilatación, exudado, líquido e infiltración leucocitaria periapical, y tal respuesta se acompaña de síntomas clínicos, como dolor e hipersensibilidad a la percusión (40, 17, 21, 57). 1.2.- Periodontitis apical aguda secundaria. Es la exacerbación periapical aguda que deriva de una lesión crónica granulomatosa preexistente al quedar combinada o infectada la zona con irritantes procedentes del conducto radicular, se caracteriza por una zona infiltrada de células inflamatorias crónicas, múltiples leucocitos polimorfonucleares y macrófagos con gran contenido de exudado purulento producto de la muerte y destrucción de los leucocitos (40).También se puede decir que es una lesión inflamatoria crónica que puede estar adaptada a la irritación, y cuando se inicia el tratamiento de conducto, nuevos agentes agresores como: microorganismos, dentina infectada, medicamentos, soluciones irritantes, etc, pueden ser introducidos en la lesión provocando una reacción violenta que constituyen una alteración local, los síntomas y signos son dolor espontáneo, edema y presión en la zona. Radiográficamente, se puede evidenciar la pérdida de tejido óseo asociada al ápice del diente lo cual indica la existencia de una patología crónica (17, 50, 57). 2.- Periodontitis apical crónica. Granuloma apical. Osteítis condensante. La periodontitis apical crónica, es una respuesta crónica del tejido conjuntivo periapical a algún irritante pulpar, se caracteriza por un ensanchamiento del espacio periodóntico apical, que contiene vasos sanguíneos dilatados, un ligero exudado inflamatorio y una densa acumulación de células inflamatorias crónicas y es una lesión periapical asintomática que sólo se evidencia en la radiografía. Habitualmente, en una pulpa infectada, las bacterias y sus endotoxinas, que alcanzan la región apical desde la pulpa necrótica, causan una reacción inflamatoria y producen desmineralización extensa del hueso trabecular y de su cortical (40, 57). Es importante señalar que se puede presentar una variante radiográfica e histológica especial de la inflamación crónica de origen pulpar. Esta patología es mas frecuente en sujetos jóvenes y en edad media, afecta sobre todo a primeros molares inferiores y es una respuesta del hueso medular frente a una agresión. También puede ser definida como una respuesta del hueso periapical a una irritación pulpar de bajo grado y prolongada, que se manifiesta como un aumento en la densidad del hueso periapical. Esta patología se observa con mayor frecuencia en los ápices de dientes mandibulares con caries extensas, grandes restauraciones; y pulpas vitales crónicamente inflamadas, o necróticas. La lesión aparece como una radiopacidad bien circunscrita en el hueso perirradicular de un diente que puede mostrar o no sensibilidad a la percusión. Desde el punto de vista histológico, tales lesiones revelan una masa densa de trabéculas óseas con espacios medulares limitados, el tejido óseo está recubierto por osteoblastos, y el espacio medular puede aparecer infiltrado por linfocitos (21,62, 63). Desde el punto de vista inmunológico son muy escasos los estudios que tratan de explicar el comportamiento de las células inmunocompetentes en este tipo de alteración. Otra forma de periodontitis apical crónica es el granuloma periapical, se caracteriza por el desarrollo de un tejido de granulación y por la presencia de células inflamatorias crónicas como respuesta a la irritación pulpar sostenida, está formado por un tejido inflamatorio con predominio de macrófagos, linfocitos, plasmocitos, polimorfonucleares, fibroblastos, vasos sanguíneos y células epiteliales(59, 64, 65). Radiográficamente, pueden observarse imágenes radiolúcidas pequeñas, grandes, circunscritas, difusas y en ocasiones suele haber dolor a la percusión y/o a la palpación o puede existir la presencia de un trayecto fistuloso que indica la presencia de una supuración activa que recibe el nombre de absceso periapical crónico (57). 3.- Absceso periapical. 3.1.- Absceso periapical agudo. El absceso periapical agudo es una respuesta inflamatoria avanzada exudativa e intensamente sintomática de los tejidos conjuntivos periapicales. Está producida por contaminantes procedentes del conducto radicular que generan grandes cantidades de exudado inflamatorio, infiltración leucocitaria y supuración, constituye el resultado de la exacerbación de la periodontitis apical aguda en una pulpa infectada y necrótica. Aunque la enfermedad suele ser muy grave, el ligamento periodontal quizás tenga un aspecto radiográfico normal o ligeramente ensanchado y el diente afectado presenta una sensación de hiperoclusión debido a la acumulación de edema en la zona (40, 57, 66). 3.2.- Absceso periapical crónico. Es la reacción inflamatoria del tejido conjuntivo periapical, leve y prolongada, se caracteriza por la aparición de un trayecto fistuloso, suele desarrollarse a partir de una periodontitis apical crónica, aunque también puede ser secundario a un absceso periapical agudo, es causada por gérmenes de bajo poder patogénico, que permiten al organismo controlar la infección, la mayoría de las veces, se mantienen asintomáticas al ser fistulizadas a la mucosa o a la piel, el trayecto fistuloso que se abre a la cavidad bucal se rodea de una lesión nodular formada por tejido de granulación (66, 67, 68). 4.- Quiste periapical. Se origina de los restos epiteliales de Malassez, los cuales aumentan de tamaño y forman un islote epitelial en el interior del granuloma, todo esto en respuesta a la inflamación desencadenada por la infección bacteriana de la pulpa o en respuesta directa al tejido pulpar necrótico, se caracteriza por una cavidad revestida por un epitelio plano estratificado; con abundantes células polimorfonucleares (41, 69, 70, 71, 72). Pueden presentarse dos clases de quistes periapicales: el quiste apical falso (llamado también en bolsa), se define como un quiste inflamatorio apical con una cavidad similar a la de un saco, recubierta por epitelio, pero abierta y comunicada con el conducto, el otro tipo se denomina quiste apical verdadero, se define como una cavidad patológica bien definida, que se encuentra encerrada en la mucosa epitelial de tal manera que no existe comunicación con el conducto radicular (21,41 73). En el gráfico 20 se puede observar una microfotografía que muestra al quiste periapical.
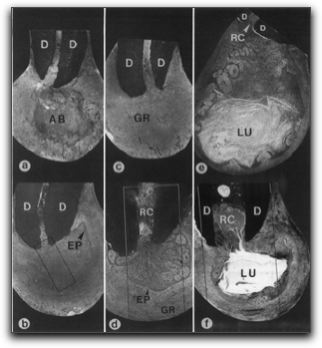
Microfotografía de un granuloma apical. AB,a,b: absceso. GR,c,d: granuloma. e,f: quiste. Dependiendo de la presencia o ausencia de epitelio. EP: b,d: epitelializado. a, b: no epitelializado. Dentro de los quistes.e: verdadero. LU: cavidad quística completamente encerrada sin comunicación con el conducto. f: en bolsa. LU: cavidad quística abierta o en comunicación con el conducto. Tomada de Nair (41).
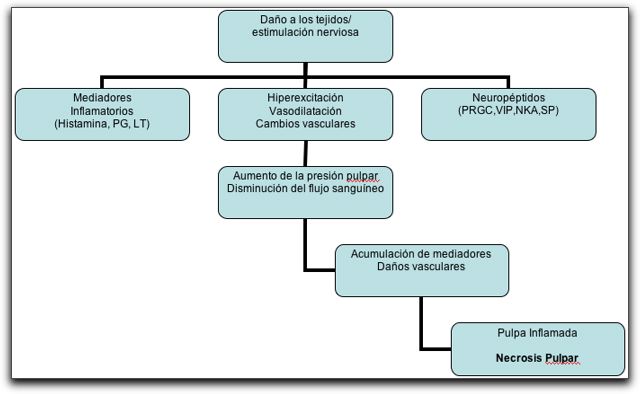
4.- HISTOPATOLOGÍA DE LA PERIODONTITIS APICAL. 4.1.- Histopatología de la periodontitis apical aguda. Independiente del agente etiológico, el organismo reacciona produciendo una serie de cambios vasculares, vasodilatación y aumento de la permeabilidad vascular, exudado y edema en la zona. Simultáneamente aparecen en la zona apical la primera línea de defensa inflamatoria celular, que caracteriza a toda la inflamación aguda; los neutrófilos polimorfonucleares (42, 74). En consecuencia ocurre congestión vascular, edema del ligamento periodontal y extravasación de neutrófilos. Las células son atraídas al área por quimiotaxis, inducida inicialmente por la lesión tisular, por mediadores moleculares y por el factor C5 del complemento, seguidamente, aparecen en la zona apical macrófagos y fibroblastos, que intentan delimitar el proceso. Sin embargo, si los irritantes no son eliminados el proceso continua y los componentes del sistema inmune no consiguen contrarrestarla, seguirán llegando más neutrófilos hasta alcanzar un número considerable, al mismo tiempo ocurre la degranulación de los mastocitos en el tejido apical y aumento de la respuesta vacuolar local por la liberación de aminas vasoactivas como la histamina. Esto ocurre básicamente por la intervención de una respuesta inmunológica netamente innata como mecanismo de defensa ante los irritantes provenientes del sistema de conductos radiculares (3, 42, 75,89). Durante el proceso, los mediadores inflamatorios causan cambios en las moléculas de adherencia expresadas por el endotelio vascular de los capilares sanguíneos apicales y alrededor de ellos. Estos cambios posibilitan que los neutrófilos de la sangre se adhieran al endotelio vascular activado y se deslicen entre las células endoteliales para entrar en el tejido comprometido, sin embargo a medida que van llegando más neutrófilos al mismo tiempo ocurre la muerte de estos y la liberación del contenido de sus gránulos, de tal manera que la acumulación y muerte local de los neutrófilos representa una causa importante de destrucción tisular durante las fases agudas de la periodontitis apical. Si la inflamación ha sido inducida por factores irritantes, no infecciosos, la lesión puede ceder, y la estructura del periodonto apical será restaurada mediante cicatrización. Si por el contrario, el origen es infeccioso, los neutrófilos no sólo atacan y destruyen a los microorganismos, sino también liberan, LTB4 y PG, que atraen más neutrófilos, macrófagos y mastocitos, al área y activan a los osteoclastos de la zona para iniciar el proceso de resorción ósea (3, 8, 21). Por su parte y paralelo a esto, la activación del sistema del complemento específicamente las fracciones solubles C3a y C5a siguen atrayendo más neutrófilos de la sangre hacia los tejidos afectados y estimulan la degranulación de más mastocitos y la síntesis de citocinas inflamatorias. El efecto combinado de estas actividades es lo que produce un estado de inflamación local con sus síntomas característicos (10, 29). a) Interleucinas. En ésta fase de la periodontitis apical, las interleucinas son liberadas por los linfocitos y macrófagos entre estas: IL-1, IL-6, IL-8 y el FNT; las acciones locales de éstas citocinas incluyen la potenciación de la adherencia de los leucocitos a las paredes endoteliales, la estimulación de los linfocitos, la potenciación de los neutrófilos, la activación de la producción de las PG y enzimas proteolíticas, la potenciación de la reabsorción ósea y la inhibición de la formación ósea (14, 17, 27, 76). Diferentes autores (26, 27, 28, 77, 78) señalan que IL-2, también inhibe la síntesis de colágeno y la acción neutrófila, impidiendo el proceso de reparación en los tejidos e IL-1? induce y regula la degradación del colágeno y las matrices extracelulares por la actividad de MMPs en los tejidos inflamados. Además, IL-2, estimula la expansión clonal de la población de linfocitos T CD4 y regula la secreción de otras citocinas proinflamatorias por parte de macrófagos y neutrófilos en la zona de la inflamación. Wisithphrom et al. (27) demostraron científicamente altos niveles de citocinas proinflamatorias específicamente FNT-?, IL-1? , IL-6 y TGF-?, en dientes con pulpas inflamadas y evaluaron los efectos que éstas citocinas podrían tener sobre los fibroblastos de la pulpa. Esto lo llevaron a cabo a través de análisis de zimografía, cultivo celular y Western Blot y llegaron a la conclusión que la inducción de citocinas en una pulpa inflamada puede activar la secreción de proteínas efectoras como las MMPs, entre ellas; la colagenasa, la cual produce la degradación de las matrices celulares (fibroblasto y colágeno tipo I y III) y en consecuencia la destrucción de la pulpa dental y en consecuencia alteraciones en el tejido apical. La periodontitis apical aguda, se caracteriza por ser una patología dolorosa, Smulson (40), señala que es una respuesta inflamatoria del tejido conectivo periapical a irritantes pulpares, en las que se produce una hiperactividad de las fuerzas exudativas agudas, los síntomas dolorosos se deben a un aumento de la presión intraperiapical y a la acción de mediadores químicos liberados por diferentes células. Entre los factores que desempeñan un papel importante en los procesos inflamatorios periapicales, se encuentran los neuropéptidos. Se ha demostrado la presencia de varios neuropéptidos involucrados en la periodontitis apical aguda (79, 80).
b) Neuropéptidos. Los neuropéptidos son sustancias moduladoras de células y tejidos, sintetizadas por células nerviosas estimuladas y por sus procesos citoplasmáticos; en diversos estudios se han reportado cinco neuropéptidos; la sustancia P (SP), el péptido relacionado al gen de la calcitonina (PRGC), el péptido vasoactivo intestinal (PVI), el neuropéptido Y (NPY) y la neurokinina A (NKA); los cuales están involucrados con la regulación del flujo sanguíneo en la pulpa dental y con los efectos de vasodilatación en los procesos inflamatorios Se ha reportado que la SP interactúa con los vasos sanguíneos, causando vasodilatación y extravasación del plasma (79, 80, 81, 82). El gráfico 21 muestra esquemáticamente la relación de los neuropéptidos y los cambios vasculares.
Neuropéptidos, cambios vasculares y mediadores inflamatorios.Tomada de Kim (82). Diversas investigaciones acerca de fibras dentales sensoriales que contienen al PRGC, SP, NKA afirman que estas forman numerosas terminaciones en los vasos sanguíneos pulpares y en el tejido periodontal (79, 81). Un estudio realizado en tejido pulpar y periapical, muestra que el PRGC y la SP, son liberados por la estimulación de las fibras sensoriales y ejercen efectos que alteran el flujo sanguíneo, las respuestas inflamatorias e inmunes y a las células del tejido conectivo periapical. Autores como Byers et al. (83), realizaron un estudio a través de métodos inmunocitoquímicos en lesiones perirradiculares en ratas de experimentación, para conocer el mecanismo de neuropéptidos, específicamente el PRGC. Los resultados de este estudio arrojaron un aumento de los brotes de las fibras nerviosas periapicales y los niveles del PRGC. Esto sugirió que las ramificaciones de las fibras nerviosas sensoriales y los neuropéptidos pueden contribuir al desarrollo de la patología. Así mismo, señalan que otros factores etiológicos, como la difusión de productos bacterianos desde abscesos pulpares podrían contribuir al desarrollo de lesiones periapicales, y que la presencia de un mecanismo neurogénico en el comienzo de una lesión periapical puede deberse también a la estimulación del flujo sanguíneo, reacciones inflamatorias, actividad celular inmune, y a otras funciones celulares por otros neuropéptidos. Sin embargo, autores como Azuero-Holguin et al.(84),señalan que es muy probable que el PVI principalmente, actúe en los receptores específicos celulares de la matríz ósea; y éstos receptores pueden actuar estimulando o activando a los osteoclastos para generar resorción ósea. Por otro lado, dos importantes mediadores biológicos, derivados del ácido araquidónico; el primero las PG y el segundo LT, también desempeñan una función en la patogénesis de las lesiones apicales dolorosas (22, 23, 25, 85). c) Metabolitos derivados del ácido araquidónico: Torabinejad et al. (25), realizaron un estudio con la finalidad de conocer la correlación existente entre la concentración de LTB4 y los síntomas clínicos en los pacientes con lesiones periapicales. La muestra para el estudio consistió en 12 lesiones apicales divididas en dos grupos; seis obtenidas de pacientes sintomáticos y seis obtenidas de pacientes completamente asintomáticos, como muestra control se usaron seis pulpas de terceros molares no erupcionados como grupo control negativo, y tejido gingival inflamado como grupo control positivo. Las concentraciones de LTB4 fueron determinadas a través de un procedimiento de cromatografía líquida de fase reversa de alta presión y comparadas entre las pulpas controles no inflamadas y las lesiones periapicales, tanto de los pacientes sintomáticos como los asintomáticos. Los resultados del estudio demuestran una concentración superior de LTB4 tanto en el tejido gingival inflamado como en las lesiones periapicales en comparación con el grupo control negativo; adicional a ésto también se pudo observar la presencia de una gran cantidad de células inflamatorias como los leucocitos polimorfonucleares. Este estudio concluye que todos los pacientes que presentaron sintomatología evidenciaron altos niveles de LTB4, lo que demuestra la correlación positiva entre los niveles de concentración de LTB4 y la presencia de síntomas en pacientes con lesiones perirradiculares. Es bién conocido que las PG se forman cuando el ácido araquidónico se metaboliza a través de la vía de la ciclooxigenasa ocasionando dolor (22, 23, 60). Chang et al. (85), concluyen que citocinas inflamatorias como la IL-1? y FNT-? estimulan la producción de PGE2, a través de la vía de la COX-2, por activación de los fosfolípidos de la membrana celular de los tejidos durante los procesos inflamatorios. Altos niveles de IL-8 también han sido asociados con pacientes que presentan lesiones perirradiculares con síntomas clínicos; autores señalan que ésta citocina tiene un papel importante en el desarrollo de las patologías perirradiculares agudas (87). Durante las fases posteriores de la respuesta aguda, comienzan a aparecer más macrófagos en el periápice. Los macrófagos activados siguen produciendo grandes cantidades de mediadores moleculares, los cuales, intensifican la respuesta vacuolar local, la resorción osteoclástica y la degradación de las matrices celulares mediada por moléculas efectoras, y pueden situar al cuerpo en una situación de alerta general, mediante una acción endocrina, con elevación súbita de la producción de proteasas de la fase aguda y otros factores séricos (30, 58, 88). Entre los factores locales que estimulan la osteoclasia se destacan IL-1, IL-6, IL-8, FNT, PGE2 y LTB4, todos estos mediadores en condiciones de normalidad se encuentran manteniendo un equilibrio biológico; sin embargo, en condiciones patológicas como la inflamación, ocasionan la resorción de los tejidos (10, 87, 88). Una vez liberadas en el área de la inflamación éstas citocinas van a estimular a las células clásticas: osteoclastos, dentinoclastos y cementoclastos, dependiendo del tejido que vayan a reabsorber, para que segreguen ácidos los cuales van a descalcificar el tejido mineralizado de la zona y van a proporcionar el medio ácido adecuado para la acción de las enzimas proteolíticas, específicamente proteasas, colagenasas y gelatinasas, las cuales van a degradar la estructura proteica de una superficie previamente desmineralizada (21, 89). Sin embargo, si el avance de la respuesta inflamatoria aguda no es tratado, puede seguir diversas vías de evolución, el agravamiento con extensión en el hueso, la formación de un trayecto fistuloso buscando siempre la vía de menor resistencia o, el paso a la cronicidad. 4.2.- Potencial de los microorganismos en el desarrollo de la respuesta inmunológica. La infección de la pulpa dental envuelve una flora polimicrobiana predominantemente anaeróbia Gram negativa, esta infección inicia una respuesta inmunológica en la pulpa dental para eliminar a los agentes agresores, sin embargo en la mayoría de los casos no se resuelve, ocasionando una necrosis total de la pulpa dental, subsecuentemente se desarrolla una respuesta inmunológica secundaria en los tejidos periapicales trayendo como consecuencia una lesión apical debido a la llegada de los microorganismos provenientes del conducto radicular. En consecuencia, el tejido periapical desarrolla una respuesta inmunológica innata inicial, guiada principalmente por leucocitos, fagocitos y citocinas proinflamatorias. Posteriormente se desarrolla una fase crónica que envuelve una respuesta inmunológica adquirida guiada principalmente por linfocitos T y B, en éste momento se activa un mecanismo inmunológico complejo, donde inicialmente se lleva a cabo un acto primario de defensa y protección a los tejidos pulpares y periapicales que conlleva a otro que conduce a la degradación de los tejidos; principalmente la resorción ósea (19, 90, 91). Los productos de los microorganismos residentes en el conducto radicular tienen varias propiedades biológicas, entre ellas; antigenicidad, actividad mitogénica, vasoactividad, quimiotaxis, histolisis enzimática y activación de las defensas del hospedero (41, 55). La respuesta inflamatoria en el periápice impide la invasión microbiana de los tejidos perirradiculares, lo que explica que los microorganismos se encuentren raras veces en los tejidos periapicales. Por lo tanto, la presencia y distribución de los microorganismos en conductos radiculares infectados y su influencia como grandes precursores de las reacciones inflamatorias de los tejidos periapicales establecen una importante asociación de causa y efecto, es decir, si se tiene un número importante de microorganismos, con gran virulencia y poca capacidad defensiva orgánica, se desencadenará un proceso inflamatorio agudo; sí por el contrario, el número de microorganismos es reducido, su virulencia atenuada y el organismo tiene buenas defensas, el proceso inflamatorio dará lugar a un cuadro crónico (15, 42, 50, 65, 92). Numerosas han sido las investigaciones que afirman que los microorganismos tienen una participación en el desarrollo y mantenimiento de las lesiones perirradiculares (17, 49, 51, 52, 53, 90, 93, 94). Nair (90), realizó un estudio para evaluar la flora endodóntica de dientes con lesiones periapicales, sus resultados concluyen que todos los dientes afectados periapicalmente contienen bacterias y que la flora endodóntica está constituida por una mezcla de cocos, bacilos, formas filamentosas y espiroquetas. También pudo observar que sólo una porción de las lesiones periapicales mostraron bacterias dentro del cuerpo de la lesión y éstas a su vez estuvieron asociadas con sintomatología. Otro estudio llevado a cabo por Nair (95), pudo observar la presencia de levaduras en dientes con lesiones periapicales. Diversos autores (93, 96, 97, 98, 99) señalan que las pulpas necróticas se encuentran compuestas por una microbiota caracterizada por una diversidad de especies microbianas, un estimado de cuatro a siete especies diferentes de bacterias Gram positivas y Gram negativas; generalmente con un predominio de éstas últimas. Entre los mecanismos patogénicos bacterianos en la enfermedad periapical se encuentran: invasión, producción de exotoxinas, endotoxinas, producción de enzimas, entre estas; colagenasa, hialuronidasa, fosfatasa ácida, fibrinolisina, coagulasa, proteasa, enzima degradadora de fibronectina; así mismo, productos del metabolismo microbiano como; ácidos grasos, ácido propiónico, butírico, acético, amonio, compuestos sulfurados, indol y, evasión de las respuestas inmunológicas del hospedero, de tal manera que la combinación de los mecanismos patogénicos bacterianos influencian e interfieren con las defensas del hospedero, determinando el tipo de respuesta periapical (17, 54, 100). Cada microorganismo en particular posee características de virulencia que determinan su mayor o menor patogenicidad;en este sentido Hahn et al. (101), evaluaron diferentes especies de microorganismos; entre ellos Streptococcus mutans, el cual tiene la capacidad de inducir citocinas inflamatorias como IFN-? e IL-10 más que cualquiera de los otros microorganismos que fueron usados en el estudio; sin embargo, Pseudoramibacter alactolyticus, indujo significativamente más IL-10 que IFN-?, mientras que Lactobacillus casei, Actynomices viscosus, y Prevotella intermedia indujeron concentraciones similares para ambas citocinas. En el gráfico 22 se puede observar una microfotografía de dos especies microbianas asociadas a lesiones perirradiculares.
Microfotografía que muestra la presencia de microorganismos asociados a dientes con lesiones perirradiculares. Izquierda; colonias de Streptococcus mutans. Derecha: GR: Granuloma, AC: ss. Actynomices. NG: leucocitos polimorfonucleares, D: dentina, ER: eritrocitos. Tomada de Nair (41). Por su parte, las bacterias anaerobias Gram negativas, presentan como componente de la pared celular una endotoxina conocida como lipopolisacárido (LPS), la cual desempeña un papel fundamental en el desarrollo de la periodontitis apical, tiene la propiedad de incentivar a células inmunocompetentes para producir mediadores moleculares inflamatorios (54, 100, 102, 103). En el gráfico 23 se muestra una figura esquemática del LPS.
Imagen esquemática que muestra al Lipopolisacárido como constituyente de la pared celular de ciertos microorganismos Gram negativos. Tomada de http://www.qb.fcen.uba.ar/microinmuno/SeminarioTinciones_archivos/image008.gif. 23.10.2007, 6:00pm
El LPS, estimula la producción de los metabolitos derivados del ácido araquidónico, especialmente prostaglandinas, la cual produce un aumento de la permeabilidad vascular e induce la resorción ósea (19). El ácido lipoteicoico (ALT), otro componente bacteriano, es una molécula constituída por una molécula de poliglicerolfosfato con un complejo glicolipídico, presente en la membrana celular de las bacterias Gram positivas, especialmente encontrada en especies bacterianas de Estreptococos, sin embargo es producido por una gran cantidad de especies cariogénicas (104, 105). En el gráfico 24 se muestra una imagen esquemática del ácido lipoteicoico.
Imagen esquemática que muestra al Ácido lipoteicoico como constituyente de la pared celular de ciertos microorganismos Gram positivos. Tomado de www.qb.fcen.uba.ar/.../SeminarioTinciones.htm23.10.2007, 6:00pm Tanto LPS como el ALT, activan la respuesta inmunológica innata por mecanismos muy similares, principalmente a través de la activación del sistema del complemento; adicional a esto, ambas tienen la capacidad de inducir la liberación de citocinas proinflamatorias tales como el FNT-?, IL-2, IL-10, IIL-4 e IFN (10, 101, 105,106). Las endotoxinas y enzimas bacterianas ejercen su función, siendo responsable de las relaciones que potencian la infección, promueven la inhibición de la quimiotaxía de los neutrófilos y fagocitosis, garantizan la migración de enzimas lisosómicas, participan en la respuesta inmunológica por la actividad de C3 y C5, inducen la producción de anticuerpos y estimulan la liberación de citocinas inflamatorias (9, 54, 86, 100). Así mismo; dentro de las propiedades de virulencia de ciertos microorganismos como Streptococcus mutans, está su habilidad para formar biopelículas bacterianas, así como también propiedades de adhesión a través de componentes bacterianos como la glucosil-transferasas, proteínas del antígeno C y una proteína de adhesión al Glucan (Gbp), ésta última le confiere al microorganismo la capacidad de evadir la respuesta inmunológica del hospedero evitando los mecanismos de fagocitosis (107). Otra especie bacteriana como Porphyromonas endodontalis, el cual es un bacilo Gram negativo, está relacionado con infecciones endodónticas mixtas asociadas a síntomas de una infección aguda. Éste microorganismo posee la capacidad de evadir las defensas del hospedero debido a que dentro de sus características de virulencia presentan una cápsula que le permite ser resistente contra los mecanismos de fagocitosis de las células del hospedero; además ésta bacteria puede estimular a células T CD4 Th1 y promover la liberación de IL-4 e IFN-?, en una fase aguda de inflamación pulpar (53, 106). Así mismo, otras bacterias como Porphyromona gingivalis y Prevotella intermedia, pueden estimular la activación de moléculas efectoras MMPs, las cuales degradan los tejidos y estimulan la liberación de FNT, IL-2, IL-6 y la síntesis de PG, así como también estimulan el aumento de proteínas solubles como proteína C reactiva y proteina A amyloide, durante los procesos inflamatorios (26, 30). Gráfico 25.
Imagen esquemática que muestra la relación de ciertas bacterias y la síntesis de diferentes mediadores inflamatorios. Tomada de Chang (26). Otro microorganismo importante en el desarrollo y persistencia de la periodontitis apical es Enterococus faecalis, éste microorganismo es asociado mayormente con lesiones perirradiculares crónicas asintomáticas persistentes. Posee factores de virulencia que incluyen enzimas líticas, citolisinas, sustancias de agregación, feromonas y ácido lipoteicoico; siendo capaz de suprimir la acción de los linfocitos (108). Los hongos, microorganismos quimiorganotrofos eucarióticos, pueden encontrarse en infecciones endodónticas y participar en el desarrollo de lesiones perirradiculares. Han sido encontrados ocasionalmente en infecciones primarias del sistema de conductos radiculares, sin embargo, se han asociado con mayor frecuencia a dientes con lesiones perirradiculares persistentes. Dentro de estas especies Candida albicans es, hasta ahora, la especie fúngica mayormente aislada de conductos radiculares infectados; posee factores de virulencia que le permiten desarrollar una función importante en el desarrollo de la periodontitis apical, entre ellos: adaptabilidad a una gran cantidad de condiciones ambientales, adhesión a una gran variedad de superficies en los tejidos dentarios, producción de enzimas hidrolíticas, transición morfológica, formación de biopelículas y evasión e inmunomodulación de las defensas del hospedero (109). a) Formación de biopelículas bacterianas. Una forma de persistencia de los microorganismos en los tejidos perirradiculares, es la formación de biopelículas bacterianas; estas son placas microbianas dentarias formadas por interacciones bacterianas entre diferentes especies dentro de una masa bacteriana. Los microorganismos de la placa son influenciados por factores del medio ambiente que pueden ser mediados por el hospedero; adicional a esto se van agregando polisacáridos extracelulares a la biopelícula en formación, los cuales no sólo van a servir como protección para las bacterias, sino que también como medio de cultivo (110, 111, 112). Con el propósito de evaluar morfológicamente la participación de biopelículas bacterianas en la periodontitis apical crónica, Noiri et al. (111) estudiaron 6 dientes y 5 puntas de gutapercha utilizadas como obturación radicular, pudieron observar biopelículas bacterianas en 9 de las 11 muestras examinadas, pudieron llegar a la conclusión que las biopelículas bacterianas formadas en las zonas extrarradiculares están relacionadas con la periodontitis apical persistente. En el gráfico 26 se muestra una microfotografía que ilustra biopelículas bacterianas.
A (izquierda): muestra como las bacterias forman conglomerados dentro de un recubrimiento de estructura de glucocálix. (flechas). B (izquierda): A gran aumento la zona de las flechas de la imagen anterior. A (derecha): algunos bacilos (flechas). B (derecha): se observa una pequeña colonia de cocos. Tomada de Noiri (111).
Por su parte Nair (99), evaluó la estructura de la microbiota de dientes de pacientes con lesiones perirradiculares y su relación con las paredes del conducto radicular, los aspectos morfológicos de las interacciones bacterianas entre las diferentes especies y la naturaleza dinámica de la respuesta inflamatoria del hospedero. Evidenció la presencia de una microbiota formando conglomerados de colonias autoagregadas y comunidades microbianas complejas, promoviendo la relación simbiótica. A través del microscopio electrónico y óptico, evidenció la presencia de una biopelícula bacteriana adherida a las superficies dentarias. Sin embargo, separando a la microbiota, se observó la presencia de una gruesa capa de neutrófilos o un tapón epitelial apical. En el estudio se concluye que la presencia de neutrófilos en el área apical tiene una explicación en la respuesta quimiotáctica a las bacterias invasoras y a sus subproductos liberados, lo que sugiere que las bacterias alcanzaron el área apical por contaminación, actuando como irritantes locales, y que en el transcurso de un largo período de tiempo provocó una respuesta inmunológica específica del hospedero en la región apical. Diferentes estudios también han confirmado la presencia no sólo de múltiples microorganismos y hongos, sino también la presencia de virus en lesiones perirradiculares en humanos (113, 114, 115, 116), los cuales han sido aislados de muestras simples de pacientes por medio de técnicas de inmunohistoquímica con anticuerpos monoclonales, pruebas ELISA, biología molecular (PCR), Western Bloot, inmunofluorescencia, entre otros. Dantas et al. (113), analizaron con métodos inmunohistoquímicos la presencia del Citomegalovirus (VHCM) y el Virus Epstein-Barr (VEB) en 35 muestras de pacientes. En la tabla I se muestra los resultados del estudio.
La tabla muestra los resultados individuales para ambos casos. Tomado de Dantas (113). Los resultados mostraron que 11 (31%) de las muestras fueron positivas al VEB y 8 (23%) positivas al VHCM. Concluyen que los virus actúan como irritantes para los tejidos apicales y pueden infectar células inflamatorias del hospedero situadas en el área y permanecer latentes durante largos períodos de tiempo, interfiriendo con la respuesta inmunológica. Por lo tanto, independientemente de los microorganismos involucrados, una vez que el organismo reconoce a los patógenos se desencadena en cascada todo un sistema inmune que intenta eliminarlos; fundamentalmente la activación del complemento por la vía alterna marca a los microorganismos para su destrucción. De esta, cuando un patógeno atraviesa una barrera epitelial y se dispone a vivir en los tejidos, inmediatamente se activan los mecanismos de defensa de la inmunidad innata, de modo que su activación representa un mecanismo de defensa molecular que puede usarse de inmediato contra una infección que acaba de comenzar. Seguidamente, la respuesta inflamatoria ocurre con rapidez y suele servir para detener la diseminación de éstos, hasta que se inicie una respuesta específica adquirida. El complemento activado a través de las vías clásica y alterna coopera con los anticuerpos para opsonizar los patógenos a fin de que puedan ser fagocitados más fácilmente. Si embargo, algunos microorganismos encuentran estrategias para evadir las respuestas inespecíficas del hospedero, lo cual hace que la respuesta inmunitaria sea lo suficientemente lenta como para que los patógenos se instauren y establezcan (1, 4, 5). 4.3.- Histopatología de la periodontitis apical crónica. La presencia contínua de irritantes, hace que la lesión precoz dominada por los neutrófilos, se convierta de manera gradual en una lesión rica de macrófagos, linfocitos y células plasmáticas, encapsulada por tejido conectivo colágeno. (12) Tal lesión clínicamente asintomática y radiográficamente radiolúcida, se puede considerar una fase de latencia después de una lucha activa, durante la que son destruidos gran números de neutrófilos. (21) En ésta etapa de la periodontitis apical, ocurre la resorción de los tejidos y pérdida de la lámina dura, esto es atribuido a la acción de citocinas como IL-1, IL-2, IL-6 y al FNT (59, 76, 88). Además, se estimula también la hormona calciomovilizante de la paratiroides, la cual tiene una función activadora sobre los osteoclastos, estos activados liberan enzimas proteolíticas (colagensas, fosfatasa ácida y el ácido láctico) que promueven la hidrólisis ácida del colágeno, polimerizando los polisacáridos y/o glucoproteínas, además de disolver componentes minerales del hueso. (34, 17) Safavi et al. (76), encontraron altos niveles de FNT en el exudado de dientes asociados con periodontitis apical crónica. Por su parte, las toxinas bacterianas también estimulan la resorción ósea, en la región apical (88, 100), es por ello que para determinar como y quienes están involucrados en el mecanismo de resorción ósea; Stashenko et al. (88), desarrollaron un sistema modelo en ratas en el cual las lesiones periapicales fueron inducidas por exposición de la pulpa e infección con el medio bucal. En éste modelo hubo una rápida destrucción del tejido óseo, en un período denominado fase activa que abarcó desde el día 1 hasta el día 15 después de haber expuesto las pulpas dentales al medio bucal, y un período denominado como fase crónica caracterizado por una estabilización de la lesión, el cual ocurrió posteriormente. Al realizar el estudio fenotípico de los casos, hubo un predominio de linfocitos T CD4 en la fase activa del modelo, pero posteriormente hubo un incremento de linfocitos T CD8 asociados a la fase crónica. De la misma manera hubo una actividad resortiva ósea asociada a la fase activa más que a la fase crónica. El análisis de la actividad resortiva determinó la presencia de mediadores inflamatorios específicamente citocinas, proteasas y lipopolisacáridos; todos involucrados en el proceso de resorción ósea de los tejidos apicales. Por otro lado, Torabinejad y Kettering (59), realizaron un estudio con la finalidad de identificar y observar la concentración relativa de linfocitos B y T en lesiones periapicales crónicas en humanos. Se obtuvieron 13 muestras de lesiones periapicales, las cuales fueron congeladas, seccionadas en forma seriada, y tratadas por la técnica de inmunoperoxidasa. En todas las lesiones se observó la presencia de células inmunocompetentes y el número de células T fue superior al número de células B. Concluyen que la presencia de células B en todas las lesiones periapicales, son las precursoras de la respuesta inmunológica de tipo humoral que se desarrolla en respuesta al daño producido en los tejidos. Afirman que sus hallazgos y los de muchos otros autores, demuestran la presencia de reacciones inmunológicas tanto de tipo humoral como de tipo celular en las lesiones periapicales crónicas, y señalan que éstas se desarrollan por la activación de una serie de eventos inmunológicos en respuesta al potencial antigénico proveniente del sistema de conductos radiculares dentro de los tejidos periapicales. En consecuencia las lesiones crónicas pueden permanecer latentes y asintomáticas durante largos períodos de tiempo, sin cambios radiográficos. Sin embargo, con el transcurso del tiempo el equilibrio en el periápice puede ser alterado por uno o más factores, quizás favorables a los agentes irritantes dentro del conducto radicular (50, 92). Los antígenos pueden avanzar hacia el periápice y la lesión se puede convertir espontáneamente en aguda, con manifestaciones clínicas. Como resultado, se pueden encontrar microorganismos extrarradiculares durante tales episodios agudos e incluso agrandamiento rápido del área radiolúcida en las radiografías sucesivas (58, 65). Sin embargo, si los irritantes permanecen por largos períodos de tiempo, puede establecerse en el seno de una periodontitis apical crónica, un trayecto fistuloso con drenaje del contenido purulento con gran concentración de masas de leucocitos neutrófilos, el trayecto fistuloso suele estar recubierto por un tejido granulomatoso, y en ocasiones también puede estar tapizado por un epitelio estratificado (67, 68). Otra vía de evolución de la periodontitis apical crónica, puede ser la formación de un granuloma apical, ésta lesión se compone de un tejido granulomatoso, con infiltrados celulares, neoformación vascular, fibroblastos, una cápsula fibrosa, puede o no presentarse epitelializado y entre los linfocitos, las células T son más numerosas que las células B (59, 65).Por su parte los mastocitos activados liberan el contenido de sus gránulos en las lesiones granulomatosas; estos en condiciones fisiológicas se encuentran distribuidos por los tejidos conectivos del organismo donde forman grupos pequeños en la continuidad de los vasos sanguíneos; en pocas ocasiones los mastocitos se encuentran en el tejido pulpar normal, sin embargo, se encuentran de forma considerable en las pulpas con inflamación crónica e incluso en lesiones como granulomas y quistes (117, 118, 119). De Oliveira et al. (119), encontraron un mayor número de mastocitos en lesiones que histológicamente habían sido diagnosticadas como quiste apical. Los resultados de su estudio señalan que las células mastoides contribuyen con los mecanismos de defensa del hospedero teniendo una clara participación en la respuesta inmunológica, y por ende en el inicio, desarrollo y persistencia de las lesiones apicales crónicas. En esta etapa de la periodontitis apical crónica; los macrófagos y fibroblastos constituyen una barrera mecánica de defensa del organismo a nivel apical, la formación de redes de colágeno por parte de los fibroblastos y la acción fagocitaria de los macrófagos intentan delimitar el proceso, neutralizando la acción patógena de los microorganismos, de las toxinas bacterianas y/o de los restos necróticos pulpares provenientes del conducto radicular (58). Por su parte, los linfocitos y las células plasmáticas van a ser estimuladas por medio de los antígenos provenientes del conducto radicular y, se produce la reacción de reconocimiento y la subsiguiente formación de complejos Ag-Ig que condicionan la respuesta inmunológica en ésta fase (60, 64). Estudios como el de Piatelli et al. (120), señalan la importancia de las células inmunocompetentes en lesiones perirradiculares crónicas; las cuales pudieron ser detectadas y analizadas a través del microscopio electrónico empleando anticuerpos monoclonales. Otro estudio realizado por Nobuyuki et al. (121), demuestra la presencia de células inmunocompetentes en lesiones periapicales crónicas en humanos, específicamente granulomas y quistes apicales; mediante inmunohistoquímica estudiaron un total de 44 lesiones apicales. Sus resultados señalan que hubo una concentración de células T y B en todas las lesiones y que el número de macrófagos fue mayor en los granulomas apicales que en los quistes apicales. Concluyen que el desarrollo de lesiones apicales crónicas forma parte de la activación de una reacción inmunológica e indica la presencia de diferentes tipos de células inmunocompetentes. 4.3.1.- Contribución de la respuesta humoral: Diferentes estudios han demostrado también la presencia de anticuerpos tipo IgG, IgM e IgA en lesiones periapicales de humanos específicamente en granulomas apicales (122, 123, 124). En general se piensa que los anticuerpos producidos por las células plasmáticas principalmente IgM, IgG e IgA viajan a través del torrente sanguíneo y llegan a la zona apical afectada, como parte de una respuesta humoral específica del sistema inmune (122). Torabinejad et al. (122), realizaron un estudio donde evaluaron la presencia de IgE e IgG en 28 lesiones periapicales a través del método de peroxidasa-antiperoxidasa; de las lesiones estudidas 17 fueron granulomas apicales, 10 quistes apicales y una sola lesión fue diagnosticada como cicatriz apical. Los resultados mostraron la presencia de IgG y plasmocitos en todas las lesiones analizadas; sin embargo se pudo observar la presencia de IgE en 13 de los 17 granulomas y en 7 de los 10 quistes; mientras que en la cicatriz apical no se evidenció la presencia de inmunoglobulinas. Estos autores concluyen que la presencia de células plasmáticas en todas las lesiones estudiadas indica una producción local de inmunoglobulinas en las lesiones perirradiculares y una clara participación de una respuesta inmunonológica específica en éste tipo de lesiones. En los granulomas apicales pueden encontrarse, aunque no siempre, cordones epiteliales provenientes de los restos epiteliales de Malassez, se categorizan como granulomas apicales simples, cuando no se evidencia la presencia de células epiteliales y granulomas apicales epitelializados, cuando si están presentes (41, 65). La evolución de la respuesta inflamatoria granulomatosa varía según una serie de circunstancias; por un lado el tejido granulomatoso puede ir creciendo lentamente originando destrucción del tejido óseo circundante sin condicionar ninguna sintomatología, por otra parte, puede resolverse definitivamente mediante tratamiento o en ocasiones puede agudizarse por nueva entrada de gérmenes, disminución de las defensas del hospedero o por mutación bacteriana y posteriormente remitir el cuadro agudo para volver de nuevo a la cronicidad (42, 50, 55). Si el granuloma apical sigue un patrón de evolución crónico, puede permanecer invariable y asintomático durante muchos años, incluso sin tratamiento, sin embargo en ocasiones el proceso inflamatorio crónico granulomatoso en el área apical puede originar otra forma de periodontitis apical conocida como quiste periapical (41, 41, 126). En relación al tipo e incidencia de los quistes apicales, pueden presentarse dos tipos; verdaderos y falsos, Simon (73) en 1980, encontró una baja incidencia para los quistes periapicales tanto verdaderos como falsos (8,6%), afirma que los primeros; son verdaderas cavidades cerradas sin conexión al conducto radicular y tapizadas por un epitelio con contenido celular en degeneración y los segundos se presentan como cavidades alrededor del ápice dentario recubiertos por epitelio, pero en comunicación con el conducto. La incidencia de los quistes dentro de las lesiones perirradiculares varía según diversos estudios; Seltzer et al. (69), reportaron un 26% de 72 lesiones estudiadas, Bhaskar (127), reportó 42% de 2.308 muestras, Simon (73), un 8.6% de 35 lesiones, Nair et al. (128), reportó un 15% de 256 biopsias analizadas; en fin son diversos los porcentajes, sin embargo, todos estos autores coinciden que los quistes apicales se presentan como una respuesta inflamatoria de los tejidos apicales, en respuesta a la presencia de irritantes. El quiste periapical es una respuesta inflamatoria crónica del periápice que se desarrolla a partir de lesiones crónicas con tejido granulomatoso preexistente, se caracteriza por la presencia de una cavidad central recubierta por epitelio y llena de líquido, rodeada por tejido granulomatoso y una cápsula fibrosa periférica. Por lo tanto, la formación de un quiste periapical dependerá de la existencia previa de un granuloma (66, 71, 73). El origen de las células epiteliales en el quiste apical, puede encontrarse en la vaina radicular de Hertwig, un tejido formado por dos estratos de células epiteliales (epitelio interno y externo del esmalte), que proliferan apicalmente a partir del órgano del esmalte. La raíz no puede formarse sin su influencia organizativa, al ir depositándose la dentina contra ésta vaina, las células epiteliales pierden su continuidad debido a la invasión del tejido conectivo del saco dentinario. En el tejido conectivo se forman cementoblastos que van depositando cemento sobre la dentina recién formada, algunas de éstas células epiteliales degeneran mientras que otras persisten en forma de islotes conocidos como restos epiteliales de Malassez, estos islotes permanecen en estado de latencia hasta que la irritación provocada por una lesión granulomatosa los activa y entran en mitosis (40, 21). Autores (69, 70, 127, 129), señalan que los quistes apicales se desarrollan por proliferación de los restos epiteliales de Malassez durante la inflamación periapical, las células inmunocompetentes del hospedero en el tejido periapical comienzan a liberar una serie de mediadores químicos inflamatorios, citocinas proinflamatorias, y factores de crecimientos (IL-1, IL-6, IL-10, TNF, PGE2, LTB4, FC) como mecanismo de defensa inmunológico y activan a los restos epiteliales de Malassez en letargo (129).
Izquierda: Imagen esquemática de la activación de los restos epiteliales de Malassez. Derecha: Imagen histológica de la proliferación epitelial. Tomada de Lin 2007 (129). Desde el punto de vista histológico, el quiste periapical verdadero tiene cuatro componentes fundamentales: la cavidad quística; la pared epitelial; el tejido extraepitelial, y la cápsula de colágeno. La cavidad se encuentra completamente encerrada dentro de la mucosa epitelial, contiene generalmente tejido necrótico y en ocasiones, restos de colesterol rodeados por macrófagos y eritrocitos, en la superficie interna del quiste se puede evidenciar la presencia de células epiteliales, neutrófilos y diferentes células en degeneración; en ocasiones se puede evidenciar restos bacterianos rodeados por neutrófilos (41, 65, 72). En relación a los cristales de colesterol, aparecen como hendiduras tisulares estrechas y largas en los cortes histopatológicos dentro de la cavidad quística, aparentemente las células inflamatorias destruidas en la zona local, constituyen la principal fuente de colesterol cuando la sustancia se libera desde la membrana celular en desintegración en las lesiones crónicas de larga evolución. Los cristales de colesterol se forman inicialmente en el tejido conectivo periapical inflamado, donde actúan como cuerpo extraño y desencadenan una reacción de cuerpo extraño, ya que los macrófagos son incapaces de digerirlos y constituyen una fuente permanente de citocinas inflamatorias y de resorción ósea (21, 41, 125). Tanto los quistes verdaderos como los quistes falsos, contienen numerosos vasos sanguíneos y células inmunológicas, entre las que predominan neutrófilos, linfocitos T, linfocitos B, macrófagos, células plasmáticas, anticuerpos y células epiteliales (64, 65, 130, 131). Se han propuesto diferentes hipótesis para explicar la formación de la cavidad quística: 1.- La teoría de la "deficiencia nutricional" se basa en que las células centrales de las hebras epiteliales pierden su fuente de nutrición, y experimentan necrosis y degeneración licuefactiva. Los espacios existentes entre las células van aumentando, y muy pronto se produce una separación total de las células epiteliales centrales. Se forma una cavidad central delimitada con contenido líquido y una serie de células en estado de degeneración. El quiste crece atrayendo líquido tisular hacia su interior según van muriendo cada vez más células epiteliales, el crecimiento del quiste comprime los capilares del tejido conectivo circundante, produciendo isquemia. A su vez, la isquemia provoca la muerte de más células epiteliales por la falta de oxígeno y nutrientes, tales microcavidades que contienen células epiteliales degeneradas, infiltrados leucocitarios y exudado tisular, confluyen para formar la cavidad quística, revestida por epitelios escamosos estratificados (21, 40, 41, 129, 132). 2.- La teoría del "absceso" postula que el epitelio en proliferación rodea al absceso previamente formado por necrosis y lisis del tejido, los cordones epiteliales proliferan con una tendencia intrínseca a cubrir la superficie del tejido conectivo expuesto (21, 41). 3.- La teoría de la "unión entre los cordones epiteliales", que postula que los cordones o hebras epiteliales continúan en crecimiento hasta formar una masa epitelial en tres dimensiones formándose de ésta manera el quiste; el tejido conectivo en la zona presenta diferente grados de inflamación, y la masa de células epiteliales podría ir degenerándose por la disminución del flujo sanguíneo en la zona (129). Las teorías basadas en la presión osmótica han perdido validez durante los últimos años, conforme el interés de los investigadores se centró en el estudio de las bases moleculares en el desarrollo de los quistes. El hecho de que el quiste apical en bolsa cuya luz comunica con el conducto radicular necrótico, puede crecer, elimina a la presión osmótica como un factor potencial en el desarrollo de los quistes radiculares (21, 41, 132). Lo cierto es, que las células inmunocompetentes persistentes en la luz del quiste proporcionan una fuente continua de prostaglandinas y citocinas proinflamatorias y quimiotácticas, que pueden extenderse a través de la pared epitelial porosa hacia los tejidos adyacentes; así mismo, la población celular residente en el área extraepitelial contiene numerosos linfocitos y macrófagos, los cuales también son capaces de producir una gran cantidad de citocinas (IL-1, IL-6, IL-10, TNF, PGE2, LTB4, FC) las cuales pueden activar a los osteoclastos, desarrollando la reabsorción ósea en la zona, y continuando el proceso de expansión quística (13, 129, 133). En el gráfico 28 y 29 se pueden observar una microfotografía de un quiste apical falso y un quiste apical verdadero respectivamente. Un mediador molecular observado en las lesiones perirradiculares crónicas es el factor de crecimiento de fibroblastos (FCF), es un factor quimiotáctico y mitogénico potente, estimula la proliferación y migración de células endoteliales, la angiogénesis, acelera la formación de tejido granulomatoso y promueve la mitosis de los fibroblastos. Para observar la influencia de éste mediador molecular en el desarrollo de lesiones apicales, Moldauer et al. (13), evaluaron 10 lesiones periapicales crónicas inflamatorias utilizando tinción inmunohistoquímica las cuales fueron obtenidas durante el procedimiento de cirugía endodóntica perirradicular. El grupo control positivo experimental estuvo conformado por cuatro especímenes de tejido del ligamento periodontal obtenidos de tejido periapical adherido a terceros molares impactados sin signos clínicos e histológicos de inflamación; los resultados de éste estudio concluyen que fueron visibles los productos de reacción inmuhistoquímicos, en los fibroblastos, células endoteliales, epiteliales e inflamatorias y la intensidad de la regulación de éste factor en las células endoteliales estuvo correlacionada con el grado de infiltrado inflamatorio, se observó la formación de tejido granulomatoso y la activación de restos celulares epiteliales de Malassez en las lesiones apicales crónicas, lo cual presume que puede estar asociado con un aumento local en los niveles del FCF. Por lo tanto, este factor de crecimiento juega un papel importante en la patogénesis de la periodontitis apical crónica y en los quistes periapicales. Por su parte, Leonardo et al. (133), afirman que el factor de crecimiento endotelial vascular conocido también como factor de permeabilidad vascular (FPV), desempeña una función fundamental en el desarrollo y crecimiento de quistes periapicales y en la patogénesis de los granulomas apicales, su función principal es promover la angiogénesis y la permeabilidad vascular. Estos autores realizaron un estudio con la finalidad de detectar el factor en lesiones apicales de humanos, se estudiaron un total de 17 granulomas apicales y 6 quistes apicales mediante técnicas inmunohistoquímicas, los resultados revelaron una reacción positiva al FPV en todas las muestras, observaron múltiples células inflamatorias como macrófagos, fibroblastos, linfocitos, plasmocitos en diferentes estados de evolución y la presencia de células epiteliales. Demostraron que las lesiones apicales tanto los granulomas periapicales como los quistes apicales expresan el FPV a través de células inmunocompetentes inflamatorias. Concluyen que inicialmente este factor podría estar involucrado en la angiogénesis y permeabilidad vascular de las lesiones granulomatosas, que posteriormente podrían estar involucradas en la acumulación del fluido contenido en las cavidades quísticas y contribuir con su crecimiento.
Microfotografía de un quiste apical falso. a: estructura inicial de un quiste en desarrollo, b: un quiste en bolsa completamente desarrollado, LU: lumen rodeado de epitelio y con abundante células inflamatorias. NG: neutrófilos, EP: epitelio, BA: bacterias, D: dentina, RC: conducto radicular. Tomado de Nair 1997 (41). Gráfico 29. Quiste apical verdadero.
Microtomografía de un quiste apical verdadero. a. vista con microscopio de luz, el lumen y el epitelio del quiste, b. vista con un microscopio electrónico de barrido, LU: lumen, EP: epitelio, ST: tejido subepitelial infiltrado con abundantes células plasmáticas PC en b. MA: macrófagos y linfocitos. NG: Neutrófilos extravasados a través del epitelio del lumen del quiste en b. Tomado de Nair 1997 (41). Son diversas las causas que pueden originar una lesión perirradicular y son muchos los tipos de patologías que se pueden desarrollar en los tejidos periapicales (4, 21, 134), como parte de un mecanismo de defensa del organismo frente a los agentes irritantes. El inicio, desarrollo y persistencia de las mismas va a depender del tipo de antígenos, la cantidad y el tiempo que permanece en los tejidos y del reconocimiento de los mismos por parte del sistema inmune; a partir de ahí se ponen en marcha una cantidad de eventos inmunológicos; que según la evolución condicionará el tipo de patología periapical a establecerse o la resolución de la lesión. 5.- INMUNOMODULACIÓN. La Inmunomodulación, consiste en modificar la respuesta inmune del organismo empleando sustancias específicas, bien sea para la aplicación de inmunoterapias en enfermedades, inhibiendo o activando la respuesta inmunológica o, para el estudio científico del comportamiento del sistema inmune que puede arrojar datos que a futuro permitan desarrollar nuevos tratamientos (135, 136, 137). En la actualidad existen numerosos ensayos basados en procedimientos que intervienen de forma específica en los mecanismos que conducen a la autoinmunidad; como por ejemplo las citocinas inflamatorias. La actividad biológica de las citocinas tiene implicaciones importantes en varios procesos normales y patológicos, entre los que se incluyen: hematopoyesis, angiogénesis, tumorogénesis, inflamación, autoinmunidad y enfermedades infecciosas (135, 136). Así mismo, una de las funciones del sistema inmune es proteger al organismo respondiendo ante los diferentes antígenos, mediante la producción de anticuerpos o linfocitos sensibilizados, lo que conlleva a la liberación de citocinas y mediadores moleculares. En condiciones normales, no se puede producir una inmunorespuesta contra las células del propio organismo; pero en ciertos casos, las células del sistema inmunológico atacan y destruyen a las mismas células que deberían proteger; esto puede conducir a una gran variedad de enfermedades y reacciones desfavorables para el organismo (135, 136, 137,138). La manipulación farmacológica del sistema inmune para conseguir respuestas linfocitarias de mayor intensidad tiene diversas aplicaciones en medicina; específicamente en; inmunoterapia tumoral, en el tratamiento de enfermedades virales crónicas, en enfermedades autoinmune, en el lupus eritematoso sistémico o enfermedades crónicas inflamatorias, en enfermedades cancerígenas, entre otros; mediante la utilización de anticuerpos monoclonales (135, 137). Los anticuerpos monoclonales inmunoestimuladores; se definen como una familia de fármacos que aumentan la respuesta inmunológica al interaccionar como ligandos artificiales con proteínas funcionales del sistema inmune, activando o inhibiendo su función. 5.1.- Aplicación de anticuerpos monoclonales en medicina. Diferentes estudios se han llevado a cabo con la finalidad de neutralizar citocinas inflamatorias (FNT, IL-1, IL-2, IL-6) por medio de anticuerpos monoclonales (135, 136, 137). Uno de éstos estudios fue el realizado por Alfaro et al. en el 2005, con anticuerpos monoclonales humanizados anti-CD137; una glicoproteína de la familia del receptor FNT; el cual tienen la capacidad de inducir potentes respuestas inmunológicas, mediadas principalmente por linfocitos T citotóxicos, su finalidad es coestimular la proliferación y favorecer la supervivencia de linfocitos T activados por el antígeno CD137 (4-1BB). Por su parte, el CD137 (4-1BB); es un antígeno de diferenciación expresado selectivamente en la superficie de linfocitos T y NK activados y sobre células dendríticas. (135) Los anticuerpos monoclonales que actúan como ligandos artificiales estimuladores de éste receptor (anticuerpos monoclonales agonistas anti-CD137) potencian la inmunidad celular antitumoral y antiviral en modelos experimentales. Es por ello, que varios grupos de investigación han procedido a la humanización de anticuerpos dirigidos frente al CD137 humano, en ratones experimentales, mediante ingeniería genética, con la finalidad de aplicar éstos anticuerpos monoclonales en ensayos clínicos in vivo, modular respuestas linfocitarias y prevenir enfermedades en humanos (135). Otros estudios se han realizado con la finalidad de inhibir al FNT e IL-1 para el control de la inflamación en enfermedades como artritis reumatoide o enfermedad de Crohn (EC) e incluso colitis ulcerativa (CU) (99, 103). Estudios confirman que el FNT, se produce en exceso en enfermedades autoinmunes; su neutralización con anticuerpos anti-FNT-? o bien el receptor soluble de la proteína, ha demostrado ser un tratamiento muy eficaz en la inmunoregulación de la inflamación. En la artritis reumatoidea (AR) se ha observado un desbalance entre citocinas proinflamatorias; FNT, IL-1 e IL-6 y antiinflamatorias, IL-10, receptores solubles de FNT y antagonista receptor de IL-1. La liberación de FNT e IL-1 provoca numerosos efectos, incluida la activación celular y secreción de mediadores inflamatorios y MMps, que producen daño en cartílagos y hueso subcondral. El FNT-? y FNT-? comparten receptores celulares de dos tipos, con diferente peso molecular, tipo I (55 kd) y tipo II (75 kd). La unión del FNT a éstos receptores induce la formación del factor de transcripción nuclear (NF? b) que inicia la síntesis de mediadores de inflamación y otras moléculas que provocan los efectos anteriormente referidos (136). Otra enfermedad donde se ha realizado inmunoterapia con anticuerpo monoclonales específicos, aplicaciones intravenosas de citocinas antiinflamatorias y corticoesteroides, es en la EC y en la CU; en éstas existen similitudes en la inmunopatología respecto a la AR; fundamentalmente la presencia de niveles elevados de FNT, macrófagos, linfocitos y células plasmáticas, en biopsias de pared intestinal y en heces, en correlación con el grado de actividad clínica (139, 140, 141). Otros estudios se han realizado mediante la aplicación de anticuerpos monoclonales ADN sobre la estimulación de citocinas IL-1, IL-6, IL-8, IL-10 y FNT de células mononucleares en la enfermedad del lupus eritematoso sistémico, las citocinas inflamatorias tales como; FNT-? IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, son producidas principalmente por macrófagos y células mononucleares; éstas citocinas a su vez son potentes estimuladores de linfocitos T, B, células NK y neutrófilos, los cuales incrementan la producción de prostaglandinas y proteínas de fase aguda. En consecuencia, los linfocitos T CD4 Th1 sensibilizados, producen IL-2 e INF-? y, linfocitos T CD4 Th2 sensibilizados, producen IL-4 e IL-10, modulando la respuesta celular y humoral, respectivamente. Tomando en cuenta éstos aspectos, autores como Sun et al. (138), realizaron un estudio in vitro, aplicando anticuerpos monoclonales específicos anti-dsADN sobre las células mononucleares humanas; llegaron a la conclusión que éstos anticuerpos monoclonaless poseen un efecto dual en las células: el primero; es sobre el aumento en la liberación de citocinas inflamatorias (IL-1, IL-8 y TNF) y el segundo; es sobre los linfocitos T CD4 Th2 para incrementar la síntesis de IL-10. 5.2.- Aplicación de anticuerpos monoclonales en odontología. En el campo de la Odontología y específicamente en el campo de la Endodoncia; se han realizado estudios para conocer los eventos inmunológicos involucrados en la patogénesis de las lesiones perirradiculares, usando anticuerpos monoclonales específicos. La inmunomodulación, es una de las líneas de investigación, aún en fase experimental, la cual se basa en producir un cambio en el sistema inmune del organismo, causado por sustancias que activan o debilitan su función. Yamasaki et al. (142); utilizaron anticuerpos monoclonales anti-IL-2 (tracolimus FK506) y anti- CD4, en lesiones perirradiculares de ratones de laboratorio infiltrados localmente para inhibir la producción de IL-1 por parte de linfocitos T CD4 y estudiar su función en la patogénesis de las lesiones perirradiculares, compararon sus resultados con grupos control (ratones no inmunosuprimidos). Observaron que las lesiones perirradiculares de los ratones inmunosuprimidos fue mayor, tanto en la necrosis del tejido y el desarrollo de abscesos como la resorción ósea en todas las muestras experimentales, en comparación con los grupos control. Demostraron que la reducción de IL-2 y linfocitos T CD4 está asociada con la formación de grandes lesiones perirradiculares en ratones; así como también la clara participación de IL-2 y linfocitos T CD4 en la respuesta inmunológica del organismo.
Tabla ilustrativa que muestra las áreas de necrosis pulpar, absceso apical y lesión apical. Tomada de Yamasaki (142). Por su parte, Tokuda et al. (102); usaron anticuerpos monoclonales específicos (anti-CD14 MAb, una proteína de membrana), en cultivos celulares pulpares para medir los niveles de expresión de IL-6 estimulados con lipopolisacáridos bacterianos (LPS extraídos de P. intermedia); sus resultados demostraron que éstos LPS, están relacionados con la etiología de la inflamación pulpar; además, la inducción de IL-6 por los fibroblastos de la pulpa al ser estimulados con LPS de P. intermedia, fue regulada por el tratamiento con anticuerpo monoclonal anti-CD14 MAb. Señalan, que es necesario el estudio de los mecanismos inhibidores de moléculas antiinflamatorias en contra de patógenos bacterianos, los cuales pueden ser de ayuda para diseñar terapias en el futuro. Nakanishi et al. (143), también usaron anticuerpos monoclonales específicos anti-Ciclooxigenasa-2 (anti-COX-2) y observaron la función en la patogénesis de la pulpa, concluyen que tanto los fibroblastos de la pulpa como macrófagos, pueden influenciar la producción de PG a través de la síntesis de COX-2 en pulpas inflamadas de ratones, teniendo una importante participación en el desarrollo de la pulpitis irreversible. Otro estudio fue el realizado por Kaneko et al. (144); usaron técnicas de inmunoperoxidasa con anticuerpos monoclonales específicos OX6, para determinar si el CMH clase II forma parte de la ultraestructura de las diferentes poblaciones de células inmunocompetentes y determinar la importancia en la presentación de antígenos a los linfocitos T, dentro de la patogénesis de lesiones perirradiculares en ratones de laboratorio. Pudieron observar, que sólo algunos linfocitos y células plasmáticas mostraron reacción positiva OX6 a la expresión de CMH clase II en la membrana celular; sin embargo, tanto macrófagos como células dendríticas si mostraron reacción positiva OX6 en la interacción célula a célula en la presentación de antígenos a los linfocitos T con la clara expresión en la membrana celular de la molécula del CMH clase II; demostrando que éstas células desempeñan una función fundamental en la respuesta inmunológica del organismo de ratones y en la patogénesis de las lesiones perirradiculares. Resultados similares a éstos reportaron Lukic et al. (145), usando anticuerpos monoclonales específicos para observar el comportamiento de células presentadoras de antígenos en lesiones perirradiculares en humanos. Son muchos los estudios que se han llevado a cabo llevando para estudiar el comportamiento de células, moléculas, mediadores, sistemas, componentes celulares, entre otros; que forman parte del sistema inmune y su especializada respuesta en la defensa de enfermedades o patologías y situaciones en general; con miras a mejorar y desarrollar diversas terapias para el futuro.
III. DISCUSION Son diversas las causas que pueden originar una lesión perirradicular y son muchos los tipos de patologías que se pueden desarrollar en los tejidos periapicales, como parte de un mecanismo de defensa del organismo frente a los agentes irritantes. El inicio, desarrollo y persistencia de las mismas va a depender de la entrada de antígenos en número, tiempo y proporción hacia los tejidos y, del reconocimiento de los mismos por parte del sistema inmune; a partir de ahí se ponen en marcha una cantidad de eventos; que según la evolución condicionará, el tipo de patología periapical a establecerse. La participación de todas y cada una de las células efectoras, moléculas y mediadores químicos en su lucha por tratar de detener a los antígenos, desempeñan diferentes funciones dentro de la patogénesis de las lesiones apicales. Farnoush (75) y de Oliveira (119) por su parte señalan que los mastocitos están presentes en los tejidos inflamados y pueden producir la degranulación con aumento de la respuesta vacuolar local de los tejidos apicales, por la liberación de aminas vasoactivas como la histamina. Así mismo, Nair (21, 41) señala que los polimorfonucleares mueren en gran número dentro de zonas con gran inflamación aguda, la acumulación y muerte local de los neutrófilos representa una causa importante de destrucción tisular durante las fases agudas de la periodontitis apical, como parte de una respuesta inmunológica innata en defensa a los irritantes antigénicos. Por su parte, la presencia de células B en todas las lesiones periapicales, son las precursoras de la respuesta inmunológica de tipo humoral que se desarrolla en respuesta al daño producido en los tejidos, estudios como el de Torabinejad y Kettering (59), demuestran la presencia de reacciones inmunológicas tanto de tipo humoral como de tipo celular en las lesiones periapicales crónicas en humanos como parte de una respuesta inmunológica fundamentalmente adquirida, y señalan que éstas se desarrollan por la activación de una serie de eventos inmunológicos en respuesta al potencial antigénico proveniente del sistema de conductos radiculares dentro de los tejidos periapicales. Un mediador molecular importante, es la IL-2 que es liberada por linfocitos T CD4 Th1, ésta inhibe la síntesis de colágeno y la acción neutrófila, impidiendo el proceso de reparación en los tejidos; así como también IL-1? induce y regula la degradación del colágeno y las matrices extracelulares por la actividad de MMPs en los tejidos inflamados. Además, IL-2, estimula la expansión clonal de la población de linfocitos T CD4 y regula la secreción de otras citocinas proinflamatorias por parte de macrófagos y neutrófilos en la zona de la inflamación (26, 27, 28, 77, 78). Azuero-Holguin (84) reporta que ciertos neuropéptidos desempeñan una función importante dentro de la patogénesis de las lesiones apicales, señalan que es muy probable que el PVI actúe en los receptores específicos celulares de la matríz ósea; y éstos receptores pueden actuar estimulando o activando a los osteoclastos para generar resorción ósea. Muchos autores (10, 87, 88) concluyen que entre los factores locales que estimulan la osteoclasia se destacan; IL-1, IL-6, IL-8, FNT-?, PG y LT, los cuales en condiciones de normalidad se encuentran manteniendo un equilibrio biológico; pero en condiciones patológicas como la inflamación, ocasionan la resorción de los tejidos. El FPV, expresado a través de células inmunocompetentes inflamatorias, inicialmente podría estar involucrado en la angiogénesis y permeabilidad vascular de las lesiones granulomatosas y posteriormente estar involucrado en la acumulación del fluido contenido en las cavidades quísticas y contribuir con el crecimiento del mismo. (133) Moldauer (13) señala que el FCF, participa en la formación del tejido granulomatoso y la activación de restos celulares epiteliales de Malassez en las lesiones apicales crónicas pudiendo estar involucrado en la proliferación epitelial y transformación quística de las lesiones apicales crónicas. En el campo de la Odontología y específicamente en el campo endodóntico; se han realizado estudios para conocer los eventos inmunológicos involucrados en la resolución y en la patogénesis de las lesiones perirradiculares, hoy en día y gracias a estas investigaciones existen un gran número de datos que explican los mecanismos inmunológicos y el comportamiento de las células efectoras del organismo. Cada vez son más las posibles dianas o células que se descubren para intervenir de forma específica sobre muchas enfermedades y un gran número de investigaciones que se están llevando a cabo para conseguir tratamientos clínicos específicos y eficaces. En la actualidad, en los desarrollos biotecnológicos de avanzada se contempla la inmunoterapia como un aporte importante en la modulación de la respuesta de defensa del individuo frente a su medio ambiente.
IV.- CONCLUSIONES La periodontitis apical aguda es una respuesta inflamatoria del tejido conectivo periapical y se caracteriza por la presencia predominante de leucocitos polimorfonucleares y mastocitos. La acumulación y muerte local de los neutrófilos representa una causa importante de destrucción tisular durante la fase aguda de la periodontitis apical. La activación del sistema del complemento específicamente las fracciones solubles C3a y C5a participan en la inflamación local aguda en la periodontitis apical. Las IL-1, IL-6, IL-8 y FNT, potencian la adherencia de los neutrófilos, la producción de PG, la resorción ósea y la inhibición de la formación ósea en la periodontitis apical. La destrucción de los tejidos apicales es consecuencia de la inducción de citocinas proinflamatorias (FNT-?, IL-1?, IL6 y TGF) que activan metaloproteinas y colagenasas con efecto degradativos de la matríz celular. Niveles aumentos de los neuropeptidos como el PRGC y la SP alteran la respuesta inflamatoria y las células del tejido conectivo periapical. Las lesiones periapicales y en particular el tejido apical inflamado, presentan concentraciones elevadas de LTB4 y PGE2. Los niveles de IL-8 se encuentran elevados en pacientes que presentan lesiones periapicales con síntomas clínicos. La periodontitis apical crónica se caracteriza por la presencia de macrófagos, linfocitos T, linfocitos B y células plasmáticas productoras de inmunoglobulinas. Los componentes celulares de las bacterias Gram positivas como el ácido lipoteicocico y Gram negativas como el lipopolisacárido, actúan como sustancias toxicas para los tejidos apicales. La biopelículas bacterianas formadas en las zonas extrarradiculares están relacionadas con la periodontitis apical persistente. Los virus Epstein-Barr y citomegalovirus se han encontrado en los tejidos apicales pudiendo actuar como irritantes. Los anticuerpos IgG, IgA e IgM se encuentran presentes en las lesiones apicales crónicas, particularmente el quiste periapical presentando un predominio de linfocitos T, linfocitos B, células plasmáticas y anticuerpos. El factor de crecimiento fibroblástico y el factor de permeabilidad vascular juegan un papel importante en la patogénesis de la periodontitis apical crónica y en la formación de los quistes apicales. Los resultados obtenidos empleando anticuerpos monoclonales en modelos experimentales permitirán a futuro extrapolar los datos para el desarrollo de inmunoterapias en humanos.
- REFERENCIAS
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||