|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"Apuntes Sobre Apice Radicular" por: Dra. Penélope Rodriguez Odontólogo. Universidad Central de Venezuela. 2012 Especialista en Endodoncia. Universidad Central de Venezuela 2016 e-mail: penelopeodont@icloud.com
DESARROLLO DE LAS ESTRUCTURAS RADICULARES Una vez formado el patrón coronario e iniciado el proceso de histogénesis dental mediante los mecanismos de dentinogénesis y amelogénesis, comienza el desarrollo y la formación del patrón radicular. En la formación de la raíz, la vaina radicular epitelial de Hertwig, desempeña un papel fundamental, determinando el tamaño y la forma de la raíz o raíces del diente. La vaina radicular epitelial de Hertwig es una estructura que resulta de la fusión del epitelio interno y externo del órgano del esmalte sin la presencia del retículo estrellado a nivel del asa cervical. La vaina prolifera en profundidad en relación con el saco dentario por su parte externa y con la papila dentaria internamente1,2,3. Al proliferar la vaina, las células del epitelio interno influyen sobre las células mesenquimatosas adyacentes, para que se diferencien en preodontoblastos y odontoblastos. Cuando se deposita la primera capa de dentina radicular, la vaina de Hertwig se desintegra, lo que permite que las células mesenquimatosas del saco dental se muevan y contacten con la dentina recién formada, estas células madres mesenquimatosas después se diferencian en cementoblastos y secretan matriz cementoide, la cual a continuación se mineraliza para formar el cemento. A medida que el cemento se forma los remanentes de la vaina de Hertwig forman los restos epiteliales de Malassez, que en el adulto persisten cercanos a la superficie radicular dentro del ligamento periodontal. Aunque el número de tales restos disminuye con la edad, se ha demostrado que al menos algunos conservan la capacidad de experimentar una división celular. Si en épocas posteriores de la vida se produce una lesión inflamatoria crónica dentro de los tejidos periapicales como consecuencia de la enfermedad de la pulpa, la proliferación de los restos epiteliales puede generar el desarrollo de un quiste periapical1,2,. En el estudio de Seltzer y colaboradores4, observaron restos epiteliales de Malassez en diferentes localizaciones, alrededor de las raíces de 45 especímenes (70%). Fueron detectados en los espacios medulares y entre las fibras colágenas del ligamento periodontal. En estos últimos sitios, estaban cerca del ápice del diente y a los lados de la raíz, en general cerca del cemento, pero ocasionalmente cerca del hueso alveolar. En cortes histológicos, la apariencia de los restos epiteliales varía de redondo o pseudotubular. Ocasionalmente, pueden calcificarse y transformarse en cementículos. La vaina radicular epitelial de Hertwig, modela además el futuro límite dentinocementario e induce la formación de dentina por dentro y cemento por fuera. La formación de la raíz de un diente unirradicular ocurre porque la lámina radicular crece como un tubo, alrededor de las células de la pulpa dental, seguida por el desarrollo de la dentina radicular; mientras que en los dientes multirradiculares la vaina emite dos o tres especies de lengüetas epiteliales o diafragmas en cervical , dirigidas hacia el eje del diente que crecen la una hacia la otra, destinadas a formar por fusión, el piso de la cámara pulpar, una vez delimitado el piso proliferan en forma individual en cada una de las raíces3. (Gráfico 1) Al completarse la formación radicular, la vaina epitelial se curva hacia adentro (en cada lado) para formar el diafragma. Esta estructura marca el límite distal de la raíz y envuelve al agujero apical primario, que es la abertura por la que entran y salen nervios y vasos sanguíneos de la cámara pulpar 3.
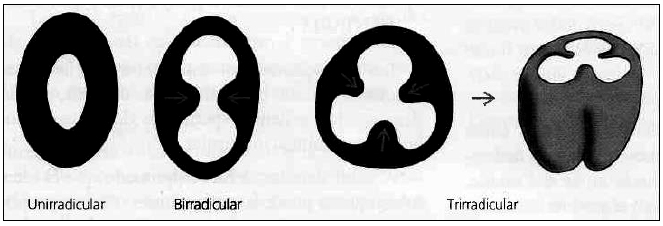
Gráfico 1. Modelación radicular. Vaina de Hertwig. Tomado de: Gómez de Ferraris M y Campos Muñoz A, 2002.
FORMACIÓN DEL PERIODONTO DE INSERCIÓN El periodonto de inserción está compuesto por: cemento, ligamento periodontal y hueso alveolar, que comparten un mismo origen embriológico (ectomesenquima), conformando una unidad funcional. Los tres se originan, al mismo tiempo que se forma la raíz del diente, a partir de la capa celular interna del saco dentario3. Como se mencionó anteriormente la formación de cemento depende de la presencia de la vaina radicular de Hertwig, cuando esta se fragmenta, involucra la degeneración o pérdida de la lámina basal del lado cementario, al volverse discontinua esta lámina basal, es reemplazada por una capa de material amorfo y finas fibrillas orientadas aI azar, las cuales contribuirán a formar la capa hialina entre el cemento y la dentina. Las células ectomesenquimáticas indiferenciadas provenientes del folículo o saco dentario, se colocan en estrecha aposición con la capa hialina que cubre la superficie de la dentina radicular. Estas células ectomesenquimáticas aumentan de tamaño y desarrollan todos los orgánelos citoplasmáticos característicos de las células sintetizadoras y secretoras de proteínas, diferenciándose en cementoblastos. Estos comienzan a depositar Ia matriz orgánica del cemento, para posteriormente mineralizarse3. El cemento en formación engloba haces de colágeno sintetizado por los fibroblastos de la región central del folículo (fibras de Sharpey), que se convierten finalmente en las fibras principales del ligamento periodontal3. (Gráfico2) El ligamento periodontal es un tejido conectivo especializado que da anclaje al diente, sus fibras están embebidas en el cemento sobre la superficie del diente y en el hueso alveolar en el otro extremo. Este tejido está en un continuo estado de remodelación, tanto durante el desarrollo y a través de la vida del diente3.
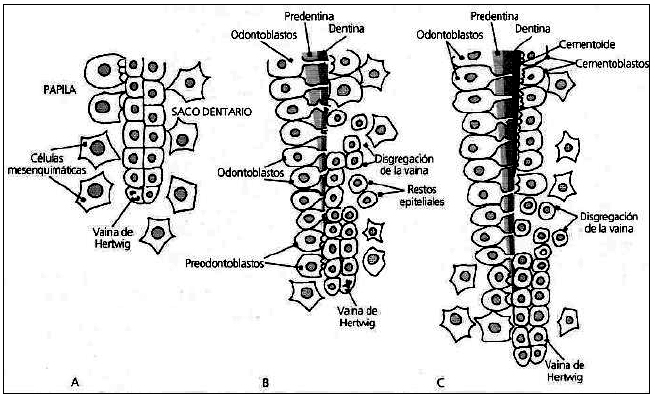
Gráfico 2. A, B y C: Etapas de la cementación. Tomado de: Gómez de Ferraris M y Campos Muñoz A, 2002.
El hueso alveolar se desarrolla a medida que el diente se desarrolla. Las células más externas del folículo dentario se diferencian en osteoblastos, estos por un proceso de osificación intramembranosa, originan trabéculas osteoides que paulatinamente se calcifican. Estas trabéculas están constituidas por un tejido óseo inmaduro que más adelante es remodelado y sustituido por un tejido óseo laminar. Las áreas mesenquimatosas que permanecen entre las trabéculas óseas se diferencian posteriormente en médula ósea3.
ASPECTOS HISTOLÓGICOS DE LAS ESTRUCTURAS QUE CONFORMAN EL TERCIO APICAL
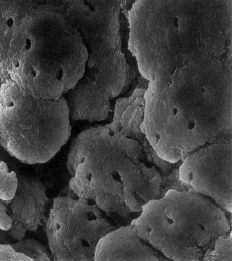
TEJIDO PULPAR APICAL El tejido pulpar apical difiere en su estructura del tejido pupar coronario, el cual este se compone principalmente de tejido conectivo celular y escasa fibras colágenas, mientras que el tejido pulpar apical es más fibroso y contiene menos células, idéntico al ligamento periodontal1,4. Esta estructura fibrosa parece actuar como una barrera contra la progresión apical de la inflamación pulpar. Sin embargo, en las pulpitis parciales o totales, generalmente no se produce la completa inhibición de la inflamación de los tejidos periapicales1. El estrato celular más externo de la pulpa sana es la capa de odontoblastos, que se localiza inmediatamente subyacente a la predentina; las proyecciones odontoblásticas, sin embargo, pasan a través de la predentina (dependiendo de la ubicación a lo largo de la porción radicular). En consecuencia, la capa odontoblástica se compone de los cuerpos celulares de los odontoblastos. Además entre estos se pueden encontrar capilares, fibras nerviosas y células dendríticas2. Marion y col.5, estudiaron los aspectos morfológicos de los odontoblastos en diferentes niveles de la cámara pulpar y conducto radicular. La capa odontoblástica de la pulpa radicular apical contiene menos células por unidad de área. Cerca del foramen apical, los odontoblastos aparecen como una capa escamosa de células planas. Puesto que el número de túbulos dentinarios por unidad de área es menor, los cuerpos celulares de los odontoblastos están menos apiñados; estos espacios intercelulares están llenos de un denso tejido fibroso dispuesto en grandes haces o en finas fibrillas. El diámetro de los túbulos en esta zona era de 1?m y algunos estaban en proceso de obliteración a diferencia de la porción coronal que era de 2?m. (Gráfico 3 y 4)
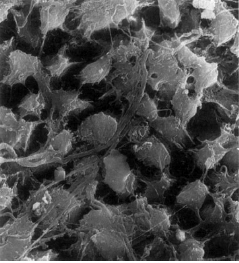
Gráfico 3: Odontoblastos vistos como glóbulos separados a nivel del tercio apical. (SEM; magnificación 2300 X.) Tomado de Marion y col. 1991
Gráfico 4: Aspecto de la dentina en el tercio apical (SEM; magnificación 2300 X.) Tomado de Marion y col. 1991
En el estudio de Seltzer y colaboradores4, observaron calcificaciones pulpares en el tejido pulpar del tercio apical en 10 dientes, representando el 15%, y en general se encuentra más de un dentículo. La mayoría de estos, están incluidos estando completamente recubiertos por dentina. En ocasiones se presenta un dentículo adherente en el cual sólo parte de la piedra pulpar está adherida a la pared dentinaria. La presencia de dentículos dentro del tejido pulpar en el tercio apical de la raíz, pueden explicar el porqué de algunas dificultades en la instrumentación del conducto radicular, en el cual durante el limado pueden comenzar a deshaderirse o impactarse en el foramen apical, haciendo dificultoso o hasta imposible la instrumentación. En el mismo estudio hallaron calcificaciones distróficas en un 25% de los dientes, localizadas dentro y alrededor de las fibras colágenas, varían en apariencia desde una variedad fina, difusa, fibrilar hasta grandes acumulaciones denticulares y no tiene relación con la edad del paciente1,4. La extirpación de una pulpa vital, involucra una división del tejido pulpar en alguna zona de la región apical del conducto principal. El tejido pulpar de la foramina accesoria, no es removido. La división del tejido pulpar del ligamento periodontal, no está bajo el completo control del operador, por lo que la separación puede producirse en el conducto radicular o aún más allá del foramen apical, en alguna zona del ligamento periodontal y cuando se produce la división pulpar a este nivel, la hemorragia resultante causa una pericementitis dolorosa1.
APORTE SANGUÍNEO Y NERVIOSO El tejido pulpar apical contiene vasos sanguíneos y nervios que entran a la pulpa que se originan en los espacios medulares del hueso que rodea el ápice radicular. Los vasos sanguíneos corren entre el trabeculado óseo y ligamento periodontal antes de entrar a la foramina como arterias o arteriolas; el ancho de estos parece ser del orden de los capilares y están rodeados por grandes nervios medulares que también se ramifican después que entran en la pulpa1,4,. La íntima relación de la sangre y los nervios que irrigan la pulpa y el ligamento periodontal, proporcionan un fundamento para la interrelación de la pulpa y la enfermedad periodontal. Un proceso inflamatorio o degenerativo que afecte el aporte sanguíneo del ligamento periodontal puede afectar el aporte sanguíneo a ciertas porciones de la pulpa, o de forma inversa, alguna enfermedad que afecte los vasos sanguíneos pulpares posiblemente podrían influir sobre algunos vasos sanguíneos del ligamento periodontal. Ya que el aporte nervioso, es similar tanto para la pulpa como para el ligamento periodontal, una inflamación periodontal puede producir un dolor similar a un dolor de origen dental producido por una pulpitis1.
DENTINA APICAL En la región apical, los odontoblastos de la pulpa están ausentes, o son de forma aplanada o cuboidea. La dentina que es producida por ellos, no es tan tubular como la dentina coronaria, es más amorfa, irregular y menos permeable; el cual la hace menos penetrable o son impenetrables por microorganismos u otros irritantes1. Fogel y col.6, determinaron que la densidad de túbulos dentinarios, en la dentina cervical es aproximadamente de 42.000/mm2 y de 8000 /mm2 en la dentina radicular, disminuyendo así la permeabilidad de la dentina radicular. Hallaron además que el movimiento de fluido a través de la dentina radicular externa era solo el 2% del de la dentina coronaria. Mjör y Nordahl7, estudiaron mediante microscopio electrónico de barrido, la densidad y ramificaciones de los túbulos dentinarios. En la dentina radicular la densidad de túbulos dentinarios es bajo y en algunas áreas carecen por completo de esta estructura. En dichas áreas se observan con frecuencia ramas tubulares finas (300-700?m de diámetro) que cursan en un ángulo de 45º hasta los túbulos principales, y microrramas (25-200?m de diámetro) que corren en un ángulo de 90º hasta los túbulos principales. (Gráfico 5)
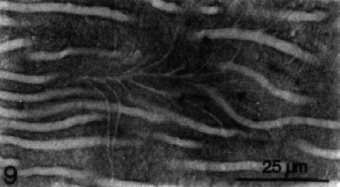
Gráfico 5: Variación de ramificaciones tubulares en la dentina radicular. Tomado de Mjör y Nordahl.1996
Mjör y col.8, en un estudio histológico de los últimos 3mm de la porción apical en 25 dientes humanos, identificaron dentina secundaria irregular sobre las paredes de la superficie interna del conducto radicular y en algunas ocasiones identificaron una interfaz bien definida de la dentina primaria/secundaria. Los túbulos dentinarios de la dentina primaria a la secundaria no mostraron continuidad, estaban dispuestos irregularmente y la interfaz no pareció ser atravesada por los túbulos dentinarios y en algunas áreas carecía de túbulos, en cual en esta zona fueron particularmente más abundante las ramas tubulares (Gráfico 6, 7)
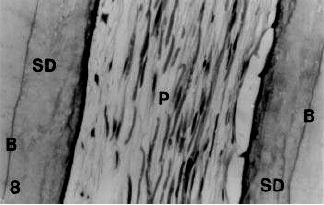
Gráfico 6: Dentina secundaria (SD) que recubre la parte apical del conducto radicular en un incisivo central superior de un individuo de 67 años de edad. Borde (B) entre la dentina primaria y secundaria. No se encontró predentina y línea de odontoblastos en el tejido pulpar periapical. Coloración con H & E. • 40. Tomado de Mjör y cols.2001
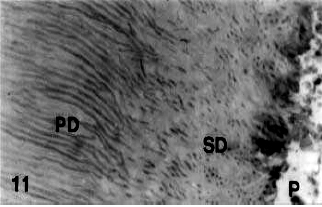
Gráfico 7: Cambio abrupto en la dirección de los túbulos dentinarios desde la dentina primaria (PD) a la dentina secundaria (SD). P, pulpa. Coloración con H & E. ? 480. Tomado de Mjör y cols.2001
En este estudio8, el número de túbulos dentinarios registrados en la porción apical correspondió a 14.400/mm2(cerca de la pulpa o en la dentina secundaria). 8.100/mm2 (en el medio) y 2.500/mm2 (dentina radicular periférica). Por lo tanto, el número de túbulos dentinarios disminuye de 40.000/mm2 en la dentina coronaria a 14.400/mm2 en la porción apical del conducto radicular. Los túbulos dentinarios primarios en la dentina apical se encuentran con menos frecuencia que en la dentina coronaria, son irregulares en cuanto a dirección y densidad. Algunas áreas carecen por completo de túbulos. Esta estructura variable de la región apical plantea dificultades para el tratamiento del conducto radicular. Las técnicas de obturación que se basan en la penetración de los adhesivos en los túbulos dentinarios, quizá no proporcionen un buen sellado en la región apical. Por lo tanto la formación de una capa híbrida se puede convertir en una parte importante de los sistemas adhesivos usados en el conducto radicular apical. Por el contrario, la reducción de los túbulos en la región apical reduce su permeabilidad, por lo que los túbulos son menos penetrables o impenetrables a microorganismos, productos bacterianos u otros irritantes6,7,8. Otra ventaja de la baja densidad de túbulos es contribuir al éxito del tratamiento quirúrgico, al modificar el ángulo de resección radicular a 90º con el eje longitudinal del diente se disminuye la exposición de los túbulos expuestos a los tejidos periapicales2. Giuseppe Lo Giudice y col.9, en un análisis con microscopio electrónico de barrido de la morfología de la dentina del conducto radicular en 30 premolares, obtuvieron una gran variedad morfológica de la dentina en las diferentes regiones del conducto. El número de túbulos dentinarios y sus diámetros disminuyen en apical en relación a coronal, a diferencia de la dentina intertubular.
CEMENTO APICAL El cemento se forma cuando la vaina radicular epitelial se destruye por la invasión de las fibras del saco del tejido conectivo, que rodea al diente desarrollado. A medida que el tejido conectivo entra en contacto con la superficie radicular del diente, alguna de las células del ligamento periodontal, se diferencia en cementoblastos. El cemento es formado en grandes cantidades en las furcas de los molares y alrededor de los ápices de todos los dientes. Por lo tanto, en los cortes tisulares de esas regiones, se encuentra las capas más espesas de cemento y es directamente proporcional a la edad del paciente. Existen tres tipos de cemento: celular, acelular e intermedio. El cemento celular, como su nombre lo indica contiene células, generalmente se encuentra alrededor de las regiones apicales y de las furcas de los dientes. El cemento acelular está libre de células, cubre prácticamente la raíz como una estructura laminada, delgada y hialina, caracterizada por numerosas líneas que corren paralelas a la superficie radicular. Y el cemento intermedio, el cual es una capa de tejido duro entre el cemento y la dentina, que posee las características del cemento y de la dentina1. El cemento es un tejido de protección, el cual entre una de sus funciones se observa en el movimiento dentario. Los dientes erupcionan continuamente. De acuerdo a las edades, el uso de los dientes es compensado por su erupción continua. Las raíces aumentan su longitud debido a la deposición de cemento en las regiones apicales y en el área de la furca. El movimiento fisiológico dentario se realiza en dirección ocluso-mesial para compensar la pérdida de estructura dentaria, debido a la mesializacion, hay una compresión del ligamento periodontal y del hueso en la superficie mesial de la raíz, produciendo resorción ósea. Sobre la superficie distal se produce una tensión, dando como resultado la aposición de cemento y hueso. Otra función, es la reparación de las resorciones radiculares. Cuando se reabsorbe la dentina o el cemento, ya sea por un proceso fisiológico o patológico, el cemento repara la zona afectada1. La aposición continúa de cemento puede verse influida por la función, oclusión y procesos patológicos10. Kuttler11, midió el espesor de cemento a cada lado del conducto desde la unión cemento dentinaria, en el lado derecho el espesor de cemento en el grupo de 18-25 años fue de 508?m y 802 ?m, en individuos mayores de 55 años; del lado izquierdo fue de 505?m y 767?m respectivamente. El espesor de cemento también se midió fuera del conducto donde a menudo el espesor disminuye. El espesor medio del cemento en el lado derecho fue de 343?m y 619?m para cada grupo respectivamente y del lado izquierdo de 326?m para la primera serie y 551?m para la segunda serie. El espesor de cemento siempre será mayor en los pacientes seniles y habrá mayor deposición en una pared que en otra. (Gráfico 8) Zander y Hürzeler12, midieron el espesor de cemento en 233 dientes unirradiculares de humanos, con un rango de edad de 11-76 años de edad y determinaron que el espesor de cemento se triplico en el grupo de mayor edad (51-76 años) con un promedio de 0,215 mm, en relación al grupo menor de 20 años con un espesor de cemento promedio de 0.076mm; es decir que el espesor de cemento era directamente proporcional a la edad del paciente y fue mayor en la porción apical del diente. En el estudio de Seltzer y colaboradores4, el cemento fue observado en capas espesas alrededor de las raíces de algunos dientes; en cambio en otros, se presentó solamente una capa delgada. El espesor de la capa de cemento varió a cada lado de la raíz, siendo más ancha en un lado que en otro. Realizaron mediciones en el espesor mesio distal del cemento en su región más ancha del tercio apical de la raíz, fue de 0,15 a 1,02mm, con un promedio de 0,464mm. Sin embargo el espesor promedio fue observado solo en seis dientes (10,2%). El espesor más frecuente encontrado, fue dentro de la categoría de 0,21 a 0,30 en 18 dientes, representando el 32,1%. Solheim T.10, midió el espesor de cemento en 1.000 dientes humanos en una población caucásica, y determinó que el espesor de este tejido era dos o tres veces mayor en apical que en el resto de la longitud radicular, lo que podría indicar que el cemento apical reacciona con más fuerza a los estímulos y directamente proporcional a la edad. Los caninos mandibulares presentaron el mayor grosor de cemento, siendo mayor en la superficie lingual que en vestibular, al igual que el resto de los dientes maxilares, puede estar relacionado a la presión masticatoria de estos dientes en dirección vestibular. Halló menos cemento en los dientes del sexo femenino, podría ser debido a que el tamaño del diente es más pequeño y la fuerza masticatoria es más débil. Ponce y Vilar13, evaluaron 18 dientes humanos anteriores maxilares, mediante microscopio óptico y determinaron que la extensión de cemento desde el foramen apical al conducto radicular difiere considerablemente, incluso cuando se comparan paredes de conductos opuestas, con valores entre 200-800?m. El cemento alcanza el mismo nivel en todas las paredes de los conductos en solo el 5% de los casos. La mayor extensión ocurre generalmente en el lado cóncavo de la curva del conducto. El espesor de cemento perirradicular no siempre parece estar correlacionado con su función o causa conocida. En algunos dientes, la aposición de cemento es tan abundante que la foramina apical parece estar prácticamente obliterada; sin embargo las foraminas apicales completamente obliteradas casi nunca se observan1,4. El cemento por lo general es más resistente que el hueso, a los procesos de resorción, posiblemente porque se ve libre del aporte sanguíneo. Solo la superficie del cemento está en contacto con los vasos sanguíneos que provienen del ligamento periodontal1,4.
UNIÓN CEMENTO-DENTINARIA La unión cemento dentinaria es la zona apical terminal del cemento donde se une a la dentina del conducto radicular interna; también es el punto donde termina el tejido pulpar y comienza los tejidos periodontales. La localización de la unión cemento-dentina es muy variable11,14,15. Kuttler, describió que el conducto radicular está formado comúnmente por dos conos: uno largo y poco marcado, el dentinario, y el otro muy corto, pero bien marcado e infundibuliforme, el cementario. Es el punto de unión donde precisamente se unen las dos partes (la cementaría con la dentinaria) dentro del conducto11. Kuttler11, demostró en su estudio histológico, que la unión cemento dentinaria, evaluada en dos paredes del conducto, en dientes de humanos de edades comprendidas entre 18-25 años, el 53% se encontraba a un mismo nivel, mientras que el grupo mayores de 55 años, en un 60%. La distancia entre estos dos puntos fue de 306 micras (18-25 años) y 274 micras (mayores de 55 años). Coincida o no ambos puntos de la unión cemento dentina el diámetro siempre será menor en los pacientes seniles. Y la distancia entre la unión cemento dentinaria y el foramen apical es de un promedio de 524um en la población joven y de 659um en la población adulta, la distancia es mayor en este grupo debido a la aposición de cemento. Seltzer y col.4 observaron en los dientes evaluados histológicamente, que el cemento que rodea algunos dientes, no parece extenderse dentro del conducto radicular, sin embargo en las raíces de otros dientes, el cemento se extiende considerablemente dentro del conducto. Cuando se observa cemento en el conducto radicular, la extensión de la aposición de cemento sobre cada pared del conducto radicular varía; una pared del conducto, en general está cubierta por una mayor cantidad de cemento que la otra pared. La cantidad de este tejido, varía entre los dientes de pacientes diferentes. No se encuentra un patrón morfológico de la unión cemento dentinaria1,4,11,14. En los dientes afectados periodontalmente la unión cemento dentinaria no presenta una apariencia típica. En algunos dientes con afección periodontal, el cemento y en ocasiones parte de la dentina apical, esta reabsorbido completamente a nivel del ápice radicular. Queda como remanente, una estructura denudada, festoneada y con forma de túnel. En otros dientes, las reabsorciones de dentina apical y de cemento son reparadas por delgadas capas de cemento en una pared de la raíz, pero el cemento es a menudo fino o está ausente sobre la otra pared. Y algunos dientes, se extiende a una distancia considerable dentro del conducto radicular, a veces cubriendo la dentina en casi toda la longitud de la raíz4. Stein y col.16 en un estudio histológico, para determinar los cambios producidos por la edad en la anatomía del ápice radicular en 111 muestras de dientes humanos, con un rango de edades de 26 a 77 años, obtuvieron que la distancia media del foramen apical a la unión cemento dentinaria era 0,724 mm en el grupo de menores de 55 años y de 0.821mm en mayores de 55 años. La distancia media del ancho de la unión cemento dentinaria fue de 0,189 mm para el primer grupo y 0.211 en el otro, determinando que no existe una correlación de la edad y el ancho de esta unión. Saad y Al-Yahya14, determinaron mediante estudios histológicos en premolares inferiores de pacientes egipcios y sauditas la localización de la unión cemento dentinaria y determinaron que esta unión no es un punto fijo en las poblaciones estudiadas. En la muestra de los pacientes egipcios, demostraron que la unión estaba completamente fuera del conducto, o solo era cubierto un lado de la superficie interna del conducto radicular. En la muestra de los pacientes sauditas, esta unión en ambos lados estaba completamente dentro del conducto radicular, sin embargo está unión a ambos lados del conducto no estaba en un mismo nivel en mesial y distal.
LIGAMENTO PERIODONTAL APICAL El ligamento periodontal es ancho en la región apical como en la cresta ósea y más estrecho en la porción central de la raíz. Las fibras periodontales de esta zona, son las fibras oblicuas o apicales, que son radiadas alrededor de la porción apical del diente. Las fibras colágenas del ligamento periodontal tienen un alto grado de síntesis particularmente en la cresta alveolar y las fibras apicales, muy posible como consecuencia de las presiones y tensiones laterales a las que están sometidas los dientes durante la masticación. La pulpa y el hueso alveolar están irrigados por los mismos vasos del ligamento periodontal, el cual las conexiones entre los vasos periodontales y pulpares son observadas frecuentemente en el tercio apical de la raíz y en la zona de las furcaciones1. Cuando se produce inflamación y/o necrosis pulpar, resultante de una caries dental o de procedimientos operatorios, pueden causar inflamación apical en el ligamento periodontal. La formación de un granuloma periapical destruye el ligamento periodontal en esa región1.
HUESO ALVEOLAR PERIAPICAL Bajo circunstancias normales, en la vecindad del ápice radicular, el hueso se reabsorbe más que el cemento. Durante el proceso inflamatorio, la reabsorción esta acentuada, de aquí que la reabsorción ósea se encuentra comúnmente alrededor de los granulomas periapicales. Las pulpitis inician los procesos de reabsorción periapical y, a medida que se forma el granuloma periapical, se crea el ámbito para él, por medio de la reabsorción del hueso alveolar1.
ASPECTOS ANATÓMICOS RELACIONADOS CON EL TERCIO APICAL Kuttler11, en el año 1955, propuso una nomenclatura sobre la anatomía de los conductos radiculares en la que prevalece la definición de estructuras a nivel del tercio apical. Conducto lateral: surge del conducto principal y se dirige lateralmente, casi perpendicular del conducto principal al espacio periodontal en el cual desemboca. Conducto colateral: Emerge del conducto principal, ligeramente paralelo a él y corre a lo largo de la raíz desembocando en un pequeño agujero individual y su diámetro es menor que el del conducto principal. Conducto secundario: tiene su origen en el conducto principal, generalmente a nivel del tercio apical de la raíz, se dirige oblicuamente hacia el ápice y termina en el espacio del ligamento periodontal. Conducto accesorio: Se refiere al tipo de conducto que deriva de un conducto secundario y desemboca individualmente. Conducto interrecurrente: Es el conducto de pequeño diámetro, corto y en número variable que intercomunica al conducto principal con otro similar o con un conducto colateral. (Gráfico 7a)
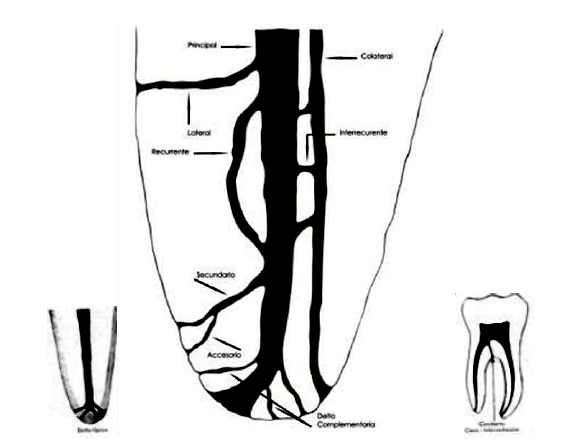
Gráfico 7a: El conducto principal y sus posibles ramificaciones. Tomado de Kuttler 1955. Kuttler11, en este estudio histológico de 436 conductos principales en dientes de humanos, los dividió en dos grupos, el primero de edades comprendidas entre 18 a 25 años y el segundo en edades de 55 o más años, observó la anatomía microscópica del ápice en cuanto a su dirección, forma, diámetro y localización. De acuerdo a su estudio pionero determinó que el conducto radicular no es un cono uniforme, con el diámetro menor en su terminación, como se sostenía equivocadamente antes, sino que está formado por una porción dentinaria, que es gradualmente cónico con el diámetro mayor en su unión con la cámara y el menor en el punto donde se une con la porción cementaria, que también es cónica, pero invertida, es decir, con su base en el foramen y vértice truncado en su unión con la parte estrecha y terminal de la porción dentinaria. El promedio de la longitud de esta porción cementaria es de 524?m en dientes de personas jóvenes y 659 ?m en personas mayores de 55 años. (Gráfico 8 y 9)
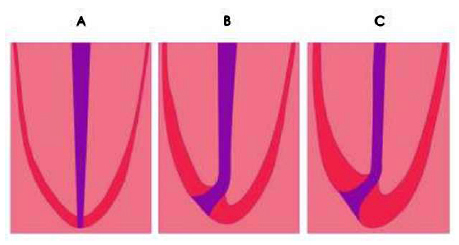
Gráfico 8: Topografía del ápice A. concepto erróneo. B. dibujo esquemático según los promedios obtenidos en la serie de 18 a 25 años. C. de la serie de 55 años en adelante. Tomado de Kuttler, 1955.
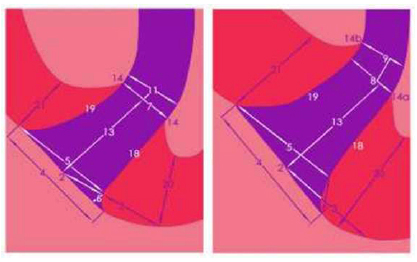
Gráfico 9: 1. vértice o centro apical. 2. centro del foramen. 3 distancia entre el vértice o centro apical al centro del foramen. 4. diámetro del foramen. 5. diámetro foramen-conducto. 6. desnivel de los diámetros. 7 diámetro del conducto a la altura de los puntos de unión cemento-dentina-conducto (CDC) que se encuentran al mismo nivel. 8. diámetro del conducto al nivel del punto de unión CDC distante. 9. diámetro del conducto al nivel del punto de unión CDC cercano. 11. ubicación del diámetro menor del conducto (42%). 13. distancia entre el centro foraminal y el diámetro más estrecho del conducto. 14,14ª,14b puntos de unión entre el cemento, dentina y conducto. 18. grosor del cemento del lado derecho del conducto. 19. grosor del cemento del lado izquierdo del conducto. 20. grosor del cemento derecho en su rápido adelgazamiento. 21. grosor del cemento izquierdo en su rápido adelgazamiento. Tomado de Kuttler, 1955
ÁPICE ANATÓMICO: Es el extremo de la raíz determinado morfológicamente17. Es el punto final de la raíz11.
ÁPICE RADIOGRÁFICO: Es la punta o extremo de la raíz determinado morfológicamente en la radiografía. Su ubicación puede variar debido a la morfología del ápice anatómico y la distorsión de la imagen radiográfica17
FORAMEN APICAL Kuttler11, lo definió como "borde circular o redondeado", como un embudo o cráter, que diferencia entre la terminación del conducto cementario y la superficie exterior de la raíz. El diámetro del foramen midió 502 ?m en los individuos de 18 a 25 años de edad y 681 ?m en aquellos con más de 55 años, lo que demuestra el crecimiento del foramen apical con la edad, debido a la aposición de nuevas capas de cemento. El foramen en la gran mayoría de los dientes, no se encuentra en un plano perpendicular al eje del conducto dentinario, sino en un plano oblicuo, en un 68% en el grupo de 18-25 años y en un 80% en el grupo de más de 55 años y en la mayoría de los casos la desviación se presentó haca distal11. La distancia media entre el vértice apical y el centro del foramen apical fue de 495?m en el primer grupo y 607?m en el otro, atribuyendo esta lateralidad del foramen a la aposición de nuevas capas de cemento y la migración dentinaria11. Stein y col.16, en su investigación afirmaron los hallazgos de Kuttler, donde encontraron una correlación positiva, entre el aumento de la edad, la desviación y diámetro del foramen apical, como resultado de engrosamiento cemento apical . Blaskovic-Subat y col.18, estudiaron la asimetría del foramen apical en 230 raíces, mediante microscopio estereoscópico y radiográficamente. Determinaron estereoscópicamente la desviación del foramen apical principal en un 76%, en un mayor porcentaje (39%) hacia la superficie vestibular seguido de la distal (33%) y a través del método radiográfico es poco fiable identificar la desviación del mismo. La distancia media del ápice anatómico al foramen fue de 0.99mm, siendo mayor esta distancia en el grupo de premolares y molares. Gutiérrez col.19, examinaron bajo microscopio electrónico de barrido, 140 dientes humanos y determinaron que el foramen apical se encontraba desviado en el 76% de la muestra. Martos y col.20, evaluaron la topografía del foramen apical, en un total de 1331 raíces de dientes humanos utilizando microscopio óptico estereoscópico. Determinaron que la distancia media entre el foramen y el ápice anatómico fue de 0.69 mm; la distancia fue mayor en los dientes posteriores (0.82mm) y menor en los dientes anteriores (0.39mm). El foramen se encontraba desviado en un 61%, con mayor frecuencia hacia vestibular (20%) y distal (14%). La localización vestibular del foramen tiene el potencial de causar una medición clínica incorrecta del conducto del conducto. Radiográficamente, un foramen apical ubicado en vestibular o lingual se superpone sobre de la raíz, por lo que es difícil observar el punto de salida del instrumento. No encontraron un patrón típico de la forma del foramen apical; sin embargo la mayor prevalencia fue de forma redondo y ovoide. En la mayoría de los casos, la superficie de la zona apical fue irregular o rugosa y en algunos otros el vértice parecía haber sido erosionado. Ponce y Vilar13, observaron la desviación del foramen en un 44,4% y mayormente hacia distal. Briseño y col.21, determinaron en un estudio de 2639 forámenes en molares maxilares y mandibulares que la forma del foramen podía ser redondo, avalado o irregular (triangular, arriñonado o formas irregulares). La forma más común de los foramen evaluados, presentaron forma ovalado en un 70%. Un foramen ovalado podría indicar la presencia de un conducto con la misma forma y la relevancia clínica, es que la conformación de estos conductos especialmente los más largos y estrechos, son difíciles de preparar por completo sin perforar o debilitar significativamente la raíz. Jou y cols.22 de acuerdo a las dimensiones horizontales (secciones transversales) del foramen y el conducto radicular en toda su extensión, demostraron que pueden ser de forma circular (el diámetro máximo y mínimo son iguales); forma ovalado (el diámetro máximo es hasta dos veces mayor que el diámetro mínimo); ovalado largo (el diámetro máximo es dos o cuatro veces mayor que el diámetro mínimo); aplanado o en cinta (el diámetro máximo es cuatro veces mayor que el diámetro mínimo) e irregular , que no puede definirse la sección transversal. En resumen, de acuerdo a los diferentes estudios, se han descrito que la distancia entre el foramen apical y extremo más apical de la raíz se encuentra en un intervalo de 0,20 a 3,80 mm y desviaciones del foramen que oscilan entre un 34% hasta 92%. Las variaciones entre los resultados pueden explicarse por las diferencias en el diseño de la investigación, número de dientes evaluados, diferencias raciales y el origen de las muestras20. La desviación del foramen es consecuencia de la adaptación de los dientes a las influencias de la función, presión de la lengua, erupción dental fisiológica; estimulando la resorción y aposición de cemento, lo que produce una remodelación permanente del ápice de la raíz. Y las circunstancias patológicas más comunes que causan la desviación del foramen son la reabsorción radicular externa y la hipercementosis11,18,20,.
CONDUCTOS LATERALES Y FORAMINAS ACCESORIAS Si la vaina radicular se desintegra antes que la dentina sea elaborada, se genera un conducto lateral. Además, los conductos accesorios o laterales, pueden ser el resultado de una falta de elaboración de dentina alrededor del vaso sanguíneo que está presente en el tejido conectivo perirradicular1,19. Un conducto lateral es aquel que está localizado en ángulos aproximadamente rectos con respecto al conducto radicular principal. Un conducto accesorio es, aquel que se ramifica del conducto radicular principal, por lo general en alguna zona de la región apical de la raíz. Casi siempre los conductos accesorios se presentan en grandes cantidades en los individuos más jóvenes. A medida que el diente envejece, algunos conductos accesorios pueden comenzar a obliterarse por medio de una posterior formación de dentina o cemento1. Al igual que los conductos laterales, las foraminas, también se forman cuando se desintegra la vaina radicular, antes que la dentina sea elaborada. Las foraminas, son conductos accesorios que no son perpendiculares al conducto principal y se hallan frecuentemente en el tercio apical de las raíces1,19. Los conductos laterales y las foraminas apicales contienen tejido fibroso, pueden presentarse fibroblastos, fibras colágenas, nervios, capilares y algunos macrófagos. Sin embargo, en muchos dientes, el ancho de las foraminas accesorias y conductos laterales es extremadamente pequeño, permitiendo solo la presencia de pequeños vasos. El tejido conectivo es el mismo que se encuentra en la pulpa pero recuerda más al tejido conectivo del ligamento periodontal1. En general, estos conductos pequeños, no pueden observarse radiográficamente y clínicamente no hay forma de determinar exactamente su salida en la raíz1,19. Seltzer y col.4, observaron en cortes seriados de 106 raíces de dientes anterosuperiores, la presencia de foraminas accesorias y conductos laterales con una incidencia del 34%. En un considerable número de dientes, fue evidente la presencia de un conducto radicular bifurcado con forma de Y cerca del ápice. En otros dientes, los conductos laterales fueron observados más coronario a la raíz. No hubo una relación aparente entre la presencia de conductos accesorios o foraminas y la edad del paciente. Gutiérrez y col.19, hallaron que no hay un patrón típico de las aberturas foraminales, que estos conductos en el cemento no eran en forma lineal, sino con un trayecto ondulado. Posiblemente, estas ondulaciones actúen como un mecanismo protector para evitar que los vasos sanguíneos y fibras nerviosas sean lesionados durante la masticación como consecuencia de los movimientos de la raíz en sus alveolos. Algunas configuraciones, simulaban una cresta con configuración de casco, cubriendo la salida de las foraminas, suministrando algún tipo de protección al suministro vascular y nervioso, sin embargo, esto es especulativo (Gráfico 10). La mayor parte de las aberturas foraminales eran de forma redondas u ovaladas y ninguna coincidió con el vértice apical. El número de foraminas encontradas osciló entre 1 a 16, se encontraron en las cuatro superficies o por las superficies interradiculares de las raíces y en relación al tamaño algunas fueron similares al foramen principal. Las aberturas siempre terminaban por debajo de los ápices a 0,20 ± 3,80 mm (Gráfico 11).
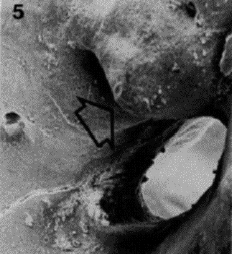
Gráfico 10: Primer premolar superior. La flecha señala una cresta con configuración de casco. (Microfografía con magnificación X116). Tomado de Gutiérrez y col. 1995
Gráfico 11: Segundo premolar superior exhibió 16 foraminas en el ápice. (Microfografía con magnificación X18) Tomado de Gutiérrez y col. 1995
De Deus23, mediante un estudio de 1.140 dientes humanos extraídos, investigó la frecuencia, localización y dirección de conductos laterales, secundarios y accesorios. En un 27,4% de los dientes estudiados, demostró la presencia de conductos laterales, secundarios y accesorios. Estas ramificaciones laterales fueron localizadas con mayor frecuencia en el área apical (17,0%). Y los premolares y molares presentaron la mayor variedad de ramificaciones. Hess y col.24, evaluaron con microscopio electrónico de barrido el aspecto morfológico del foramen apical y foraminas accesorias de 27 dientes humanos, y determinaron que estos son más pequeños y algunos son sólo una quinta parte del tamaño del foramen apical principal con un promedio de 60-80?m de diámetro; generalmente son permeables, pero pueden estar obliterados por una reacción a una inflamación crónica o una cicatrización. En contraste, con una inflamación crónica del periodonto (granuloma) que puede conducir a la resorción de la superficie de la raíz. Briseño y col.21, reportaron una alta frecuencia de forámenes accesorios en las raíces mesiovestibulares maxilares (33%) y raíces mesio mandibulares (26%). Los conductos laterales y/o foraminas accesorias, son vías para el intercambio de productos metabólicos y de descomposición, entre la pulpa y los tejidos periodontales. La pulpa puede inflamarse o necrosarse por la presencia de bolsas periodontales profundas que causan la exposición de los orificios de los conductos, permitiendo así el ingreso de productos tóxicos dentro de la pulpa. A la inversa, los productos de descomposición de las lesiones pulpares inflamatorias, pueden tener un efecto sobre los tejidos periodontales por vía de estos conductos, causando cambios inflamatorios1. Las complicaciones de estos conductos accesorios en la terapia endodóntica, suscita preguntas con referencia al destino del tejido pulpar en aquellos conductos, luego de la terapia endodóntica. El rol que juegan estos conductos con el fracaso o éxito después de la terapia endodóntica, aún no está claro. La presencia de estos conductos ocasionalmente es ignorada inadvertidamente, sin embargo ocurre frecuentemente la reparación, porque cuando la pulpa es extirpada, se forma un coágulo en el sitio de la herida ocurriendo la reparación, y con el paso del tiempo, la continua deposición de dentina o cemento tiende estrechar las luces de esas foraminas. En forma eventual, las células necróticas es probable que se calcifiquen debido a que pierden su aporte sanguíneo. Debido a la multiplicidad de los conductos laterales y las foraminas, es dudosa la obturación completa del sistema radicular1,4,8. Ricucci y Langeland25, refieren que los conductos laterales no son relevantes en la tasa de éxito de la terapia endodóntica, ya que no pueden ser debridado ni mecánica ni quimicamente, cuando aparecen radiográficamente es debido al desplazamiento del cemento sellador. Cuando está en contacto con tejido vital, causara la desintegración del tejido, produciendo una reacción a cuerpo extraño, en la misma forma cuando ocurre una sobreobturación del conducto principal, a un nivel más reducido, porque hay menos material.
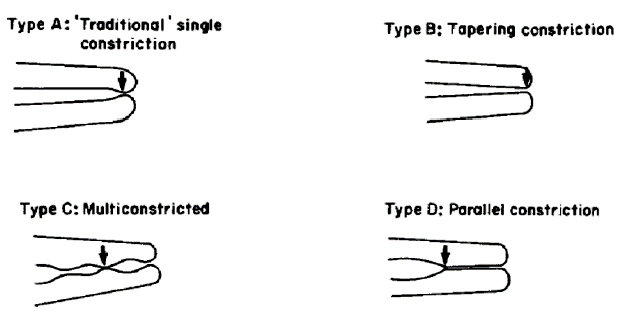
CONSTRICCIÓN APICAL Es la porción apical del conducto radicular que tiene el diámetro más estrecho. Se considera como la terminación apical para la conformación, limpieza y obturación. Su posición, puede variar, generalmente situada a menos de 0,5 a 1,0 mm del foramen apical17. Se ha cuestionado su existencia, ya que puede ser más teórica que real. La localización de la constricción apical y el foramen apical es casi imposible determinarla clínica y radiográficamente. Los vasos sanguíneos de la pulpa en este nivel son más estrechos, por lo que la resolución de los procesos inflamatorios en el conducto es más difícil. Las molestias postratamientos son en general mayores cuando esta zona es lacerada por los instrumentos o materiales de obturación, y se puede comprometer el proceso de curación1,2,13,20,26,27 . Kuttler11, determinó la localización y el diámetro de la constricción apical. La constricción se localizó en la porción de cemento del conducto en un 26% en el grupo de 18-25 años y en un 29,5% en el grupo de 55 años, con un diámetro de 225?m y 240?m respectivamente. Se localizó en dentina en un 42% en el primer grupo y en un 29,5% en el segundo grupo, con un diámetro de 299?m y 254?m respectivamente. El restante 32% en el primer grupo y 41% en el segundo grupo, la constricción apical coincidió con la unión cemento dentina, con un diámetro de 244?m y 210?m respectivamente. Y la distancia del centro del foramen apical a la porción más estrecha del conducto es de 524?m en el grupo de 18-25 años y 569?m en las personas mayores de 55 años. Dummer y col.28, en un estudio de 270 dientes humanos extraídos, determinaron que la distancia entre el ápice y la constricción fue de 0,89 mm. Del mismo modo, concluyeron que la topografía de la constricción nunca fue constante, razón por la cual, la clasificaron en cuatro tipos: A. constricción tradicional o sencilla, B. constricción con la porción más estrecha cerca del ápice, C. tipo multiconstricción, D. la constricción es seguida por una porción estrecha y paralela al conducto (Gráfico 11). La topografía de las constricciones encontrada en este estudio parece tener una influencia importante en la distancia con respecto al ápice y por lo tanto es probable que afecte el establecimiento de una distancia de trabajo precisa. La importancia de la constricción en la terapia endodóntica, es intentar hacer uso de su potencial para actuar como una barrera natural entre el contenido de los conductos y los tejido apicales. El método radiográfico y la sensación táctil no determinan la ubicación precisa de la constricción apical.
Gráfico 11b. Clasificación de la constricción apical. Las flechas indican la porción más reducida del conducto y el punto de medición. Tomado de Dummer, 1984.
Hassanien y col.29, hallaron en dientes premolares mandibulares, que la constricción apical no coincide con la unión cemento dentinaria. Encontraron que la constricción apical se detectó a una distancia media de 1,2mm con un diámetro de 0.22mm y siempre estuvo coronal a la unión cemento dentinaria, el cual esta se encontraba a una distancia media del foramen a 0,3mm y un diámetro de 0,32mm. Briseño y cols.21, en su estudio denominaron la constricción apical como foramen fisiológico; el cual la media de sus diámetros fue de 0,20-0,26 mm en molares inferiores; 0,18-0,25 mm en la raíz mesiovestibular y distovestibular maxilar y 0,22-0,29 mm en la raíz palatina del maxilar. Estos resultados sugieren que los instrumentos de tamaños #10 o´ 20 a menudo no tienen ningún tipo de fricción en la constricción, sino más bien encuentran resistencia en otros lugares debido a las irregularidades del conducto radicular o curvaturas. De acuerdo a estos resultados y los reportados por Wu y cols.30, en la mayoría de los casos, un instrumento de tamaño #25, tiene un diámetro similar a la constricción. ElAyouti y col.26, realizaron un estudio con microtomografía computarizada en 90 molares humanos, y determinaron que todos los conductos evaluados presentaron una constricción apical, se ubicaba aproximadamente a 0,2mm del foramen apical, la ubicación tan cerca al foramen, puede resaltar que las dos opiniones sobre el punto final de preparación del conducto (foramen/constricción) pueden no ser tan diferente. La distancia media de la constricción apical al ápice fue de 0.9mm, sin embargo, en el 68% de los conductos esta distancia fue 0,5mm más larga o más corta que la media, por lo que demostraron que la determinación de la constricción mediante radiografías puede ser preciso en solo el 32% de los conductos. Y el tamaño de la constricción correspondió al tamaño de instrumento 30 y los pacientes jóvenes (15-30 años) tenían una constricción significativamente mayor. A diferencia del estudio de Alves y col.31, en 169 raíces palatinas de primeros molares superiores, analizados con microtomografía computarizada, solo identificaron la constricción apical en un 38%, con una localización y forma variable.
MANEJO CLÍNCO DEL TERCIO APICAL DETERMINACIÓN DE LA LONGITUD DE TRABAJO y LIMITE APICAL DE LA INSTRUMENTACIÓN: La longitud de trabajo es la distancia desde un punto de referencia coronal hasta el punto en el que terminará la preparación y obturación del conducto17. La eliminación del tejido pulpar, material necrótico y los microorganismos del conducto radicular es esencial para el éxito del tratamiento de conductos. Esto sólo se puede lograr si la longitud del diente y del conducto radicular se determina con precisión32,33,.Se ha considerado que la constricción apical es el punto final apical ideal para la instrumentación y obturación del tratamiento de conducto. Tradicionalmente los métodos comúnmente utilizados para este propósito incluyen el empleo de las radiografías, la sensación táctil, presencia de fluidos en las puntas de papel y el conocimiento de la anatomía y promedios de la morfología de los conductos; sin embargo a través de estos métodos no se puede determinar la constricción apical28,34. El desarrollo del localizador apical electrónico ha ayudado a determinar la longitud de trabajo de una forma más precisa y predecible y conduce a una reducción en el número de radiografías tomadas35,36,37. El localizador apical es un instrumento electrónico, usado para determinar la longitud de trabajo del conducto radicular o perforaciones; que opera en los principios de frecuencia, resistencia e impedancia17. Los localizadores apicales son particularmente útiles cuando a la parte apical del conducto se superpone ciertas estructuras anatómicas tales como dientes retenidos, torus, el arco cigomático, densidad ósea excesiva, superposición de raíces, bóvedas palatinas poco profundas que pueden hacer imposible la visualización de la lima en el conducto38. Seltzer y colaboradores39, en un estudio in vivo, en 27 dientes humanos y 24 dientes de mono no cariados, evaluaron la respuesta del tejido periapical, cuando se realiza la extirpación pulpar e instrumentación de los conductos. A toda la muestra se le realizo la extirpación pulpar, 12 dientes de cada uno de los grupos fueron instrumentados de 2 a 10mm antes de llegar al ápice. En 15 dientes humanos y en 12 dientes de mono, los conductos fueron instrumentados varios milímetros más allá de los ápices radiculares. Concluyeron que las reacciones inflamatorias alrededor de los dientes en los cuales la instrumentación de los conductos radiculares fue realizada más allá de los ápices, estuvieron mucho más severas que las reacciones en los dientes cuyos conductos fueron instrumentados cortos con respecto al ápice. Ricucci40, en base a la revisión de estudios científicos, reportó que algunos autores sugieren elegir una longitud de trabajo a 0,5mm del ápice radiográfico en dientes con pulpa necrótica, mientras que en casos de dientes con pulpa vital, a 1mm menor Wu y cols.30, informaron que el punto de terminación apical en dientes vitales, reportó una mejor tasa de éxito cuando los procedimientos se realizaron a 2-3 mm del ápice radiográfico, debido a que los microorganismos no están presentes en la porción apical del conducto. Mientras que en la necrosis pulpar, las bacterias y sus productos, así como los desechos de dentina infectada puede permanecer en la parte más apical del conducto, estos irritantes pueden poner en peligro la curación apical. En estos casos, el éxito se logró cuando los procedimientos se realizaron de 0-2mm del ápice radiográfico. Cuando los procedimientos se realizaron más cortos que 2 mm o más allá del ápice radiográfico, la tasa de éxito fue de aproximadamente 20% menor que cuando los procedimientos se realizaron de 0 a 2 mm del ápice radiográfico. Stein y Corcoran38, en 84 dientes vitales y 24 no vitales, establecieron la longitud de trabajo través de la longitud media del diente o hasta que el clínico sintiera la constricción apical. Determinaron la relación de la lima colocada a la longitud de trabajo radiográfica y la posición real de la lima en muestras seccionadas obteniendo una discrepancia entre ambas de un 79%. La distancia de la longitud de trabajo radiográfica al vértice apical fue 0.7mm mayor que en la medición real microscópica, el cual indica que el método radiográfico presenta deficiencias en la estimación de la longitud y esta discrepancia puede llevar al clínico a tratar de estar más cerca del ápice radiográfico, cuando en realidad la punta de la lima está más cerca del vértice de lo que se sospecha. ElAyouti y cols.41, determinaron la frecuencia de la instrumentación más allá del ápice en 169 conductos radiculares, con una longitud radiográfica aceptable (0 a 2 mm del ápice radiográfico) y evidenciaron la instrumentación más allá del ápice en los premolares en un 51%, en los molares en un 22% y ningún caso en los dientes anteriores. Estos resultados sugieren que en premolares y en molares una longitud de trabajo radiográfica de 0 a 2mm por encima del ápice radiográfico, suministra, con más frecuencia de lo previsto, una base para la sobreinstrumentación no intencional. En un estudio posterior, ElAyouti y col.42, evaluaron la capacidad del localizador de ápice Root ZX® (J.Morita, JP), para evitar la instrumentación más allá del foramen apical en 43 conductos de dientes premolares, que tenían una longitud radiográfica aceptable 0-2mm del ápice radiográfico. Determinaron que la longitud de trabajo radiográfica produjo una sobrestimación de un 51%, una explicación puede ser que el foramen apical a menudo se encuentra lateralmente en lugar del vértice apical y el foramen apical que se encuentra por debajo del ápice radiográfico en posición vestibular o lingual de la raíz hace que sea generalmente difícil de identificar la posición del foramen apical en la radiografía. Con el empleo del localizador apical se redujo el porcentaje de sobreestimación en un 21%. Concluyeron mediante los resultados del presente estudio, que la complementación de ambos elementos pueden ser bastantes efectivos para evitar la sobrestimación en el foramen apical de premolares. Nguyen y cols.43, en un estudio in vitro, evaluaron el efecto en la medición del Root ZX, en relación al diámetro de la lima y el conducto radicular; el cual concluyeron que no es necesario que ambos diámetros coincidan. Una lima de pequeño calibre es igual de probable que identifique la constricción apical, como una lima de gran tamaño en los conductos de diámetro ancho, incluso en la ausencia de una constricción apical anatómica. Según Olson y col.44, dentro de la región apical de la raíz, existen dos medidas diferentes que son consideradas importantes durante la determinación de la longitud de trabajo; estas son la distancia comprendida entre el ápice al foramen apical y la distancia entre el foramen apical y la constricción apical. En su estudio evaluaron la capacidad de las radiografías para determinar la ubicación del foramen apical, mediante la colocación de la punta de la lima en el foramen apical en dientes extraídos, sólo el 82% se encontraba en el foramen apical. Indicaron que la ubicación del foramen apical no se pudo determinar radiográficamente con precisión, la distancia desde la constricción apical para el foramen apical no se puede medir, particularmente cuando este último se encuentra por vestibular o lingual/palatino. Concluyeron que en la mayoría de los casos, las radiografías paralelas proporciona un medio preciso para determinar la longitud del conducto y la ubicación del foramen apical; sin embargo al no ser 100% efectiva, recomiendan los investigadores utilizarla en combinación con otros métodos para lograr resultados clínicos más predecibles. Kqiku y cols.45, mediante un estudio in vitro compararon la exactitud de los métodos radiográficos y el localizador apical (Roo ZX) para la determinación de la longitud del conducto radicular, el cual obtuvieron una precisión de 93.34% y el 90%, mediante el localizador apical y el método radiográfico respectivamente; proporcionando ambos métodos un buen desempeño en la determinación de la longitud del conducto radicular. Sin embargo debemos tener presente que la radiografía proporciona una imagen bidimensional de una estructura tridimensional y es una técnica sensible, tanto en su exposición como en la interpretación. La radiografía preoperatoria es esencial en endodoncia para determinar la anatomía del sistema de conductos radiculares, el número y la curvatura de las raíces, la presencia o ausencia de enfermedad, y actuar como una guía inicial para la longitud de trabajo. Otra ventaja de tomar una radiografía con la longitud de trabajo, es la documentación de la medida que se ha llevado a cabo. El localizador de ápice electrónico es un instrumento, que se usa con las radiografías apropiadas, permitiendo una mayor precisión de la longitud de trabajo. Shafait y cols.46, determinaron en 50 dientes anteriores y premolares, las diferencias entre la longitud real de trabajo y la longitud de trabajo, con un localizador apical (Unidad de Elemento Diagnóstico- SybronEndo), radiografía digital y convencional. Con el localizador apical, no se revelo ninguna diferencia estadísticamente significativa entre ambas longitudes, en el 96% de los casos la longitud del conducto era ± 0,5 mm de longitud real de trabajo, a diferencia de la radiografía convencional y digital que mostraron una mayor desviación de la longitud real de trabajo y entre ambos métodos radiográficos no hubo diferencia significativa. Vieyra y cols.33, compararon la exactitud de la determinación de la longitud de trabajo in vivo, mediante cuatro (04) modelos de localizadores apicales (Root ZX, Elements Diagnostic, Precision AL, Raypex 5) y radiografías; el cual la medición de los cuatro localizadores fue más preciso que las radiografías; reduciendo el riesgo de la instrumentación y obturación más allá del foramen apical. No se reportó diferencia significativa entre los cuatro localizadores apicales. Sobre la base de los principios biológicos y mecánicos, la instrumentación y la obturación no debe extenderse más allá del foramen apical30. Y a pesar de la gran exactitud de los localizadores apicales para determinar la longitud de trabajo no debería ser utilizado para reemplazar la confirmación radiográfica de rutina43. Con el advenimiento de la tecnología, se ha utilizado los estudios tomográficos para determinar la longitud de trabajo, destacando que no se utiliza como una indicación. Solo en aquellos casos en los que ya están disponibles para el diagnóstico y plan de tratamiento; esto puede evitar incluso radiografías adicionales durante el tratamiento. Como se mencionó anteriormente las radiografías es una proyección bidimensional y sobrestima la longitud del conducto y los localizadores pueden dar una lectura errónea a ciertas condiciones del diente que no permiten la fiabilidad del mismo. Por el contrario los estudios tomográficos tienen el potencial de localizar el foramen apical y mostrar la anatomía del conducto radicular en 3 dimensiones. Janner y cols.47, realizaron un estudio piloto para evaluar la utilidad y precisión de la tomografía computarizada (CBCT) ya existentes, en la medición de la longitud de trabajo comparado con los procedimientos clínicos estándar (localizador apical y confirmación radiográfica), en cual encontraron una alta correlación entre ambos métodos, concluyendo que la CBCT puede ser útil para determinar la longitud de trabajo. En un estudio posterior, realizado por los mismos investigadores, en una muestra de 40 conductos radiculares, obtuvieron la misma conclusión, donde sugieren más estudios para evaluar si la CBCT podría remplazar a las radiografía periapicales iniciales y radiografía de longitud de trabajo48. Liang y cols.49, en un estudio in vitro en 162 dientes, determinaron la exactitud de la tomografía computarizada de haz cónico (CBCT) con un estándar de oro (medida real del diente, calibrado a 0.01mm del foramen apical). Y determinaron que la CBCT, arrojo un intervalo de confianza del 95%, solo el 4,5% sobrestimo la longitud del conducto.
INSTRUMENTACIÓN DEL TERCIO APICAL El objetivo de la preparación del conducto en apical es permitir la colocación y recambio de la solución irrigante, colocación de la medicación intraconducto y facilitar los procedimientos de obturación. Por otro lado, no debería ser tan amplia que debilite innecesariamente la estructura radicular y aumente el riesgo de fractura50. Walton y Torabinejad, citado por Wu51, recomendaron la instrumentación del tercio apical con tres instrumentos más grandes a partir de la primera lima que tenga fricción en el conducto a la longitud de trabajo. El enfoque de esta tendencia, es que la primera lima en tener fricción refleja el diámetro del conducto en apical y que mediante el uso de tres limas sucesivamente más grandes a la misma longitud de trabajo, es removido la dentina infectada de las paredes del conducto apical. Otro propósito de este enfoque es crear un tope apical (matriz apical) que supuestamente reduce la extrusión de material. Sin embargo, la utilización de limas sucesivamente más grande a la misma longitud de trabajo en conductos curvos predispone a laceraciones apicales o escalones. Además, puesto que muchos conductos son ovales, no está claro si la eliminación de la dentina es siempre posible. El concepto de la ampliación del conducto en apical de tres tamaños más grandes que la primera lima que tenga fricción no se basa en la evidencia. Yared y Dagher52,determinaron la influencia de la ampliación apical en una muestra de 60 dientes unirradiculares, el cual la mitad de la muestra se preparó con limas ISO#25 y la otra mitad con limas ISO#40 y con una medicación con hidróxido de calcio por una semana. No encontraron ninguna diferencia estadísticamente significativa, informaron que una lima #25 era tan eficiente como una lima # 40 para la reducción de microorganismos residuales. Parris y cols.53, demostraron la efectividad de la limpieza apical final, a través de una evaluación histológica y radiográfica, procedimiento que pretende preparar la porción final del ápice luego de la limpieza y conformación, mediante el empleo de limas de 2 a 4 veces más grandes que la lima apical inicial, con un movimiento de rotación en sentido de las agujas del reloj a la longitud de trabajo y con el conducto húmedo para luego ejercer nuevamente estos movimientos de rotación con una lima de diámetro mayor luego de la irrigación y secado de los conductos. Siqueira y cols.54, evaluaron mediante cinco técnicas de instrumentación (técnica paso atrás usando limas de acero, paso atrás usando limas de níquel-titanio, ultrasónica, de fuerzas balanceadas, y de canal master U) la efectividad de la limpieza del tercio apical en conductos mesiales de molares inferiores a través de la evaluación histológica. Los resultados no mostraron diferencias significativas entre las técnicas. Todas las técnicas fueron eficaces en la eliminación de tejido de los conductos; sin embargo, ninguno logró una completa eliminación de tejido, especialmente cuando se presentaban variaciones de la anatomía interna a nivel de tercio apical. Wu y Wesselink50, evaluaron la eficacia de tres técnicas (corono apical, paso atrás y fuerzas balanceadas) en la limpieza de la porción apical en 135 conductos radiculares curvos. Los resultados obtenidos indicaron que la porción apical del conducto contenía mayor cantidad de detritus en comparación a los tercios medio y coronal independientemente de la técnica utilizada. La técnica de fuerzas balanceadas produjo un mayor efecto de limpieza en la porción apical, probablemente, porque en esta técnica se utilizó una lima apical más grande (ISO #45) y también puede explicarse por el hecho de que una aguja calibre 27, corresponde con una lima #45, permitiendo una mejor irrigación. Siqueira y cols.55, evaluaron en 35 premolares inferiores, tres tipos de instrumentos (limas tipo K de NiTi; G.T y Profile), el cual todos fueron capaces de reducir significativamente el número de bacterias en el conducto radicular. La ampliación con una lima tipo K de NiTi 30/.02 fue significativamente más eficaz en la eliminación de bacterias en comparación con las limas G.T 20/.12, y sin una diferencia estadísticamente significativa con una lima Profile #5 (diámetro de la punta 0.279mm); sin embargo una lima tipo K de NiTi 40/.02 fue significativamente más eficaz en la eliminación de bacterias del conducto radicular cuando se compara con una lima Profile #5.Además de permitir un mayor intercambio del irrigante en el tercio apical. Wu y cols.51, determinaron si la primera lima que logra fricción a la longitud de trabajo, corresponde al diámetro del conducto radicular apical. El encajamiento de la lima ocurrió en el 75% de los casos cuando el instrumento contactaba con sólo un lado de la pared del conducto apical, y en el 25% restante de los casos ocurrió sin ningún contacto con la pared apical (Gráfico 12 y 13). En el 90% de los conductos, el diámetro del instrumento inicial era más pequeño que el diámetro menor del conducto. En consecuencia, el uso de la primera lima que se encaja para calibrar el diámetro del conducto apical, y como guía para el agrandamiento apical, no es fiable. Además queda incierto si la eliminación de la dentina en toda la circunferencia de la pared del conducto sea posible.
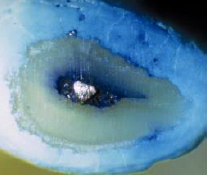
Gráfico 12: superficie radicular que muestra la forma triangular de una lima-K, que toca solo un lado del conducto. El diámetro de la lima es menor que el diámetro del conducto. Tomado de Wu y cols.2002
Gráfico 13: superficie radicular que muestra un instrumento Lightspeed modificado, que no tocó la pared del conducto y el área del conducto era mucho más grande que el área del instrumento. Tomado de Wu y cols.2002
Contreras y cols.56, compararon la primera lima que es colocada en el ápice, antes y después de la ampliación previa del conducto y determinaron que el ensanchamiento del tercio coronal y medio antes de la exploración del conducto, elimina interferencias y aumenta el tamaño de la lima inicial que encaja en el ápice (casi dos tamaños mas grandes). El ensachamiento previo proporciona al clínico un mejor sentido del tamaño del conducto apical, y permite tomar decisiones, acertadas del diámetro final necesario para la conformación y limpieza apical. Este estudio fue realizado en las raices mesiales de molares inferiores, donde el diámetro de los conductos es pequeño, donde comúnmente se realiza la ampliación apical con una lima #25 o #30. Sin embargo los resultados obtenidos en este estudio, indicaron que la primera lima que se encaja en apical, posterior al ensanchamiento del conducto fue una lima #25 o mayor. Si se considera que los conductos son mas ovales, sería apropiado agrandar al menos un par de limas de tamaños sucesivos. Tan y Messer57, compararon la calidad de la ampliación apical en conductos mesiovestibulares de molares mandibulares utilizando limas K de acero inoxidable e intrumentos rotarios de NiTi (LightSpeed). La muestra se dividio en 3 grupos con 10 especímenes. El grupo 1 y 2, se instrumentó con limas tipo K,con la técnica paso atrás, donde la lima apical maestra se determinó de acuerdo a los criterios de Grossman (tres instrumentos más grandes, a partir de la primera lima que lográ fricción a la longitud de trabajo) sin ensanchamiento y con ensanchamiento previo respectivamente y el grupo 3 se preparó con LightSpeed (LS) y la lima apical maestra se determinó de acuerdo a las recomendaciones del fabricante. Encontraron que el ensanchamiento previo parecía tener un efecto sobre el tamaño inicial de la lima apical, las limas K registraron un tamaño más grande después del ensanchamiento en comparación con los conductos donde no se realizo y los instrumentos LS registraron cerca de dos tamaños de lima más grande que las limas K. Ninguna de las tres técnicas fue totalmente eficaz en la limpieza del espacio del conducto apical; sin embargo con LS, obtuvieron un mayor ensanchamiento apical, conductos significativamente más limpios, menos transporte apical, y una mejor forma del conducto en comparación con los otros dos grupos. La ampliación apical en conductos estrechos, depende de: diseño del instrumento, propiedades de la aleación, grado de curvatura del conducto y experiencia del clínico. Barbizam y cols58, en un estudio in vitro del tecio apical de conductos radiculares aplanados, encontraron que las dos técnicas de preparación empleada no fue capaz de limpiar completamente las paredes a nivel del tercio apical; sin embargo la preparación manual circunferenial con lima K 40/.02 en apical, mostró mayor efectividad que la instrumentación con limas Profile 40/.04. Usman y cols.59, evaluaron histologicamente la eficacia del debridamiento en el tercio apical, de conductos instrumentados con limas de gran taper (GT) #20 y #40; con muestras seccionadas a 0,5 mm, 1,5 mm, 2,5 mm desde el vértice apical. No encontraron diferencias entre cada nivel para cada grupo, sin embago el grupo GT 20, contenia significativamente mas detritus en comprarcion con el grupo GT40. Concluyeron que la limpieza apical se podría predecir principamente por el tamaño del instrumento y en menor medida por la longitud del conducto. No fue probable explicar las diferencias en el debridamiento, en relación a el volumen del irrigante, el número de cambios del instrumento y la profundidad de penetración de la aguja de irrigación.A pesar de que los conductos preparados con GT40, permitieron que la aguja de irrigación calibre 27 se moviera pasivamente en el conducto a la longitud de trabajo en un 94%, a diferencia del grupo GT20 (76,6%). Jou y cols.22, expresaron que para la limpieza y conformación del sistema de conducto radicular, el clínico debe determinar tres parámetros: longitud del conducto, conicidad de la preparación y la dimensión horizontal de la preparación en su punto más apical, también conocida como tamaño de la lima apical inicial. El método más común para decidir el tamaño de la preparación apical , es determinar primero el diámetro del conducto, a través de instrumentos consecutivamente más grandes que lleguen a la longitud de trabajo. Esta estimación de la lima apical inicial, se conoce como la determinación de la mínima dimensión horizontal inicial a la longitud de trabajo. Algunos autores sugieren, preparar el tercio apical con tres instrumentos siguientes a la lima apical inicial, denominada lima apical maestra (máxima dimensión horizontal final a la longitud de trabajo). Hay factores que influyen en la determinación de la dimensión mínima horizontal inicial a la longitud de trabajo (forma del conducto, longitud, irregularidades, curvatura, contenido del conducto y el instrumento utilizado también pueden influir en el resultado porque cada uno puede afectar la percepción táctil del clínico). La combinación de estos factores hace que la determinación correcta de la dimensión horizontal inicial sea muy difícil y hasta imposible, por lo que la comprensión de estos factores pueden reducir al mínimo la subestimación de la misma. Antes de determinar la lima apical inicial, sugirieron ensanchar los conductos en sentido corono apical, para asegurar una irrigación efectiva y minimizar cualquier interferencia. Una preparación circunferencial, puede reducir al mínimo los casos de limpieza incompleta del sistema del conducto radicular, sobre todo en los conductos ovalados, avalados largos y aplanados. La mayoría de los instrumentos rotatorios de NiTi proporcionan una preparación del conducto relativamente de forma circular, sin embargo su uso indiscriminado puede dar lugar a una limpieza incompleta y conducir al fracaso de la terapia endodóntica. De esta manera en los conductos de forma circular puede ser muy fácil su determinación, ya que ambos diámetros son iguales; sin embargo en los conductos ovalados, ovalados largos y aplanados seleccionar el instrumento correcto y la sensación táctil no es fácil. Khademi y cols.60 determinaron la ampliación mínima del conducto en el tercio apical para la eliminación de la capa de detritus. Obtuvieron como resultado que la instrumentación mínima para la penetración adecuada del irrigante al tercio apical era con una lima #30; por lo cual no parece necesario eliminar mas tejido en el tercio apical, cuando se ha obtenido un adecuado acceso corono apical. Mickel y cols.61, compararon el tamaño de las limas que llegan al ápice antes y posterior a la preparacion corono apical y determinaron la carga bacteriana en relación al tamaño apical. Las limas posterior al ensanchamiento previo de los conductos revelo ser en promedio hasta 4 limas mas grande que las que utilizaron previo al ensanchamiento. En todas las muestras, el tamaño apical y ensanchamiento apical fueron mayores que limas # 30. Contrariamente a otros estudios los recuentos bacterianos registrados fueron mayor en las preparaciones ISO 60, el cual pudo ser debido a la distribución desigual de las muestras. Paqué y cols.62, evaluaron mediante tomografía computarizada los últimos 4mm apicales de 60 molares superiores, que fueron escaneados antes y después de la conformación del conducto con FlexMaster, GT,Lightspeed, ProFile, Protaper y limas NiTi manuales. La preparación apical fue de un tamaño # 40 en los conductos mesiovestibular y distovestibular y # 45 en los conductos palatinos, a excepción de GT (# 20) y ProTaper (# 25 en mesiovestibular y distovestibular y # 30 en los conductos palatinos). Los conductos preparados con instrumentos GT a un tamaño apical # 20 dejaron mayor superficie del conducto sin tocar, lo que podría afectar la capacidad de desinfección de los conductos radiculares de los molares superiores. ElAyouti y cols.63, evaluaron el ensanchamineto apical bajo tomografía microcomputarizada, en 90 conductos mesiales curvos de molares, a 1 mm de la longitud de trabajo, preparados con limas manuales de NiTi, Mtwo y Protaper, con una preparacion final ISO 50. Ninguna de las 3 técnicas proporcionó una preparación completa del contorno del conducto, además produjo una eliminación innecesaria de dentina, el cual fue significativamente mayor en limas Protaper . En general, los estudios apoyan que la mayor preparacion apical reduce la carga barteriana y se obtienen conductos más limpios que pueden promover un mayor éxito. El no poder limpiar los conductos, especialmente en la región apical, puede resultar en el fracaso del tratamiento.
LIMITE APICAL DE LA OBTURACIÓN El objetivo de la obturación es crear un sellado hermético a lo largo de la longitud del sistema del conducto radicular desde la abertura coronal hasta la terminación apical. Grove64 en 1930, indicó que el punto adecuado para la obturación de los conductos radiculares debe ser hasta la unión cemento dentinaria, de esta manera no será posible que las bacterias presentes en la dentina puedan invadir el tejido periapical; pero si la obturación no logra llegar a este punto, las bacterias presentes en los túbulos tendrá una apertura para llegar al tejido periapical. Seltzer y colaboradores65, en un estudio in vivo, en 34 dientes anteriores humanos y en 32 raíces de dientes de monos, compararon la reacción de los tejidos periapicales a una instrumentación corta con respecto al ápice y obturados 25 dientes humanos y 22 raíces de dientes de mono con una obturación corta y el resto de la muestra de ambos grupos fue obturado más allá del ápice. Inicialmente las reacciones de los tejidos periapicales fueron similares en ambos grupos, generándose una respuesta inflamatoria aguda en el tejido pulpar apical y tejido periapical, que fue sustituida gradualmente por una inflamación crónica. En ambos grupos, la inflamación periapical fue acompañado por resorción ósea alveolar y en el extremo de la raíz. En un período de 3 a 6 meses, en la mayoría de los dientes, las resorciones fueron reparadas por cemento secundario y elaboración de hueso. De 6 a 12 meses posterior al tratamiento, se observó una completa reparación en el grupo con obturaciones cortas con respecto al ápice, mientras que la reparación se retrasó en el grupo en el cual se produjo la sobreobturación, en este grupo hubo una mayor tendencia a la proliferación de restos celulares de Malassez. Concluyeron que en la extirpación de casos de pulpa vital, obtuvieron un resultado óptimo en cuanto a la reparación de los tejidos, cuando los conductos fueron instrumentados y obturados cortos al ápice de los dientes. En otro estudio realizado por los mismos investigadores66, en dientes humanos y en monos, contrariamente evaluaron la reacción de los tejidos periapicales, en conductos instrumentados de 2-10mm más allá del ápice, con una obturación corta y otro grupo obturado más allá del ápice. Encontraron que en todas las muestras, se produjo una respuesta inflamatoria periapical. Cuando los conductos fueron obturados cortos con respecto al ápice, las reacciones tendieron a desaparecer dentro de los 3 meses y finalmente ocurrió una reparación completa; sin embargo en los dientes sobreobturados, exhibieron una inflamación crónica persistente con una mayor tendencia a la formación de quistes. Concluyendo, que el sistema de defensa de los tejidos periapicales, aparentemente son capaces de superar los efectos de la instrumentación, pero los cementos y materiales de obturación en los tejidos periapicales causan una inflamación persistente. Swartz y cols.67 analizaron 1.007 dientes tratados endodónticamente durante un período de 20 años y se encontró una tasa de éxito del 87,75%, y observaron que los especímenes sobreobturados tuvieron aproximadamente una tasa de fracaso 4 veces mayor de aquéllos en donde el nivel de la obturación era corta en relación al ápice radiográfico. Al-Nazhan68, evaluaron radiográficamente y microscópicamente, el nivel de obturación apical, a 0,5mm y 1,0-1,5mm del ápice radiográfico. Los resultados mostraron una extrusión del material de obturación, cuando se obtura a nivel del ápice radiográfico o a 0,5mm de este. Mientras que la obturación a 1,0-1,5 mm del ápice radiográfico mostró una posición aceptable microscópicamente. (Gráfico 14)
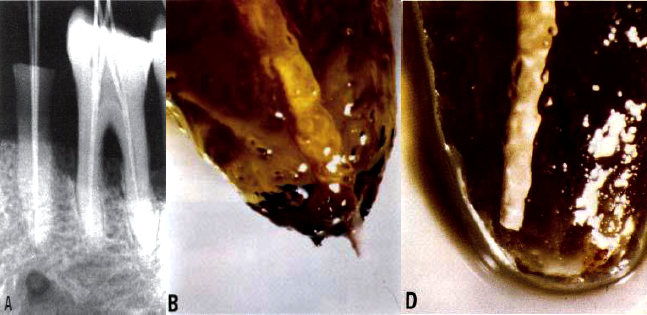
Gráfico 14: Radiografía periapical de dos dientes tratados (A). El segundo premolar muestra obturación a nivel del ápice radiográfico. La raíz mesial del primer molar muestra una obturación a 1,0 mm del ápice radiográfico. (B) Ápice del segundo, nótese la extrusión del material de obturación (gutapercha). (D) ápice de la raíz mesial, mostrando la obturación con gutapercha en el interior del conducto. Tomado de: Al-Nazhan y cols., 1994.
Sjögren y cols. 69, en un estudio retrospectivo investigaron la influencia del nivel de la obturación apical en el resultado del tratamiento, una obturación del conducto radicular fue considerado satisfactorio, entre otros factores, cuando el nivel apical fue de 0-2mm del ápice radiográfico; este nivel apical contribuyó a tasas más altas de éxito (94%). Ricucci y Langeland25, evaluaron el limite apical de la instrumentación y obturación, y demostraron que las condiciones histológicos más favorables fue cuando la instrumentación y obturación se mantuvo en o por debajo de la constricción apical, tanto en pulpas vitales o necróticas. El peor pronóstico se obtuvo cuando la instrumentación y obturación se extendió más allá de la constricción apical. Cuando el sellador y la gutapercha fueron extruidos hacia los tejidos periapicales, conductos laterales y ramificaciones apicales, hubo siempre una reacción inflamatoria severa a cuerpo extraño con ausencia clínica de dolor. El segundo peor pronóstico lo atribuyen a una obturación 2 mm corta de la constricción, combinadas con una pobre instrumentación y obturación. Villegas y cols.70, obtuvieron una mejor adaptación de la gutapercha en las paredes del tercio apical del conducto, cuando utilizaron el System B® a 1mm de la longitud de trabajo hasta lograr una obturación de los 3 mm apicales. Sin embargo, este método es clínicamente aplicable a conductos relativamente cortos y amplios. Los conductos utilizados en este estudio, eran amplios (lima apical ISO # 45) y corto (12 mm). Schilder15, expreso que la obturación del conducto radicular hasta la constricción apical, supone no tener incidencia sobre los tejidos periapicales y promueve al cierre fisiológica eventual del conducto radicular con cemento. Sin embargo refirió también que muchos especialistas prefieren obturar hasta al ápice radiográfico, el cual las obturaciones realizadas a este punto pueden acercarse más al 100% de la obturación del sistema de conductos radiculares, pero son probablemente sobreobturados en la mayoría de los casos. Innumerables dientes han sido tratados con éxito a este punto, lo que indica el alto grado de tolerancia de los tejidos periodontales a los materiales de obturación. Suzuki y cols.71, analizaron la reacción tisular de conductos radiculares obturados con gutapercha y cemento sellador endometazona cortos o más allá del ápice. Ninguno de los límites de obturación propuestos para el tratamiento usando endometasona representó un éxito completo en el mantenimiento de la normalidad de los tejidos periapicales dentro de un período de evaluación relativamente corto (90 días). Independientemente del límite apical de la obturación, se observó un infiltrado inflamatorio crónico, siendo más severo en el grupo donde ocurrió la sobreobturación. Ricucci y cols.72, evaluaron en un estudio retrospectivo la extrusión apical de cementos selladores, en relación al destino de los mismos y su influencia en el resultado del tratamiento. El control postoperatorio a los 4 años, se observó radiográficamente la eliminación total de los selladores Pulp Canal Sealer, Tubli-Seal y endometasona, a diferencia del AH Plus y Apexit. En cuanto a la influencia en el resultado del tratamiento, no hubo diferencias estadísticamente significativas entre los selladores, el 79% de los dientes con periodontitis apical preoperatoria se curaron en comparación con el 100% de los dientes sin periodontitis apical.
CONCLUSIONES 1. Un profundo conocimiento de la morfología
del conducto radicular es esencial para el
éxito del tratamiento de conducto. 2. El tercio apical, es una estructura irregular y
variable, el cual representa un desafío para
el profesional. 3. La unión cemento dentinaria, la
constricción apical, y el foramen apical son
los principales puntos de referencia utilizados
para determinar el límite apical para la
instrumentación y obturación. 4. La longitud de trabajo, es subestimada a
través del método
radiográfico, por lo que se debe incorporar
la utilización del localizador apical para
tratamientos más predecibles. Si se dispone
de la tomografía volumétrica
computarizada debe ser aprovechada para la
determinación de la misma. 5. La ampliación del tercio coronal y medio,
facilita la determinación de la lima apical
inicial 6. De acuerdo a los principios biológicos y
mecánicos, la instrumentación y
obturación no debe extenderse más
allá del foramen apical. 7. El tamaño apical final de la
preparación deberá determinarse de
forma individual para cada conducto. 8. Ninguna técnica de preparación es
capaz de limpiar por completo las paredes del
conducto a nivel del tercio apical.
REFERENCIAS BIBLIOGRÁFICAS 1. Samuel S. ENDODONCIA Consideraciones
Biológicas En los Procedimientos
Endodónticos.; 1979. 2. Kenneth Hargreaves Y Cohen Stephen. Vías
de La Pulpa. Editorial Elsevier Mosby.
Décima Edición. 2011.; 2011. 3. Peter AS. Histología Y
Embriología. 2a ed. (Panamericana. EM,
ed.).; 1981. 4. Seltzer S, Soltanoff W, Smith J. Biologic
aspects of endodontics. I. Histologic observations
of the anatomy and morphology of root apices and
surronding structures. Oral Surgery, Oral Med Oral
Pathol. 1973;36(5):725-737. 5. Marion D, Jean A, Hamel H, Kerebel LM, Kerebel
B. Scanning electron microscopic study of
odontoblasts and circumpulpal dentin in a human
tooth. Oral Surg Oral Med Oral Pathol.
1991;72(4):473-478. 6. Fogel HM, Marshall FJ, Pashley DH. Effects of
distance from the pulp and thickness on the
hydraulic conductance of human radicular dentin. J
Dent Res. 1988;67(11):1381-1385. 7. Mjör I a., Nordahl I. The density and
branching of dentinal tubules in human teeth. Arch
Oral Biol. 1996;41(5):401-412. 8. Mjör IA, Smith MR, Ferrari M, Mannocci F.
The structure of dentine in the apical region of
human teeth. Int Endod J. 2001;34(5):346-353. 9. Lo Giudice G, Cutroneo G, Centofanti A, et al.
Dentin Morphology of Root Canal Surface: A
Quantitative Evaluation Based on a Scanning
Electronic Microscopy Study. Biomed Res Int.
2015;2015:1-7. 10. Solheim T. Dental cementum apposition as an
indicator of age. Scand J Dent Res.
1990;98(6):510-519. 11. Kuttler Y. Microscopic investigation of root
apices. J Am Dent Assoc. 1955;50:544-552. 12. B. Zander HH. Continuos cementum apposition. J
Dent Res. 1958;37:1035. 13. Ponce EH, Vilar Fernández JA. The
cemento-dentino-canal junction, the apical foramen,
and the apical constriction: evaluation by optical
microscopy. J Endod. 2003;29(3):214-219. 14. Saad AY, Al-Yahya a. S. The location of the
cementodentinal junction in single-rooted
mandibular first premolars from Egyptian and Saudi
patients: A histological study. Int Endod J.
2003;36(8):541-544. 15. Schilder H, Hargreaves KM. Filling root canals
in three dimensions. J Endod.
2006;32(4):281-290. 16. Stein TJ, Corcoran JF. Anatomy of the root apex
and its histologic changes with age. Oral surgery,
oral Med oral Pathol. 1990;69(2):238-242. 17. AAE. Glossary of Endodontic Term.
http://www.aae.org/publications-and-research/glossaries-and-guides/glossaries.
2012. 18. Blaskovi?-Subat V, Marici? B, Sutalo J.
Asymmetry of the root canal foramen. Int Endod J.
1992;25:158-164. 19. Gutierrez JH, Aguayo P. Apical foraminal
openings in human teeth. Number and location. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod.
1995;79(6):769-777. 20. Martos J, Ferrer-Luque CM,
González-Rodríguez MP, Castro LAS.
Topographical evaluation of the major apical
foramen in permanent human teeth. Int Endod J.
2009;42(4):329-334. 21. Briseño MB; El-Sayed
M;Willershausen-Zönnchen B. Morphology of the
Physiological Apical Foramen in Maxillary and
Mandibular First Molars. J Endod.
2004;30(5):321-328. 22. Jou YT, Karabucak B, Levin J, Liu D. Endodontic
working width: Current concepts and techniques.
Dent Clin North Am. 2004;48(1):323-335.
doi:10.1016/j.cden.2003.12.006. 23. De Deus QD, Horizonte B. Frequency, location,
and direction of the lateral, secondary, and
accessory canals. J Endod. 1975;1(11):361-366. 24. Hess JC, Culieras MJ, Lambiable N. A scanning
electron microscopic investigation of principal and
accessory foramina on the root surfaces of human
teeth: thoughts about endodontic pathology and
therapeutics. J Endod. 1983;9(7):275-281. 25. Ricucci D, Langeland K. Apical limit of root
canal instrumentation and obturation, part 2. A
histological study. Int Endod J.
1998;31(6):394-409.
doi:10.1046/j.1365-2591.1998.00184.x. 26. ElAyouti A, Hülber-J M, Judenhofer MS, et
al. Apical constriction: location and dimensions in
molars-a micro-computed tomography study. J Endod.
2014;40(8):1095-1099.
doi:10.1016/j.joen.2013.12.002. 27. Herrera M, Ábalos C, Planas AJ, Llamas R.
Influence of Apical Constriction Diameter on Root
ZX Apex Locator Precision. J Endod.
2007;33(8):995-998.
doi:10.1016/j.joen.2007.05.009. 28. Dummer PM, McGinn JH, Rees DG. The position and
topography of the apical canal constriction and
apical foramen. Int Endod J. 1984;17(4):192-198.
doi:10.1111/j.1365-2591.1984.tb00404.x. 29. Hassanien EE, Hashem A, Chalfin H.
Histomorphometric Study of the Root Apex of
Mandibular Premolar Teeth: An Attempt to Correlate
Working Length Measured with Electronic and
Radiograph Methods to Various Anatomic Positions in
the Apical Portion of the Canal. J Endod.
2008;34(4):408-412.
doi:10.1016/j.joen.2007.12.013. 30. Wu MK, Wesselink PR, Walton RE. Apical terminus
location of root canal treatment procedures. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod.
2000;89(1):99-103. 31. Marceliano-Alves M, Alves FRF, Mendes D de M,
Provenzano JC. Micro&endash;Computed Tomography
Analysis of the Root Canal Morphology of Palatal
Roots of Maxillary First Molars. J Endod. 2015:1-4.
doi:10.1016/j.joen.2015.10.016. 32. M. P. J. Gordon & N. P. Chandler. Electronic
apex locators. Int Endod J. 2004;37:425-437.
doi:10.1016/j.denabs.2010.02.011. 33. Vieyra JP, Acosta J. Comparison of working
length determination with radiographs and four
electronic apex locators. Int Endod J.
2011;44(6):510-518.
doi:10.1111/j.1365-2591.2011.01855.x. 34. Ushiyama J. New Principle and Method for
Measuring the Root Canal Length.
1983;9(3):97-104. 35. Ebrahim AK, Wadachi R, Suda H. Electronic apex
locators - A review. J Med Dent Sci.
2007;54(3):125-136. 36. Fouad a F, Reid LC. Effect of using electronic
apex locators on selected endodontic treatment
parameters. J Endod. 2000;26(6):364-367.
doi:10.1097/00004770-200006000-00013. 37. Kim E, Lee SJ. Electronic apex locator. Dent
Clin North Am. 2004;48(1):35-54.
doi:10.1016/j.cden.2003.10.005. 38. Stein TJ, Corcoran JF. Radiographic "working
length" revisited. Oral Surg Oral Med Oral Pathol.
1992;74(6):796-800. 39. Seltzer S, Soltanoff W, Sinai I, Goldenberg A,
Bender IB. Biologic aspects of endodontics. III.
Periapical tissue reactions to root canal
instrumentation. Oral Surg Oral Med Oral Pathol.
1968;26(5):694-705. doi:00004770-200407000-00008
[pii]. 40. Ricucci D. Apical limit of root canal
instrumentation and obturation, part 1. Literature
review. Int Endod J. 1998;31:384-393. 41. ElAyouti a, Weiger R, Löst C. Frequency of
overinstrumentation with an acceptable radiographic
working length. J Endod. 2001;27(1):49-52. 42. ElAyouti A, Weiger R, Löst C. The ability
of root ZX apex locator to reduce the frequency of
overestimated radiographic working length. J Endod.
2002;28(2):116-119. 43. NGUYEN, H. Q., KAUFMAN, A. Y., KOMOROWSKI, R. C.
and FRIEDMAN S. Electronic length measurement using
small and large files in enlarged canals. Int Endod
J. 1996;26(6):359-364. 44. OLSON, A. K., GOERING, A. C., CAVATAIO, R. E.
and LUCIANO J. The ability of the radiograph to
determine the location of the apical foramen. Int
Endod Journal,. 2007;24(1):28-35. 45. Kqiku L SP. Radiographic versus electronic root
canal working length determination. ind.
2011;22:777-780.
doi:10.1007/s13398-014-0173-7.2. 46. Khateeb SU, Rudra Kaul, Kumar A, Bukhari SS.
Comparative study for determination of Root Canal
working length accuracy by different methods
&endash; An In Vivo/ In Vitro study. Int J Clin
Cases Investig. 2013;4(4):39-50.
doi:10.1007/s13398-014-0173-7.2. 47. Janner SFM, Jeger FB, Lussi A, Bornstein MM.
Precision of endodontic working length
measurements: A pilot investigation comparing
cone-beam computed tomography scanning with
standard measurement techniques. J Endod.
2011;37(8):1046-1051.
doi:10.1016/j.joen.2011.05.005. 48. Jeger FB, Janner SFM, Bornstein MM, Lussi A.
Endodontic working length measurement with
preexisting cone-beam computed tomography scanning:
A prospective, controlled clinical study. J Endod.
2012;38(7):884-888.
doi:10.1016/j.joen.2012.03.024. 49. Liang YH, Jiang L, Chen C, et al. The validity
of cone-beam computed tomography in measuring root
canal length using a gold standard. J Endod.
2013;39(12):1607-1610.
doi:10.1016/j.joen.2013.08.001. 50. Wu MK, Wesselink PR. Efficacy of three
techniques in cleaning the apical portion of curved
root canals. Oral Surgery, Oral Med Oral Pathol
Oral Radiol. 1995;79(4):492-496.
doi:10.1016/S1079-2104(05)80134-9. 51 Wu MK, Barkis D, Roris A, Wesselink PR. Does the
first file to bind correspond to the diameter of
the canal in the apical region? Int Endod J.
2002;35(3):264-267.
doi:10.1046/j.1365-2591.2002.00474.x. 52. Yared GM, Bou Dagher FE. Influence of apical
enlargement on bacterial infection during treatment
of apical periodontitis. J Endod.
1994;20(11):535-537.
doi:10.1016/S0099-2399(06)80067-1. 53. Parris J, Wilcox L, Walton R. Effectiveness of
apical clearing: Histological and radiographical
evaluation. J Endod. 1994;20(5):219-224.
doi:10.1016/S0099-2399(06)80281-5. 54. Siqueira JF, Araújo MC, Garcia PF, Fraga
RC, Dantas CJ. Histological evaluation of the
effectiveness of five instrumentation techniques
for cleaning the apical third of root canals. J
Endod. 1997;23(8):499-502.
doi:10.1016/S0099-2399(97)80309-3. 55. Siqueira JF, Lima KC, Magalhães FA, Lopes
HP, de Uzeda M. Mechanical reduction of the
bacterial population in the root canal by three
instrumentation techniques. J Endod.
1999;25(5):332-335.
doi:10.1016/S0099-2399(06)81166-0. 56. Contreras M a, Zinman EH, Kaplan SK. Comparison
of the first file that fits at the apex, before and
after early flaring. J Endod. 2001;27(12):113-116.
doi:10.1097/00004770-200102000-00014. 57. Tan BT, Messer HH. The quality of apical canal
preparation using hand and rotary instruments with
specific criteria for enlargement based on initial
apical file size. J Endod. 2002;28(9):658-664.
doi:10.1097/00004770-200209000-00008. 58. Barbizam JVB, Fariniuk LF, Marchesan MA, Pecora
JD, Sousa-Neto MD. Effectiveness of manual and
rotary instrumentation techniques for cleaning
flattened root canals. J Endod. 2002;28:365-366.
doi:10.1097/00004770-200205000-00004. 59. Usman N, Baumgartner JC, Marshall JG. Influence
of instrument size on root canal debridement. J
Endod. 2004;30(2):110-112.
doi:10.1097/00004770-200402000-00012. 60. Khademi A, Yazdizadeh M, Feizianfard M.
Determination of the Minimum Instrumentation Size
for Penetration of Irrigants to the Apical Third of
Root Canal Systems. J Endod. 2006;32(5):417-420.
doi:10.1016/j.joen.2005.11.008. 61. Mickel AK, Chogle S, Liddle J, Huffaker K, Jones
JJ. The Role of Apical Size Determination and
Enlargement in the Reduction of Intracanal
Bacteria. J Endod. 2007;33(1):21-23.
doi:10.1016/j.joen.2006.08.004. 62. Paqué F, Ganahl D, Peters OA. Effects of
Root Canal Preparation on Apical Geometry Assessed
by Micro-Computed Tomography. J Endod.
2009;35(7):1056-1059.
doi:10.1016/j.joen.2009.04.020. 63. Elayouti A, Dima E, Judenhofer MS, Löst C,
Pichler BJ. Increased apical enlargement
contributes to excessive dentin removal in curved
root canals: A stepwise microcomputed tomography
study. J Endod. 2011;37(11):1580-1584.
doi:10.1016/j.joen.2011.08.019. 64. Grove CJ. Why Root Canals should be Filled to
the Dentinocemental Junction. J Am Dent Assoc.
1930;17(2):293-296.
doi:10.14219/jada.archive.1930.0049. 65. Seltzer S, Soltanoff W, Smith J. Biologic
aspects of endodontics. IV. Periapical tissue
reactions to root-filled teeth whose canla had been
instrumented short of their apices. Oral Surgery,
Oral Med Oral Pathol. 1969;28(5):724-737.
doi:10.1016/0030-4220(73)90146-1. 66. Seltzer S, Soltanoff W, Smith J. Biologic
aspects of endodontics. V. periapical tissue
reactions to root canal instrumentation beyond the
apex and root canal fillings short of and beyond
the apex. Oral Surgery, Oral Med Oral
Pathol.1973;36(5):725-737.
doi:10.1016/0030-4220(73)90146-1. 67. Swartz DB, Skidmore AE, Griffin JA. Twenty years
of endodontic success and failure. J Endod.
1983;9(5):198-202.
doi:10.1016/S0099-2399(83)80092-2. 68. Al-nazhan SA, Al-jarrah A, Al-ali T. THE
RELATIONSHIP OF APICAL OBTURATION LEVEL.
1994;6(3):156-159. 69. Sjogren U, Hagglund B, Sundqvist G, Wing K.
Factors affecting the long-term results of
endodontic treatment. J Endod. 1990;16(10):498-504.
doi:10.1016/S0099-2399(07)80180-4. 70. Villegas JC, Yoshioka T, Kobayashi C, Suda H.
Three-step versus single-step use of system B:
evaluation of gutta-percha root canal fillings and
their adaptation to the canal walls. J Endod.
2004;30(10):719-721.
doi:10.1097/01.DON.0000129961.58129.E6. 71. Suzuki P, Souza V De, Holland R, et al. Tissue
reaction to Endométhasone sealer in root
canal fillings short of or beyond the apical
foramen. J Appl Oral Sci. 2011;19(1990):511-516.
doi:10.1590/S1678-77572011000500013. 72. Ricucci D, Rôças IN, Alves FRF,
Loghin S, Siqueira JF. Apically Extruded Sealers:
Fate and Influence on Treatment Outcome. J Endod.
2016;42(2):243-249.
doi:10.1016/j.joen.2015.11.020. 73. Sinai I., Seltzer S., Soltanoff W. GA. Biologic
aspects of endodontics. II. Periapical tissue
reactions to pulp extirpation. Oral Surg Oral Med
Oral Pathol. 1967;23(65):664-678.
Invitados Anteriores y sus Trabajos
¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||