|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
"Manejo Clínico del Tercio Apical en la Terapia Endodóncica Convencional" por Maria Teresa Bellera O. Odontólogo, Universidad de Carabobo, Venezuela, 2000 Especialista en Endodoncia, U.C.V., Venezuela, 2002-2004 e-mail: mbellera@hotmail.com
Introducción Uno de los principales objetivos de la terapia endodóncica se basa en el establecimiento de un adecuado diagnóstico y una correcta selección de caso, fundamentados en la concepción de los aspectos biológicos, los cuales, alternados con la tecnología, puntualizan las bases para el correcto desenvolvimiento del tratamiento a seguir según los requerimientos de cada entidad en particular. Desde el punto de vista clínico, son muchos los factores que influyen en el éxito del tratamiento. El tercio apical, constituye una de las principales consideraciones endodóncicas que ha requerido mayor atención por parte de investigadores y clínicos debido a la complejidad anatómica que caracteriza esta región, lo que representa, en la mayoría de los casos, un inconveniente para el operador. El objetivo de este trabajo es describir el manejo clínico del tercio apical durante la terapia endodóncica convencional, considerando la importancia de los aspectos biológicos y mecánicos, así como la influencia de nuevos conceptos y consideraciones en el manejo de esta zona.
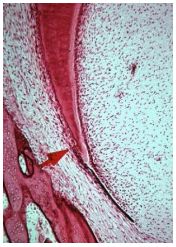
Aspectos Histológicos y Anatómicos del Tercio Apical Desarrollo y formación de la raíz Los estadios del desarrollo radicular y los tipos de tejido presentes en el ápice, son temas de gran relevancia para el endodoncista, ya que estos se encuentran íntimamente relacionados con los aspectos histológicos del tercio apical, los cuales se evidencian desde el mismo momento en que el órgano dental forma a partir de las células cilíndricas del epitelio dental interno y células cúbicas del epitelio dental externo, la vaina radicular epitelial de Hertwig, estructura responsable de la formación de la raíz dentaria.(16,92,112,114) Esta determinará el tamaño y la forma de la raíz o raíces del diente. Posteriormente, las células de la capa interna inducen la diferenciación de las células del tejido conjuntivo hacia odontoblastos y se deposita la primera capa de dentina.(17) La diferenciación de los odontoblastos y la formación de dentina siguen al alargamiento de la vaina radicular. Al mismo tiempo, el tejido conjuntivo del saco dentario que la rodea, prolifera y divide a la capa epitelial en una malla de bandas continuas (113,115) Una vez formada la vaina radicular epitelial de Hertwig, se inicia rápidamente la formación de la raíz y luego se fragmenta. Posteriormente, la corona del diente comienza a crecer y se aleja de la base ósea de la cripta, y la vaina se halla en realidad creciendo dentro del maxilar inferior. Debido a los cambios establecidos por el crecimiento, esta estructura se estira, aunque hay división celular dentro de ella; luego se fragmenta para formar una red fenestrada alrededor del diente.(74) (Gráfico 1) Tan pronto como se mineraliza la primera capa de la matriz de la dentina, las células mesenquimáticas del saco dental se mueven hasta hacer contacto con la dentina recién formada. Estas células se diferencian en cementoblastos y depositan la matriz del cemento en la dentina radicular.(17) Al completarse la formación de la raíz, la vaina radicular se dobla finalmente hacia adentro en cada lado para formar el diafragma epitelial. Esta estructura marca el límite más inferior de la raíz y envuelve el agujero apical primario, que es la abertura por la que entran y salen nervios y vasos sanguíneos de la cámara pulpar.(93)
Ocasionalmente, las células de la vaina radicular quedan adheridas a la superficie dentinaria, y se pueden diferenciar hacia ameloblastos completamente funcionales a nivel de las regiones cervicales y en las furcaciones de la raíz, dando como resultado la formación de "perlas del esmalte". Así mismo, si se rompe la continuidad de la vaina o si esta no se establece antes de la formación de la dentina, sobreviene un defecto en la pared dentinaria de la pulpa. Tales defectos se encuentran en el piso pulpar correspondiente a la bifurcación o en cualquier punto de la raíz si la fusión de las extensiones horizontales del diafragma se conserva incompleta. Esto explica el desarrollo de conductos radiculares accesorios sobre la superficie periodontal de la raíz.(95) El remanente epitelial no desaparece por completo al comenzar la dentinogénesis. Algunas de estas células permanecen en el ligamento periodontal, siendo conocidas como "Restos epiteliales de Malassez"; los cuales persisten cercanos a la superficie radicular y se presentan como fuente de revestimiento de los quistes periapicales (radiculares) que se forman como reacción a la inflamación crónica de la pulpa o tejido subyacente. Es interesante hacer notar que en cortes longitudinales los restos aparecen como grupos aislados de células, pero en cortes tangenciales aparecen como una red fenestrada casi continua.(17,74,93,95,113) (Gráfico 2) Ten Cate(113) demostró por métodos histoquímicos, que los restos epiteliales contienen enzimas oxidativas específicas, así como también la presencia de glicógeno dentro de estos restos celulares. La Interpretación de la presencia de tales sustancias indica un metabolismo que requiere poca energía. Así se descuenta la funcionalidad de estos restos en el ligamento periodontal adulto.
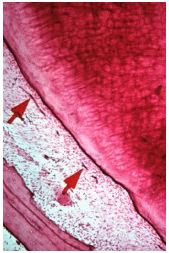
Aspectos histológicos de las estructuras que conforman el tercio apical Tejido pulpar apical : El tejido pulpar apical difiere en su estructura del tejido pulpar coronario; este último se compone principalmente de tejido conectivo celular y escasas fibras colágenas; mientras que el tejido pulpar apical es más fibroso y contiene menos células.(93) En el área cercana al foramen apical, los odontoblastos aparecen como una capa de células planas, a diferencia de la porción coronal de una pulpa joven, donde los odontoblastos adoptan una forma columnar alta, cuyo cuerpo mide 35Um aproximadamente. Del mismo modo, se evidencian menos túbulos dentinarios por unidad de área en la raíz que en la corona del diente, y los cuerpos celulares de los odontoblastos son menos compactos y pueden extenderse lateralmente.(17,93) De manera similar, la capa odontoblástica de la pulpa muestra variaciones de la corona al ápice. Los odontoblastos varían de aspecto; el citoplasma suele ensancharse y ser mas conspicuo en la zona apical que en la zona coronaria.(17) Histoquimicamente, se evidencian grandes concentraciones de glicógeno(89), condición compatible con la presencia de un medio anaeróbico. Por otra parte, se ha demostrado que el tejido pulpar apical contiene altas concentraciones de mucopolisacáridos ácidos sulfatados.(130) El tejido fibroso de la porción apical del conducto radicular es idéntico al del ligamento periodontal. Esta estructura fibrosa parece actuar como una barrera contra la progresión apical de la inflamación pulpar. Sin embargo, en las pulpitis parciales o totales, generalmente no se produce la completa inhibición de la inflamación de los tejidos periapicales.(94). Del mismo modo, cabe destacar que el tejido pulpar apical contiene los vasos sanguíneos y los nervios que entran a la pulpa. La pulpa dental está irrigada por un número de vasos sanguíneos que se originan en los espacios medulares del hueso que rodea al ápice radicular. No obstante, ocasionalmente, el ancho de todos los vasos parece ser similar al de los capilares.(17, 25,113) Reader y Foreman(83) investigaron las características ultraestructurales de la inervación intradental en la región apical de la pulpa humana a través de microscopio electrónico de transmisión. Se determinó que los nervios dentales apicales fueron cualitativamente similares a otros nervios periféricos. Así mismo, determinaron que la mayoría de los nervios mielinicos estaban agrupados circunferencialmente en el centro de la pulpa apical mientras que los nervios dentales amielinicos estaban distribuidos alrededor de los axones mielinicos en el centro del paquete nervioso, aunque fueron aislados otros en la periferia. Las microangiografías revelan que a medida que los vasos sanguíneos entran al foramen apical, la arteria apical se divide casi de inmediato en varias arterias principales o centrales. Los vasos sanguíneos, están rodeados por grandes nervios medulares que también se ramifican después de entrar en la pulpa. A medida que los vasos sanguíneos logran el centro de la pulpa, se ramifican y comienzan a ensancharse.(93) La íntima relación de la sangre y los nervios que irrigan la pulpa y el ligamento periodontal, proporciona un fundamento para la interrelación de la pulpa y la enfermedad periodontal. Un proceso inflamatorio o degenerativo que afecte el aporte sanguíneo del ligamento periodontal puede afectar el aporte sanguíneo a ciertas porciones de la pulpa.(25) Mendoza et al.(66)describieron los cambios ultraestructurales en los vasos sanguíneos y tejido conectivo a nivel del tejido pulpar apical de dientes clínicamente diagnosticados con pulpitis irreversible. Los resultados demostraron que hubo variaciones individuales, con cambios degenerativos de moderados a severos dentro de estos vasos, así como en el tejido conectivo del tejido pulpar apical en condiciones clínicas de pulpitis irreversible. Un dramático incremento del número de vesículas se vió presente en las células endoteliales. Del mismo modo, se observó el incremento de lípidos y del número de mitocondrias y ribosomas. Los cambios en el estroma del tejido conectivo evidenciaron mineralización del colágeno en 5 de los especimenes, así como también incremento en el número de mitocondrias de los fibroblastos.(66) Ya que el aporte nervioso es similar tanto para la pulpa como para el ligamento periodontal, una inflamación periodontal puede producir un dolor similar a un dolor de diente causado por una pulpitis. Las fibras tisulares, en su mayoría, son de naturaleza colágena, y tienen un gran aporte vascular el cual se diferencia del tejido pulpar.(95) Mientras que el tejido apical tiene una vascularización de tipo colateral, el tejido pulpar tiene un solo terminal. Esta es una consideración importante en la cicatrización de lesiones periapicales cuando se compara la incapacidad del tejido pulpar a resistir lesiones y daños severos causado por problemas inflamatorios. El aporte nervioso es autonómico cuando las fibras nerviosas son provenientes del ganglio cervical superior y fibras sensoriales de la segunda y tercera rama del nervio trigémino.(25) Es importante hacer hincapié en que el plano de división del tejido pulpar del ligamento periodontal, no está bajo el completo control del operador, especialmente cuando se usan sondas barbadas para extirpar la pulpa. De cualquier forma, la separación puede producirse en el conducto radicular o aun más allá del foramen apical, en alguna zona del ligamento periodontal.(71) Dentina apical : La dentina producida por los odontoblastos a nivel apical, no es tan tubular como la dentina coronaria, de hecho, es más amorfa e irregular.(93) Esto hace que la permeabilidad de la dentina a este nivel sea mas reducida, ya que los tubulos dentinarios son los canales principales para la difusión de los líquidos a través de la dentina.(17,93) Esta configuración se ha logrado demostrar a través de cortes microscópicos y de barrido en estudios de dentina humana. En un estudio realizado por Pashley et al.(78), se demostró que la permeabilidad de la dentina radicular es mucho mas baja que la de la coronal. Esto se atribuyó a un descenso en la densidad de los tubulos dentinarios desde alrededor de 42.000/mm2 en la dentina cervical, hasta 8.000/ mm2 en la radicular. Estos investigadores observaron que el movimiento de líquidos a través de la dentina radicular externa era aproximadamente de un 2% del observado en la dentina coronal. Nalbandian et al.(70), examinaron la dentina radicular esclerótica de los dientes humanos, a través de la microrradiografía de secciones muy delgadas y por medio del microscopio electrónico de secciones descalcificadas, encontraron que la mineralización secundaria de esta dentina estaba caracterizada por un periodo prolongado de aposición de cristales a una distancia considerable de las células pulpares. Cemento Apical : Desde el punto de vista morfológico, se pueden diferenciar dos tipos de cemento a lo largo de la raíz del diente; el celular, que se encuentra en el tercio apical y el acelular, que es encontrado a nivel de dentina en los tercios cervical y medio.( 17, 25,113) Sin embargo, hay variaciones en el patrón de distribución del cemento, y hay capas de cemento acelular y celular que alternan, a menudo de modo aparentemente aleatorio.(113) (Gráfico 3) Debido a su continua aposición, se ha establecido que el cemento ejerce ciertas funciones directamente relacionadas con la endodoncia, como compensar la cantidad de esmalte y dentina que se pierde debido a fuerzas oclusales e interproximales, ayudar a: la erupción pasiva de los dientes en dirección mesio-oclusal, al restablecimiento de fracturas oblicuas u horizontales y al restablecimiento de lagunas de resorción de dientes permanentes en casos de lesiones periapicales o traumatismos; ejecutar una obliteración biológica del foramen apical luego del tratamiento endodóncico, ya que con el tiempo, la acumulación continua de cemento apical tras la obturación del conducto radicular va aumentando la distancia entre dicha unión y el ápice radicular.(17) Skillen(106) en el año de 1932, destaca la importancia de la permeabilidad del cemento en el pronóstico del diente cuando la infección se desarrolla en el área periapical. Así mismo, destaca la presencia de células y corpúsculos cementoides en el área apical; los cuales deben recibir nutrientes, que llegan al cemento a través del ligamento periodontal. Del mismo modo, se ha establecido que a nivel del cemento apical se producen una serie de cambios compensatorios según las fuerzas que actúan sobre el diente, provocando un cambio constante en la morfología apical. Debido a las tensiones funcionales, el cemento del tercio apical es más grueso, presentando una laminación irregular, a veces bastante celular.(1) Altman et al.(3) en observaciones histológicas del ápice radicular, determinaron que el nivel en que el tejido pulpar se encontraba completamente circunscrito por cemento presentaría una variación desde 110 micrones a 1,016 micrones coronal al ápice. En cada diente, la iniciación apical de la circunscripción cementaria fue observada hacia un nivel más coronal. Por otro lado, se ha constatado que la aposición del cemento es mayor en la porción apical del diente y tiende a disminuir en las porciones medias y coronarias.(100) Seltzer et al.(95) determinaron que el cemento presentaba capas espesas alrededor de las raíces de algunos dientes; en cambio, en otros, se evidenciaba solo una capa delgada. El promedio de medidas del espesor de cemento en la región mas ancha del tercio apical fue de 0,15 a 1,02 mm, con un promedio de 0,464 mm. Sin embargo, el promedio de espesor fue observado solo en 6 dientes (10,2%). El espesor de cemento perirradicular no siempre parece estar relacionado con alguna función o causa conocida. En algunos dientes, la aposición de cemento fue tan profusa que el foramen apical se mostró prácticamente obliterado.
Unión cemento-dentinaria: Es la región donde se unen la dentina y el cemento, el punto en el cual termina la superficie de cemento en el vértice de un diente o cerca de el.(38) Sin embargo, es importante destacar que esta unión representa un punto de referencia histológico que no puede localizarse de manera clínica o radiográfica.(48). Kuttler(55), definió la unión cemento dentinaria como el punto donde el cemento se une al conducto dentinario. En análisis posteriores realizados en esta investigación, demostró que la localización de la unión cemento dentinaria estudiada sobre la base de la longitud de la extensión del cemento en el conducto, presentaba una extensión de X508 Um y X343 Um en los lados derechos e izquierdos, respectivamente, en secciones de cortes histológicos de personas de edades comprendidas entre 18-25 años. En personas mayores de 55 años estos valores fueron X802 Um y 619 Um para los lados derechos e izquierdos, respectivamente. Coolidge(18) estableció que la localización de la unión cemento-dentina podría ser muy variable; y del mismo modo, ser considerada como ayuda en los parámetros de determinación del limite apical para la remoción de tejido, preparación y obturación del sistema de conductos radiculares. De manera similar, Langeland(58) afirma que la unión cementodentinaria no siempre coincide con la constricción apical. (Gráfico 4)
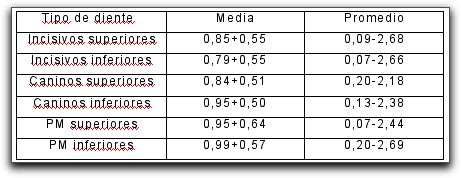
Dummer et al.(28) estudiaron todos los grupos dentarios y concluyeron que la distancia desde el foramen apical a la unión cemento-dentina fue extremadamente variable, mostrando un rango de 2,68mm en incisivos superiores (longitud máxima) a 2,18 mm para caninos superiores (longitud mínima). Aguadé(1) demostró histológicamente que la aposición de cemento en el área apical se reducía a nivel del diámetro del conducto cementario; mas no así en la unión cemento-dentina, localizada en la porción mas estrecha del conducto cementario. La forma de la unión cemento-dentina no es exactamente redonda debido a que el cemento no alcanza la misma longitud ni el mismo grosor en todas las superficies dentro del conducto cementario. Harrán Ponce y Vilar Fernandez(48) evaluaron histológicamente la longitud del conducto cementario desde el foramen hasta la unión cemento-dentina-conducto, así como el diámetro del foramen apical y la constricción apical. Se analizaron 18 dientes anteriores superiores (6 incisivos centrales, 5 laterales y 7 caninos) de pacientes en edades promedio de 42 años, donde se observaron 269 secciones histológicas analizadas bajo microscopio óptico. Los resultados establecieron que la mayor extensión de cemento dentro del conducto fue observada en los caninos, disminuyendo en los incisivos laterales y aun más en los incisivos centrales.(48) La gran variabilidad de las medidas obtenidas en la longitud del cemento hasta la unión cemento-dentina-conducto (CDC) y los diferentes diámetros de la constricción apical, permitieron concluir que la utilización de dichos puntos como referencias para determinar el limite apical ideal no son fiables, ya que es imposible su localización clínica.(48) Saad et al.(90) determinaron la localización de la unión cementodentinaria en premolares inferiores de pacientes egipcios y sauditas mediante estudios histológicos que permitieron la medición de dicha unión, en un plano paralelo a lo largo de la pared axial del diente desde la superficie externa del ápice radicular hasta la superficie mesial y distal del conducto. Los resultados de las muestras obtenidas de los 122 dientes (68 egipcios y 54 sauditas) indican que la unión cementodentinaria de las secciones egipcias fueron de 0 a 2mm (media + SD =0,9+0,4mm) a nivel mesial del conducto y 0,2-2,5mm (media + SD =1,0+0,5mm) a nivel distal. En los pacientes sauditas se logró determinar que la unión cementodentinaria arrojó un promedio de 0,5 a 1,2 mm (media+ SD=0,8+0,3mm) a nivel mesial y 0,6 a 0,9 (media +SD =0.7+0.4mm) a nivel distal. Por lo tanto, se concluye que la localización de la unión cementodentinaria varía entre pacientes egipcios y sauditas y que no se muestra un punto fijo de determinación de tal estructura entre poblaciones de diferentes países.(90) En resumen, la distancia entre el foramen apical y la unión cemento-dentina estará influenciada por muchos factores tales como: aposición continua de cemento, la cual, en parte estará influenciada por la edad o procesos de resorción así como también, por trauma, movimientos ortodoncicos o enfermedad periodontal. En consecuencia, la posición del foramen apical y de la unión cemento-dentina no presenta una localización espacial específica. El foramen apical puede estar localizado en cualquier punto de la superficie radicular mientras que la unión cemento dentina podría estar localizada a 3mm por encima del ápice radiográfico.(15,44,55) Ligamento periodontal apical : El ligamento periodontal apical constituye un área importante, debido a que, al igual que el resto de su estructura, cuenta con un gran número de células, vasos, nervios, fibras y sustancia fundamental, razón por la cual, presenta una gran capacidad de promover cicatrización y sellado biológico del foramen apical por aposición de cemento.(113) El tejido fibroso del ligamento periodontal apical, en su mayoría de naturaleza colágena, muestra un rico aporte vascular el cual lo diferencia del tejido pulpar. (Gráfico 5)
Se han identificado 5 tipos de células en el ligamento periodontal apical, entre las cuales destacan: células de defensa, células epiteliales derivadas de la vaina epitelial de Hertwig, células mesenquimatosas indiferenciadas las cuales tienen un papel de suma importancia en los procesos de cicatrización, células clásticas, como cementoclastos y osteoclastos, responsables de los procesos de resorción.(130) Del mismo modo, es importante destacar que el ligamento periodontal apical presenta un tipo de vascularización colateral, mientras que el tejido pulpar solo presenta uno terminal. Esto representa una consideración importante en la cicatrización de lesiones periapicales.(18) Hueso alveolar periapical : El hueso alveolar, consta de dos regiones distintas: una capa externa de hueso compacto, la lamina dura, en el cual el ligamento periodontal esta anclado, es de tipo fibroso y tiene numerosas perforaciones para el paso de fibras nerviosas y vasos sanguíneos; y una zona interna de hueso esponjoso cuya cantidad varia en diferentes lugares.(21) Resulta interesante destacar que a diferencia de la dentina, el hueso que rodea al ligamento periodontal permite una mayor liberación de la presión que la que presenta el tejido pulpar durante una reacción inflamatoria. Esto explica el porqué la inflamación de la pulpa es mas dolorosa que la inflamación en el ligamento periodontal.(74)
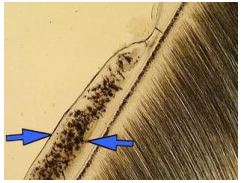
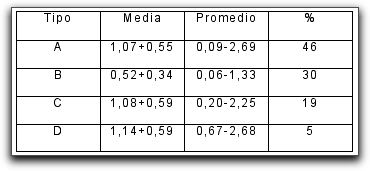
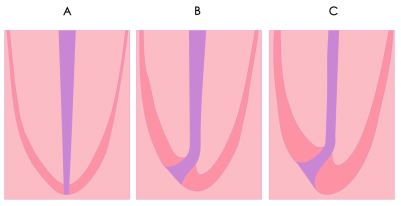
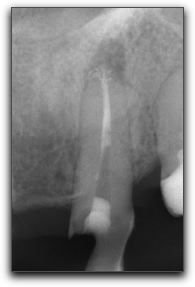
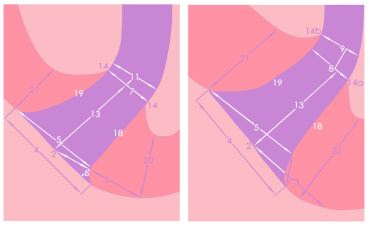
Aspectos anatómicos relacionados con el tercio apical La anatomía apical del sistema de conductos radiculares juega un papel muy importante para el entendimiento de los principios del tratamiento endodóncico.(1,34,38,43,96) Existen diversas opiniones con respecto a la configuración anatómica del tercio apical. Cada una de estas, ajustadas a los resultados de los estudios realizados. Constricción apical : Kuttler(55) señala que el diámetro más estrecho del conducto no se encuentra en el punto de salida del mismo, sino que suele localizarse en la dentina, justo antes de las primeras capas del cemento dentario. El autor denomina a este punto como el diámetro menor del conducto, aunque actualmente se utiliza con más frecuencia el término de constricción apical. A través de su estudio microscópico de los ápices radiculares, este autor confirma que en la zona de unión entre el conducto dentinario y el conducto cementario (limite C-D-C: conducto-dentina-cemento) existe una constricción que mide en promedio 224 micrómetros en los jóvenes y 210 micrómetros en adultos.(54) (Gráfico 6) Mizutani et al.(67) investigaron la porción anatómica apical del conducto radicular en 30 incisivos centrales superiores, 30 laterales superiores y 30 caninos superiores de pacientes en edades comprendidas entre 11 y 73 años. En este estudio el diámetro vestíbulo-lingual desde el ápice radicular a la constricción apical de incisivos centrales, laterales y caninos; arrojó un promedio de 0,425mm, 0,369mm y 0,375mm respectivamente y la distancia vertical entre el ápice y la constricción apical fue de 0,863 mm, 0,825 mm y 1,010 mm respectivamente. Por otro lado, se logró determinar que el ápice radicular coincidió con el foramen principal en un 16,7% de los incisivos centrales y caninos, mientras que en los incisivos laterales en un 6,7%. Chapman(19) observó la morfología de los últimos 3 mm del conducto radicular en secciones de cortes en dientes anteriores y reportó que un 83% de los conductos mostró una constricción apical de tipo circular. Así mismo, notó que la mayoría de las constricciones (92,5%) fueron encontradas entre 0,5mm y 1mm del ápice. Dummer et al.(28) mediante el estudio de 270 dientes humanos extraídos, evaluaron la distancia entre el ápice y la constricción. La distancia entre estas fue de 0,89 mm. (Tabla II) Del mismo modo, concluyeron que la topografía de la constricción nunca fue constante, razón por la cual, señalaron cuatro tipos: A. constricción tradicional o sencilla, B. constricción con la porción mas estrecha cerca del ápice actual, C. tipo multiconstricción, D. la constricción es seguida por una porción estrecha y paralela al conducto. (Tabla I)
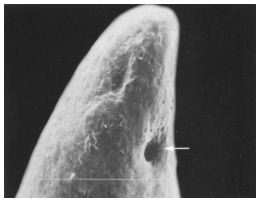
Foramen Apical : Kuttler(55) a través de cortes transversales de raíces, observó la anatomía microscópica del ápice en cuanto a su dirección, forma, diámetro y localización. Posteriormente, definió el foramen apical como una circunferencia en forma de túnel o cráter que diferencia la terminación del conducto cementario de la superficie exterior de la raíz. Este autor diseñó un estudio que incluyó 268 dientes extraídos de cadáveres divididos en 2 grupos, el primero de edades comprendidas entre 18 a 25 años y el segundo en edades de 55 o más años; Los resultados obtenidos mostraron que un 32% de las raíces de los dientes de la primera serie estudiada, presentaban el centro del foramen apical localizado en el vértice apical o en el centro y, generalmente seguido por la pared axial del conducto; en los dientes de la segunda serie la coincidencia del centro del foramen y el vértice o centro del ápice fue encontrado en un 20%; mientras que en el 68% restante de las raíces en la primera serie, el foramen se mostró fuera o hacia el centro o vértice del ápice.(55) Se ha establecido que el promedio de distancia entre el vértice o el centro apical y el centro del foramen es de 495 micrones en personas jóvenes y de 607 micrones en personas mayores de 55 años; el promedio del diámetro del foramen en jóvenes es de 502 micrones y de 681 micrones en personas de edad avanzada.(55) Del mismo modo, se ha determinado que el diámetro del foramen se incrementa con la edad por la aposición de nuevas capas de cemento. (Gráfico 6) El promedio del diámetro del foramen en el grupo de 18 a 25 años mostró un mayor diámetro vestíbulo- lingual que mesio-distal, así como también el grupo de 55 años o más. Del mismo modo se determinó que el menor diámetro del conducto radicular es encontrado usualmente en la dentina justo antes de la porción cementaria.(55) Para Green(44) el diámetro más estrecho (0,30mm) fue encontrado en incisivos, caninos y segundos premolares inferiores, mientras que el mas ancho (0,65mm) fue encontrado en la raíz distal de los molares inferiores. Del mismo modo, describió las diversas formas del foramen apical como circular, ovalado, asimétrico, o en forma de reloj de arena en la raíz distal de los molares inferiores, afirmación que posteriormente seria considerada por otros autores.(52) De manera similar, reportó un porcentaje de desviación del foramen de un 69,3% para dientes anteriores y 50,0% para dientes posteriores.
Palmer et al.(76) describieron a través de un estudio en 40 dientes extraídos seleccionados al azar, la localización del foramen en el conducto. Instrumentos de menor calibre fueron insertados en los conductos hasta hacer resistencia, para posteriormente ser radiografiados. Los resultados obtenidos indican que en 20 muestras, la lima se extendió al menos 1 mm más allá de la superficie apical. Incluso, en algunos casos, el instrumento se extendió en más de 2,5mm. Se concluyó que a través del examen radiográfico no es posible determinar cuando el foramen apical no coincide con el ápice anatómico. Burch y Hulen(15) examinaron 877 dientes para determinar frecuencia, dirección y distancia de la desviación del foramen al ápice anatómico radicular. En dicho estudio la desviación tuvo un promedio de un 92,4%, dependiendo del diente examinado. Se determinó que el promedio de la desviación fue de 0,59 mm entre el ápice anatómico y el foramen apical. Melius et al.(65) determinaron la distancia entre el foramen apical y el ápice anatómico mediante un estudio comparativo de visualización radiográfica y digital en 30 dientes monoradiculares. En las radiografías digitales, la distancia entre la punta del instrumento y el centro del ápice radiográfico fue medida directamente a través de un software computarizado, mientras que en las películas convencionales, la distancia fue medida bajo magnificación estereomicroscópica de 10X con regla milimetrada calibrada. La distancia obtenida fue de 0,494 mm para radiografías convencionales y 0,594 para radiografías digitales. Estos resultados concuerdan con la concepción de que la longitud de trabajo endodóncica debe terminar a 1 mm del ápice radiográfico, debido a que la pequeña diferencia expresada no refiere significancia clínica alguna.(65) La importancia de ciertos factores en la determinación de la longitud del conducto radica en el conocimiento de la longitud normal en cada diente en particular, radiografías preoperatorias, sensibilidad periodontal apical a la instrumentación y la percepción táctil de la constricción a nivel del foramen apical.(44)
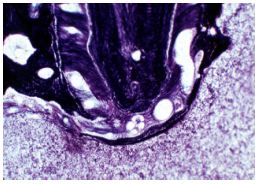
Las observaciones de Harrán Ponce y Vilar Fernández(48) reportaron un promedio de mayor diámetro del foramen para los incisivos laterales superiores (X519,21 Um +31,49) y un menor diámetro para los incisivos centrales superiores (X353,98Um +18,79). Foraminas accesorias : Exámenes histológicos con cortes seriados de raíces, evidencian la presencia frecuente de foraminas accesorias.(49) Kramer(53) visualizó por medio de su técnica de inyección vascular, anastomosis entre los vasos de los conductos radiculares principales. En ciertos casos, el ancho de las foraminas accesorias se evidenció extremadamente pequeño, permitiendo solo la presencia de vasos de un calibre de menor diámetro. Pucci y Reig(82) afirman que en el momento en que se va a alcanzar la apertura apical, un conducto puede dividirse en dos o mas ramas, teniendo cada una el mismo o casi el mismo diámetro. Este sistema, correspondiente a un "delta apical" lo definieron como "un complejo anatómico el cual está constituido por múltiples terminaciones de distintos conductos que alcanzan el foramen apical, formando un delta de ramas terminales".(Gráfico 7) El mayor porcentaje de ramificaciones se observa entre los 20 y 40 años, mientras que en dientes monoradiculares, se ha comprobado una disminución de esas ramificaciones entre los 40 y 55 años; en los dientes multirradiculares aumenta durante ese mismo periodo.(63) Este segmento anatómico significa, quizás, el mayor problema histopatológico, terapéutico y de pronóstico de la endodoncia actual.(6)
Conducto cementario : De acuerdo con Kuttler,(56) el conducto radicular está dividido en una larga porción cónica de dentina y en una corta porción de cemento en forma de túnel. La porción cementaria o conducto cementario generalmente tiene la forma de un cono invertido con su diámetro mas estrecho en o cerca de la unión cementodentinaria y su base en el foramen apical.
No obstante, en ocasiones, el cemento termina directamente sobre la dentina del ápice; aunque a veces, el cemento se extiende por una distancia considerable dentro del conducto radicular, revistiendo la dentina de una manera irregular. Las variaciones suceden especialmente en los dientes afectados periodontalmente o aquellos que hayan sido sometidos a fuerzas ortodoncicas.(56) El conducto dentinario no sigue la misma vía del conducto cementario, ya que este ultimo se desvía en diferentes ángulos en relación a el. Esto ocurre como resultado de la adaptación del diente a algunas influencias funcionales como la lengua, presión oclusal y movimientos mesiales.(55) Conductos laterales : Durante la formación de la vaina de la raíz, se produce una pequeña brecha como consecuencia de la interrupción de la continuidad de la vaina. Cuando esto sucede, no tiene lugar la dentinogénesis; el resultado es la formación de un pequeño conducto accesorio entre el saco dental y la pulpa.(17) Hess(49) examinó bajo microscopio óptico series de 50 secciones de dientes, 48 mostraron conductos laterales a nivel apical con morfología y disposición diferente. En estas investigaciones, el autor hace especial referencia de la raíz mesio-vestibular de los molares superiores como los dientes que muestran mayor porcentaje de conductos laterales a nivel apical. Seltzer(70) afirma que la presencia de éstos, en dientes con pulpas enfermas permite un intercambio de productos inflamatorios de desecho entre el espacio pulpar y los tejidos perirradiculares que puede influir en el resultado del tratamiento del conducto radicular y en la conservación de la salud periodontal.
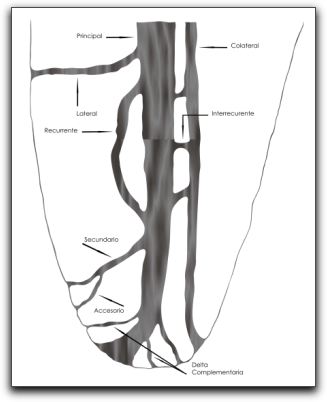
La presencia de conductos laterales en las áreas de bifurcación de los molares esta bien probada y su incidencia es alta. En un 59% de los molares se encuentran conductos laterales permeables en el tercio coronal o medio.(19) Kuttler(56) propuso una nomenclatura sobre la anatomía de los conductos radiculares en la que prevalece la definición de estructuras a nivel del tercio apical. (Gráfico 11.) Conducto lateral: surge del conducto principal y se dirige lateralmente, casi perpendicular del conducto principal al espacio periodontal en el cual desemboca. Conducto colateral: Emerge del conducto principal, ligeramente paralelo a el y corre a lo largo de la raíz desembocando en un pequeño agujero individual y su diámetro es menor que el del conducto principal. Conducto secundario: tiene su origen en el conducto principal, generalmente a nivel del tercio apical de la raíz, se dirige oblicuamente hacia el ápice y termina en el espacio del ligamento periodontal. Conducto accesorio: Se refiere al tipo de conducto que deriva de un conducto secundario y desemboca individualmente. Conducto interrecurrente: Es el conducto de pequeño diámetro, corto y en número variable que intercomunica al conducto principal con otro similar o con un conducto colateral. Nicholls(71) resaltó la importancia de los conductos laterales en la prevalencia de lesiones laterales radiculares al evaluar 228 conductos, durante un periodo promedio de 6 meses en un lapso de 4 años. Del número de conductos estudiados, con evidencia radiográfica de destrucción alveolar obvia, debido a la enfermedad pulpar, 10 de estos (4,4%) estuvo asociado a lesión radicular debido a la presencia de conductos laterales. De Deus(23) mediante un estudio de 1.140 dientes humanos extraídos, correspondientes a la dentición permanente, investigó la frecuencia, localización y dirección de conductos laterales, secundarios y accesorios. En un 27,4% de los dientes estudiados se demostró la presencia de conductos laterales, secundarios y accesorios. Estas ramificaciones laterales fueron localizadas con mayor frecuencia en el área apical (17,0%). Cabe destacar que en las bifurcaciones y trifurcaciones de las áreas de los premolares y molares estudiados, un 2,3% mostraron conductos laterales que emanaron desde le conducto principal. Así mismo, ningún conducto lateral fue observado a nivel de la cámara pulpar. Los conductos secundarios fueron localizados en frecuencia de un 16,4%, mientras que en los conductos accesorios se evidenció la frecuencia de un 0,6%.(23)
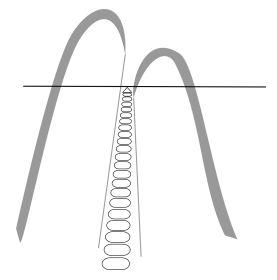
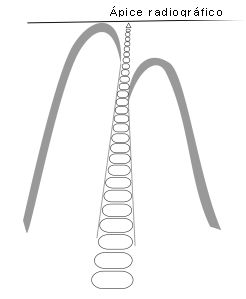
Altman et al.(3) estudiaron 20 incisivos centrales superiores hasta 2,5 mm del ápice, mediante radiografías y cortes histológicos seriados. Las observaciones radiográficas indicaron que solo 6 dientes presentaban conductos accesorios, mientras que el estudio histológico reveló 15 muestras con conductos accesorios a nivel del tercio apical. En 14 dientes se visualizó entre 1 y 4 conductos accesorios y en un diente detectaron más de 20 forámenes apicales separados. Concluyeron afirmando que el estudio radiográfico para diagnosticar la presencia de los conductos accesorios no es confiable. Ápice anatómico : Es el extremo de la raíz determinado morfológicamente.(40) Ápice radiográfico : Es la punta o extremo de la raíz determinado morfológicamente en la radiografía.(40)
Manejo clínico del tercio apical durante la preparación y conformación del sistema de conductos radiculares Determinación de la longitud de trabajo Es la distancia desde un punto de referencia coronal hasta el punto en el que terminará la preparación y obturación del conducto. Esta medida limita la profundidad de la penetración de los instrumentos y determina el proceso de conformación del conducto radicular.(40) Para muchos investigadores, la constricción apical es considerada como el punto final apical ideal para la instrumentación y obturación en el tratamiento endodóncico,(35,85) debido a que más allá de la constricción, el conducto se amplía y desarrolla un mayor flujo vascular. Por tanto, desde una perspectiva biológica, la constricción es el punto más importante para finalizar la preparación del conducto ya que la existencia del riego sanguíneo funcional controla el proceso inflamatorio. Según Olson et al.(73) dentro de la región apical de la raíz, existen dos medidas diferentes que son consideradas importantes durante la determinación de la longitud de trabajo; estas son la distancia comprendida entre el ápice al foramen apical y la distancia entre el foramen apical y la constricción del conducto. Otros autores recomiendan utilizar la constricción apical como el punto que marca la longitud de trabajo, porque implica que el término de la preparación se localiza en el diámetro mas estrecho del conducto. Esta preparación de la conformación ayuda a optimizar el sellado apical cuando se obtura el conducto.(3,16,41) Sin embargo, muchos investigadores han llevado a cabo estudios para la determinación de la longitud de la superficie radicular mediante el método radiográfico(15,18,40,71,73,107). Desafortunadamente, la localización y forma de la constricción apical es variable y no es radiográficamente detectable.(13,33) El ligamento periodontal se utiliza habitualmente para identificar la terminación apical . Este punto incluye la parte del conducto que se extiende mas allá de la constricción y como consecuencia, las técnicas rutinarias añaden cierto error.(13) Vande Voorde y Bjorndahl(116) en un estudio de 101 dientes anteriores, observaron que la longitud del diente fue magnificada en un 5,4% usando la técnica radiográfica de cono paralelo. Estos autores concluyeron que esta técnica puede ser utilizada como una guía confiable en la predeterminación de la longitud de trabajo. Por su parte, Fava y Siquiera(35) afirman que las constantes variaciones que ocurren a nivel del ápice radicular durante el transcurrir del tiempo y la imposibilidad de una visualización directa del foramen apical, hacen que la localización radiográfica sea un desafío durante la determinación de la longitud de trabajo. Del mismo modo, refieren que la observación en dos dimensiones de un objeto tridimensional limita en gran medida la correcta interpretación de la dirección del foramen y longitud del conducto radicular. ElAyouti et al.(30) estudiaron la frecuencia de la sobreinstrumentación con una longitud de trabajo radiográfica aceptable en 91 dientes extraídos. Los resultados evidenciaron la sobreinstrumentación del foramen apical en premolares en un 51% de los casos, mientras que en molares se observó en un 22%. En dientes anteriores no hubo hallazgos de sobreinstrumentación. Estos resultados sugieren que en premolares y en molares una longitud de trabajo radiográfica de 0 a 2mm por encima del ápice radiográfico, suministra, con mas frecuencia de lo previsto, una base para la sobreinstrumentación no intencional. En la actualidad, el uso de los localizadores electrónicos de ápice, ha brindado mayor eficacia y precisión en la determinación de la longitud de trabajo. La base científica de estos se originó con las investigaciones realizadas por Suzuki en 1942. Su investigación in vivo en perros utilizando corriente directa descubrió que la resistencia eléctrica entre el ligamento periodontal y la mucosa bucal tenía un valor constante de 6,5 kiloohms.(51) La utilización de dos corrientes alternadas de frecuencias diferentes, detectan la diferencia máxima en los valores de impedancia asociados a diversas frecuencias (altas 8 kiloohms y bajas 400 kiloohms en los localizadores de generación actual). Con la penetración de la lima, en dirección apical, la discrepancia entre los valores de impedancia comienza aumentar y será máxima en la constricción apical. (51) ElAyouti et al.(31) evaluaron mediante un estudio in vitro el uso del localizador de ápice Root ZX® (J.Morita, JP) al reducir la frecuencia de la sobrestimación de la longitud de trabajo en conductos de premolares que demostraron radiográficamente una longitud de trabajo aceptable. Concluyeron que las medidas de longitud de trabajo obtenidas mediante el examen radiográfico produjeron una sobrestimación de un 51%, mientras que con el empleo de localizador se redujo el porcentaje de sobreestimación en un 21%. Por lo tanto, los autores recomiendan mediante los resultados del presente estudio, que la complementación de ambos elementos pueden ser bastantes efectivos para evitar la sobrestimación en el foramen apical de premolares. El método táctil es otra alternativa sugerida para la determinación de la longitud de trabajo.(50,51) Un minucioso estudio de la anatomía apical pone de manifiesto dos hechos que permiten la identificación táctil; el conducto no reabsorbido suele estrecharse antes del punto de salida de la raíz y por otra parte, el conducto tiende a cambiar su curso en los últimos 2-3mm. La sensibilidad manual es capaz de detectar un cambio repentino en la presión necesaria para mantener el movimiento.(20) Seidberg et al.(92) reportaron exactitud en un 64% utilizando la sensación táctil digital. Sin embargo, se ha descrito que si los conductos se ensanchan previamente, un experto podía detectar la constricción apical en un 75% de los casos.(98) Mientras que en condiciones donde los conductos no se ensanchaban previamente, solo se podía determinar la constricción apical mediante sensación táctil en un tercio de los casos.(73) Por otra parte, en casos en que se ha perdido la constricción apical debido a resorción o perforación, la humedad o la sangre en la punta de papel representa una estimación del grado en que la preparación está sobreextendida.(48)
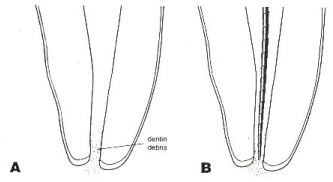
Permeabilidad apical Durante la instrumentación, el remanente pulpar y dentinario puede bloquear el acceso al tercio apical, incrementando la posibilidad de la formación de escalones, desviación y perforación. En 1989, Buchanan(14) estableció que el bloqueo a este nivel puede ser evitado durante la instrumentación, usando una lima de pasaje, la cual define como "una lima flexible #10 ó #15 que debe ser llevada de forma pasiva a través de la constricción apical sin ensancharla". En este concepto de lima de pasaje, el instrumento es llevado a 1mm más de su longitud de trabajo original. Goldberg y Massone(42) determinaron el desplazamiento producido a nivel del foramen apical por el uso de limas de acero inoxidable y de níquel titanio #10,#15,#20 y #25 como limas de pasaje. Concluyeron que el desplazamiento del foramen apical fué detectado en 18 de los 30 especímenes y no se evidenciaron diferencias significativas entre estos grupos. El tapón de virutas dentinarias en la zona apical se sugiere para impedir la sobreobturación del conducto, y al menos, en conductos no infectados, parece ser compatible con los tejidos periapicales. Safavi et al.(91) examinaron la reacción del tejido periapical al tapón de virutas de dentina y si ese tapón puede actuar como una barrera biocompatible entre el tejido periapical y el material de obturación del conducto. Los autores concluyeron a través de su investigación que la respuesta del tejido periapical a la presencia de virutas de dentina fue generalmente favorable. Wu et al.(124) establecen que la recapitulación de la longitud de trabajo solo podría mantener esta medida, más no así, remover el remanente dentinario, que es capaz de crear un tapón mas allá de la longitud de trabajo. (Gráfico 12) Cailleteau y Mullaney(16) evaluaron la prevalencia de la enseñanza de la permeabilidad apical en las escuelas de odontología de los Estados Unidos de América mediante encuestas realizadas en 53 facultades de este país. 48 de 53 escuelas dentales respondieron a las encuestas. Se determinó que en un 50% de las facultades se maneja el concepto de permeabilidad bajo premisas desde el punto de vista teórico y práctico tanto en estudiantes como en egresados.
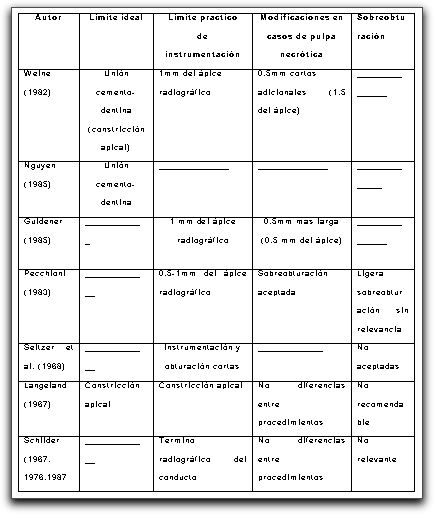
Limite apical de la instrumentación del sistema de conductos radiculares El límite apical de la instrumentación del sistema de conductos radiculares es uno de los aspectos más controversiales en la terapia endodóncica. Durante décadas, este punto ha sido y continua siendo, un tópico de discusión entre especialistas de la endodoncia. En una pulpitis, las bacterias se encuentran, por lo general, limitadas a la cámara pulpar. La instrumentación a nivel apical bajo estas condiciones, consiste en remover el tejido no infectado y configurar la forma del conducto. Un punto favorable para la terminación de la instrumentación a nivel apical solía ser 2 o 3 mm del ápice, más que 0 a 2mm. Este principio, (pulpectomía parcial) fue originalmente propuesto por Davis(21) en 1922, quien sugirió la preservación de la pulpa a nivel apical. Siguiendo esta teoría, algunos autores(41) obtuvieron buenos índices de éxito en sus reportes. Por lo tanto, las evidencias clínicas y biológicas indican que para casos de pulpa vital no resulta necesario que la terminación de los procedimientos se encuentren limitados a una cercanía absoluta del tercio apical.(94) Weine(119) sugiere la instrumentación hasta la unión cemento-dentina. Así como Nguyen (72), quien de manera similar indica la unión cemento-dentina como el límite de la preparación. Otros autores han establecido que durante la instrumentación es mejor no aproximarse más de 0,5-1mm del ápice radiográfico; Incluso, afirman que se debería, en cualquiera de los casos, finalizar la obturación a 0,5mm del ápice radiográfico. Ingle,(51) estableció que el diámetro mas estrecho del foramen apical fue localizado a nivel de la unión cemento-dentina, el cual, fue regularmente encontrado a 0,5mm de la superficie externa de la raíz. Es así, como el autor afirma que limitando la instrumentación a 0,5mm del término radiográfico se podrá mantener una apertura apical adecuada. La sobrextensión de la instrumentación y el traslado de productos tóxicos desde la raíz a los tejidos periapicales deberán evitarse. Ricucci(85) comparó las diversas tendencias entre diferentes autores y conceptos en cuanto al límite de la instrumentación y sobreobturación (Tabla IV). Algunos autores sugirieren elegir una longitud de trabajo menor a 0,5mm en dientes con pulpa necrótica, mientras que en casos de dientes con pulpa vital, recomiendan una reducción adicional de 0,5mm, es decir, 1mm menor a la longitud de trabajo correspondiente. Del mismo modo, otros hacen referencia sobre el establecimiento de un tope apical localizado entre 0,5mm y 1 mm del ápice (Gráfico 13).
Langeland(58) establece que el aspecto clínico de mayor controversia radica en que no hay distancia exacta entre el ápice radiográfico y la constricción apical, debido a que existen muchas variaciones entre una raíz y otra. Histológicamente, demostró que la unión cemento-dentina, no coincidía con la constricción apical, ya que ésta se presenta en muchas oportunidades mas alta (en una pared que la otra), y por ende, no coincidente con la constricción apical. En las pulpitis, las bacterias se encuentran generalmente limitadas a nivel de la cámara pulpar. En estos casos, el punto de terminación favorable para la instrumentación y para formar un tope apical es de 2 a 3mm menos con respecto al ápice, en vez de 0 a 2mm(9). Harrán Ponce y Vilar Fernández(48) aseguran que para el éxito del tratamiento endodóncico, la instrumentación y obturación a nivel apical deberán ser efectuadas en la unión cemento-dentina-conducto (CDC). Del mismo modo, hacen mención sobre la importancia la constricción apical y el foramen apical. El conocimiento por parte del clínico de estos puntos anatómicos le permitiría un mayor respeto a los tejidos apicales y periapicales. Por su parte, Stringberg(109) estudió 775 dientes tratados endodoncicamente, con un seguimiento clínico de 10 años posterior al tratamiento, donde, a través de observaciones clínicas y radiográficas, demostró que el mayor índice de éxito de los tratamientos endodóncicos realizados, fueron obtenidos cuando la obturación terminaba a 1 mm del ápice radiográfico.
Muchos estudios histológicos, basados en biopsias del ápice y tejido periapical adyacente o de dientes extraídos a periodos de tiempo variables, seguidos del tratamiento endodóncico, han confirmado las observaciones de estudios realizados por Davis,(21) quien bajo las bases de los estudios de Hess, fue el primero en sugerir el cuidado del tejido apical durante la terapia endodoncia como un requerimiento para el éxito. Seltzer et al.(98) realizaron un estudio de 27 dientes humanos y 24 dientes de monos libres de caries. Luego se procedió a la extirpación pulpar de los conductos en 12 dientes de cada uno de los grupos. Estos fueron instrumentados de 2 a 10mm antes de llegar al ápice. Dicha medida fue obtenida mediante imagen radiográfica. En 15 dientes humanos y en 12 dientes de mono, los conductos fueron instrumentados varios milímetros más allá de los ápices radiculares. Se evidenció que la reacción de los tejidos posterior a la instrumentación donde no se llegó al ápice se mostró menos severa que aquellas reacciones en la cual la instrumentación se realizaba más allá del ápice.(98) Bergenholtz et al.(7) realizaron una investigación clínica y radiográfica durante un periodo de dos años en 410 pacientes para determinar el efecto de la sobreinstrumentación y sobreobturación apical en conductos radiculares retratados. Concluyeron que si se producía una instrumentación a través del ápice radicular y posteriormente una sobreobturación, la frecuencia de una completa regeneración a nivel apical disminuiría significativamente. Así mismo se destacó la completa regeneración de lesiones periapicales en aquellos casos donde la sobreinstrumentación y sobreobturación no ocurría. Gutierrez et al.(46) evaluaron el comportamiento de dientes humanos con patología periapical luego de la sobreinstrumentación y sobreobturación del sistema de conductos radiculares mediante microscopía electrónica de barrido, para la determinación del potencial de riesgo de dolor post-operatorio y agudizaciones en el tratamiento de conductos infectados. Los resultados obtenidos en este estudio señalan que existía la presencia de bacterias adheridas a las estrías de los instrumentos que fueron introducidos en tales dientes, así como también en los ápices radiculares, sobretodo, alrededor del foramen apical principal.(46) Se observaron bacterias firmemente adheridas a lagunas de resorción, a pesar de que los ápices presentaban grandes cambios incluyendo fracturas y escalones. El grupo control, que consistió en 10 dientes humanos con pulpa vital, también fue sobreinstrumentado y sobreobturado; en este no se observaron bacterias en los ápices radiculares.(46)
Wildey y Senia(122) explican que no se debe instrumentar el foramen apical debido a la anatomía y el comportamiento de los instrumentos en el conducto. Así mismo apuntan que si la intención fuera limpiar el conducto a nivel del foramen, se requeriría una lima #60 en promedio. Esta medida de instrumento destruiría la constricción apical natural, la cual es de un #30 en promedio de las serie ISO. Se ha demostrado que la preparación del foramen provocaría la instrumentación del ligamento periodontal y el cemento más no de la pulpa y la dentina. Del mismo modo, se afirma que la instrumentación a este nivel desplazaría el conducto apical de 1 a 3mm y cambiaria la forma del foramen a ovalada.(122)
Instrumentación del tercio apical Los últimos 3 mm del conducto radicular son de vital importancia, y su preparación debe ser meticulosa para así lograr una configuración cilíndrica o circular que permita un correcto sellado apical para de este modo, evitar microfiltración. Esta porción es particularmente difícil en conductos curvos durante la preparación, debido a la dificultad del contacto y penetración de los instrumentos a las paredes del mismo. Las dificultades encontradas en la limpieza y conformación del tercio apical, tienden a influir en la consecución de errores. Instrumentos rígidos sin precurvar en conductos curvos, provocan desviación, escalones, o falsas vías.(87,100)
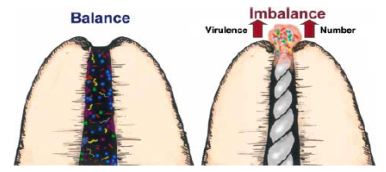
Druttman(27) establece las consideraciones que deben ser tomadas en cuenta a la hora de preparar conductos curvos pronunciados. Este autor sugiere que cuando se evidencia una curvatura pronunciada, la cavidad de acceso debe extenderse hacia la punta de la cúspide relacionada con el conducto a tratar. Explica que esta acción reducirá el grado de curvatura en la parte coronal del conducto permitiendo un mejor acceso al tercio apical. Weine et al.(120), mediante el uso de bloques de resina transparente, crearon conductos curvos simulados, que servirían para la observación de los efectos de los procedimientos de la preparación sobre la forma original del conducto y del foramen apical, usando varias técnicas de preparación manual, en las que se incluyeron, limado, cuarto de vuelta, raspado o combinaciones de estas. Las preparaciones finales de este estudio experimental mostraron características similares de conformación, donde se evidenció desplazamiento y deformación a nivel apical. A partir de estos resultados se recomienda la modificación de las preparaciones convencionales, el uso de la técnica de raspado más que de rotación y la técnica de ampliación.(120) Gani y Visvisian(36) evaluaron la forma de los conductos a través de cortes seccionados a 2 mm del ápice radicular y su correlación con el diámetro (D0) de los instrumentos endodonticos en 40 primeros molares superiores. Estos dientes fueron agrupados de acuerdo a la edad: niños (menores de 13 años) adolescentes (18-20 años) adultos (30-40 años) y mayores de 50. La evaluación de los diámetros reveló que las formas fueron predominantemente circulares en el conducto palatino, más plano en el conducto mesiovestibular, y circular y plano en iguales proporciones en la raíz distovestibular. Del mismo modo, se infirió, para la aplicabilidad de este estudio, que la edad no parece afectar la forma de los conductos(36). Solamente se ha observado una estrechez estadísticamente significativa para los conductos mesiovestibular y palatino. Incluso en los dientes de mayor edad, los diámetros observados en el conducto y el calibre de los instrumentos no se han correspondido, debido a que el diámetro interno excedía al diámetro externo de la raíz.(36) Laguna Contreras et al.(57) realizaron un estudio, en el que compararon la primera lima que es colocada en el ápice, antes y después de la ampliación previa del conducto. A través de las conclusiones obtenidas se indica que el ensanchado previo de los conductos ofrece una mejor información de las dimensiones apicales y concientiza, para una mejor decisión respecto al diámetro apropiado final que se necesita para la completa conformación apical. Parris et al.(77) demostraron a través de una evaluación histológica y radiográfica, la efectividad del vaciado apical; técnica que pretende preparar la porción final del ápice luego de la limpieza y conformación, mediante el empleo de movimientos de rotación con limas de 2 a 4 calibres de mayor diámetro que la lima inicial apical que fuese tomada para la determinación de la longitud de trabajo, para luego ejercer nuevamente estos movimientos de rotación con una lima de diámetro mayor luego de la irrigación y secado de los conductos. Por otro lado, con el uso de técnicas de instrumentación bajo el control rotacional de motor y frecuente irrigación en conductos suficientemente conformados, se ha determinado una disminución de la acumulación de detritus a nivel apical.(94) Reddy et al.(84) investigaron la cantidad de detritus apical producido in vitro usando dos técnicas de instrumentación rotatoria y dos técnicas manuales: fuerzas balanceadas, y paso atrás con instrumentos de níquel-titanio. Aunque todas las técnicas de instrumentación produjeron detritus, la técnica manual de paso atrás produjo significativamente mayor cantidad de este que otros métodos (p>0,005). No se evidenció diferencia entre la técnica manual de fuerzas balanceadas y los dos métodos con instrumentación rotatoria de níquel-titanio. Portenier et al.(80) realizaron una evaluación in vitro para determinar la desviación de conductos en 18 dientes humanos antes y después de la conformación realizada con las técnicas de preparación manual step back y rotatoria con Lightspeed® (Lightspeed Technology Inc., San Antonio TX, USA). Se determinó que los instrumentos de níquel-titanio mediante la configuración de Lightspeed® causaron un desplazamiento significativamente menor en el centro de los conductos que la técnica manual de step-back o paso atrás. Clínicamente, esto implica que se produce una menor desviación apical y una menor destrucción de dentina con la técnica de Lightspeed® que con la de paso atrás. Por su parte, Ehrlich et al.(29) compararon el desplazamiento apical producido en conductos curvos por la instrumentación con dos instrumentos ultrasónicos (Rispi-Sonic® y Trio Sonic®) y limas tipo K en 75 molares inferiores permanentes extraídos. Los resultados indican que 92 (61%) de las 150 muestras mostraron ausencia de desplazamiento y solo 7 (5%) evidenciaron un desplazamiento apical entre 0,25 y 0,5mm. Ninguna lima produjo mas de 0,5mm en dirección vestibulolingual o mesiodistal. El análisis estadístico demostró que no hubo diferencia significativa (p>0,05) en la cantidad de desplazamiento apical en conductos preparados con limas tipo k, y limas ultrasónicas Rispi-Sonic® y Trio Sonic®. Ruddle(88) sugiere decidir en una primera instancia, (a expensas del grado de complejidad anatómica que ofrezca el diente, procesos de resorción, o situaciones de iatrogénia) la determinación de la técnica a emplear para la preparación del sistema de conductos radiculares. Así mismo, establece que en curvaturas abruptas es recomendable la preparación del segmento apical con instrumentos manuales, previa a la preparación de los tercios coronal y medio del conducto. Serota et al.(100) describen una "zona de control apical" que definen como una región creada en el tercio apical del espacio del conducto, la cual demuestra una conicidad exagerada para ofrecer resistencia y retención en contra de la presión ejercida por la condensación durante la obturación, previniendo la extrusión del material de relleno durante la obturación. Siqueira et al.(104) compararon mediante cinco técnicas de instrumentación la efectividad de la limpieza del tercio apical en conductos curvos a través de una evaluación histológica. Las técnicas empleadas fueron: técnica paso atrás usando limas de acero, paso atrás usando limas de níquel-titanio, ultrasónica, de fuerzas balanceadas, y de canal master U. Concluyeron que no se evidenciaron diferencias significativas entre las técnicas utilizadas. Sin embargo, a pesar de que todas fueron efectivas en la remoción de tejido de los conductos, ninguna logró una completa eliminación de tejido, especialmente cuando se presentaban variaciones de la anatomía interna a nivel de tercio apical. Buchanan(14) señala que la única manera de determinar el diámetro del conducto en su porción terminal es mediante el uso de limas de acero o níquel titanio que actúan como calibradores para medir la continuidad de la conicidad establecida en la preparación. En cuanto a los conductos con pulpa necrótica, Siqueira(103) señala que en patologías periapicales, durante la preparación quimiomecánica, si los microorganismos se encuentran apicalmente extruidos, el huésped, hará frente a una cantidad considerable de irritantes, donde, consecuentemente, se producirá una disrupción en el balance entre agresión y defensa. Posteriormente, el huésped movilizará una inflamación aguda para el restablecimiento del equilibrio (Gráfico 17).
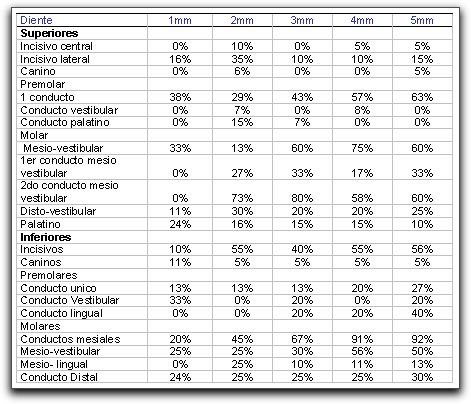
Bajo la misma línea de estudio, Garcia Filho et al.(37) observaron microscópicamente la efectividad de dos instrumentos rotatorios en la limpieza del tercio apical en conductos curvos. Concluyeron que ambos sistemas no fueron capaces de limpiar por completo las paredes del conducto a nivel del tercio apical y que a mayor variación anatómica, se mostraba una mayor prevalencia en la cantidad de capa de desecho. Bradford et al.(10) evaluaron la presión apical ejercida por diferentes agujas para la irrigación del sistema de conductos radiculares en dientes extraídos con ápices completamente desarrollados. Los resultados de este estudio indicaron que el doblar la aguja dentro del conducto ofrece una mayor presión a nivel apical que cuando esta se mantiene en su posición original y que las presiones fueron más altas en los ápices instrumentados a un número 30 o mayor. De igual forma se logró determinar que las agujas de mayor diámetro provocaron mayor presión que las agujas de diámetro menor. Wu et al.(126) destacan la importancia de la prevalencia y extensión de conductos ovales en el tercio apical, mediante un estudio realizado en 1,168 secciones de cortes horizontales a 1,2,3,4, y 5 mm del ápice radicular en 180 dientes humanos extraídos. Concluyeron que en 293 casos (25%) de las secciones observadas, se identificaron conductos ovales y que en algunos grupos dentarios, a un nivel de 5 mm del ápice radicular, el porcentaje aumentaba a un 50%. Es así como señalan la importancia de la identificación de este tipo de conductos, ya que la instrumentación, limpieza, conformación y obturación de los mismos se hace difícil e incluso, imposible en muchos de los casos (Tabla IV).
Obturación del tercio apical Limite apical de la obturación La completa regeneración de cemento y hueso no ocurre alrededor de los dientes con conductos radiculares sobreobturados. El material extraño que se impacta en los tejidos periapicales actúa como un irritante y existe una gran tendencia a que se produzca una proliferación epitelial.(85) Seltzer et al.(99) compararon la reacción de los tejidos periapicales en grupos donde se estableció una instrumentación y obturación cortos y más allá del ápice radiográfico respectivamente. La reacción fue similar en ambos grupos inicialmente. Hubo una respuesta inflamatoria aguda en el tejido pulpar apical y tejido periapical, el cual fue gradualmente reemplazado por tejido con infiltrado inflamatorio crónico. De igual manera, la inflamación periapical fue acompañada por resorción ósea. En un periodo de 6 a 12 meses, se observó una completa reparación en el grupo que se obturó por debajo de los ápices. Posteriormente, se observó que la reparación se retrasó en el grupo en el cual se produjo la sobreobturación. Concluyeron que en la extirpación de casos de pulpa vital, los mejores resultados en términos de reparación de tejidos fue obtenido cuando los conductos fueron instrumentados y obturados cortos al ápice de los dientes.(99) Bergenholtz et al.(7) establecen que el material de obturación per se, no es necesariamente la causa inmediata del fracaso de los tratamientos. De hecho, la gutapercha, material utilizado para la obturación se ha demostrado compatible con los tejidos vitales en estudios in vivo de implantación en animales así como en otras investigaciones in vitro con cultivo de células. Ricucci y Langeland(86) estudiaron la respuesta histopatológica de los tejidos periapicales a los procedimientos de instrumentación y obturación; determinando que cuando el sellador y la gutapercha fueron extruidos hacia los tejidos periapicales, conductos laterales y ramificaciones apicales, hubo siempre una reacción inflamatoria severa a cuerpo extraño con ausencia clínica de dolor. De igual forma concluyen que el mejor pronóstico para el tratamiento endodontico se basa en una adecuada instrumentación y obturación homogénea a nivel de la constricción apical y que el peor pronóstico está relacionado con la instrumentación y obturación más allá de esta. El segundo peor pronóstico lo atribuyen a una obturación 2 mm menos de la constricción, combinadas a una pobre instrumentación y obturación. (86) Otra razón por la que la sobreobturación no es preferible, se debe a que el material de obturación en exceso puede actuar como un irritante en el desarrollo de la enfermedad periodontal con una movilidad dentaria concomitante. De esta manera, en dientes con zonas e rarefacción, es preferible la obturación del conducto radicular ligeramente corta, o justa con respecto al ápice radiográfico.(86) Swartz et al.(110) estudiaron 1.007 dientes tratados endodóncicamente para observar 1.770 conductos obturados. Finalmente concluyeron que la sobreobturación de los conductos resultó ser un factor que condujo cuatro veces mas al fracaso que aquellos conductos en los que se dejaba una obturación corta al ápice radiográfico. En conductos sobreobturados, los tejidos periapicales son irritados tanto químicamente por medio de los ingredientes de los cementos para el conducto; como mecánicamente por medio del material de obturación radicular. El examen histológico de los tejidos periapicales de dientes con conductos sobreobturados, mostró respuestas inflamatorias severas alrededor de partículas de cemento para el conducto radicular y los conos de plata.(52)
Sellado apical De nada vale alcanzar de manera satisfactoria el nivel apical si permanecen espacios laterales, que son sitios adecuados para la supervivencia y desarrollo de bacterias y para la acumulación de sus toxinas. Independientemente de la técnica de obturación endodóncica que se vaya a emplear, resulta sumamente importante el sellado apical. La obturación debe asegurar un sellado óptimo en todas las dimensiones, y bloquear las comunicaciones del conducto con el periodonto, ya sean apicales o laterales(34).La selección de un cono patrón de gutapercha con diámetro similar al del conducto en su porción apical es decisiva para la calidad de la obturación. Allison et al.(2) estudiaron la influencia de la adaptación del cono patrón en la calidad del sellado apical en 43 dientes monorradiculares extraídos, usando técnica de condensación lateral para la obturación. Sus resultados establecieron que la mayor incidencia de microfiltración en conductos con conos principales adaptados no se diferenciaba estadísticamente de aquellos conductos en los que el cono principal no estaba adaptado. Del mismo modo, el criterio visual y táctil ha sido utilizado para adaptar el cono principal a un punto clínicamente aceptable. Sin embargo, la adaptación del cono principal establecido por el criterio radiográfico ha demostrado ser más efectivo que el método táctil. La microfiltración de los conductos obturados con condensación lateral se ha relacionado directamente a la forma de preparación del conducto.(2) Yared et al.(127) evaluaron la influencia de la conformación apical sobre la habilidad del sellado de la técnica de compactación vertical en 60 dientes anteriores. La mitad de estos dientes fueron preparados hasta una lima 25 y la otra mitad hasta una lima 40. La microfiltración apical fue determinada usando filtración fluida presurizada a 90 min, 6 h, 1 día, 4 días, y 1, 2, 4, 8, 12, 16 y 24 semanas posterior a la obturación de los conductos. Se observó una tendencia de filtración en el tiempo en ambos grupos. Sin embargo, el grupo con una preparación apical hasta el instrumento #25 mostró significativamente menos filtración que el grupo con preparación hasta la lima número #40. Esta diferencia comenzó a ser mas evidente al comienzo de la décima segunda semana luego de la obturación(127).
Delle Done y Wallace(24) realizaron un estudio en 120 dientes monorradiculares para comparar las técnicas de condensación lateral con Ultrafil®(Hygienic,Corp.,Akron OH), Succesfill® y Thermafil®(Tulsa Dental Products) (con transportador plástico, de titanio y de acero inoxidable). Esta comparación se realizó tanto en un microscopio electrónico de barrido como con la penetración de tinte de azul de metileno. Evidenciaron que la técnica de condensación lateral permite una filtración significativamente menor que las otras técnicas. Lares-Ortiz y El Deeb(59) llevaron a cabo un estudio con la finalidad de evaluar la capacidad del sellado que brinda el dispositivo Thermafil®(Tulsa Dental Products) tanto en conductos rectos como en conductos curvos. Ellos afirman que la técnica de Thermafil® dió como resultado obturaciones que se adaptan a las paredes de los conductos tan bien como las producidas por la técnica de condensación lateral. En este estudio, la condensación lateral permitió menos filtración que la técnica Thermafil®. Evans y Simon(34) estudiaron el efecto de la presencia o ausencia de la capa de desecho en el sellado del tercio apical, utilizando dos técnicas de obturación de condensación lateral e inyección de gutapercha termorreblandecida, Obtura (Unitek, Monrovia, CA) con o sin cemento sellador. Los dientes de todos los grupos fueron irrigados con hipoclorito de sodio al 5,25%, y en los casos donde la capa de desecho fue removida, se combinó con la sal disódica del acido etilendiaminotetracético con bromuro de cetil-trimetil-amonio (EDTAC) al 17%. Se encontró que con ambas técnicas de obturación se obtuvo un adecuado sellado apical. Con este estudio se puede concluir que la capa de desecho no ejerce un efecto apreciable en el sellado del tercio apical. Se observó que el uso de la técnica de inyección de gutapercha termoreblandecida en ausencia de la capa de desecho favorece la entrada del material a los tubulos dentinarios. Venturi et al.(117) mediante una técnica modificada de transparentación, observaron conductos accesorios a través de la obturación con técnica de condensación vertical y la aplicación de uno o dos cementos selladores diferentes; AH-Plus® (Dentsply DeTrey GMBH,Konstanz,Germany) y Pulp Canal Sealer® (Kerr Co.,Romulus MI,USA) en 10 molares superiores extraídos, los cuales fueron divididos en dos grupos de 5 cada uno, tomando como muestra 15 conductos en cada grupo. A nivel del tercio apical, se evidenció ausencia de relleno en un 26,8 y 58,1% con AH-Plus y Pulp Canal Sealer respectivamente. Un relleno parcial con cemento sin gutapercha fue observado en un 5,3% del grupo de AH-Plus y un 29,0% del grupo de Pulp Canal Sealer. El relleno completo con cemento sin gutapercha fue observado en un 50,0% y 9,7% con AH-PLUS y Pulp Canal Sealer respectivamente. Un sellado completo con cemento y parcial con gutapercha asi como el relleno completo con cemento y gutapercha fueron observados en un número pequeño de conductos laterales; 17,9% del grupo perteneciente a AH-Plus y un 3,2% en el de Pulp Canal Sealer.(117) (Gráficos 19-20)
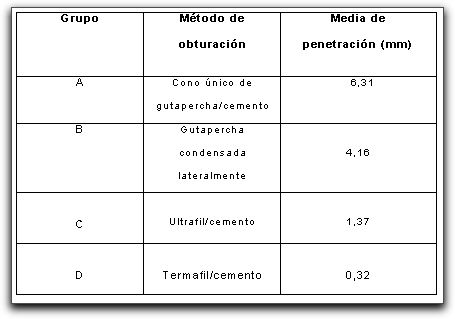
Timpawat et al.(114) investigaron el efecto de la remoción de la capa de desecho sobre la microfiltración apical en dientes preparados con EDTA y obturados con gutapercha termoplastificada usando Obtura II® (Obtura corporation, Fenton MO) y Ketac-Endo® (ESPE, Seefeld, Germany) como cemento sellador. Los resultados de este estudio confirmaron que la remoción de la capa de desecho causa una mayor microfiltración apical (p<0.005) que cuando la capa de desecho se deja intacta. Beatty et al.(6) estudiaron a través de 80 caninos superiores e inferiores, el promedio de filtración apical observada luego de sellar los conductos con cuatro diferentes técnicas de obturación; cono único de gutapercha, gutapercha condensada lateralmente, Ultrafil®(Hygienic Corp. Akron OH), y Thermafil® (Tulsa Dental Products). Se realizó un análisis de penetración lineal de tinte, para poder establecer el valor de filtración, realizando el seccionamiento longitudinal de los dientes (Tabla III). Los dientes con obturaciones de cono único no se observaron bien en los tercios medio y coronal; sin embargo, en el tercio apical de las raíces, el cono de gutapercha se mostró en íntimo contacto con las paredes del conducto. A su vez, la obturación con gutapercha condensada lateralmente también se observó muy bien adaptada, a pesar de que se evidenció una diferencia significativa en el valor medio de filtración apical para los dos grupos. Del mismo modo se describe que las obturaciones con gutapercha termoplastificada tenían una apariencia uniforme, completa y homogénea. En los casos obturados con Ultrafil® se notó una marcada tendencia a la sobreobturación.(6)
Haddix et al.(47) compararon la capacidad de sellado apical de dos técnicas de obturación con Thermafil®(Tulsa Dental Products) y la técnica de gutapercha condensada lateralmente, con base en un estudio espectrofotométrico del nivel de penetración de tinte. En este estudio se evidenciaron diferencias significativas en el valor medio de filtración de tinte entre los tres grupos. La data señala que el grupo de condensación lateral ofrece la menor filtración apical, mientras que el grupo que evidenció la mayor filtración fue el Thermafil®. McMurtrey et al.(64) realizaron un estudio para establecer si existía alguna diferencia en el sellado apical producido por la condensación lateral y el producido por el Thermafil® (Tulsa Dental Products) en conductos con curvaturas pronunciadas. Utilizaron molares extraídos de humanos con conductos que presentaron curvaturas mayores de 30 grados. Los resultados de este estudio arrojaron una media de 1,15mm para los dientes obturados con Thermafil® y una media de 1,09mm para los dientes obturados con condensación lateral. Concluyeron que la técnica de Thermafil® permite una penetración de tinte similar a la que permite la técnica de condensación lateral. Krell y Madison(54) compararon la capacidad de sellado apical del cemento de fosfato de calcio con el cemento de Grossman. 22 dientes anteriores fueron instrumentados, de los cuales, 2 sirvieron de grupo control; 10 de ellos, fueron obturados utilizando cemento de Grossman, gutapercha y condensación lateral, mientras que en los diez restantes se empleó la misma técnica, pero con la utilización de cemento de fosfato de calcio. Los resultados demostraron que el cemento de fosfato de calcio no ofreció un sellado apical tan adecuado como el cemento de Grossman en las condiciones experimentales usadas. Dallat y Spangberg(20) compararon el nivel de filtración apical con una técnica de tinte al vacío por rastreo controlada en conductos obturados con 5 métodos de obturación; técnica de cono único, condensación lateral, condensación vertical, Thermafil®(Tulsa Dental Products) y Ultrafil®(Hygienic,Coltene/ Waledent.,USA). No se reportó diferencia significativa entre ninguno de los grupos con respecto a la filtración apical observada en cada una de las muestras. Sin embargo, el grupo que ofreció mayor nivel de filtración fue el de condensación vertical, mientras que el grupo de menor filtración fue el de Thermafil®. ElDeeb et al.(33) establecieron la relación entre la filtración apical y la densidad radiográfica obtenida con la técnica de McSpadden de gutapercha caliente y la condensación lateral en 60 incisivos centrales superiores extraídos. Usando tintura de azul de metileno al 2% como detector, se estableció la calidad del sellado apical midiendo la filtración lineal y volumétrica de la tintura. No se evidenciaron diferencias significativas entre los grupos respecto a las densidades promedio a nivel apical. En el tercio medio de la raíz, la técnica de McSpadden demostró menor densidad que las otras técnicas. La medición lineal y volumétrica de la filtración apical de la tintura demostró que la técnica de la gutapercha caliente permite menos filtración que las otras técnicas. Así mismo, se encontró una evidente correlación entre la densidad radiográfica y la filtración, especialmente en el tercio medio de la raíz.(33) Manocci y Ferrari(62) compararon a través de 32 dientes preparados quimiomecánicamente, el sellado apical de raíces obturadas con dos tipos de agentes de enlace de dentina, gutapercha y resina-epoxy-base como cemento sellador. Estos fueron divididos en 3 grupos experimentales, para luego, comparar mediante una prueba de tinte y determinar la microfiltración apical in vitro de obturaciones realizadas con cementos selladores a base de resina-epoxy usadas en conjunto con dos agentes de enlace para dentina y la condensación lateral con gutapercha realizada solo con cemento sellador a base de resina-epoxy. Concluyeron que todas las muestras demostraron penetración del tinte en varios grados y el material observado con mayor frecuencia a nivel del ápice fué el mostrado por el grupo 1, es decir, aquellos que fueron obturados con la tecnica de condensación lateral con gutapercha y adhesivo dental All Bond 2® (Bisco,Itasca;IL) y resina-epoxy como cemento sellador. (62) Brosco et al.(12) compararon el sellado apical de conductos radiculares con diferentes técnicas de obturación, donde 106 incisivos inferiores fueron sometidos a instrumentación con la técnica de paso atrás. Luego de la instrumentación, 100 de estos dientes fueron divididos en 5 grupos según la técnica de obturación empleada en cada uno: condensación lateral, onda continua de condensación con System B® (Analytic endodontic, Sybron Endo,USA), gutapercha termoplastificada inyectable con sistema Ultrafil® (Hygienic,Coltene/ Waledent.,USA), gutapercha mecánicamente termoplastificada con el sistema JS Quick-Fill® (JS Dental Manufacturing, Inc.,USA) y gutapercha termoplastificada asociada a un cono principal con sistema microseal® (Analytic endodontic, Sybron Endo USA). El sistema Microseal ha demostrado mejor sellado apical, seguido por el System B®, JS Quick-Fill®, Ultrafil® y condensación lateral. Los resultados estadísticos, han señalado que el sistema Microseal ofrece un sellado similar al del System B®. Del mismo modo, System B® sugiere mejor sellado apical que la técnica de condensación lateral, mientras los grupos obturados con técnica de condensación lateral, Ultrafil® y JS Quick-Fill® cuentan con una capacidad de sellado bastante similar.(12)
Discusión La anatomía del tercio apical, es un factor que concierne de manera directa al especialista en Endodoncia, debido a que el difícil acceso, limpieza y conformación del mismo, en muchas oportunidades impide abarcarlo por completo; comprometiendo el pronóstico del tratamiento y generando serias dificultades en su evolución. La unión cemento-dentinaria, a pesar de ser un punto de referencia histológico que no puede localizarse de manera clínica o radiográfica, es considerado por muchos clínicos e investigadores, como el limite ideal de preparación y obturación del sistema de conductos radiculares. Sin embargo, desde una perspectiva clínica, la constricción apical resulta ser el punto límite más factible en cuanto al manejo para el operador. Las constantes variaciones que ocurren a nivel del ápice radicular durante el transcurrir del tiempo y la imposibilidad de una visualización directa del foramen apical, hacen que la localización radiográfica sea un desafío durante la determinación de la longitud de trabajo. Del mismo modo, se ha establecido que la observación en dos dimensiones de un objeto tridimensional limita en gran medida la correcta interpretación de la dirección del foramen y longitud del conducto radicular. Bajo esta misma premisa, se ha concluido de igual forma que a través del examen radiográfico no es posible determinar cuando el foramen apical no coincide con el ápice anatómico. En cuanto a la determinación de la técnica a emplear para la preparación del sistema de conductos radiculares, se ha señalado que esta debe considerarse a expensas del grado de complejidad anatómica que ofrezca el diente, procesos de resorción, o situaciones de iatrogénia Así mismo, resulta relevante destacar que en curvaturas abruptas es recomendable la preparación del segmento apical con instrumentos manuales, previa a la preparación de los tercios coronal y medio del conducto. En curvaturas pronunciadas, la cavidad de acceso debe extenderse hacia la punta de la cúspide relacionada con el conducto a tratar. Esta acción reducirá el grado de curvatura en la parte coronal del conducto permitiendo un mejor acceso al tercio apical. Por otro lado, se ha comprobado a través de numerosos estudios, que ninguna técnica de preparación ofrece la completa limpieza del conducto a nivel del tercio apical, así como ninguna de las técnicas de obturación conocidas hasta el momento proporciona una barrera de impermeabilidad absoluta. Hay autores que explican que no se debe instrumentar el foramen apical debido a la anatomía y el comportamiento de los instrumentos en el conducto. Así mismo se señala que si la intención fuera limpiar el conducto a nivel del foramen, se requeriría una lima #60 en promedio. Esta medida de instrumento destruiría la constricción apical natural, la cual es de un #30 en promedio de las serie ISO. La selección de un cono patrón de gutapercha con diámetro similar al del conducto en su porción apical es decisiva para la calidad de la obturación. Sin embargo, se han reportado estudios que señalan que la mayor incidencia de microfiltración en conductos con conos patrones adaptados no se diferencia estadísticamente de aquellos conductos en los que el cono patrón no estaba adaptado. En conductos sobreobturados, los tejidos periapicales se han visto irritados tanto químicamente por medio de los ingredientes de los cementos para el conducto; como mecánicamente por medio del material de obturación radicular. El examen histológico de los tejidos periapicales de dientes con conductos sobreobturados, ha mostrado respuestas inflamatorias severas alrededor de partículas de cemento para el conducto radicular y los conos de plata. De esta manera es factible concluir que el mejor pronóstico para el tratamiento endodóncico se basa en una adecuada instrumentación y obturación homogénea a nivel de la constricción apical y el peor pronóstico está relacionado con la instrumentación y obturación más allá de esta.
Conclusiones
Referencias 1. Aguadé EB. Reflexiones clínicas de la terapéutica endodontica a partir de un estudio sobre la morfología apical. Endodoncia 1991; 9:15-21 2. Allison CA, Weber CR, Walton RE. The influence of the method of canal preparation on the quality of apical and coronal seal. Journal of Endodontics 1979; 5: 298 3. Altman M, Gutusso J, Seidberg B, Langeland K. Apical root canal anatomy of human maxillary central incisors. Oral Surgery, Oral Medicine and Oral Pathology 1970; 30:694-698 4. Ardila CN, Wu M-K, Wesselink PR. Percentage of filled canal area in mandibular molars after conventional root-canal instrumentation and after a noninstrumentation technique (NIT). International Endodontic Journal 2003; 36:591-598. 5. Azabal M, Kessler F. ¿Hasta donde llegar el limite de nuestra preparación?. Endodoncia 1993; 11:17-21 6. Beatty R, Baker P, Haddix J, Hart F. The efficacy of four root canals obturation techniques in preventing apical dye penetration. Journal of the American Dental Association 1989; 119:633 7. Bergenholtz G, Lekholm U, Milthon R, Engstrom B. Influence of apical overinstrumentation and overfilling on re-treated root canals. Journal of Endodontics 1979; 5: 310-314 8. Bourgeois RS, Lemon RR. Dowel space preparation and apical leakage: Journal of Endodontics 1981; 7: 66-69. 9. Bóveda C. Obturación endodontica con técnica de Johnson. Acta Odontológica. Venezolana 1992; 30:41-47. 10. Bradford CE, Eleazer PD, Downs KE, Scheetz JP. Apical pressures developed by needles for canal irrigation. Journal of Endodontics 2002: 28: 333-335. 11. Briseño MB, El-Sayed MA, Willershaunsen ZB. Morphology of the physiological foramen: I. Maxillary and Mandibular molars. Journal of Endodontics 2004: 30: 321-328. 12. Brosco VH, Bernardineli N, Moraes IG. "In vitro" evaluation of the apical sealing of root canals obturated with different techniques. Journal Applegate Oral Science 2003; 11:181-5. 13. Buchannan L.S. Negotiating root canals to their termini. Dentistry Today 2000; 19: 60-71 14. Buchannan L.S. The predefined preparation comes of age. Endodontic Practice 2001 ;12: 6-18 15. Burch JC, Hulen S. The relationship of the apical foramen to the anatomic apex of the tooth root. Oral Surgery, Oral Medicine, and Oral Patology 1972; 34:262-8 16. Cailleteau JG, Mullaney TP. Prevalence of teaching apical patency and various instrumentation and obturation techniques in United States dental schools. Journal of Endodontics 1997; 23:394-6. 17. Cohen S, Burns R. Las vías de la pulpa. 7ma ed. San Francisco (CA): Edit Harcourt; 1999. 18. Coolidge ED. Anatomy of the root apex in relation to treatment problems. Journal of the American Dental Association 1929; 1456-1465. 19. Chapman CE. A microscopy study of the apical region of human anterior teeth. Journal of the British Endodontic Society 1969; 3: 52-58. 20. Dallat DM, Spangberg LS. Comparison of apical leakage in root canals obturated with various gutta-percha techniques using a dye vacuum tracing method. Journal of Endodontics 1994; 20:315-9. 21. Davis WL. Histología y embriología bucal. Interamericana McGraw-Hill. 1998 p. 51 22. Davis W. Pulpectomy vs. pulp extirpation. Dental Items of interesting 1922; 44:81-100. 23. De Deus Q. Frecuency, location and direction of the lateral, secondary and accessory canals. Journal of Endodontics 1975; 1: 361-366. 24. Delle Done D, Wallace JA. Comparison of obturation technique with SEM and dye penetration. Journal of Endodontics 1992; 18:186. 25. Diab M, Stallard R. A study of the relationship between epithelial root sheat and root development, Periodontics 1965; 3:10. 26. Diaz JV. Comparación de hallazgos radiológicos y de transparentación en la anatomía de conductos radiculares. Trabajo especial para optar al titulo de Doctor en Odontología. Universidad Central de Venezuela;1976. 27. Druttman A. Access cavity design in curved canals- Is it time to rethink? Endodontic Practice 2001;4(5):21-28 28. Dummer PM, McGinn J, Rees D. The position and topography of the apical canal constriction and apical foramen. International Endodontic Journal 1984: 17,192-198. 29. Ehrlich D, Boyer T, Hicks L, Pelleu G.B. Effects of sonic instrumentation on the apical preparation of curved canals. Journal of Endodontics 1989; 15:200-203. 30. ElAyouti A, Weiger R, Lost C. Frequency of overinstrumentation with an acceptable radiographic working length. Journal of Endodontics 2001; 2:49-52. 31. ElAyouti A, Weiger R, Lôst C.The ability of Root ZX apex locator to reduce the frequency of overestimated radiographic working length. Journal of Endodontics 2002; 28:116-119. 32. ElDeeb ME, Nguyen TQ, Jensen JR. The dentinal plug: its effect on confining substances to the canal and on the apical seal. Journal of Endodontics 1983; 9:355. 33. ElDeeb ME, Zucker KJ, Messer H. Apical leakage in relation to radiographic density of Gutta-percha using different obturation techniques. Journal of Endodontics 1985; 11:25-9. 34. Evans JT, Simon JH. Evaluation of the apical seal produced by injected thermoplasticized gutta-percha in the abscense of smear layer and root canal sealer. Journal of Endodontics 1986; 12:101-107. 35. Fava LR, Siqueira JF. Considerations in working length determination. Endodontic Practice 2000; 3(5): 22-33. 36. Gani O, Visvisian C. Apical canal diameter in the first upper molar at various ages. Journal of Endodontics 1999; 25:689-691. 37. Garcia FP, Santos LL, Carvalho KB, Menezes R, Letra AM. Cleaning ability of rotary instrument in the apical third of curved molars. Revista Facultad Odontologia Bauru 2002; 10:253-6. 38. George JW, Michanowitz AE, Michanowitz JP. A method of canal preparation to control apical extrusion of low temperature thermoplasticized gutta-percha. Journal of Endodontics 1987; 13:18. 39. Ghassan M. Yared, Fadia E. Bou Dagher. Apical enlargement: Influence on the sealing ability of the vertical compaction technique. Journal of Endodontics 1994; 7:313-314. 40. Glossary: contemporary terminology for endodontics. 6th ed. Chicago: American Association of Endodontist;1998 41. Goldberg F, Soares I. Endodoncia Técnica y Fundamentos. Buenos Aires: Editorial Médica Panamericana; 2002: p.102-110. 42. Goldberg F, Massone E. Patency file and apical transportation: An in vitro study. Journal of Endodontics 2002; 28:510-11. 43. Green D. Stereomicroscopic study of 400 root apices of maxillary and mandibular posterior teeth. Oral Surgery, Oral Medicine and Oral Pathology 1956; 9:1224-1232. 44. Green D. Stereomicroscopic study of 700 root apices of maxillary and mandibular posterior teeth. Oral Surgery, Oral Medicine and Oral Pathology 1960;13: 728-733. 45. Grove C. Why root canals should be filled to the dentinocemental junction. Journal of the American Dental Association 1930; (2): 293-296. 46. Gutierrez JH, Brizuela C, Villota E. Human teeth with periapical pathosis after overinstrumentation and overfilling of the root canals: a scanning electron microscopy study. International Endodontic Journal 1999; (32) 40-48. 47. Haddix JE. Jarrel M, Mattison GD, Pink FE. An in vitro investigation of the apical seal produced by a new thermoplasticized gutta-percha obturation technique. Quintessence International 1991;22:159. 48. Harrán PE, Vilar FJ. The cemento-dentino-canal junction, the apical foramen and the apical constriction: Evaluation by optical microscopy. Journal of Endodontics 2003; 29:214-19. 49. Hess W, Formation of root canals in human teeth. The Journal of the National Dental Association 1921;8:704-791. 50. Holland R et al. Tissue reactions following apical plugging of the root canal with infected dentin chips. Oral Surgery, Oral Medicine and Oral Pathology 1980;49: 366. 51. Ingle J, Backland. Endodoncia. 5ta Edición. McGraw-Hill Interamericana. México. 2002. 52. Kerekes K, Tronstad L. Long-term results of endodontic treatment performed with a standardized technique. Journal of Endodontics 1979; 5:83-90. 53. Kramer IR. The vascular architecture of the human dental pulp. Arch Oral Biology. 1960; 2:177. 54. Krell KV, Madison S. Comparison of apical leakage in teeth obturated with calcium phosphate cement or Grossman's cement using lateral condensation. Journal of Endodontics 1985; 11:336-339. 55. Kuttler Y. Microscopic investigation of root apices. Journal of the American Dental Association1955; 50:544-52. 56. Kuttler Y: Endodoncia práctica para estudiantes y profesionales de odontología. Mexico, Editora "A.L.P.H.A".1961; p. 303-330. 57. Laguna CM, Zinman E, Kuttler KS. Comparison of the first file that fits at the apex, before and after early flaring. Journal of Endodontics 2001; 27:113-115. 58. Langeland K. The histopatologic basis in endodontic treatment. Dental Clinics of North America. Philadelphia and London: WB Saunders Co., 1967;p. 491-520. 59. Lares-Ortiz C, ElDeeb ME. Sealing ability of the thermafill obturation technique. Journal of Endodontics 1989;15:177. 60. Lasala Carreras, A. Endodoncia. 4ta edición. Masson-Salvat. 1992; p.6-16 61. Madeira MC, Hetem S. Incidence of bifurcations in mandibular incisors. Oral Surgery, Oral Medicine and Oral Pathology 1973; 36: 589-591 62. Manocci F, Ferrari M. Apical seal of roots obturated with laterally condensed gutta-percha, epoxy resin cement, and dentin bonding agent. Journal of Endodontics 1998; 24:41-44. 63. Mauger MJ, Schindler WG, Walker WA. An evaluation of root canal morphology at different levels of root resection in mandibular incisors. Journal of Endodontics 1998; 24: 607-609. 64. McMurtrey LG, Kreli KV, Wil Cox LR. A comparation between Thermafil and lateral condensation in highly curved canals. Journal of Endodontics 1992;18:68. 65. Melius B, Jiang J, Zhu Q. Measurement of the distance between the minor foramen and the anatomic apex by digital and conventional radiography. Journal of Endodontics 2002;28:125-6. 66. Mendoza MM, Reader A, Meyers WJ, Marquard JV. An ultraestructural investigation of the human apical pulp in irreversible pulpitis. II. Vasculature and connective tissue. Journal of Endodontics 1987; 13:318-327. 67. Mizutani T, Okuo W, Nakamura H. Anatomical study of the root apex in the maxillary anterior teeth. Journal of Endodontics 1992; 18:344-7. 68. Molven O. The apical level of root fillings. Acta Odontologica Scandinavica. 1976; 34: 89-105. 69. Moodnick R, Hempstead NY. Clinical correlation of the development of the root apexes and surrounding structures. Oral Surgery, Oral Medicine and Oral Pathology 1963; 16: 600-607. 70. Nalbandian J, Gonzalez F, Sognnaes en Selter S. Consideraciones biológicas en los procedimientos endodonticos. New York (NY): Edit Mundi Saic y F;1979. p.14. 71. Nicholls E. Lateral radicular disease due to lateral branching of the root canal. Oral Surgery, Oral medicine and Oral pathology 1963; 16:839-845. 72. Nguyen TN. Otturazione del canale radicolare. In: Cohen S, Burns R. eds Clinica e Terapia dele pulpopate. 2nd ed. Padova Italy: Piccin p.131-89. 73. Olson AK, Goerig AC, Catavaio RE, Luciano J. The ability of the radiography to determine the location of the apical foramen. International Endodontic Journal 1991; 24:28-35. 74. Orban B. Development and growth of teeth. Oral Histology and Embriology. 10th ed. St. Louis, CV: Mosby;1985. 75. Ounsi HF, Haddad G. In vitro evaluation of the reliability of the Endex electronic apex locator. Journal of Endodontics 1998; 24:120. 76. Palmer MJ, Weine FS, Healey HJ. Position of the apical foramen in relation to endodontic therapy. Journal Canadian Dental Association 1971; 8: 305-308. 77. Parris J, Wilcox L, Walton R. Effectiveness of apical clearing: histopatological and radiographic evaluation. Journal of Endodontics 1994; 20:209. 78. Pashley DH, Fogel HM, Marshall FJ. Effects of distance of the pulp and thickness on the hydraulic conductance of human radicular dentin. Journal Dental Research 1988;67:1381. 79. Pineda F, Kuttler Y. Mesiodistal and buccolingual roentgenographic investigation of 7275 root canals. Oral Surgery, Oral medicine and Oral pathology 1972; 35:101-10. 80. Portenier I, Lutz F, Barbakow F. Preparation of the root canal by Lightspeed and step-back techniques. International Endodontic Journal 1998; (31) 103-111. 81. Provenza DV. Oral histology. Inheritance and development. Philadelphia, PI.USA: Lippincott. p. 298-303. 82. Pucci F, Reig R. Conductos radiculares. Montevideo. 1945; Tomo I, p.145 y ss. 83. Reader A, Foreman D.W. An ultraestructural qualitative investigation of human intradental innervation. Journal of Endodontics 1981;7:161-8. 84. Reddy SA, Hicks ML. Apical extrusion of debris using two hand and two rotary instrumentation techniques. Journal of Endodontics. 1998;24:180-3. 85. Ricucci D. Apical limit of root canal instrumentation and obturation, part.1. Literature review. International Endodontic Journal 1998: 31,384-393. 86. Ricucci D, Langeland K. Apical limit of root canal instrumentation and obturation, part.2. -A histological study-. International Endodontic Journal 1998: 31,394-409. 87. Ruddle CJ. Current concepts for preparing the root canal system. Dentistry Today. 2001; 20(2):76-83. 88. Ruddle CJ. Finishing the apical one-third. Endodontic Practice. 2002; 9:15-24. 89. Russell,DL. The distribution of glycogen in bovine dental pulp. Journal Dental Research 1967; 46:1182. 90. Saad AY. Al-Yahya. The location of the cementodentinal junction in single-rooted mandibular first premolar from Egypctian and Saudi patients: A histological study. International Endodontic Journal 2003 ;36,541-544. 91. Safavi K, Horsted P, Pascon EA, Langeland K. Biological evaluation of the apical dentin chip plug. Journal of Endodontics 1985;11(1):18-24. 92. Seidberg BH, Alibrandi BU, Fine H, Logue B. Clinical investigation of measuring working length of root canals with an electronic device and with digital-tactil sense. Journal of the American Dental Association 1975; 90:379. 93. Seltzer S. Consideraciones biológicas en los procedimientos endodonticos. New York (NY): Edit Mundi Saic y F;1979. p.1-27. 94. Seltzer S, Bender IB, Turkenopf S. Factors affecting successful repair after root canal therapy. Journal of the American Dental Association 1962; 67: 651-61. 95. Seltzer S, Bender IB, Ziot M. The dynamics of pulp inflammation: Correlation between diagnostic data and actual histologic findings in the pulp. Oral Surgery, Oral Medicine and Oral Pathology 1963;16: 846-969. 96. Seltzer S, Turkenopf S, Vito A, Green D, Bender IB. A histologic evaluation of periapical repair following positive and negative root canal cultures. Oral Surgery 1964; 17:507. 97. Seltzer S, Soltanoff W, Bender IB, Ziontz M. Biologic aspects of endodontics. Part I: Histologic observations of the anatomy and morphology of root apices and surrounding structures. Oral Surgery, Oral Medicine and Oral Pathology 1966: 22,375-385. 98. Seltzer S, Soltanoff W, Sinai I, Goldenberg A, Bender IB. Biologic aspects of endodontics. Part III.Periapical tissue reactions to root canals instrumentation. Oral Surgery, Oral Medicine and Oral Pathology 1968; 26,534-46; 694-705. 99. Seltzer S, Soltanoff W, Sinai I, Smith.J. Biologic aspects of endodontics. Part IV.Periapical tissue reactions to root-filled teeth whose canals had been instrumented short of their apices. Oral Surgery, Oral Medicine and Oral Pathology 1969;28:124-38. 100. Serota K, Nahmias Y, Barnett F, Brock M, Senia S. Predicatble Endodontic success: the apical control zone. Dental Today. 2003;22:90-7. 101. Serota K, Nahmias Y. Predictable endodontic success: The hybrid approach-Part I. Oral Healht 2003; 5:41-48 102. Schilder H. Clearing and shaping the root canal. Dental Clinic of North America 1974; 18:269. 103. Siqueira JF. Microbial causes of endodontics flare-ups. International Endodontic Journal 2003; 36: 453-463. 104. Siqueira JF, Araujo MC, Garcia P, Fraga R, Sabóia C. Histological evaluation of the effectiveness of five instrumentation techniques for cleaning the apical third of root canals. Journal of Endodontics 1997:23; 499-502. 105. Sjogren U, Hagglund B, Sundqvist G, Wing K. Factors affecting the long-term results of endodontic treatment. Journal of Endodontics 1990:16; 498-504. 106. Skillen WG. Morphology of root canals. Journal of the American Dental Association 1932; 19(5): 719-735. 107. Stabholz A, Rostsein I, Torabinejad M. Effect of preflaring on tactile detection of the apical constriction. Journal of Endodontics 1995:21;92. 108. Stallard, RE en Seltzer Consideraciones biológicas en los procedimientos endodonticos. Edit Mundi 1979. 109. Strindberg LZ. Dependence of the results of pulp therapy on certain factors. An analytical study based on radiographic and clinical follow-up examination. Acta Odontologica Scandinavica 1956; 14: (Suppl.21). 110. Swartz DB, Skidmore AE, Griffin JA. Twenty years of endodontic success and failure. Journal of Endodontics 1998; 9: 198-202. 111. Tam A, Yu D. Location of canal isthmus and accessory canals in the mesiobuccal root of maxillary first permanent molars. Journal Canadian Dental Association. 2002;68:28-33. 112. Tan BT, Messer HH. The effect of instrument type and preflaring on apical file size determination. International Endodontic Journal 2002; 35,752-58. 113. Ten Cate AR. Oral histology, development, structure and function. 2nd ed. St. Louis. Mosby; 1985. 114. Timpawat S, Vongsavan N, Messer HH. Effect of removal of the smear layer on apical microleakage. Journal of Endodontics. 2001;27: 351-3. 115. Torneck CD, Torabinejad M. Biology of the pulp and periapical tissues. In: Walton R.E. Torabinejad M. Principles and practice of endodontics. 2nd ed.Philadelphia. Pi, USA: Saunders, pp 6-28. 116. Vande Voorde HE, Bjorndhal AM. Estimating endodontic working length with paralleling radiographs. Oral surgery, Oral Medicine and Oral pathology 1969;27:106-110. 117. Venturi M, Prati C, Capelli G, Falconi M, Breschi L. A preliminary analysis of the morphology of lateral canals after root canal filling using a tooth-clearing technique : International Endodontic Journal 2003 ;36,54-56. 118. Weiger R, John J, Geigle, Lôst C. An in vitro comparison of two moderns apex locator. Journal of Endodontics 1999:25; 765-8. 119. Weine F. Endodontic therapy. 4th ed. Saint Louis MI. USA Mosby pp 277-369. 120. Weine F, Kelly R, Lio P. The effect of preparation procedures on original canal shape and on apical foramen shape. Journal of Endodontics 1975; 1: 255-262. 121. West J, Roane D. Sistemas de limpieza y conformación de los conductos radiculares. Cap. 8 en: Los caminos de la pulpa. 7ma ed. p. 209-210. 122. Wildey W, Senia S. Another look at root canal obturation: part one. Endodontic Practice 2002; 5:(4)33-38. 123. Wu M-K, Wesselink PR. Efficacy of three techniques in cleaning the apical portion of curved root canals. Oral Surgery, Oral Medicine and Oral Pathology 1995; 79:492-6. 124. Wu M-K, Bing F, Wesselink PR. Leakage along apical root fillings in curved root canals. Part I: Effects of apical transportation on seal of root fillings. Journal of Endodontics 2000; 26: 210-216. 125. Wu M-K, Wesselink PR, Walton R. Apical terminus location of root canal treatment procedures. Oral Surgery, Oral Medicine, Oral Pathology 2000; 89:99-103. 126. Wu M-K, R'oris A, Barkis D, Wesselink PR. Prevalence and extent of long oval canals in the apical third. Oral Surgery, Oral Medicine and Oral Pathology 2000; 89 (6):739-743. 127. Yared G, Bou Dagher F. Apical enlargement: Influence on the sealing ability of the vertical compactation technique. Journal of Endodontics. 1994; 20: 313-314. 128.Yun HH. Kim SK. A comparison of the shaping abilitiesnof 4 niquel-titanium rotary instruments in simulated root canals. Oral Surgery, Oral Medicine and Oral Pathology 2003; 95 (2):228-33. 129. Zander HA, Hurseler B. Continuous cementum apposition: Journal of Dental Research 1958; 37:501-504. 130. Zerosi C. Comparative histochemical observations of different pulp region. Journal of Dental Research 1967; 46:1246.
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||