![]()
![]()
![]()
![]()
![]()
 |
 |
|
|

![]()
![]()
Invitado # 35 : (Octubre 2003)
"Efecto de los Compuestos Eugenólicos en los Materiales Utilizados en Endodoncia Sobre la Unión de los Sistemas Adhesivos "
por Carlos Javier Otamendi Saade
Odontólogo, Universidad Central de Venezuela, 1998
Especialista en Endodoncia, U.C.V., Venezuela, 2001-2002
e-mail: carlosotamendi@cantv.net
Resumen
Son diversos los tipos de cementos y sus aplicaciones en odontología. Es así como podemos encontrar cementos resinosos, cementos de ionómero de vidrio, de fosfato de zinc, policarboxilato de zinc y cementos cuya base lo constituye el óxido de zinc-eugenol. Estos últimos se comenzaron a utilizar hace más de un siglo y aún en el presente son aplicados como materiales de obturación provisional y cementado de restauraciones provisionales siendo además parte común de la composición de bases cavitarias, liners y selladores de conductos radiculares. De aparición más reciente, la odontología adhesiva es responsable de una gran revolución en la práctica odontológica. Debido al amplio uso de los sistemas adhesivos y de la frecuente utilización de los cementos de óxido de zinc-eugenol en forma de agentes de cementación, cementos de obturación provisional y selladores eugenólicos en endodoncia, se ha investigado sobre las posibles interacciones que estos últimos pueden tener una vez que han estado en contacto con el tejido dentario y previo a la utilización de un sistema adhesivo. Por ser el eugenol un recolector de radicales libres, puede ser capaz de inhibir el proceso de polimerización de materiales resinosos lo que puede ocasionar la reducción de la resistencia de unión de los sistemas adhesivos al diente y un aumento de la microfiltración entre resina y sustrato.
Introducción
Los cementos de óxido de zinc-eugenol son uno de los materiales más utilizados en odontología restauradora y en endodoncia. Esto se debe a su bajo costo, fácil manipulación y remoción, a sus propiedades antibacterianas y sedantes, además de proveer un buen sellado cavitario.
Sin embargo, se ha sugerido que el eugenol presente en ellos tiene un efecto negativo sobre la unión de los sistemas adhesivos ampliamente utilizados. También se ha mencionado que las propiedades físicas de los materiales resinosos restauradores se ven afectadas negativamente al estar en presencia de restos de algún material eugenólico. Esto se podría traducir en fracasos causados por una resistencia adhesiva disminuida, fallas en el adaptado marginal y microfiltración de las restauraciones. De allí la importancia de conocer los efectos reales de los cementos eugenólicos sobre los sistemas adhesivos.
El objetivo de este trabajo especial de grado es descubrir si los materiales eugenólicos utilizados en endodoncia producen algún efecto sobre la unión de los sistemas adhesivos a la estructura dentaria.
Cementos Eugenólicos
Generalidades de los cementos: Un cemento se describe como aquella sustancia que sirve para unir, pegar, adherir dos cosas. Desde el punto de vista estructural y de composición son materiales que se preparan a partir de la combinación de un polvo con un líquido. 54
Desde el punto de vista químico, el polvo está constituido por una base (hidróxido u óxido básico) y el líquido es una solución de un ácido en agua. Una vez mezclados se obtiene una masa plástica, constituida por una fase sólida (el polvo) y una fase líquida (el ácido o solución ácida). 54
El líquido produce un ataque químico de la superficie del polvo generando nuevos compuestos resultantes de dicha reacción, en otras palabras, no todo el polvo es atacado por el líquido, fundamentalmente por la carencia de líquido. La estructura del cemento, una vez endurecido y observada al microscopio, está formada por dos componentes: los núcleos (partículas de polvo sin reaccionar) y la matriz (englobando los núcleos y es la que se forma por los productos resultantes de la reacción del polvo). A ésta se le conoce como estructura nucleada. 54
El fraguado de un cemento se produce por: disolución del polvo básico en un líquido ácido, reacción entre lo disuelto y el ácido con formación de sal y precipitación de la sal. 54
En odontología los cementos son utilizados en áreas como restauradora, endodoncia, periodoncia y cirugía. De manera específica, pueden emplearse como base de cavidades, recubridor del órgano dentino-pulpar, agente de cementación y material de restauración. 23, 47
Cementos de óxido de zinc-eugenol: Los cementos de óxido de zinc-eugenol son utilizados en odontología desde 1890.23 Este tipo de cementos constituye uno de los materiales de mayor versatilidad en odontología. Su selección se basa fundamentalmente en sus propiedades biológicas y sus relativamente aceptables propiedades físicas y mecánicas. En este sentido, los cementos de óxido de zinc-eugenol se adaptan bastante bien a las paredes cavitarias, sufren relativamente pocos cambios dimensionales, se disuelven y desintegran con cierta lentitud y presentan un pH casi neutro; sin embargo, tienen una baja resistencia a la compresión y a la tracción al compararse con cementos como el fosfato de zinc.32
El largo tiempo de fraguado de los cementos de óxido de zinc-eugenol se mejoró al agregar cloruros, resinas, nitratos y acetatos, en especial el acetato de zinc. De igual modo, la incorporación de materiales de relleno como resina hidrogenada, polímeros como el poliestireno o el polimetacrilato de metilo, aumentó la resistencia a la compresión y a la tracción, su adaptabilidad y el sellado marginal. 21,47,70
La adición de ácido ortoetoxibenzoico (EBA) como agente quelante en el líquido con el eugenol y la resina hidrogenada junto a cuarzo fundido o alúmina, mejoró las propiedades físicas y mecánicas de forma notable.70 Estos cementos de óxido de zinc-eugenol reforzados han demostrado ser fáciles de manipular y pueden ser tallados sin que ocurra desprendimiento de sus márgenes. Se ha observado que luego de su colocación en dientes sintomáticos sin exposición pulpar la sintomatología desaparece. 23
En el área endodóncica, los cementos eugenólicos se utilizan como medio para obtener un cierre y protección de la cavidad de acceso por tiempo limitado, a fin de evitar el ingreso de líquidos bucales, bacterias y la salida de medicamentos intraconducto. También son utilizados en el sellado de los conductos radiculares, ya sea solos o en combinación con gutapercha. 23, 78
Obturación provisional: La composición general de los cementos de óxido de zinc-eugenol utilizados para obturación provisional consta de un polvo compuesto por óxido de zinc (69% en peso), colofonia blanca (29,3% en peso), estearato de zinc (1% en peso) y acetato de zinc (0,7% en peso). El líquido está constituido por eugenol (85% en peso) y puede contener aceite de oliva (15% en peso). 23
La colofonia blanca es utilizada para reducir la fragilidad del cemento luego de fraguado, el estearato de zinc funciona como plastificante y el acetato de zinc incrementa la resistencia del cemento. 23
Los cementos eugenólicos reforzados con EBA-alúmina contienen un 70% de óxido de zinc y un 30% en peso de alúmina en polvo. El líquido contiene ácido ortoetoxibenzoico en un 62,5% en peso y eugenol en un 37,5%. Otros componentes que pueden ser añadidos son aceite de oliva, vaselina, ácido oleico y cera de abejas. 23
El líquido está formado en un 100% por eugenol (2-metoxi-4-propenil-fenol), también llamado ácido eugénico. Este es un fenol que se extrae del aceite de clavo. Se caracteriza por ser un líquido incoloro o con ligero tono amarillento que se torna marrón al contacto con el aire. El olor y sabor que presenta son particulares. Es soluble en alcohol, cloroformo, éter y aceites volátiles y su solubilidad en agua es muy reducida. El eugenol se utiliza en la fabricación de perfumes, aceites esenciales y en medicinas como germicida activo. 53, 71
Los cementos de óxido de zinc-eugenol se forman por una reacción de quelación que ocurre al unir el eugenol con el óxido de zinc, formando eugenolato de zinc. Su ultraestructura está compuesta por granos de óxido de zinc-eugenol embebidos en una matriz de eugenolato de zinc. Debido a que las unidades de esta estructura son unidas por fuerzas de van der Waals y por interconexión de partículas, estos cementos son mecánicamente débiles. 22, 48, 77
Existen requisitos específicos que regulan las propiedades físicas importantes de los cementos de óxido de zinc-eugenol. Entre estas propiedades se encuentran el espesor de película, el tiempo de fraguado, la resistencia a la compresión y solubilidad. 23
La especificación n.° 30 de la ANSI/ADA (ISO 3107) establece las propiedades que deben cumplir tanto los cementos de óxido de zinc-eugenol como no eugenólicos, utilizados como cementos provisionales, permanentes, materiales para obturación, bases y liners cavitarios. 23
Es así como el espesor de película no debe ser superior a los 25_m y el tiempo de fraguado debe ubicarse entre los 2 y 10 minutos. La resistencia compresiva requiere un valor máximo de 35 MPa para los cementos de obturación provisional. 4,23
La solubilidad máxima para los materiales de cementación provisional se establece en 2,5% luego de 24 horas, mientras que para los materiales de cementación definitiva el valor es de 1,5%. 23
Selladores endodóncicos: Muchos de los selladores endodóncicos son simplemente cementos de óxido de zinc-eugenol con propiedades modificadas de acuerdo a las necesidades endodóncicas. Entre estas modificaciones tenemos ajuste del tiempo de endurecimiento, viscosidad y radiopacidad. La adición de sustancias como paraformaldehído, corticoesteroides y bálsamo de Canadá, les confieren mayores efectos antimicrobiano, momificante, germicida, antiinflamatorio y cierta adhesión a las paredes dentinarias. 23, 78
Los cementos selladores más comunes en la práctica endodóncica están basados en fórmulas de óxido de zinc-eugenol. La mayoría de estos cementos selladores se fundamentan en las fórmulas de Rickert o Grossman. 23,61,78
El desarrollo de la fórmula de Rickert fue una alternativa a los selladores como eucapercha y cloropercha. Este cemento fue probado por primera vez en 1938 en dientes de perros tratados endodóncicamente. La fórmula consiste en un 41,21% en peso de óxido de zinc, 30% de plata precipitada, 16% de resina blanca y 12,79% de yoduro de timol. El líquido contiene un 78% de aceite de clavo y 22% de Bálsamo de Canadá. 23, 26
Debido al corto tiempo de endurecimiento del sellador de Rickert, Grossman 34 desarrolló una fórmula que suministró un tiempo de trabajo más prolongado. Este sellador estaba compuesto por un polvo que contiene 40% de óxido de zinc, 30% de resina estibelita y subcarbonato de bismuto y sulfato de bario en un 15% cada uno. El líquido contenía eugenol y aceite de almendras dulces. Hoy en día, se han efectuado pequeñas variaciones, como añadirle borato de sodio anhidro en un 1% al polvo y eliminar el aceite de almendras al líquido para dejar el eugenol en un 100%. 61
La resina estibelita proporciona al cemento cierta adhesividad, el subcarbonato de bismuto provee suavidad durante el espatulado y el sulfato de bario aporta mayor radiopacidad. El aceite de almendras dulces retarda el proceso de endurecimiento, así toma aproximadamente 20 minutos luego de su inserción en el conducto radicular para que se inicie el proceso de endurecimiento. 34
Dentro de los cementos basados en estas fórmulas están el sellador Kerr Pulp Canal Sealer® (Kerr Manufacturing Co. Romulus, Mich), sellador de Grossman® y Proco-Sol® (Proco-Sol Chemical Co. Filadelfia, Pa). El sellador de conductos radiculares de Wach® (King´s Specialty Co. Fort Wayne, Ind.) y Tubliseal® (Sybron/Kerr, Orange, CA, Estados Unidos de Norteamérica) constituyen variantes de los cementos selladores a base de óxido de zinc-eugenol. Al primero se le añadió creosota de haya como componente medicinal y el segundo varió la presentación acostumbrada de polvo-líquido a un sistema pasta-pasta. 65
Al igual que los cementos anteriores, la reacción de fraguado de los cementos selladores eugenólicos se produce entre el óxido de zinc y el eugenol. La inclusión de resinas mejora las características de mezcla y aumentan el tiempo de fraguado. La radiopacidad se puede obtener también gracias a las sales de bismuto o polvo de plata. 22,23,77
De manera similar a los cementos eugenólicos para obturación provisional, los cementos selladores deben cumplir con requisitos específicos relacionados con su viscosidad, tiempo de fraguado, espesor de película, resistencia a la compresión, solubilidad, radiopacidad y variación dimensional. 23
La especificación n.° 57 (ISO 6876) hace referencia a los cementos selladores, estableciendo requisitos sobre el tiempo de trabajo, la fluidez, el espesor de película, la estabilidad dimensional, la solubilidad y la radiopacidad. 23
El tiempo de trabajo de estos cementos selladores debe estar ubicado entre los 15 minutos y las 12 horas a temperatura bucal y su fluidez o viscosidad debe oscilar entre 8 y 680 x 103 cp (centipoise). 23
Los espesores de película reducidos se consideran idóneos y deben oscilar entre 80 y 500 _m y en cuanto a la estabilidad dimensional, la mayoría de ellos experimentan contracción durante el fraguado, afectando la integridad de la unión entre el sellador y el diente. En pruebas efectuadas en tubos capilares la pérdida volumétrica oscila entre -0,7 y -5,0% luego de 90 días. 23
La disolución de cemento sellador de conductos radiculares puede liberar componentes biológicamente incompatibles, por lo que la solubilidad en estos materiales es poco deseable. Los valores típicos para estos materiales oscilan entre 0,10 y 3,5%. 23
La radiopacidad es una cualidad deseable a la que se ha establecido un valor mínimo equivalente a 3 mm de aluminio. Para los diferentes selladores la radiopacidad oscila entre 0,10 mm y 0,98 mm de aluminio. 23
Toxicidad del eugenol contenido en los cementos eugenólicos: Las propiedades biológicas de los cementos eugenólicos son un punto importante a considerar y están dadas por el desprendimiento de eugenol a partir de la masa de cemento. 48
Al ser utilizado un sellador endodóncico eugenólico, éste puede estar en contacto con un tejido periapical sano o inflamado. Esta interfase húmeda entre el cemento eugenólico y el tejido permite la liberación de grandes cantidades de eugenol en los tejidos periapicales durante un periodo de tiempo relativamente corto que ha demostrado tener efectos citotóxicos. 56
Concentraciones igual o mayores a 10-2 mol/L de eugenol presentan gran citotoxicidad. El contacto directo de tejido vital con materiales con contenido eugenólico causa inflamación crónica y necrosis, por lo que el máximo beneficio de estos cementos se obtiene evitando el contacto directo con el tejido, permitiendo al efecto analgésico y antiinflamatorio del eugenol predominar sobre su potencial tóxico. 56
El eugenol puede ser, además, un inhibidor competitivo de la síntesis de prostaglandina y leucotrienos cuando sus concentraciones se ubican entre 10-5 y 10-4 mol/L. La liberación sostenida de eugenol a estas concentraciones puede disminuir el proceso inflamatorio periapical. 24, 41, 46, 56
Por otro lado, el eugenol es capaz de inhibir la actividad nerviosa de manera reversible como ocurre con un anestésico local. Sin embargo, a altas concentraciones, el eugenol tiene un efecto neurotóxico causando un bloqueo de la conducción nerviosa de manera irreversible. 16 Ambos efectos a nivel periapical pueden disminuir la percepción de dolor. 56
Al estar presente en concentraciones de 10-4 y 10-3 mol/L el eugenol puede provocar vasodilatación reversible e inhibir la respuesta de vasos sanguíneos a la norepinefrina e histamina. 41
Adicionalmente, a estas concentraciones también es capaz de inhibir de manera reversible la respiración de células de mamíferos. Sin embargo, luego de 12 horas de exposición al eugenol a 10-3 mol/L, estas células son aniquiladas. Concentraciones de 10-3 y10-2 mol/L son suficientes para eliminar un amplio rango de microorganismos de la cavidad bucal. 45
Entre los mecanismos propuestos para explicar la citotoxicidad del eugenol tenemos que su oxidación por parte de las enzimas peroxidasas genera un producto tóxico. También se ha demostrado que el eugenol y otros compuestos relacionados tienen una alta afinidad por las membranas plasmáticas debido a su solubilidad lipídica, lo que puede contribuir al daño celular. Otro mecanismo propuesto es el desacoplamiento de la fosforilación oxidativa a nivel mitocondrial. 48
A pesar de que se ha demostrado la naturaleza tóxica e inflamatoria del eugenol contenido en algunos cementos, éstos han mostrado a través del tiempo un desempeño clínico satisfactorio. 48
Efecto de los cementos eugenólicos sobre la dentina:
El efecto de los cementos eugenólicos sobre la dentina es un punto importante a considerar y se debe al desprendimiento de eugenol a partir de la masa de cemento. La liberación de eugenol ocurre, como se mencionó anteriormente, por la hidrólisis que experimenta el eugenolato de zinc al entrar en contacto con un medio húmedo, lo que provoca liberación de hidróxido de zinc y eugenol. 44, 48, 95
La cantidad de eugenol liberado por el cemento varía de acuerdo a las proporciones de mezcla y disminuye con el tiempo. 44, 95
Hume 44 observó que se establecía un gradiente de concentración 12 horas posteriores a la colocación de un cemento eugenólico en contacto directo con dentina humana intacta. En este estudio in vitro, el gradiente de concentración se mantuvo por un mínimo de 10 semanas. La concentración de eugenol en la dentina subyacente al cemento fue de aproximadamente 10-2 mol/L. mientras que en la dentina más profunda la concentración se ubicó entre 10-4 y 10-5 mol/L.
La concentración de eugenol en dentina de 10-2 mol/L, es suficiente para ejercer un efecto bactericida, aún después de una breve exposición; esto previene la contaminación de la cavidad y contrarresta el pobre sellado que ofrecen los cementos eugenólicos para obturación provisional.40,42,48
A nivel de la dentina radicular, la liberación y concentración de eugenol proveniente del cemento sellador eugenólico debe ser similar por lo que el efecto bactericida también está presente a este nivel. 1, 46
Rotberg y DeShazer 72, estudiaron química e histológicamente la acción del eugenol y de un cemento de óxido de zinc-eugenol sobre dentina humana sana y observaron la presencia de liberación de calcio a partir de este tejido. Dedujeron que la dentina debía experimentar un ligero reblandecimiento luego de la aplicación clínica de eugenol o algún cemento eugenólico.
Sin embargo, Biven et al.10 señalaron que el contacto prolongado del eugenol y cementos selladores eugenólicos con la dentina conduce a un aumento de la microdureza de este tejido en dientes humanos. Este incremento se ve disminuido a medida que se reduce la liberación del eugenol por parte del cemento sellador.
El aumento en la microdureza de la dentina podría ser el resultado de la acumulación del cemento endurecido dentro de los túbulos dentinarios, del aumento de la mineralización de la hidroxiapatita menos cristalizada y de las regiones menos mineralizadas de la matriz dentinaria por efecto del eugenol o por la coagulación o deshidratación del colágeno. 10
ADHESIÓN A LA ESTRUCTURA DENTARIA
Definición de adhesión
La palabra adhesión se deriva del latín adhaes_o y es definida por la Real Academia Española como la fuerza de atracción que mantiene unidas moléculas de distinta especie química. 25
Se puede entender por adhesión a la unión mutua de cuerpos que se hallan en estrecho contacto, mediante fuerzas mecánicas y químicas. 11 Craig 23 define la adhesión como la unión de materiales diferentes mediante la atracción de sus átomos o moléculas. Este proceso de adhesión implica una interacción de sólidos y líquidos entre un material (adhesivo) y otro (adherente) a nivel de una misma interfaz. 7
A nivel dentario, la mayoría de los casos de adhesión consisten en verdaderas articulaciones adhesivas resultado de las interacciones de una capa de material intermedio o adhesivo con dos superficies adherentes, dando lugar a dos interfases adhesivas. 7
El adhesivo es denominado agente o sistema adhesivo y puede ser definido como el material que al ser aplicado a superficies de sustancias sólidas, las une, resistiendo a la separación y transmitiendo cargas a través de la unión. 87
Tipos de adhesión y sus mecanismos
Para poder explicar el proceso de adhesión se han desarrollado 4 teorías: mecánica, de adsorción, de difusión y electrostáticas. 87
La teoría mecánica establece que el adhesivo solidificado se traba de manera micromecánica con las rugosidades e irregularidades de la superficie del adherente. 87
La teoría de adsorción abarca todas aquellas uniones químicas entre el adhesivo y el adherente, incluyendo fuerzas de valencia primarias (iónica y covalentes) y secundarias como hidrógeno, interacción bipolar y dispersión de London. Esta última se presenta casi universalmente ya que se origina y sólo depende de la presencia de núcleos y electrones. 87
La teoría de difusión propone que la adhesión es el resultado de la unión entre moléculas móviles, donde los polímeros de cada lado de una interfase pueden atravesar y reaccionar con moléculas del otro lado. Eventualmente, la interfase desaparece y las dos partes se vuelven una. 87
Por último, la teoría electrostática establece que se forma una capa doble eléctrica en la interfase entre un metal y un polímero. 87
La unión entre fases puede ser catalogada como adhesión química, mecánica o física. La adhesión química se establece al formarse enlaces entre átomos a través de la interfase entre el adhesivo y adherente. 7, 54
En la adhesión mecánica, cuya intensidad dependerá de la traba formada a nivel microscópico entre las irregularidades presentes y la adhesión física donde intervienen interacciones electrostáticas de van der Waals o de otros tipos. 7, 54
La adhesión dental se basa en la unión de tipo mecánico; una unión de tipo químico contribuye en poca medida a la fuerza general de adhesión. 7
Para lograr cualquiera de los mecanismos de unión antes mencionados, es imprescindible lograr una correcta adaptación entre las partes a unir. La ausencia de adaptación es lo que generalmente impide la adhesión entre dos partes sólidas. 54
Es por ello que las técnicas adhesivas requieren aplicar un líquido (adhesivo) sobre un sólido. Esta adaptación dependerá de factores interrelacionados como la energía superficial, la humectación y el ángulo de contacto. 54
Para la adhesión se requiere que las superficies sean atraídas entre sí hacia su interfase. Los átomos que conforman un objeto sólido ubicados en su interior son igualmente atraídos entre sí (fuerza cohesiva), por lo que la distancia interatómica es igual y la energía es mínima. A nivel de la superficie, la energía es mayor debido a que los átomos más externos no son atraídos de igual forma en todas las direcciones. 4, 54
A este incremento de energía por unidad de superficie se le denomina energía superficial y tiende a formar enlaces con otros átomos que se encuentran cerca de la superficie, reduciendo así la energía superficial del sólido. Mientras mayor energía superficial tenga un sólido mayor capacidad de adhesión. 4, 54
Por lo tanto, la energía superficial está dada por las fuerzas de cohesión o uniones químicas "sobrantes" presentes en la superficie de un cuerpo. Los materiales con mayor energía superficial serán aquellos en los que las uniones sean más fuertes. 54
La tensión superficial es esta misma energía libre presente en la superficie de un líquido y se mide en términos de fuerza por centímetro de superficie del líquido. Se ve afectada por factores como la temperatura y la impureza; al aumentar la temperatura, la tensión superficial disminuye. Lo mismo sucede al estar presente cualquier impureza. 23
Existen sustancias que al concentrarse en la interfase líquido-aire o en otras superficies alteran la tensión superficial. La presencia de estas sustancias, denominadas agentes tensoactivos, en el estrato superficial reduce la tracción de la masa del líquido sobre las moléculas superficiales, lo que disminuye la tensión superficial y aumenta la humectación. 23
La humectación se refiere a la capacidad de un líquido de fluir con facilidad sobre toda una superficie y adherirse a ella. La baja tensión superficial de un líquido permite su posible diseminación sobre cualquier sólido que presente una alta energía superficial. Es por ello, que la formación de una unión adhesiva fuerte requiere de la presencia de buena humectación. 4
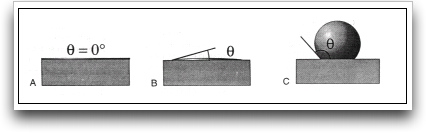
El grado en que un adhesivo humedece la superficie de un adherente se determina por la medición del ángulo formado por el adhesivo con el adherente y su interfase. A este ángulo se le denomina ángulo de contacto. 4, 23, 73, 87
Cuanto mayor es la tendencia de un líquido (adhesivo) a humectar la superficie de un sólido, menor es el ángulo de contacto. La humectación se considera completa cuando el ángulo de contacto alcanza un valor de cero grados. 5,23,87 Para ello es necesario que la tensión superficial del adhesivo sea menor que la energía superficial del esmalte y la dentina.73 Gráfico 1.
La presencia de contaminantes sobre la superficie del sólido conlleva a un aumento del ángulo de contacto lo que disminuye en gran medida la humectación del líquido (adhesivo).5
La mejor adhesión se obtendrá con aquellos adhesivos que sean capaces de formar un ángulo de contacto lo más cercano a cero grados al ser aplicado sobre la superficie de un sólido. 5
 |
|
|
A nivel de la estructura dentaria, la adhesión requiere del contacto íntimo entre la estructura del diente y el material restaurador. 73, 87
La adhesión sobre la estructura dentaria puede inhibirse fácilmente debido a la falta de humectación de los materiales adhesivos sobre la superficie dentaria. La presencia de contaminantes, como exceso de humedad y la capa de detritus formada luego del corte del tejido dentario, disminuye la energía superficial y por ende la humectabilidad, por lo que las paredes cavitarias deben estar libres de estos contaminantes. 73 Su presencia provoca la formación de vacíos a nivel de la interfase y reduce en gran medida la adhesión. 5
La eliminación de los contaminantes y la producción de una textura superficial que haga posible la retención mecánica con el material adhesivo se logra con el uso de agentes acondicionadores o de grabado ácido. 5
Los principios de unión al tejido dentario se basan en una unión mutua del adhesivo y el sustrato los cuales deben estar en íntimo contacto. 73, 87 La unión se obtiene gracias a la ayuda de fuerzas mecánicas y químicas. 11
En odontología cobra mayor importancia la retención mecánica que se produce gracias al aprovechamiento de microporosidades y superficies rugosas para obtener anclaje. 11
La utilización de una sustancia adhesiva líquida con buenas cualidades de humectación para ocupar estas irregularidades superficiales hace posible la obtención de este anclaje micromecánico. 11
ADHESIÓN AL ESMALTE
Características morfohistológicas del esmalte
El conocimiento de la composición, morfología y comportamiento del sustrato constituyen la base para el desarrollo y entendimiento de las interacciones entre los materiales (adhesivos) y el sustrato (estructura dentaria).36 El tejido adamantino maduro se encuentra altamente mineralizado. Contiene un 96% de materia inorgánica, un 1% de materia orgánica y un 3% de agua en relación con su peso. En relación a su volumen presenta un 89% de material inorgánico, un 2% de material orgánico y un 9% de agua. 8
El componente inorgánico corresponde fundamentalmente a fosfato cálcico en forma de cristales de hidroxiapatita. Además, se pueden encontrar pequeñas cantidades de carbonato, magnesio, potasio, sodio y flúor 8, así como aluminio, bario, estroncio, radio y vanadio. 35 Sin embargo la composición exacta varía de un diente a otro, en distintas partes del mismo diente e incluso entre el centro y la periferia del mismo prisma. También, se encuentran productos de degradación de proteínas amelogeninas y no amelogeninas. 8
La unidad histológica básica del esmalte es el prisma, a nivel ultraestructural y submicroscópico, cada prisma está compuesto por una multitud de cristales de hidroxiapatita dispuestos en un patrón tridimensional. 8, 35 El tamaño de cada prisma varía entre 4-7 micrómetros. Tienen su origen en la región cercana a la unión amelo-dentinaria y sigue un curso tortuoso a través de los dos tercios internos del tejido antes de presentar una alineación paralela en el tercio externo del esmalte. 35
Comúnmente, se describe al prisma en forma de agujeros de cerradura entrelazados (patrón 3), sin embargo, no todo el esmalte prismático tiene este patrón. 8
Una forma completamente circular de los prismas (patrón 1) se ubica con mayor frecuencia cerca de la unión esmalte dentina; no obstante se ha descrito una disposición de los prismas en forma de hileras longitudinales (patrón 2). 8
El esmalte superficial presenta una mayor dureza, menor porosidad y solubilidad. Puede no mostrar prismas debido a la disposición paralela de los cristales. 8 Esta área denominada esmalte aprismático es común en las fosas, fisuras y región cervical de los dientes permanentes. Como característica morfológica presenta una apariencia semejante a escamas y a nivel ultramicroscópico sus cristales están apilados paralelamente entre sí y perpendicular a la superficie externa. 35
La región superficial también constituye un área micromorfológica y química compleja. Las secreciones final de los ameloblastos y la atribuida al epitelio del esmalte reducido producen una capa de aproximadamente un micrómetro de espesor rica en componentes orgánicos (hidratos de carbono, proteínas y grasas). Esta capa de baja energía superficial presenta gran importancia en la interacción con biomateriales. 35
Relación de las características del esmalte con la adhesión
Los intentos de obtener adhesión al diente se remontan a 1952 cuando Kramer y McLean efectuaron el primer estudio experimental sobre adhesión. 88
En 1955, Buonocore 17 propone el uso de ácidos sobre la superficie dentaria antes de la aplicación de resinas para hacerla más receptiva a la adhesión. Este procedimiento efectuado con ácido fosfórico sobre la superficie adamantina, demostró aumentar la duración de la adhesión bajo condiciones de humedad.
El procedimiento de grabado ácido sobre el esmalte aumenta su área de superficie para lograr adhesión. La superficie lisa del esmalte es transformada en una superficie irregular y se ha registrado in vivo un aumento de la energía superficial de 28 dinas/cm2 a casi 72 dinas/cm2, lo que favorece a la adhesión. Durante el proceso es removido aproximadamente de 2 a 7 µm de la superficie del esmalte dejando una microcapa porosa de 5 a 50 µm de profundidad. 87
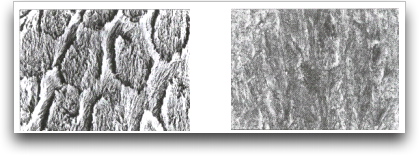
Trabajos como los de Hoffman et al. 43, Silverstone et al. 75 y Gwinnett 37 mostraron que luego del proceso de desmineralización se pueden observar tres diferentes tipos de patrones de grabado. El tipo I presenta una disolución del núcleo del prisma dejando la periferia del mismo casi intacta. Gráfico 2.
 |
|
|
El patrón de grabado tipo II presenta una disolución de la periferia del prisma, dejando el núcleo casi intacto y el tipo III se caracteriza por no presentar evidencias de ninguna estructura prismática. 37, 43, 75 Gráfico 3.
 |
|
|
Aunque el patrón de grabado comúnmente observado corresponde al tipo I, los resultados del estudio de Silverstone et al. 75 sugieren que no existe un patrón de grabado específico producido por la acción del ácido sobre el esmalte dental humano. 37, 75
El patrón de grabado puede ser consecuencia de la diferente solubilidad de los cristales de hidroxiapatita contenidos en el prisma del esmalte y de su disposición respecto al ácido. 12, 37
Otros parámetros de los que depende el efecto del grabado ácido sobre el esmalte son: composición y estructura del esmalte, tiempo de grabado, tipo de ácido, 75 concentración del ácido y presentación del agente de grabado. 87
Una vez acondicionado el esmalte, se aplica una mezcla de monómero acrílico líquido. Éste se introduce en las porosidades creadas entre y los bastones de esmalte y en el interior de los mismos. 7
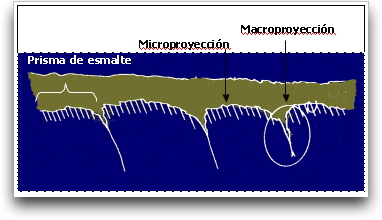
La adhesión depende de los empalmes o prolongaciones de monómero que penetran en las irregularidades superficiales creadas. De acuerdo a su tamaño son clasificados como macroproyecciones y microproyecciones. 7 Gráficos 4 y 5.
Las macroproyecciones se forman entre la periferia de los bastones del esmalte mientras que las microproyecciones se forman a nivel de pequeñas criptas producidas por la disolución de los cristales de hidroxiapatita ubicados en el extremo de cada bastón. 7, 91
Estas proyecciones constituyen la base fundamental para la adhesión micromecánica. Se piensa que las microproyecciones son más importantes debido a que se presentan en mayor número y con mayor superficie de contacto. 7
Usualmente, los monómeros o agentes de enlace de esmalte están constituidos por una combinación de diferentes metacrilatos. El bisfenol glicidil metacrilato (Bis-GMA), desarrollado por Bowen, 14 y el trietileno glicol dimetacrilato (TEG-GMA) constituyen dos ejemplos de estos materiales.
Una vez polimerizado el agente de enlace se pueden obtener valores de resistencia adhesiva superiores a los 20 MPa. 36 La adhesión al esmalte se puede obtener con relativa facilidad, de manera predecible y clínicamente confiable. 91
 |
|
|
 |
|
|
ADHESIÓN A LA DENTINA
Características morfohistológicas de la dentina
En la dentina el componente no mineral es mucho más alto que en el esmalte. Alrededor de un 70% en peso corresponde a material orgánico, un 20% a materia orgánica y un 10% de agua. En relación a su volumen, estos componentes representan entre 47-50%, 30-32% y 20-21%, respectivamente. 35, 58
Como componentes principales de éste tejido encontramos la hidroxiapatita y el colágeno tipo I (90 % de la matriz). Entre las proteínas presentes en la matriz dentinaria calcificada están las fosfoproteínas, proteínas que contienen gamma-carboxiglutamato, glucoproteínas ácidas y proteínas del plasma. Alrededor del 17% de la matriz orgánica de la dentina está constituida por lípidos. 35
Los túbulos dentinarios mantienen la comunicación con el tejido pulpar y son ocupados de manera parcial por los procesos odontoblásticos. Un fluido de origen pulpar ocupa el interior de los túbulos con un flujo lento y continuo. Es por ello, que la humedad es un factor constante en la dentina. 13
La disposición de los túbulos es radial y divergente de la pulpa hacia el esmalte. El número y el diámetro de estos varían de acuerdo a la proximidad a la pulpa, localización y edad del individuo. El promedio de túbulos a nivel de la dentina superficial es de 20.000 x mm2, con aproximadamente 0,9 _m de diámetro; en la parte media del espesor del tejido dentinario presenta aproximadamente 29.000 túbulos/mm2 con 1,2 _m de diámetro y la dentina profunda 45.000 túbulos/mm2 con 2,5 _m de diámetro.13
El fluido dentinario contenido en los túbulos se encuentra bajo una ligera presión externa constante desde la pulpa, que se calcula entre 25&endash;30 mm Hg. Por tal motivo, la dentina es un tejido intrínsecamente húmedo. 85
En la periferia del túbulo, se encuentra la dentina peritubular que presenta gran contenido mineral y entre los túbulos se localiza la dentina intertubular, constituida principalmente de fibras colágenas envueltas por pequeños cristales de apatita. 13
Relación de las características de la dentina con la adhesión
En 1963, Buonocore 18 observó que la adhesión a la dentina es considerablemente más difícil de llevar a cabo en comparación con la unión al esmalte. Las razones por las cuales ha sido difícil obtener una adhesión exitosa a la dentina son su estructura y composición. 11 El área de adhesión está conectada con la pulpa mediante túbulos dentinarios los cuales contienen fluido derivado de la pulpa. 38
Asimismo, el contenido proteico que se expone, luego del grabado ácido o acondicionamiento, deja una dentina con baja energía superficial libre (44,8 dinas/cm2). La humectación y la adhesión de una superficie con tales características, es difícil de lograr si esta energía no es aumentada mediante el uso de agentes que promuevan una superficie activa. 87
La heterogeneidad de la estructura dentinaria y su humedad hacen más difícil el contacto íntimo requerido entre el material adhesivo y la dentina. 12 La vitalidad y dinamismo del tejido permiten desarrollar mecanismos de defensa específicos contra lesiones externas. Estos mecanismos conllevan a transformaciones morfológicas y estructurales en la dentina, inducidas por procesos fisiológicos y patológicos, que resultan en un sustrato dentinario menos receptivo a los tratamientos adhesivos. 3, 99
Otro obstáculo para lograr el íntimo contacto entre la resina y la dentina es la denominada capa de desecho que se forma luego de la preparación mecánica del diente. 27 Este cubre el tejido dentario y forma proyecciones de unos cuantos micrómetros que ocluyen a los túbulos dentinarios.38, 58 Su espesor se ubica entre 0,5 y 5 _m. 27 Gráfico 6.
Bowen et al.15 señala que la capa de desecho está formada por colágeno parcialmente desmineralizado y un componente mineral constituido por partículas de apatita. En su estructura se encuentra una capa externa compuesta de colágeno y detritos de apatita y una capa interna que presenta un arreglo cristalino desordenado y alterado.
La capa de desecho sobre la superficie dentinaria actúa como una barrera de difusión protectora al disminuir la permeabilidad del tejido dentinario. Además, también parece dificultar el acceso de las bacterias a los túbulos dentinarios. Por estas razones su presencia fue considerada como ventajosa. 65
La primera y segunda generación de sistemas adhesivos fueron desarrollados para ser colocados sobre la capa de desecho, sin embargo su resistencia adhesiva dependía de su fuerza cohesiva que se ubicó aproximadamente en 5 MPa. 64
 |
|
|
La capa de desecho puede tener una gran influencia sobre la unión entre el diente instrumentado y el material restaurador.26 El mantener la capa de desecho sobre el sustrato puede tener inconvenientes que se derivan de su potencial para limitar o impedir el acceso de los sistemas adhesivos al sustrato, 36 de su unión débil a la dentina subyacente 65 y de su contenido bacteriano. 19
Con el advenimiento de la tercera generación de sistemas adhesivos el grabado ácido dentinario buscó la eliminación parcial y modificación de la capa de desecho dentinaria. 51 Los sistemas actuales buscan su disolución o remoción completa. Los sistemas adhesivos basados en esta última forma han mostrado un mejor desempeño clínico en comparación con los sistemas que modifican la capa de desecho, por lo que parece ser más indicada su remoción completa. 88
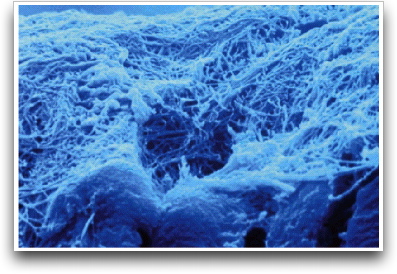
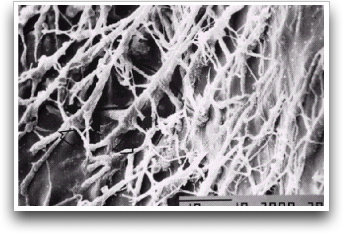
Fusayama et al. 29 indicaron, por primera vez, realizar el acondicionamiento ácido simultáneo de esmalte y dentina o técnica de grabado total de manera rutinaria. Mediante la desmineralización superficial se elimina la capa de desecho, se abren los túbulos dentinarios, se aumenta la permeabilidad de la dentina65 y se expone una red microporosa de fibras colágenas ubicadas en la superficie dentinaria y a nivel de sus túbulos y conexiones laterales. 19, 85 Gráfico 7.
El proceso de desmineralización puede exponer un espesor de malla colágena de 3 a 5 _m que corresponde al espesor de desmineralización aproximado de la dentina peritubular e intertubular, que servirá de red microrretentiva para la interdigitación micromecánica del adhesivo (capa híbrida).19,63,88
 |
|
|
AGENTES EMPLEADOS PARA OBTENER ADHESIÓN A ESMALTE Y DENTINA
Acondicionadores
Se entiende por acondicionador a aquella solución ácida utilizada para remover la capa de desecho y desmineralizar superficialmente al esmalte y la dentina. 13, 54
De acuerdo a la técnica de grabado total, el esmalte y la dentina son comúnmente acondicionados con ácido fosfórico en concentraciones de 30 al 40%. Sin embargo, en la década de los años 90 se comenzó a utilizar concentraciones menores (10-20%) del mismo ácido y acondicionadores alternativos de grabado como el ácido maléico al 10%, cítrico 10%, nítrico del 2,5% al 3% y agentes quelantes como el ácido etilendiaminotetraacético (EDTA) con la finalidad de disminuir la agresividad del grabado dentinario. 9, 87, 91
Posteriormente estudios efectuados por Van Meerbek et al. 89, 90 y Swift y Cloe 79 mostraron que los acondicionadores alternativos producían un grabado insuficiente del esmalte disminuyendo los valores de resistencia adhesiva en comparación con la obtenida al utilizar ácido fosfórico al 35%. El tejido adamantino parece requerir un grabado más agresivo capaz no sólo de remover la capa de desecho sino de producir patrones de grabado microrretentivos con alta energía superficial, lo cual se logra con la aplicación de ácido fosfórico con concentraciones entre el 30 y 40%. 91
Por otro lado, el uso del ácido fosfórico al 50% sobre el esmalte durante 60 segundos produce un precipitado de monohidrato de fosfato monocálcico que inhibe el proceso de disolución del esmalte. 31 Este precipitado puede ser retirado mediante el lavado. Concentraciones menores del 27% producen un precipitado de dihidrato de fosfato cálcico de difícil remoción que reduce la fuerza de unión. En cambio el uso de concentraciones no menores del 10% no parecen producir efectos adversos sobre la fuerza de adhesión. 31, 36, 87
Silverstone 76 demostró que a medida que aumenta la concentración de ácido fosfórico menos efectiva es su acción sobre el esmalte dental. Tanto la profundidad de grabado como la disolución del calcio aumentan hasta una concentración del 40%; sin embargo, a mayores concentraciones tanto la disolución como la profundidad de grabado disminuyen.
Originalmente el tiempo estándar para el acondicionamiento del esmalte fue de 60 segundos. Barkemeier et al. 6 observaron que los patrones de grabado obtenidos en esmalte son similares luego de la aplicación de ácido fosfórico al 10 y 35% durante 15 y 60 segundos, con una efectividad de unión semejantes.
Goes et al. 31 señalaron que el uso de ácido fosfórico con concentraciones de 10 y 35% produjo patrones micromorfológicos de grabado similares en la superficie del esmalte y la dentina luego de su aplicación.
En la actualidad se recomienda utilizar ácido fosfórico con concentraciones entre 30 y 40% durante 15 segundos, debido a que provee una morfología superficial y resistencia adhesiva similares. La aplicación del ácido por este tiempo produce un acondicionamiento discreto a fin de obtener una disolución selectiva del núcleo de los prismas o su periferia y así transformar al esmalte en una superficie más receptiva para la adhesión. 31
Luego de su colocación, el acondicionador debe ser completamente eliminado para aplicar el promotor de adhesión y la resina adhesiva. La remoción del acondicionador con un chorro de agua es suficiente para obtener una superficie adecuada que permita la formación de la capa híbrida. 91
Promotores dentinarios
Los promotores dentinarios son soluciones compuestas por monómeros hidrofílicos que se encuentran disueltos en solventes orgánicos y fotoiniciadores añadidos. A diferencia de los agentes acondicionadores, los promotores dentinarios son aplicados y dejados in situ. 13, 29
Estos promotores fueron introducidos por primera vez en los sistemas adhesivos de tercera generación. 13 El promotor actúa como un puente de enlace entre la dentina y la resina. Para ello debe: asegurar la humectación de las fibras colágenas expuestas durante el acondicionamiento, desplazar cualquier residuo superficial de humedad y transformar un tejido originalmente hidrofílico en un sustrato hidrofóbico, para poder llevar suficiente cantidad de monómeros hidrofóbicos al interior de los espacios ubicados entre las fibras colágenas. 19, 91
Estas soluciones contienen uno o más monómeros, entre los que se encuentran el 2-hidroxietil metacrilato (HEMA), N-toliglicina glicidil metacrilato (NTG-GMA), ácido piromelítico dietilmetacrilato (PMDM), metacriloxietiltrimelitato anhidro (4-META), bifenil-dimetacrilato (BPDM) y dipentaeritritol penta acrilato monofosfato (PENTA). Todos ellos son sustancias bifuncionales que presentan grupos moleculares hidrofílicos, como carboxilato o fosfato, con afinidad por la dentina húmeda y grupos hidrofóbicos polimerizables (enlaces doble carbono) que reaccionan con la resina adhesiva. 19, 87
Los solventes orgánicos utilizados en los promotores de adhesión son acetona, etanol y agua. 11, 54, 81, 91 Durante el proceso de acondicionamiento y posterior lavado, el agua invade los espacios entre las fibras colágenas que antes eran ocupados por los cristales de hidroxiapatita. En la técnica de adhesión húmeda introducida por Kanca 50, los promotores de adhesión deben ocupar estos espacios, por lo que compiten con el agua. Para ello se utilizan solventes como la acetona y el etanol. 11, 81
El agua, como solvente de los promotores de adhesión, se contempla en casos de colapso de la red colágena producido por la desecación de la superficie dentinaria. Los sistemas adhesivos que proveen de promotores a base de agua logran hidratar y expandir nuevamente la red colágena colapsada por la desecación y permite la difusión eficiente de los monómeros adhesivos a través de la red. 81, 93
La selección del sistema adhesivo y en particular del solvente contenido en el promotor de adhesión se debe realizar en base al método clínico utilizado para obtener hibridización. 11, 91
Recientemente fueron integrados en una solución el acondicionador y el agente promotor para formar los denominados promotores acídicos o promotores autoacondicionantes. Su finalidad es simplificar los procedimientos clínicos adhesivos, disminuyendo el número de pasos, el tiempo de trabajo y prevenir el colapso de la red colágena de la dentina desmineralizada. 33, 51
Los sistemas adhesivos que proveen los promotores autoacondicionantes son clasificados como sistemas de quinta generación. 51 Su acción se basa en la infiltración del monómero resinoso a través de la capa de desecho disuelta parcialmente mientras que se desmineraliza la dentina para producir la hibridización. Debido a que la disolución de la capa de desecho es parcial, sus residuos quedan incorporados en la unión adhesiva. A esta capa se le denomina capa de reacción. 13, 33
Dentro de la composición de estos promotores se encuentran monómeros ácido-fosfatados como el 2-metacriloxi etil fenil hidrógeno fosfato (Phenyl-P) y el tetrametacriloxietilpirofosfato que presentan un pH alrededor de 1,4. Entre los productos comerciales están Clearfil Liner Bond 2® y Clearfil SE® (Kuraray Co. Ltd., Osaka, Japón), Denthesive II® (Heraeus&endash;Kulzer, Wehrheim, Alemania), Syntac® (Vivadent, Schaan, Liechtenstein) y XR-Bond® (Sybron/Kerr, Orange, CA, Estados Unidos de Norteamérica). 13, 19, 88
Agentes de unión
La primera generación de agentes adhesivos estaba compuesta por monómeros hidrofóbicos como cianoacrilatos y poliuretanos. Se especuló que la adhesión de estos sistemas se producía por una unión de tipo químico gracias a la interacción de esta molécula de resina bifuncional con los iones de calcio de la hidroxiapatita. Los valores de resistencia obtenidos en dentina fueron entre 2 y 3 MPa, sin embargo la unión no era duradera debido al proceso de hidrólisis. Esto contrastaba con los resultados obtenidos en el esmalte grabado, donde la unión era más longeva en agua y con valores de resistencia ubicados entre 15 y 20 MPa. 13, 51, 87
La segunda generación de sistemas adhesivos contenía éster fosfato y poliuretanos asociados a monómeros como el Bis&endash;GMA, uretano dimetacrilato (UDMA) y 2-hidroxietil metacrilato (HEMA). El objetivo de estos adhesivos era obtener una adhesión química a la dentina. 13, 51
La base éster fosfato de estos materiales hacía suponer la existencia de interacciones iónicas entre los grupos fosfato y el calcio de la capa de desecho, sin embargo estas uniones eran hidrolizadas provocando desunión posterior. El uretano/isocianato tenía como objetivo formar una unión con los grupos hidroxilo en las fases orgánica e inorgánica de la dentina.13, 51 Los valores obtenidos de resistencia pocas veces excedían 5 a 6 MPa. 87
En los sistemas de adhesión actuales, el agente de unión está compuesto por una combinación de monómeros como el Bis-GMA, MDP, HEMA y otros monómeros dimetacrilatos. Su función es ocupar los poros entre las fibras colágenas, estabilizar la capa híbrida, sellar los túbulos dentinarios mediante la formación de empalmes o "tags" de resina y proveer suficientes dobles enlaces metacrilato para copolimerizar con la resina restauradora. 12, 13, 19, 88 Gráfico 8.
La capa de adhesivo formada debe saturar la red de fibras colágenas y establecer un espesor de capa resinosa que sea capaz de absorber tensiones y proteger la unión adhesiva de la separación provocada por la contracción de polimerización de la resina restauradora. 84, 92
La unión del agente adhesivo con la resina restauradora se establece por la copolimerización dobles enlaces metacrilatos. Estos están presentes en la capa de resina inhibida por el oxigeno en su superficie. Esta zona de resina no polimerizada tiene un espesor aproximado de 15 _m. 13, 88
A nivel del sustrato dentinario, los sistemas adhesivos más recientes pueden formar empalmes o "tags" de resina unidos íntimamente a las paredes de los túbulos con núcleos de resina rodeados de capa híbrida. Además, se ha observado infiltración de resina y formación de capa híbrida dentro de las ramificaciones laterales de los túbulos dentinarios. Este fenómeno de formación de empalmes submicrómicos se ha denominado hibridización de los túbulos laterales. 19, 67, 88, 91
 |
|
|
Como parte de la simplificación de los sistemas adhesivos, se combinaron en una sola solución las funciones del promotor de adhesión y las funciones del agente de unión. Al igual que los promotores de adhesión autoacondicionantes, estos sistemas forman parte de la quinta generación de sistemas adhesivos.13,51,91
El último avance en el campo de los agentes adhesivos lo constituyen los agentes autoacondicionantes-promotores-adhesivos. 38 Estos sistemas adhesivos de sexta generación permiten la obtención de una unión adecuada al tejido adamantino y dentinario utilizando sólo una solución. 51
Sin embargo, Fabianelli et al. 28 estudiaron la influencia de los agentes autoacondicionantes-promotores&endash;adhesivos sobre el sellado de cavidades clase II. Estos autores observaron una unión a la dentina adecuada mientras que al esmalte no fue tan efectiva. Justificaron estos resultados con el hecho de que esta generación se compone de una solución acídica que posee un pKa insuficiente para grabar adecuadamente al esmalte y muy poca viscosidad por lo que necesita aplicarse varias veces.
La zona donde la resina del sistema adhesivo forma una traba micromecánica con el colágeno dentinario se denomina capa híbrida. 11, 19, 87, 94 En ella se describen tres estratos diferentes: la capa superior, la parte media y la base. 87
El estrato superior de la capa híbrida está constituido por una fase densa posiblemente compuesta por colágeno desnaturalizado y fibrillas colágenas desordenadas formando una fase amorfa. La parte media de la capa híbrida contiene fibrillas colágenas transversales y seccionadas de forma longitudinal separadas por espacios libres y residuos de cristales minerales esparcidos entre las fibrillas. Finalmente la base de la capa híbrida se caracteriza por una transición abrupta o gradual de una zona parcialmente desmineralizada de dentina con cristales de hidroxiapatita envueltos en resina hasta llegar a una zona de dentina subyacente inalterada. 87
FACTORES QUE INFLUYEN EN LA ADHESIÓN
Entre los factores que influyen en el proceso de adhesión pueden mencionarse la presencia de contaminantes, las características del sustrato y la contracción por polimerización. 73,86,92
La composición del esmalte hace que el proceso de adhesión sea más fácil de lograr que en la dentina. El tejido adamantino contiene una alta energía superficial libre luego de su acondicionamiento.87 Sin embargo, esta superficie puede ser fácilmente contaminada por saliva u otras impurezas que pueden disminuir su energía superficial impidiendo la humectación por parte del monómero. 73 Por otro lado, la hidroxiapatita y el colágeno que componen a la dentina le confieren una baja energía superficial lo que dificulta el proceso de adhesión a este sustrato. De igual forma los cambios estructurales en este tejido, por procesos fisiológicos o patológicos, dificultan la unión. 86,87
Otro aspecto a considerar es la contracción por polimerización; si ésta es baja se obtienen una buena adhesión y adaptación. Las brechas marginales se presentan al no existir adhesión a las paredes de la cavidad durante el proceso de polimerización. Al cumplir los requerimientos para obtener adhesión y baja contracción, se logrará la adhesión al diente, sea gracias a retención mecánica o química. 92
Otros factores que pueden afectar la adhesión y formar brechas son la tensión desarrollada por las diferencias de coeficientes de expansión térmica y conducción térmica entre el diente y el material restaurador. 73, 86
Terata et al.82 señalan que al utilizar sistemas adhesivos en presencia de eugenol provocaría un aumento del espesor de la brecha entre el agente adhesivo y el diente. Por otro lado, Bottino et al.13 refieren que podría producirse una reducción de la fuerza de adhesión de la resina a la dentina y disminución del adaptado marginal, por lo que la contaminación previa del tejido dentinario con eugenol podría ser visto como un factor adicional que podría influir en el proceso de adhesión. 68,98
EFECTO DE LOS COMPUESTOS EUGENÓLICOS CONTENIDOS EN LOS MATERIALES UTILIZADOS EN ENDODONCIA SOBRE LA UNIÓN DE LOS SISTEMAS ADHESIVOS.
Como se mencionó inicialmente, el empleo del óxido de zinc-eugenol tiene varios usos en la profesión odontológica. 62 En el área endodóncica, los cementos eugenólicos son utilizados para obtener el cierre y la protección de la cavidad de acceso por un periodo de tiempo limitado y para sellar los conductos radiculares, ya sea solos o en combinación con gutapercha. 23, 78
Del mismo modo, los sistemas adhesivos son ampliamente utilizados en odontología restauradora no sólo para mejorar la unión de los materiales al diente, sino para prevenir la microfiltración bajo las restauraciones. Específicamente, en el campo endodóncico, estos agentes han sido evaluados en obturaciones de sistemas de conductos radiculares, reparación de perforaciones y como barreras apicales. 96
Los materiales con compuestos eugenólicos, al estar en contacto prolongado con la dentina, conllevan a la presencia de concentraciones de eugenol en este tejido.30 En el caso de los cementos selladores eugenólicos es probable que el eugenol penetre dentro de las paredes dentinarias. Estos selladores tienen un tiempo de endurecimiento que puede llegar a varios días, otorgando amplia oportunidad al eugenol de penetrar los túbulos y la estructura dentinaria circundante. 74
Ganss y Jung 30 indican que el posible reblandecimiento del tejido dentinario causado por el eugenol, señalado por Rotberg y DeShazer 72, podría considerarse como uno de los factores que disminuye el porcentaje de difusión a través de la dentina y del esmalte hacia las resinas compuestas. No obstante, la desmineralización causada por el grabado ácido total requerido por el sistema adhesivo podría superponerse a la ligera desmineralización causada por el eugenol, por lo que parece poco probable que el fenómeno de reblandecimiento tenga influencia sobre la resistencia adhesiva.
Se ha demostrado que el eugenol, al igual que otros compuestos fenólicos, son recolectores de radicales libres los cuales inhiben el proceso de polimerización de los materiales resinosos.80 Asimismo, se han observado efectos tales como: (1) incremento de la rugosidad de la superficie y reducción en la microdureza de la resina, (2) disminución en la resistencia transversal y en la estabilidad del color de las resinas compuestas 2, 30, 52, 57, (3) aumento del espesor de la brecha agente adhesivo-diente 82 y (4) reducción de la fuerza de adhesión de la resina al tejido dentinario 13 y del adaptado marginal. 68, 98
Al Wazzan et al. 2 refieren que la interacción del eugenol con los radicales libres asociados con la polimerización del material resinoso produce un retraso en el proceso de reacción y una disminución del grado de polimerización de las resinas.
Hansen y Asmussen 39 señalan que las resinas compuestas y los agentes adhesivos dentinarios requieren de la presencia de radicales para inducir el proceso de polimerización. El grupo hidroxilo presente en la molécula de eugenol tiende a cargar positivamente a estos radicales libres bloqueando su reactividad. Este fenómeno ocurre aún en presencia de muy bajas dosis de eugenol.
Peters et al., 68 en el 2000, evaluaron la adaptación marginal de restauraciones de resina luego de ser contaminadas con el sellador endodóncico eugenólico Tubli-seal® (Kerr/Sybron, Salerno, Italia) y compararon diferentes métodos para remover los contaminantes. Observaron que la adaptación marginal disminuyó significativamente en dentina cuando el sellador es empleado previamente a un sistema adhesivo. Consideraron además, que el empleo de una fresa de acabado por toda la cavidad, antes de obturarla, parece ser el método más efectivo para remover al contaminante comparado con el arenado de la cavidad o el uso de alcohol.
Tjan y Nemetz 83 realizaron un estudio donde observaron que existe un efecto negativo del eugenol residual, contenido en los selladores endodóncicos, sobre la retención de pernos Parapost (Colténe/ Whaledent Inc. Estados Unidos de Norteamérica) empleando el cemento resinoso Panavia EX® (J. Morita, Estados Unidos de Norteamérica Inc.). De igual forma establecieron que el procedimiento de limpieza que puede contrarrestar el efecto del eugenol es el uso de alcohol (etanol), como irrigante de conductos debido a que este compuesto es altamente soluble en alcohol. Para ello se basan en las excelentes propiedades de humectabilidad del alcohol lo que le permite extenderse sobre toda la superficie dentinaria. También señalaron que el acondicionamiento con ácido fosfórico es un procedimiento de limpieza válido.
Meyerowitz et al. 60 diseñaron un estudio para determinar el efecto de los cementos eugenólicos y no eugenólicos sobre la unión resina-esmalte y comparar la resistencia de unión de tres cementos resinosos: Panavia TC®, Bifix® (Voco, Cuxhaven, Alemania) y Twinlook® (Heraeus-Kulzer, Wehrheim, Alemania) colocados sobre superficies previamente tratadas con cemento eugenólico TempBond® (Kerr Orange, CA, Estados Unidos de Norteamérica), con cemento no eugenólico TempBond NE® (Kerr Orange, CA, Estados Unidos de Norteamérica) y no tratadas (grupo control).
Estos autores encontraron diferencias significativas entre los grupos en los que se empleó cemento eugenólico con respecto a los grupos con cemento no eugenólico y control. Concluyeron que: (1) el eugenol contenido en los cementos de obturación provisional reduce significativamente la unión de los cementos resinosos sobre el esmalte, (2) los cementos de obturación provisional no eugenólicos no afectan la unión esmalte-resina, (3) los procedimientos de remoción mecánica del cemento, el acondicionamiento y lavado no eliminan el efecto del eugenol sobre la resina y (4) los cementos provisionales con contenido eugenólico no deben emplearse previo al uso de cementos resinosos. 60
Terata et al.82 señalan en su estudio que la aplicación de cementos tanto eugenólicos como no eugenólicos para obturación provisional sobre superficies dentarias (esmalte y dentina) disminuye la resistencia de unión traccional de los cementos resinosos. De igual forma señalaron que la reducción en la resistencia de unión, por efecto del eugenol sobre los cementos resinosos, incrementa la microfiltración entre resina y sustrato y consideran que la presencia y penetración de restos de cemento pueden cambiar las características de la estructura dentaria, tales como ángulo de contacto y permeabilidad dentinaria. Con respecto a este último punto recomiendan mayor investigación.
Paul y Schärer 66 realizaron pruebas in vitro, utilizando cuatro sistemas adhesivos con el cemento resinoso Porcelite U® (Sybron/Kerr, Orange, CA, Estados Unidos de Norteamérica) sobre dientes previamente contaminados con uno de los siguientes compuestos: agente de cementación provisional con eugenol TempBond®, cemento a base de hidróxido de calcio Kerr Life® (Kerr Orange, CA, Estados Unidos de Norteamérica;), cemento sin eugenol Freegenol® (GC American Inc., IL, Estados Unidos de Norteamérica;) y cemento provisional a base de metacrilato Fermit® (Vivadent, Schaan, Liechtenstein). Tres de los sistemas adhesivos: ART Bond® (Coltène, Altstätten, Suiza), AllBond2® (Bisco, Schaumburg, IL, Estados Unidos de Norteamérica) y Syntac® presentaron disminución dramática de los valores de resistencia adhesiva al ser colocados sobre dentina previamente contaminada con cemento provisional eugenólico al compararlos con el grupo control. Los autores atribuyeron este efecto a la posible interacción de las moléculas de eugenol sobre la polimerización del material resinoso.
Yap et al. 98 observaron valores de resistencia de unión menores si se aplican cementos eugenólicos previa y temporalmente al empleo de cementos resinosos, más aun si se altera la relación polvo/líquido del cemento eugenólico. Los autores argumentaron que los resultados obtenidos se deben al aumento de la concentración de eugenol, por lo que la disminución de la fuerza de adhesión de los sistemas adhesivos parece estar relacionada de forma directa con la cantidad de eugenol presente en los cementos para obturación provisional.
Por el contrario, Jung et al. 49 estudiaron el grado en que pueden afectar los cementos provisionales como Temp-Bond®, Provicol® (Voco, Cuxhaven, Alemania) y óxido de zinc-eugenol (ZOE, fórmula magistral) sobre la resistencia de unión de los cementos resinosos de curado dual para cementación en esmalte acondicionado. El sistema adhesivo y cemento resinoso evaluados fueron Heliobond® (Vivadent, Schaan, Liechtenstein) y Dual Cement radiopaque® (Vivadent, Schaan, Liechtenstein), respectivamente. Encontraron que la presencia de eugenol no ejerce ningún efecto sobre la fuerza de adhesión en esmalte.
Peutzfeldt y Asmussen 69 examinaron la influencia de los cementos de obturación provisional IRM® (De Trey, Konstanz, Alemania) y Cavit® (ESPE, Seefeld, Alemania) sobre la eficacia de los sistemas adhesivos Scotchbond Multi-Purpose plus® (3M, Paul, MN, Estados Unidos de Norteamérica) y Gluma CPS® (Bayer Dental, Dormagen, Alemania). La eficacia fue evaluada en base a la formación de brechas en la interfase resina-diente y la resistencia adhesiva a nivel de esmalte y dentina. Los autores no encontraron diferencias en la eficacia de los dos sistemas adhesivos luego de haber aplicado y eliminado los cementos eugenólicos utilizados y señalan que la profundidad de desmineralización producida por el acondicionamiento (10-15 _m) remueve con mayor efectividad cualquier resto de cemento por lo que no son afectados por los cementos provisionales eugenólicos. Estos resultados coinciden con los señalados por Terata et al. 82 que indican que el acondicionamiento con ácido fosfórico produce la remoción de los restos de cemento.
Leirskar y Nordb_ 52 obtuvieron valores de resistencia de unión mayores en superficies dentinarias tratadas previa y temporalmente con un cemento de óxido de zinc-eugenol y posteriormente obturadas con resina en comparación con aquellas en las que sólo se empleó resina. El agente adhesivo utilizado fue Scotchbond Multi-Purpose®. En base a los resultados obtenidos, los autores afirmaron que el efecto negativo del eugenol sobre los sistemas adhesivos es eliminado durante los procedimientos de acondicionamiento y concluyeron que el uso de óxido de zinc-eugenol previo y temporalmente a la obturación con material resinoso no afecta de manera negativa la resistencia de unión de la resina.
Mayhew et al. 59 investigaron el efecto de los residuos de tres selladores y de los irrigantes sobre la resistencia de unión de pernos prefabricados de acero inoxidable Dentatus® (Dentatus Estados Unidos de Norteamérica, New York, NY) cementados con Panavia 21TC®. El sellador a base de resina epóxica AH26® (Caulk/Dentsply, York, PA) y el cemento eugenólico EWT® (Sybron/Kerr, Orange, CA, Estados Unidos de Norteamérica) no afectaron la resistencia de este cemento resinoso. Por el contrario, el sellador sin contenido eugenólico Nongenol® (GC América Inc., Chicago, IL) presentó los valores más bajos de resistencia de unión, por lo que advirtieron no emplear este sellador con Panavia 21 TC®. De igual manera, recomendaron el uso de ácido cítrico o fosfórico antes de cementar los pernos con Panavia 21TC®.
En una investigación realizada por Mannocci et al. 55 evaluaron la microfiltración de tres sistemas adhesivos usados para cementar pernos de fibra de carbono en dientes tratados o no con selladores endodóncicos y cemento provisional con contenido eugenólico; posteriormente se efectuó la reconstrucción de la corona con resina compuesta. Los resultados demostraron que no hubo diferencias significativas en los valores de filtración entre grupos con o sin cementos a base de eugenol. Igualmente, coinciden en que los procedimientos de preparación del conducto radicular para el perno y el acondicionamiento son capaces de remover los residuos de cemento de obturación provisional y selladores endodóncicos.
Wolanek et al. 96 realizaron un estudio para determinar la efectividad de un sistema adhesivo dentinario Clearfil Liner Bond 2V®, en la prevención de la microfiltración y evaluar el efecto de un cemento endodóncico a base de eugenol sobre la capacidad de sellado de la resina adhesiva. Concluyeron que este sistema adhesivo, como barrera coronal provee un adecuado sellado contra la microfiltración. También observaron que el uso del cemento endodóncico a base de eugenol no tuvo efecto alguno sobre la capacidad de sellado del sistema adhesivo empleado. Sugirieron la limpieza con torundas de algodón impregnadas con cloroformo para neutralizar el efecto adverso del eugenol sobre el sistema adhesivo.
A través de la revisión realizada se sugiere la utilización de medios mecánicos y químicos para evitar los posibles efectos nocivos de los residuos de cementos eugenólicos presentes en dentina. 20
El uso de fresas de acabado sobre la superficie dentinaria ha demostrado ser efectivo en la limpieza de la cavidad. 68 Además, Burns et al. 20 y Woody y Davis 97 afirmaron que la limpieza mecánica de la dentina con piedra pómez antes de la adhesión dentinaria eliminó los efectos de los cementos eugenólicos sobre la fuerza de adhesión dentina-resina. Sin embargo, Paul y Schärer 66 cuestionaron que este procedimiento sea suficientemente efectivo.
Igualmente, Al Wazzan et al. 2 encontraron que la contaminación de la dentina con cementos provisionales eugenólicos sí resulta perjudicial para la resistencia de unión de la resina aún cuando el sustrato fuese tratado con piedra pómez y agua. Sin embargo, Woody y Davis 97 reportaron la ausencia de restos de cemento o eugenol luego de una limpieza mecánica con piedra pómez y posterior grabado con ácido fosfórico al 37% y refieren que la presencia de dichos restos podría permitir la microfiltración a nivel de los márgenes adamantinos.
El alcohol, EDTA, cloroformo y ácido fosfórico al 37% son medios químicos propuestos para disminuir el efecto negativo del eugenol sobre la unión entre la resina y la dentina. 52, 55, 69, 74, 82, 83, 96, 98
El eugenol muestra una completa solubilidad en alcohol y adicionalmente presenta excelentes propiedades de humectabilidad por lo que es capaz de esparcirse con facilidad sobre la superficie dentinaria. 31
En cuanto al uso de EDTA, Schwartz et al. 74 sugirieron que podría también remover algo del eugenol residual al ser capaz de eliminar la capa de desecho en dentina.
El uso del grabado ácido con ácido fosfórico al 37% para la remoción de componentes de la superficie dentinaria y por ende de los residuos de eugenol con sus efectos negativos en la fuerza de adhesión, es bien aceptado y documentado. 52,55,74,82,83,97
DISCUSIÓN
A pesar de la comprobada toxicidad que pueden presentar los cementos a base de óxido de zinc-eugenol, es evidente que su amplio uso en odontología obedece en gran medida a sus conocidas propiedades farmacológicas, a la simplicidad de uso, eficacia y bajo costo. Son estas características en las que se apoya nuestra profesión para usar estos cementos.
El uso de la tecnología adhesiva en la restauración de dientes que además han sido tratados endodóncicamente y la utilización de los cementos con contenido eugenólico, en esta área, llevó a investigar el efecto que podía tener el eugenol como contaminante del tejido dentario sobre los sistemas adhesivos.
A través de la revisión de la literatura realizada, se pudo constatar que el resultado entre diferentes estudios sobre el posible efecto del eugenol contenido en algunos cementos sobre la unión de sistemas adhesivos a la estructura dentaria, son controversiales. Algunos autores 60, 66, 68, 80, 82, 83, 97 mencionan un efecto negativo del eugenol sobre esta unión e indican que este compuesto es un recolector de radicales libres, capaz de inhibir el proceso de polimerización de materiales resinosos lo que ocasiona una reducción de la resistencia de unión de los sistemas adhesivos al diente y un aumento de la microfiltración entre resina y sustrato
Contradictoriamente, Peutzfeldt y Asmussen 69 no encontraron disminución en la resistencia adhesiva en esmalte luego de contaminar este tejido con cementos provisionales eugenólicos y no eugenólicos. Sus resultados fueron corroborados por el estudio efectuado por Jung et al.49 Además, son notorios los resultados de Leirskar y Nordb 52, al obtener valores de resistencia adhesiva mayores en superficies dentarias tratadas con cemento eugenólico.
Los resultados de Mannocci et al.55 y Wolanek et al.96 al evaluar la microfiltración y capacidad de sellado de sistemas adhesivos, tampoco sugirieron efectos adversos del eugenol sobre ellos.
La ausencia de estudios que intenten corroborar los resultados de otros trabajos por medio de la reproducción de iguales condiciones y el uso de los mismos materiales, podría constituir la base de la controversia sobre el posible efecto del eugenol contenido en algunos cementos sobre la unión de sistemas adhesivos a la estructura dentaria. Estas diferencias dificulta la emisión de un juicio preciso sobre el tema.
Por otra parte, no parece existir un acuerdo sobre cuál de los métodos propuestos, mecánicos o químicos, es más efectivo para eliminar los restos de cemento y eugenol presentes sobre la estructura dentaria.
A pesar que Meyerovitz et al.60 afirman que el grabado ácido no elimina el efecto del eugenol residual, varias investigaciones 52,55,59,69,83 afirman que el acondicionamiento del sustrato, llevado a cabo con ácido fosfórico y ácido cítrico es el medio más efectivo para eliminar el efecto del eugenol residual sobre la unión de sistemas adhesivos dentinarios.
CONCLUSIONES
1. La gran variedad de aplicaciones de los cementos eugenólicos es posible gracias a la modificación de sus propiedades físicas que adecuan sus características según las necesidades.
2. A pesar del hecho comprobado de que los cementos eugenólicos pueden tener un efecto citotóxico sobre los tejidos, sus propiedades analgésicas, antiinflamatorias y su satisfactorio desempeño clínico, los mantienen como una buena elección en diferentes áreas de la odontología.
3. Con los sistemas adhesivos actuales, el proceso de adhesión se basa en la unión micromecánica que se establece con las microporosidades presentes en el esmalte grabado, a los empalmes de resina formados dentro del gran número de túbulos dentinarios y formación de capa híbrida formada por la malla colágena en dentina y la infiltración de resina dentro de ella.
4. Entre los factores que influyen en el proceso de adhesión se encuentran: la presencia de contaminantes (saliva, eugenol y restos de cemento), las características del sustrato, la contracción por polimerización, la tensión desarrollada por las diferencias de coeficientes de expansión térmica entre el diente y el material restaurador y diferencia en la conducción térmica del diente y el material restaurador.
5. El eugenol, al igual que otros compuestos fenólicos, son recolectores de radicales libres los cuales inhiben el proceso de polimerización de los materiales resinosos. La interacción entre estos materiales produce un retraso en la reacción y una disminución del grado de polimerización.
6. La efectividad de los medios químicos y mecánicos para lograr la remoción de los restos de cemento o eugenol es controversial.
7. Existe controversia sobre la existencia o no del efecto ejercido por restos de eugenol o cemento eugenólico en la unión de sistemas adhesivos a la superficie dentaria.
Bibliografía Consultada y Recomendada
1. Al-Khatib ZZ et al. The antimicrobial effect of various endodontic sealers. Oral Surg Oral Med Oral Pathol 1990;70:784-90.
2. Al Wazzan KA, Al Harbi AA, Hammad IA. The effect of eugenol &endash;containing temporary cement on the bond strength of two resin composite core materials to dentin. J Prosthodont 1997;6:37-42.
3. Alonso JM, González VV, Menasalvas MG, García AE. Estudio comparativo de la adhesión a dentina sana y esclerótica. Quintessence (ed. esp.) 1999;12:376-81.
4. Anusavice KJ. Ciencia de los materiales dentales de Phillips. 10° ed. México. McGraw-Hill Interamericana, 1998:746.
5. Baier RE. Principles of adhesión. Oper Dent 1992; suppl 5: 1-9.
6. Barkemeier WW, Shaffer SE, Gwinnett AJ. Effects of 15 vs 60 seconds enamel acid conditioning on adhesion and morphology. Oper Dent 1986;11:111-16.
7. Bayne SC, Taylor DF. Materiales odontológicos. En: Sturdevant CM, Roberson T, Heymann H, Sturdevant JR. Arte y ciencia &endash; operatoria dental. 3ª ed. Madrid. Mosby, 1996:207- 288.
8. Berkovitz BK, Holland GR, Moxham BJ. Atlas a color y texto de anatomía oral, histología y embriología. 2° ed. Madrid. Mosby, 1995:112-44.
9. Bertolotti RL. Conditioning of the dentin substrate. Oper Dent 1992; suppl 5:131-36.
10. Biven GM, Bapna MS, Heuer MA. Effect of eugenol and eugenol-containing root canal sealers on the microhardness of human dentin. J Dent Res 1971; 51:1602-09.
11. Blunck U, Haller B. Clasificación de los sistemas de adhesión (sistemas bonding). Quintessence (ed. esp.) 2001;14:129-40.
12. Blunck U. Adhesivos para dentina y compómeros. Quintessence (ed. esp.) 1996;9:475-83.
13. Bottino MA, Quintas AF, Miyashita E, Giannini V. Estética en rehabilitación oral. Metal Free. Brasil. Editorial Artes Médicas Latinoamérica, 2001:27 &endash; 65.
14. Bowen RL. Adhesive bonding of of various materials to hard tooth tissues II. Bonding to denting promoted by a surface active comonomer. J Dent Res 1965;44:895-902.
15. Bowen RL. Eick DJ, Henderson DA, Anderson DW. Smear layer : removal and bonding considerations. Oper Dent 1984;suppl 3:30-34.
16. Brodin P, Røed A. Effects of eugenol on rat phrenic nerve and phrenic nerve-diaphragm preparations. Arch Oral Biol 1984; 29:611-15.
17. Buonocore MG. A simple method of increasing the adhesión of acrylic filling materials to enamel surfaces. J Dent Res 1955;34:849-53.
18. Buonocore MG. Principles of adhesive retention and adhesive restorative materials. J Am Dent Assoc 1963;67:382-91.
19. Burke FJ, Combe EC, Douglas WH. Dentine bonding sistems I. Mode of action. Dent Update 2000;27:85-93.
20. Burns DR, Moon PC, Neal PW, Burns DA. Effect of endodontic sealers on dowels luted with resin cement. J Prosthodont 2000;9:137-41.
21. Civjan S, Huget EF, Wolfhard G, Waddell LS. Characterization of zinc oxide-eugenol cements reinforced with acrylic resin. J Dent Res 1972;51:107-14.
22. Copeland HI, Brauer GM, Forziati AF. The setting mechanism of zinc oxide and eugenol mixtures. J Dent Res 1955;34:740.
23. Craig RG et al. Materiales de odontología restauradora. 10ª ed. Madrid. Harcourt Brace, 1998:584.
24. Dewhirst FE. Structure-activity relationships for inhibition of prostaglandin cyclooxigenase by phenolic compounds. Prostaglandins 1980;20:209-22. Comentado en: J Am Dent Assoc 1986;113:789-91.
25. Diccionario de la Real Academia Española. CD ROM. Espasa Calpe S.A. 21ª ed. Versión 21.1.0. 1995.
26. Dixon CM, Rickert UG. Histologic verification of results of root-canal therapy in experimental animals. J Am Dent Assoc 1938;25:1781-1803.
27. Eick JD, Wilko RA, Anderson CH, Sorensen SE. Scannning electron microscopy of cut tooth surfaces and identification of debris by use of the electron microprobe. J Dent Res 1970;49:1359-68.
28. Fabianelli A. Vichi A, Kugel G, Ferrari M. Influence of self-etching-priming bonding systems on sealing ability of class II restorations: leakage and SEM evaluation. Artículo presentado en la reunión anual de la Asociación Internacional de Investigación Dental; 6 de Abril de 2000; Washington, DC. Comentado en: J Am Dent Assoc 2000;131:20-25.
29. Fusayama T, Nakamura M, Kurosaki N, Iwaku M. Non-pressure adhesion of a new adhesive restorative resin. J Dent Res 1979;58:1364-70.
30. Ganss C, Jung M. Effect of eugenol&endash;containig temporary cements on bond strength of composite to dentin. Oper Dent 1998;23:55-62.
31. Goes MF, Sinhoreti MA, Consani S, Da Silva MA. Morphological effect of the type, concentration and etching time of acid solutions on enamel and dentin surfaces. Braz Dent J 1998;9:3-10.
32. Gómez M, Cementos de óxido de zinc-eugenol como materiales de restauración intermedia. Acta Odontol Venez 1972;10:236-49.
33. Gordan VV, Vargas MA, Cobb DS, Denehy GE. Evaluation of acidic primersin microleakage of class 5 composite resin restorations. Oper Dent 1998;3:244-49.
34. Grossman LI. An improved root canal cement. J Am Dent Assoc 1958;56:381-85.
35. Gwinnett J. Structure and composition of enamel. Oper Dent 1992;suppl 5:10-17.
36. Gwinnett AJ. Adhesivos dentales. En: Baratieri LN, Cabral JR, Cabral RJ. Estética. Restauraciones adhesivas directas en dientes anteriores fracturados. Sao Paulo. Santos Livraria ed, 1998:57-72.
37. Gwinnett AJ. Histologic changes in human enamel following treatment with acidic adhesive conditioning agents. Arch Oral Biol 1971;16:731-38.
38. Haller B. Recent development in dentin bonding. Am J Dent 2000;13:44-50.
39. Hansen EK, Asmussen E. Influence of temporary filling materials on effect of dentin-bonding agents. Scand J Dent Res 1987;95:516-20. Comentado en: J Oral Rehabil 1997;24:8 -14.
40. Hashieh IA, Camps J, Dejou J, Franquin JC. Eugenol diffusion through dentin related to dentin hydraulic conductance. Dent Mater 1998;7:229-35.
41. Hashimoto S, Uchiyama K, Maeda M, Ishitsuka K, Furumoto K, Nakamura Y. In vivo and in vitro effects of zinc oxide-eugenol (ZOE) on biosynthesis of cyclo-oxygenase products in rat dental pulp. J Dent Res 1988;67:1092-96.
42. Heling I, Chandler NP, The antimicrobial effect within dentinal tubules of four root canal sealers. J Endod 1996;22:257-59.
43. Hoffman S, McEwen WS, Drew CM. Scanning electron microscopy studies of dental enamel. J Dent Res 1969;48:242-50.
44. Hume WR. An analysis of the release and the diffusion through dentin of eugenol from zinc oxide-eugenol mixtures. J Dent Res 1984;63:881-84.
45. Hume WR. Effect of eugenol on respiration and division in human pulp, mouse fibroblasts and liver cells in vitro. J Dent Res 1984;63:1262-65.
46. Hume WR. The pharmacologic and toxicological properties of zinc oxide-eugenol. J Am Dent Assoc 1986;113:789-91.
47. Jendresen MD, Phillips RW, Swartz ML, Norman RD. A comparative study of four zinc oxide and eugenol formulations as restorative materials. Part I. J Prosthet Dent 1969;21:176-83.
48. Jendresen MD, Phillips RW. A comparative study of four zinc oxide and eugenol formulations as restorative materials. Part II. J Prosthet Dent 1969;21:301-08.
49. Jung M, Ganss C, Sender S. Effect of eugenol &endash;containig temporary cements on bond strength of composite to enamel. Oper Dent 1998;23:63-8.
50. Kanca J. Improving bond strenghth through acid etching of dentin and bonding to wet dentin surfaces. J Am Dent Assoc 1992;123:35-43.
51. Kugel G, Ferrari M. The science of bonding: from first to sixth generation. J Am Dent Assoc 2000;131:20-25.
52. Leirskar J, Nordb_ H. The effect of zinc oxide-eugenol on the shear bond strength of a commonly used bonding system. Endod Dent Traumatol 2000;16:265-68.
53. Lide DR. Handbook of chemistry and physics. 82nd ed. New York . CRC Press LLC. 2001:3-257.
54. Macchi RL. Materiales dentales. 3° ed. Buenos Aires. editorial Médica Panamericana, 2000: 373.
55. Mannocci F, Ferrari M, Watson TF. Microleakage of endodontically treated teeth restored with fiber posts and composite cores after cyclic loading: a confocal microscopic study. J Prosthet Dent 2001;7:284-91.
56. Markowitz K, Moynihan M, Liu M, Kim S. Biologic properties of eugenol and zinc oxide-eugenol. Oral Surg Oral Med Oral Pathol 1992;73:729-37.
57. Marshall SJ, Marshall GW, Harcourt JK. The influence of varios cavity bases on the micro-hardness of composites. Aust Dent J 1982:27:291-95.
58. Marshall GW, Marshall SJ, Kenney JH, Balooch M. The dentin substrate: structure and properties related to bonding. J Dent 1997;25:441-58.
59. Mayhew JT, Windchy A, Goldsmith J, Lawrence G. Effect of root canal sealers and irrigation agents in retention of preformed posts luted with resin cement . J Endod 2000;28:341-44.
60. Meyerowitz JM, Rosen M, Cohen J, Becker PJ. The effect of eugenol containing and non-eugenol temporary cements on the resin-enamel bond. J Am Dent Assoc 1994;49:389-92.
61. Miserendino LJ. Intrumentos, materiales y aparatos. En: Cohen S, Burns R. Endodoncia. Los caminos de la pulpa. 5a ed. México D.F. Editorial Médica Panamericana, 1993:507-66.
62. Ngoh EC, Pashley DH, Loushine J, Weller RN, Kimbrough F. The effects of eugenol on resin bond strengths to root canal dentin. J Endod 2001;27:411-14.
63. Pashley DH, Carvalho RM. Dentine permeability and dentin adhesion. J Dent 1997;25:355-72.
64. Pashley DH, Horner JA, Brewer PD. Interaction of condicioners on the dentin surface. Oper Dent 1992; suppl 5:137-150.
65. Pashley DH, Michelich V, Kehl T. Dentin permeability: effects of smear layer removal. J Prosthet Dent 1981;46:531-37.
66. Paul SJ, Schärer P. Effect of provisional cements on the bond strenght of various adhesive bonding systems on dentine. J Oral Rehabil 1997;24:8 -14.
67. Perdigão J, May KN, Wilder AD, Lopes M. The effect of depth of dentin demineralization on bond strengths and morphology of the hybrid layer. Oper Dent 2000;25:186-194.
68. Peters O, Göhring TN, Lutz F. Effect of eugenol.containing sealer on marginal adaptation of dentine-bonded resin fillings. Int Endod J 2000; 33:53-9.
69. Peutzfeldt A, Asmussen E. Influence of eugenol-containing temporary cement on efficacy of dentin-bonding systems. Eur J Oral Sci 1999;107:65-9.
70. Phillips RW, Love DR. The effect of certain additive agents on the physical properties of zinc oxide-eugenol mixtures. J Dent Res 1961;40:294-03.
71. Rose A, Rose E. The condensed chemical dictionary. 6th ed. New York. Reinhold publishing corp. 1961:479.
72. Rotberg SJ, DeShazer DO. The complexing action of eugenol on sound dentin. J Dent Res 1966;45:307-10.
73. Ruyter IE. The chemistry of Adhesive Agents. Oper Dent 1992; suppl 5:32-43.
74. Schwartz R, Murchison D, Walker W. Effects of eugenol and non eugenol endodontic sealer cements on post retention. J Endod 1998;24:564-67.
75. Silverstone LM, Saxton CA, Dogon IL, Fejerskov O. Variation in the pattern of etching of human dental enamel examined by scanning electron microscopy. Caries Res 1975;9:373-87.
76. Silverstone LM. Fissure sealants. Caries Res 1974;8:2-26.
77. Smith DC. The setting of zinc oxide/eugenol mixtures. Br Dent J 1958;105:313-21.
78. Spångberg LS. Instruments, materials, and devices. En: Cohen S, Burns R. Pathways of the pulp. 7° ed. St. Louis. Mosby, 1998:476-531.
79. Swift EJ Jr, Cloe BC. Shear bond strengths of new enamel etchants. Am J Dent 1993;6:162-4.
80. Taira J, Ikemoto T, Yoneya T, Hagi A, Murakami A, Makino K. Essencial oil phenyl propanoids. Useful as &endash;OH scavengers?. Free Radic Res Commun 1992;16:197-04. Comentado en: Eur J Oral Sci 1999;107:65-9.
81. Tay FR, Gwinnett JA, Wei SHY. Relation between water content in acetone/alcohol-based primer and interfacial ultrastructure. J Dent 1998;26:147-56.
82. Terata R, Nakashima K, Obara M, Kubota M. Characterization of enamel and dentin surfaces after removal of temporary cement on tensile bond strength of resin luting cement. Dent Mater J 1994;13:148-54.
83. Tjan AHL, Nemetz H. Effect of eugenol-containing endodontic sealer on retention of prefabricated post luted with an adhesive composite resin cement. Quintessence Int 1992;23:839-44.
84. Uno S, Finger W. Función de la zona híbrida como capa absorbente de tensiones en la unión resina-dentina: Presentación de un caso. Quintessence (ed. esp.) 1996;9:469-74.
85. Van Hassel HJ. Physiology of the human dental pulp. Oral Surg Oral Med Oral Pathol 1971;32:126-134.
86. Van Meerbeek B, Lambrechts P, Inokoshi S, Braem M, Vanherle G. Factors affecting adhesion to mineralized tissues. Oper Dent 1992; suppl 5:111-24.
87. Van Meerbeek B, Perdigão J, Gladis S, Lambrechts P, Vanherle G. Adhesión al esmalte y dentina. En: Schwartz RS, Summit JB, Robbins JW. Fundamentos en odontología operatoria &endash; un logro contemporáneo. Bogotá. Actualidades Médico Odontológicas Latinoamérica, 1999:141-86.
88. Van Meerbeek B, Perdigão J, Lambrechts P, Vanherle G. The clinical perfomance of adhesives. J Dent 1998;26:1-20.
89. Van Meerbeek B, Peumans M, Gladys S, Braem M, Lambrechts P, Vanherle G. Three-year clinical effectiveness of four total-etch dentinal adhesive systems in cervical lesions. Quintessence Int 1996;27:775-84.
90. Van Meerbeek B, Peumans M, Verschueren M, Gladys S, Braem M, Lambrechts P, Vanherle G. Clinical status of ten dentin adhesive systems. J Dent Res 1994;73:1690-702.
91. Van Meerbeek B, Vargas M, Inoue S, Yoshida Y, Peumans M, Lambrechts P, Vanherle G. Adhesives and cements to promote perservation dentistry. Oper Dent 2001;suppl 6:119-44.
92. Van Meerbeek B, Willems G, Celis JP, Roos JP, Braem M, Lambrechts P, Vanherle G. Assessment by nano-indentation of the hardness and elasticity of the resin-dentin bonding area. J Dent Res 1993;72:1434-42.
93. Van Meerbeek B, Yoshida Y, Lambrechts P, Vanherle G, Duke ES, Eick JD, Robinson SJ. A TEM study of two water- basedadhesive systems bonded to dry and wet dentin. J Dent Res 1998;77:50-59.
94. Vargas MA, Cobb DS, Armstrong SR. Resin-dentin shear bond strength and interfacial ultrastructure with and without a hybrid layer. Oper Dent 1997;22:159-66.
95. Wilson AD, Batchelor RF. Zinc oxide-eugenol cements: II. Study of erosion and disintegration. J Dent Res 1970;49:593-98.
96. Wolanek G, Loushine R, Weller N, Kimbrough F, Volkmann KR. In vitro bacterial penetration of endodontically treated teeth coronally sealed with a dentin bonding agent. J Endod 2001;27:354-57.
97. Woody TL, Davis RD. Effect of eugenol-containing and eugenol free temporary cements on microleakage in resin bonded restorations. Oper Dent 1992;17:175-80.
98. Yap A, Shah KC, Loh ET, Sim SS, Tan CC. Influence of eugenol- contaning temporary restoration on bond strength of composite to dentin. Oper Dent 2001;26:556-61.
Invitados Anteriores y sus Trabajos
![]()
¿Comentarios? carlosboveda@carlosboveda.com.
![]()
![]()
![]() Carlos
Bóveda
Z.v
Octubre 2003
Carlos
Bóveda
Z.v
Octubre 2003