|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
" Conceptos Actuales sobre el Complejo Dentino-Pulpar. Fisiología Pulpar " por María Alejandra Navarro Odontólogo, Universidad Central de Venezuela , 2001 Especialista en Endodoncia, Universidad Central de Venezuela, 2003-2005 e-mail: marialenavarro@hotmail.com
Complejo Dentino Pulpar El tejido pulpar y dentinario conforman estructural y funcionalmente una verdadera unidad biológica denominada complejo dentino-pulpar. La dentina y la pulpa constituyen una unidad estructural, por la inclusión de las prolongaciones de los odontoblastos en la dentina; conforman una unidad funcional, debido a que la pulpa mantiene la vitalidad de la dentina y ésta a su vez la protege. También comparten un origen embrionario común, ambas derivan del ectomesénquima que forma la papila del germen dentario. 34 48 55 59 A pesar de lo expuesto anteriormente la dentina y la pulpa se describen por separado solamente por cuestiones de técnicas histológicas. La pulpa al ser un tejido conectivo laxo, se estudia exclusivamente en cortes descalcificados, los cuales permiten también analizar la relación dentino-pulpar; por su parte por ser la dentina un tejido duro, las observaciones se realizan generalmente en cortes por desgastes para poder observar su estructura mineralizada. 34
Histología de la Dentina. Generalidades La dentina es el eje estructural del diente y constituye el tejido mineralizado que conforma el mayor volumen de la pieza dentaria. En la porción coronaria se halla recubierta a manera de casquete por el esmalte, mientras que en la región radicular se encuentra tapizada por el cemento. Interiormente, la dentina delimita una cavidad denominada cámara pulpar, la cual contiene a la pulpa dental. 34 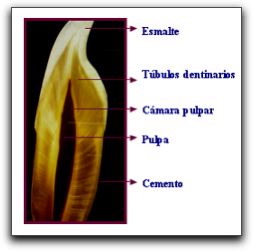 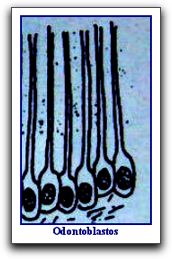 La formación de la dentina se inicia por un grupo de células especializadas denominadas odontoblastos, las cuales se diferencian de la papila dental alrededor de la octava o novena semana de la vida fetal. Los odontoblastos son células que se cree que derivan del mesodermo. Cuando estas células elaboran dentina toman apariencia alargada y de columna. 55 En la estructura de la dentina se pueden distinguir dos componentes básicos: la matriz mineralizada y los túbulos dentinarios que la atraviesan en todo su espesor y que alojan a los procesos odontoblásticos; dichos túbulos miden desde 1 um de diámetro a nivel de la unión de la dentina con el esmalte y hasta 3 um a nivel de su superficie radicular. Los procesos odontoblásticos son largas prolongaciones citoplasmáticas de las células especializadas llamadas odontoblastos, cuyos cuerpos se ubican en la región más periférica de la pulpa. Estas células producen la matriz colágena de la dentina y participan en el proceso de calcificación de la misma, siendo por tanto, responsables de la formación y del mantenimiento de la dentina. 34 48
Propiedades Físicas 1-Color: La dentina presenta un color blanco amarillento, pero puede presentar variaciones de acuerdo a la edad y de un individuo a otro. El color puede depender de:
2- Traslucidez: la dentina es menos traslúcida que el esmalte, debido a su menor grado de mineralización, pero en las regiones apicales donde el espesor de la dentina es mínimo, puede verse por transparencia el conducto radicular. 3- Dureza: esta determinada por su grado de mineralización, es mucho menos que la del esmalte y algo mayor que la del hueso y el cemento. 4- Radiopacidad: depende también del contenido mineral. Por su baja radiopacidad, la dentina aparece en las placas sensiblemente más oscuras que el esmalte. 5- Elasticidad: tiene gran importancia funcional, ya que permite compensar la rigidez del esmalte, amortiguando los impactos masticatorios. 6- Permeabilidad: Se da debido a la presencia de los túbulos dentinarios, que permiten a distintos elementos penetrar con relativa facilidad. 34
Composición La composición química de la dentina es de aproximadamente de 70% de materia inorgánica (principalmente cristales de hidroxiapatita), 18% de materia orgánica (principalmente fibras colágenas) y 12% de agua. 34 55
Matriz Orgánica Está constituida por varios componentes entre los que se destaca el colágeno tipo I, que es sintetizado por el odontoblasto y representa el 90% de dicha matriz. Los colágenos tipo III, IV, V y VI se han descrito en pequeñas proporciones. El tipo III se segrega en casos de dentina opalescente y está ocasionalmente presente en la dentina peritubular; el tipo IV, en los momentos iniciales de la dentinogénesis y los tipos V y VI se han descrito en distintas regiones de la predentina. También en la matriz orgánica se han detectado proteínas semejantes a las existentes en la matriz ósea tales como: la osteonectina, la osteopontina y la proteína Gla de la dentina que contiene ácido glutámico. Dichas matriz contiene además tres proteínas que se localizan únicamente en la dentina como son: la fosforina dentinaria (DPP) que tras el colágeno es el componente más abundante de la dentina, La proteína de matriz dentinaria 1 (DMP1) y la sialoproteína dentinaria (DPS). Las dos primeras son segregadas por los odontoblastos y la última es segregada por odontoblastos jóvenes y también por preameloblastos. Los proteoglicanos también se encuentran presentes en la matriz dentinaria. El condroitín 4-sulfato y el condroitin 6-sulfato son los GAG más frecuentes, predominando el segundo de ellos en la predentina. 34
Matriz Inorgánica La matriz inorgánica está compuesta por cristales de hidroxiapatita, similares químicamente a los del esmalte, cemento y hueso. Por su tamaño se diferencian de los grandes cristales del esmalte ya que son más pequeños y delgados. Las dimensiones de los cristales son de 36nm de longitud, 25 nm de anchura y 10 nm de altura, además se orientan de forma paralela a las fibras de colágeno de la matriz de la dentina, disponiéndose entre las fibras y también dentro de las mismas, ya que ocupan los espacios entre las moléculas de colágeno que la forman. 34 Además de los cristales de hidroxiapatita hay cierta cantidad de fosfatos amorfos, carbonatos, sulfatos y oligoelementos como flúor, cobre, zinc, hierro, magnesio entre otros. La fase inorgánica hace que la dentina sea algo más dura que el hueso y más blanda que el esmalte, esta diferencia se puede observar en las radiografías en las cuales la dentina aparece lago más radiolúcida que el esmalte, y más radiopaca que la pulpa
Zonas de la Dentina 1-Dentina del Manto Es la primera dentina sintetizada por los odontoblastos recién diferenciados, constituye una delgada capa de 20 um de espesor que queda ubicada por debajo del esmalte y el cemento. La matriz orgánica de este tipo de dentina está formado por fibras de colágeno muy gruesa que se disponen en forma ordenada y regular. La dentina del manto posee abundante sustancia fundamental, rica en GAG sulfatadas, pero carece de DPP (fosforina dentinaria). Además presenta un número aumentado de túbulos, pues contiene las ramificaciones terminales de los mismos. 34 59 2-Dentina Circumpulpar Una vez formada la dentina del manto, comienza a depositarse el resto de dentina, que se conoce como dentina circumpulpar. Esta forma el mayor volumen de dentina de la pieza dentaria, y se extiende desde la zona del manto hasta la predentina; su nombre proviene del hecho de que rodea a la pulpa. Las fibras colágenas son considerablemente más delgadas que las del manto, y se disponen irregularmente, formando una malla densa. La calcificación de esta dentina es de tipo globular y no lineal como ocurre en la dentina del manto. 34 59 3-Predentina Es una capa de dentina sin mineralizar, de 20 um a 30 um de ancho, situada entre los odontoblastos y la dentina circumpulpar. Está constituida por prolongaciones citoplasmáticas, acompañadas por fibras nerviosas amielínicas y matriz orgánica dentinaria. 34 La primera capa de matriz extracelular formada por los odontoblastos es predentina; a medida que esta se calcifica se forma nueva predentina. Así, dicha capa se mantiene durante toda vida del diente, como consecuencia de la actividad cada vez más lenta, pero continua, de los odontoblastos. La presencia de esta dentina es importante ya que constituye una fuente de producción continua de dentina. También es muy importante conocer que si la predentina se calcifica completamente, esta podría comenzar a ser resorbida por los odontoclastos. 34  Tipos de Dentina A-Dentina Primaria Es la dentina que se forma primero, representa la mayor parte de ésta y delimita la cámara pulpar de los dientes ya formados. Desde el punto de vista funcional se considera dentina primaria la que se deposita desde que comienza las primeras etapas de la dentinogénesis hasta que el diente entra en oclusión, es decir, cuando se pone en contacto con su antagonista. Cuando el volumen de la pulpa disminuye como consecuencia de la formación de la dentina primaria los odontoblastos modifican su distribución y se organizan en varios estratos en la zona coronaria. 34 B-Dentina Secundaria Es la dentina que se forma después que se ha completado la formación de la raíz del diente. Clásicamente se describía como la sintetizada a partir del momento en que el diente entra en oclusión, pero se ha demostrado que también se halla presente en dientes que aún no han erupcionado o están retenidos. Esta dentina se deposita mas lentamente que la primaria, pero su producción continúa durante toda la vida del diente. También se ha denominado dentina adventicia, regular o fisiológica. 34 44 55 En cuanto a la distribución de los túbulos en esta dentina, es ligeramente menos regular que la dentina primaria. El límite entre ambas se manifiesta por un cambio en la dirección de los túbulos dentinarios. La dentina secundaria se forma por dentro de la circumpulpar en toda la periferia de la cámara pulpar, alcanzando mayor espesor en el piso, techo y paredes, especialmente en el piso, mientras que es más delgada en los cuernos y en los ángulos diedros que los unen. La formación de esta dentina determina una progresiva disminución de la cámara pulpar, la cual es marcada en los dientes monoradiculares cuya cámara pulpar carece de techo y piso y en las raíces de los multiradiculares. 34 44 La disminución del volumen de la pulpa como resultado de la formación de dentina secundaria trae como consecuencia la disminución del número de odontoblastos. Los cambios en el espesor del tejido dentario pueden ser controlados mediante radiografías y se debe tener en cuenta al momento de realizar cualquier procedimiento operatorio o protésico, debido a que en un individuo joven el procedimiento puede involucrar un cuerno pulpar, a diferencia de un adulto, el cual ha sufrido reducción del volumen pulpar y se puede trabajar con mayor seguridad. C-Dentina Terciaria También llamada dentina reparativa, reaccional, irregular o patológica, se forma más internamente, deformando la cámara, pero en los sitios donde existe un estímulo localizado. Es decir, que esta dentina es producida por odontoblastos que se encuentran directamente implicados con los estímulos nocivos tales como: caries o los procedimientos operatorios, de manera que sea posible aislar la pulpa de la zona afectada. 34 55 La cantidad y calidad de la dentina terciaria que se produce se halla relacionada con la duración e intensidad del estímulo; cuanto más sean esos factores, más rápida e irregular será la aposición de dentina reparativa; si por el contrario el estimulo es menos activo, esta se deposita lentamente, siendo su patrón tubular más regular. 34 Si bien la dentina terciaria ofrece una protección pulpar de acuerdo con su espesor, la pulpa subyacente a la dentina terciaria puede inflamarse y su normalización dependerá de la intensidad y la duración del irritante, la extensión del tejido pulpar dañado y el estado previo de la pulpa. 34 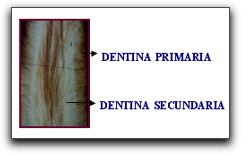 
Estructura Histológica de la Dentina A- Unidades Estructurales Básicas 1-Túbulos Dentinarios Son estructuras cilíndricas delgadas que se extienden por todo el espesor de la dentina desde la pulpa hasta la unión amelodentinaria o cementodentinaria. La pared del túbulo está formada por dentina peritubular la cual se encuentra constituida por una matriz mineralizada, que ofrece una estructura y una composición química característica. En su interior se encuentra el liquido tisular y las prolongaciones odontoblásticas (proceso odontoblástico o fibrilla de Tomes. 34 45 Estas siguen un trayecto en S desde la superficie externa de la dentina hasta su límite con la pulpa en la dentina coronaria. Esta curvatura en S es menos pronunciada en la dentina radicular y aún menos pronunciada en el tercio cervical de raíz.46 Dichas curvaturas se originan como resultado del apiñamiento de los odontoblastos a medida que se dirigen hacia el centro de la pulpa. 55 18 Los número de túbulos en un área dada depende de su localización dentro de la dentina. En la dentina coronal esta varia de 8.000 a 58.000 mm2, estas diferencias son importantes en la evaluación de las reacciones a los procedimientos restauradores. La menor cantidad de túbulos se han encontrado en la periferia y especialmente en las áreas debajo de las fisuras oclusales y el mayor número de túbulos se encuentran a nivel de los cuernos pulpares y en la superficie pulpar. Las variaciones marcadas en el número de túbulos por mm2 tienen diversas implicaciones clínicas. El promedio de túbulos a intertúbulos dentinarios sobre la pared pulpar de la preparación, será diferente en las cavidades profundas por lo tanto la vulnerabilidad de la pulpa será diferente. Este promedio también será afectado por la edad del diente debido a que la oclusión de los túbulos por el crecimiento de la dentina peritubular reducirá o eliminará el lumen del mismo.45 Garberoglio y Brännström (1976) observaron al microscopio electrónico de barrido dentina coronaria fracturada, encontrando entre 7.000 túbulos por mm2 en la dentina periférica y 60.000 por mm2 cerca de la pulpa. La variación entre el número de túbulos en los dientes puede ser debido a variaciones individuales de los mismos y a la inexactitud en el momento de tomar las medidas de la pulpa. Los túbulos dentinarios también presentan extensiones laterales que se ramifican a partir del túbulo principal y que pueden alojar o no prolongaciones odontoblásticas, dichas ramificaciones se denominan canalículos. Los túbulos dentinarios hacen permeable a la dentina, ofreciendo una vía de entrada a los irritantes del tejido pulpar para la caries. 20 -La dentina peritubular como se comentó anteriormente los túbulos están rodeados por una pared denominada dentina peritubular. La formación de la dentina peritubular se produce cuando se termina de completar la mineralización de la dentina intertubular. Se deposita en forma centrípeta en relación al túbulo dentinario, de manera lenta y gradual, y con la edad puede llegar a obliterar parcial o totalmente los túbulos dentinarios. 34  Mjör I (2002) señala que se forma como una estructura primaria en la porción principal de la dentina circumpulpar coronal y que esta estructura altamente mineralizada se forma durante el proceso de dentinogénesis. El mismo autor señala, que esta no se forma en la parte más pulpar de la dentina de los dientes recién erupcionados. Esto es importante en la odontología restauradora porque la parte principal de una preparación dentaria profunda en un individuo joven, comprometerá más material citoplasmático que matriz dentinaria mineralizada, en realidad casi el 80% del piso de la cámara pulpar podría estar compuesta por túbulos abiertos. La dentina peritubular puede ser diferenciada fácilmente de la dentina intertubular, debido a que presenta menos cantidad de fibrillas de colágeno y mayor proporción de proteoglicanos sulfatados, mientras que la dentina intertubular contiene gran cantidad de colágeno. 34 59 45 57. Además está más mineralizada y por ello es más dura que la intertubular. La dureza de esta dentina puede proporcionar un soporte estructural adicional para la dentina intetubular y con ello fortalecer el diente. 59 El crecimiento continuo de la dentina peritubular se produce como un cambio relacionado con la edad o por otras razones como procedimientos restauradores que llevan a la obliteración de los túbulos pudiendo producirse una esclerosis dentinaria. 45 57 El término de esclerosis es usado para describir la deposición continua de dentina peritubular el cual puede ocasionar la obliteración del túbulo, denominándose dentina esclerótica fisiológica. La esclerosis de la dentina también aparece con la edad, se puede observar frecuentemente en el tercio apical de la raíz y en la corona. La esclerosis reduce la permeabilidad de la dentina y puede ayudar a prolongar la vitalidad de la pulpa. 55 Por su parte Trowbridge y Kim en Cohen (2002) señalan que la esclerosis dentinal se da por la obturación parcial o completa de los túbulos dentinales, puede ser el resultado del envejecimiento o producirse como respuesta a determinados estímulos, como la atricción de la superficie del diente o caries dental. Cuando los túbulos se llenan con depósitos minerales, la dentina se convierte en esclerótica. La esclerosis da lugar a la disminución de la permeabilidad de la dentina; así la esclerosis dentinal, al limitar la difusión de las sustancias nocivas a través de la dentina, ayuda a proteger la pulpa frente a la irritación. Los túbulos dentinarios también pueden bloquearse mediante la precipitación de cristales de hidroxiapatita en el interior del túbulo. Este tipo ocurre en la zona translucente de una caries en la dentina y en una dentina atriccionada la cual se le denomina esclerosis patológica. -Contenido de los túbulos dentinarios. El interior del túbulo dentinario como se describió anteriormente, se encuentra ocupado por la prolongación odontoblástica, aunque entre dicha prolongación y la pared del túbulo existe un espacio estrecho (espacio periprocesal) el cual se encuentra ocupado por el liquido tisular. Los procesos odontoblásticos son las prolongaciones citoplasmáticas que dejan los odontoblastos a medida que forman la dentina; ellos determinan la morfología de los túbulos. Estos procesos son más anchos en su base (cerca del cuerpo del odontoblasto) y terminan en punta afilada; sus ramas colaterales y terminales ocupan las ramificaciones de los túbulos detinarios. No se ha podido establecer de manera segura la longitud de esas prolongaciones. Sobre este aspecto existen varias opiniones; con las técnicas de MET y de MEB se han observado prolongaciones odontoblásticas que no parecen extenderse más allá de los dos tercios internos de la dentina; por otro lado, resultados obtenidos con otros métodos de estudio, apoyan la idea que dichas prolongaciones ocupan toda la longitud del túbulo dentinario aún en un diente adulto. 34 Alrededor del 22% del volumen total de dentina está ocupado por fluido tisular el cual circula por el espacio periprocesal. Éste es un ultrafiltrado de la sangre presente en los capilares pulpares, su composición se asemeja a la del plasma 57 59. El fluido se dirige hacia fuera entre los odontoblastos, en los túbulos dentinarios, y escapa a través de los poros existentes en el esmalte. La exposicisión de los túbulos por fractura de un diente o por una preparación de una cavidad expone los túbulos, produciendo un movimiento de líquido no sólo hacia la superficie de la dentina expuesta en forma de gotitas muy pequeñas, sino también en profundidad, presionando las fibras nerviosas dentales las cuales inician el dolor. Se cree que el movimiento rápido del fluido a través de los túbulos dentinarios es una de las causas de que la dentina tenga sensibilidad. 34 59 En el espacio periprocesal también penetran hasta ciertas distancias, fibras nerviosas amielínicas provenientes de la pulpa; también se pueden distinguir algunas fibras colágenas e inclusive cristales de hidroxiapatita. 34 La existencia de los túbulos dentinarios determina que la dentina sea muy permeable; también constituyen una vía de ingreso rápido de microorganismos provenientes de una caries. En la dentina de dientes jóvenes, en donde, no se ha terminado de formar el ápice, los túbulos son más amplios y permeables, lo cual facilita aún más la filtración de bacterias o sus toxinas. 2- Dentina Intertubular La dentina intertubular se distribuye entre las paredes de los túbulos dentinarios y su componente fundamental son las fibras de colágeno que constituyen una malla fibrilar entre la cual y sobre la cual se depositan los cristales de hidroxiapatita. 34. Conforma el mayor componente de la dentina y representa el principal producto secretor de los odontoblastos, además esta constituida por una red tejida de fibrillas colágenas que miden entre 50 y 200 mm de diámetro, en las cuales se deposita cristales de hidroxiapatita. 55 Trowbridge H, Kim S por su parte refieren, que la dentina intetubular se localiza entre los anillos de la dentina peritubular y constituye el grueso de la dentina circumpulpar. Su matriz orgánica está compuesta principalmente por fibrillas de colágeno con un diámetro de 500-1000 A. 
B- Unidades Estructurales Secundarias -Dentina Interglobular La dentina interglobular es el término utilizado para describir zonas de dentina no mineralizada o hipomineralizada que persisten dentro de la dentina madura. Esta se encuentra principalmente en la dentina circumpulpar, justo por debajo de la dentina del manto. 55 59 47. Como resultado de algunas enfermedades como deficiencias hormonales o nutricionales, la mineralización de la dentina se ve afectada y se produce un aumento de las áreas de la dentina interglobular. 20 Mjör I (1985) señala que la dentina integlobular se forma durante la dentinogénesis y que representa islas no mineralizadas de tejido que puede ser producto de muchos factores locales y sistémicos. Como esta irregularidad de la dentina es un defecto de la mineralización y no de la formación de la matriz, el patrón arquitectónico normal de los túbulos permanece inalterado y corren sin interrupción a través de la áreas interglobulares. 20 -Lineas Incrementales La dentina al igual que el hueso crece por aposición, este crecimiento es el que determina la formación de las líneas incrementales. 34. Estas líneas corren en ángulo recto respecto a los túbulos dentinarios y marcan el patrón rítmico normal de la aposición de dentina en dirección interna y hacia la raíz. 55 Las menores líneas incrementales que pueden ser distinguibles son las líneas incrementales de Von Ebner. Ellas representan el patrón diario de formación de dentina, se hallan separadas por una distancia regular, que es de unos 6 um en la corona y de unos 3.5 um en la raíz. Esta diferencia se debe a que la formación de la dentina en la corona es más rápida que en la raíz. 34 Otro tipo de líneas incrementales son las de Owen. Estas líneas mayores son irregulares en grosor y espaciamiento. Owen las describió originalmente como una coincidencia de las curvaturas secundarias entre los túbulos dentinarios vecinos, pero actualmente se dice que son alteraciones en el proceso de calcificación de la dentina. 34 55 -Zona Granulosa De Tomes Se encuentra en toda la periferia de la dentina radicular. En cortes longitudinales se observa como una franja oscura, delgada de 50 um aproximadamente, vecina a la unión cemento dentinaria y paralela a ella en toda su longitud. El aspecto granular se atribuyó a la existencia de numerosos espacios de dentina interglobular, que se originarían por la falta de mineralización de las haces de fibras colágenas de la zona más periférica de la dentina radicular. 34 47 Por otra parte Seltzer y Bender (1970) refieren que su función es de protección del diente durante las fuerzas oclusales exageradas que son transmitidas de forma súbita de la dentina al ligamento periodontal.
Permeabilidad Dentinaria Los túbulos dentinarios son los conductos principales para la difusión del fluido a través de la dentina. 59. Los túbulos dentinarios convergen en la cámara pulpar a partir de la unión de la dentina con el esmalte. De este modo, las sustancias permeables tienden a concentrarse en una zona pequeña al llegar a la pulpa. Brännström y Garberoglio (1972) observaron que el área de la dentina ocupada por túbulos es de 1% en la unión dentina con el esmalte aumentando hasta un 45% a nivel de la cámara pulpar. Esto conduce implicaciones clínicas de gran importancia porque al exponerse una cantidad mayor de dentina profunda al realizar procedimientos restauradores o por caries y atricción, la dentina restante se hace más permeable, por consiguiente esto hace a la pulpa más susceptible a la irritación química o bacteriana. Esta consecuencia funcional de la zona tubular es también la causa de la disminución de la microdureza de la dentina más cercana a la pulpa, al aumentar la densidad tubular, disminuye la cantidad de matriz calcificada entre los túbulos. 48 Por su parte Mjör I (2002) refiere, que la permeabilidad dentinaria varía según la edad del diente, el grado de mineralización de los túbulos dentinarios, los cambios tisulares en la dentina, el nivel de localización de la dentina, la proporción de dentina intertubular y cualquier cosa que reduzca el paso de fluido dentro de los túbulos. La gran variación en el número de túbulos y el tipo de ramificaciones en las diferentes localizaciones de la dentina coronal también puede ocasionar marcada diferencia en la permeabilidad. Trowbridge (1981) refiere, que en el caso de caries dental, la pulpa desarrolla una reacción inflamatoria antes de ser infectada, lo que indica que los productos bacterianos llegan a la pulpa antes que las bacterias. La formación de dentina reparadora bajo una caries dental reduce la permeabilidad por obstrucción de los túbulos dentinarios, y por consiguiente, la cantidad de irritantes que penetran a la pulpa.
Histología Pulpar. Generalidades La pulpa es un tejido blando de origen mesenquimatoso, con células especializadas como son los odontoblastos, los cuales se encuentran dispuestos periféricamente en contacto directo con la matriz de la dentina. La relación que se establece entre los odontoblastos y la dentina es lo que se denomina complejo dentino-pulpar y es una de las razones por las cuales la pulpa y la dentina se deben considerar una unidad funcional. 59 Ten Cate (1986) refiere, que la pulpa dental es el tejido conectivo blando que mantiene a la dentina. En ella se pueden distinguir cuatro zonas diferentes: la zona odontoblástica, la zona subodontoblástica u oligocelular de Weil, la zona rica en células y la zona central de la pulpa o tejido pulpar propiamente dicho. Las células principales de la pulpa son: los odontoblastos, fibroblastos, células mesenquimatosas indiferenciadas y los macrófagos, las cuales serán descritas a continuación. 34 55
Componentes Estructurales de la Pulpa La pulpa dental consta básicamente de los mismos componentes que el tejido conjuntivo laxo de cualquier otra parte del cuerpo y se encuentra ricamente vascularizado e inervado. 62. Está formada por un 75% de agua y por un 25% de materia orgánica. Esta última está constituida por células y matriz extracelular (MEC) representada por fibras y sustancia fundamental. 34 18 A-Elementos Celulares de la Pulpa Normal -Odontoblastos. Son las células más predominantes del órgano dentino-pulpar. Son células específicas o típicas del tejido pulpar, situadas en la periferia y adyacente a la predentina. Los odontoblastos conforman por su disposición en empalizada la capa odontoblástica, la cual es semejante a un epitelio cilíndrico pseudoestratificado en la región coronaria y un epitelio cilíndrico simple en la zona radicular. Los odontoblastos en la porción coronaria alcanzan la cifra de 45.000 m2, el cual va disminuyendo en la zona radicular. Los odontoblastos de la corona son también mas grandes que en la zona radicular: esta célula adopta una forma cilíndricas altas 40 um, mientras que en la zona media las células son cúbicas y en la zona apical son de aspecto aplanado. Las variaciones morfológicas están directamente relacionadas con la actividad funcional. 34 59 62 18 55 45 Trowbridge y Kim (2002) refieren que la dentinogénesis, la osteogénesis y la cementogénesis son similares en muchos aspectos, por lo tanto los odontoblastos, los cementosblastos y los osteoblastos presentan características similares. Todas estas células poseen una matriz compuesta con fibras colágenas y proteoglucanos, capaz de mineralizarse. Las características ultraestructurales de estas células son similares, contienen un RER(retículo endoplasmático rugoso) muy extenso que ocupa gran parte del citoplasma, un aparato de Golgi bien desarrollado y localizado en el lado dentinario del núcleo, gránulos secretores y numerosas mitocondrias, además son ricas en ARN, y sus núcleos contienen uno o varios nucleolos prominentes. Las diferencias más significativas entre estas células, quizás sean el aspecto morfológico y la relación anatómica que se establece entre las células y las estructuras que producen. Los odontoblastos por otra parte presentan prolongaciones celulares para formar los túbulos dentinarios. Con respecto a las variaciones de la longitud, de la prolongación celular o citoplasmática en el interior del túbulo dentinario, numerosas investigaciones demuestran que su extensión promedio oscila entre 0.2 a 0.7 mm. Por otra parte, trabajos realizados con MEB (microscopia electrónica de barrido) o mediante técnicas inmunohistoquímicas, demuestran que puede llegar hasta la unión amelodentinaria. Se ha sugerido que el proceso odontoblástico ocupa toda la longitud de los túbulos sólo en las primeras fases del desarrollo, mientras que en un diente adulto las prolongaciones pueden presentar distintas longitudes, alcanzando en algunos casos la dentina periférica. 34 48 39 Mjör I (2002) por su parte señala, que la extensión de las prolongaciones odontoblásticas es un punto muy controversial. Muchos investigadores sugieren que los procesos citoplasmáticos o prolongaciones citoplasmáticas solo se extienden cerca de un tercio de la distancia, desde la predentina al esmalte en dientes normales de jóvenes adultos. Byers y Sugaya (1995) emplearon en su estudio el colorante de carbocianina fluorescente y la microscopia confocal, se demostró que en los molares de ratas, las prolongaciones odontoblásticas no se extendían a la dentina externa ni a la UDE (limite amelo-dentinario), excepto durante las primera fases del desarrollo dental. Evidentemente se ameritan más estudios sobre el tema. En cuanto a la vida del odontoblasto no se conoce aún, pero es probable que sea la misma que el diente. 55. Sin embargo Trowbridge y Kim refieren que la vida media del odontoblasto coincide con la vida media de la pulpa viable. Es importante hacer referencia, que el odontoblasto maduro es una célula altamente diferenciada que ha perdido la capacidad de dividirse. Los nuevos odontoblastos que se originan en los procesos reparativos de la dentina, es a expensas de las células mesenquimatosas indiferenciadas, aunque algunos autores opinan que podría derivar de los fibroblastos pulpares. -Fibroblastos. Son las células principales y más abundantes del tejido conectivo pulpar, especialmente en la corona, donde forman la capa rica en células. 34 55 59 18. Los fibroblastos pulpares son células fusiformes con núcleos ovoides. Sintetizan y secretan la mayor parte de los componentes extracelulares, es decir, el colágeno y la sustancia fundamental. 34 48 Los fibroblastos tienen por función formar, mantener y regular el recambio de la matriz extracelular fibrilar y amorfa: además son células multifuncionales, pues tienen también la capacidad de degradar el colágeno como respuesta ante distintos estímulos fisiológicos del medio interno. 34 48 59. Se piensa también que estas células pueden tener el potencial de originar nuevos odontoblastos en la periferia de la pulpa cuando se amerita. 55 59 -Células Mesenquimáticas Indiferenciadas. Estas células derivan del ectodermo de las crestas neurales. Constituyen las células de reserva de la pulpa por su capacidad de diferenciarse en nuevos odontoblastos o fibroblastos, según el estimulo que actúe. 34. Se encuentran bajo los odontoblastos en la zona rica en células. 48 Ten Cate (1986) refiere que estas células se hallan en toda el área celular y en la zona central de la pulpa y se relacionan a menudo con los vasos sanguíneos. Además menciona que poseen abundante citoplasma y prolongaciones citoplasmáticas periféricas. Baume referido por Ingle (1996), revisó estudios ultraestructurales que sugieren la existencia de conexiones citoplasmáticas entre los odontoblastos y éstas células mesenquimatosas subyacentes. El mismo autor señaló que al morirse o lesionarse los odontoblastos, a través de tales conexiones se pueden enviar señales a éstas células menos diferenciadas y hacer que se dividan y se diferencien, formando odontoblastos o células similares a estas. El número de células mesenquimáticas disminuye con la edad, lo cual produce una reducción en la capacidad de autodefensa de la pulpa. 34 -Macrófagos. Son monocitos que han abandonado el torrente sanguíneo, entran en los tejidos y se diferencian en varias subpoblaciones, una de esta subpoblación son los macrófagos, los cuales desempeñan funciones activas de endocitosis y fagocitosis, Debido a su movilidad y actividad fagocítica, estos elementos celulares son capaces de actuar como reservorios, que eliminan hematíes extravasados, células muertas y sustancias extrañas presentes en los tejidos, todo el material ingerido por los macrófagos es destruido por la acción de enzimas lisosomales. Además otro grupo de macrófagos participan en reacciones inmunes mediante el procesamiento del antígeno y su presentación posterior a la célula T de memoria.48 59 -Células Dendríticas. Son elementos accesorios del sistema inmune. En la epidermis y en las membranas de las mucosas se encuentran células similares llamadas células de Langerhans. Las células dendríticas se hallan especialmente en los tejidos linfoides, pero también están ampliamente distribuidas por los tejidos conectivo, entre ellos el de la pulpa. 59 -Linfocitos. Se ha demostrado que en la pulpa sana solamente posee linfocitos de tipo T, los linfocitos B normalmente están ausentes. Los linfocitos T participan en la respuesta inmunológicas inicial; esta células se activan mediante mecanismos inmunológicos ante la presencia de antígenos provenientes de la caries, los cuales liberan linfoquinas que provocan vasodilatación pulpar, La interacción entre ambos tipos de linfocitos facilitaría la diferenciación de linfocitos B en células plasmáticas, las cuales son la que elaboran anticuerpos específicos contra los antígenos que han propiciado la respuesta inflamatoria. 34 -Mastocitos. Se encuentran ampliamente distribuidos por los tejidos conectivos. En pocas ocasiones se hallan en le tejido pulpar, mientras que se encuentran de forma sistémica en las pulpas con inflamación crónica. 18 59 Mjör I (2000) por su parte refiere que los mastocitos no se encuentran en las pulpas normales, pero se encuentran abundantemente en las pulpas inflamadas. Farnoush A (1984) señala que existen muchas controversias sobre la presencia de mastocitos en pulpas dentales. El autor realizó un estudio donde fueron observadas las pulpas dentales de dientes permanentes libres de caries y dientes primarios con caries, los resultados indicaron que los mastocitos están presentes en pulpas tanto inflamadas como no inflamadas. Los mastocitos provenientes de pulpas inflamadas mostraron signos de desgranulación con gránulos por fuera de la membrana celular.
B- Fibras
C- Sustancia Fundamental La sustancia fundamental o matriz extracelular amorfa, está constituido principalmente por proteoglicanos y agua. 34. Es de consistencia similar a un gel y constituye la mayor parte del órgano pulpar. La sustancia fundamental rodea y da apoyo a las estructuras. Se comporta como un verdadero medio interno, a través del cual las células reciben los nutrientes provenientes de la sangre arterial; igualmente los productos de desechos son eliminados en él para ser transportados hacia la circulación eferente. 34 48
Zonas Morfológicas de la Pulpa A-Capa Odontoblástica. Es la capa más superficial de la pulpa, la cual se localiza debajo de la predentina. Está constituida por los odontoblastos dispuestos en empalizada. En consecuencia esta capa se compone de los cuerpos celulares de los odontoblastos, además entre estos se pueden encontrar capilares, fibras nerviosas y células dendríticas. 34 18 59 La capa odontoblástica de la pulpa coronal contiene más células por unidad de área que la pulpa radicular. Mientras que los odontoblastos de la pulpa coronal maduran suelen ser cilíndricos, los de la porción media de la pulpa radicular son más cúbicos. Cerca del foramen apical aparecen como una capa de células planas. Entre los odontoblastos existen una serie de uniones intercelulares especializadas, es decir, complejos de unión, que incluyen desmosomas, uniones en hendiduras (nexos) y uniones estrechas (zónulas ocluyentes). 58. Funcionalmente estas uniones son las que mantienen la integridad de la capa odontoblástica. 34 B-Zona pobre en Células O Zona Odontoblástica U Oligocelular De Weil. Esta capa se encuentra situada por debajo de la anterior, tiene aproximadamente 40 um de ancho y se la identifica como una zona pobre en células. Está conformada por capilares sanguíneos, fibras nerviosas amielínicas y las finas prolongaciones citoplasmáticas de los fibroblastos. 59. En ella existe el plexo nervioso de Raschkow, el plexo capilar subdentinoblástico y fibroblastos. 18 .Esta zona puede no ser aparente en las pulpas jóvenes, donde la dentina se forma con rapidez, o en las pulpas adultas, donde se genera dentina reparadora. 59 C-Zona rica en Células. Se caracteriza por su amplia densidad celular, donde se destacan las células mesenquimáticas y los fibroblastos que originan las fibras de Von Korff. 34. Además esta capa puede contener un número variable de macrófagos, células dendríticas y linfocitos. Esta capa es mucho más predominante en la pulpa coronal que la radicular. Fitzgerald M, Ciego D, Heys D (1990) refieren, que aunque la división celular dentro la zona rica en células es rara en pulpas normales, la muerte de los odontoblastos causa un gran aumento en la mitosis. Puesto que los odontoblastos con lesiones irreversibles se sustituyen por células que emigran desde la zona rica en células hasta la superficie interna de la dentina. D-Pulpa propiamente dicha. Es la masa central de la pulpa, está formado por el tejido conectivo laxo característico de la pulpa, con sus distintos tipos celulares, escasas fibras inmersas en matriz extracelular amorfa y abundantes vasos y nervios. El componente celular está formado principalmente por fibroblastos, células mesenquimáticas y macrófagos, pero proporcionalmente tiene menor cantidad de células por unidad de superficie que la zona rica en células. 34 
Fisiología del Complejo Dentino-Pulpar La actividad funcional del tejido dentario consiste en actuar como soporte mecánico en la actividad masticatoria normal de las estructuras dentarias y en participar también, por sus características estructurales y biológicas, en la defensa y en la sensibilidad del complejo dentino pulpar. 40 La dentina posee dos propiedades físicas esenciales, la dureza y la eslaticidad, que resultan imprescindibles en la fisiología de las estructuras dentarias. El complejo u órgano dentino-pulpar responde por medio de su función defensiva ante los distintos irritantes que actúan sobre ella, formando la dentina terciaria, la dentina traslúcida o esclerótica y la dentina opaca o tractos desvitalizados. 34 Los estímulos nocivos además de provocar el depósito de dentina terciaria, pueden inducir cambios en los túbulos dentinarios de la dentina primaria y secundaria. Las porciones dentinarias que son sometidas a estímulos lentos, persistentes o no muy severos, pueden producir un depósito de sales de calcio sobre las prolongaciones odontoblásticas en degeneración, aumentando de esta forma la cantidad de dentina peritubular, la cual puede producir la obliteración de los túbulos y en consecuencia toda la región queda constituida por una matriz mineralizada denominada dentina traslúcida o esclerótica. 34 40 Cuando la dentina es afectada por una lesión intensa, los odontoblastos se defienden retrayendo sus prolongaciones quedando segmentos de los túbulos vacíos, es decir, sin procesos odontoblásticos; en cambio si el estímulo es excesivo se produce la muerte de los odontoblastos y una necrosis de sus prolongaciones, quedando restos celulares incluidos en los túbulos acompañados de liquido y sustancia gaseosa. Esta zona de dentina afectada se conoce como dentina opaca o tractos desvitalizados. 34 La dentina traslúcida y la opaca son consideradas dentina de remineralización. Como estas son menos permeables y más resistentes que la normal, puede proporcionar mayor protección en los casos filtración o invasión bacteriana. Sin embargo en dientes desvitalizados la filtración va a hacer mayor por la ausencia del líquido dentinario. 34 En cuanto a la actividad sensitiva de la dentina se conoce que ésta es un tejido sensible y que todos los estímulos externos (frío, calor) recibidos por las terminaciones nerviosas de la pulpa producen la sensación del dolor. Entonces se puede decir que el complejo dentino-pulpar va a cumplir 5 funciones:
Función Nutritiva. Vascularización 1-Circulación Sanguínea Los vasos sanguíneos penetran en la pulpa acompañados de fibras nerviosas sensitivas y simpáticas y salen de ella a través del foramen apical. Los vasos menores pueden entrar a la pulpa a través de conductos laterales o accesorios. Las arteriolas entran en la pulpa coronal, se abren en abanico hacia la dentina disminuyen de tamaño y dan lugar a una red capilar en la región subodontoblástica (plexo capilar subodontoblástico), esta red capilar es muy extensa y se localiza en la zona basal u oligocelular de Weil y su función es nutrir a los odontoblastos, a su vez en la porción central emiten pequeñas ramas colaterales que se extienden lateralmente hacia la capa odontoblástica. Los capilares subodontoblásticos están rodeados por una membrana basal. En cuanto al tipo de capilares que se encuentran en la pulpa está el tipo continuo y sólo un pequeño porcentaje aproximadamente del 4% es del tipo penetrado (poros en los capilares). 24 35. Se cree que estas fenestraciones proporcionan un medio de transporte rápido de fluidos y metabolitos, desde los capilares hasta los odontoblastos adyacentes. 34 45 48 55 59 18 23 El flujo sanguíneo coronal es casi dos veces mayor que el de la porción radicular. Además el flujo sanguíneo de las astas es mayor que el de otras áreas de la pulpa. En los dientes jóvenes, los capilares normalmente se extienden en la capa odontoblástica con el fin de asegurar el suministro adecuado de nutrientes para la actividad metabólica de los odontoblastos.59 El lado eferente de la circulación se compone de un extenso sistema de vénulas. El flujo sanguíneo pasa desde el plexo capilar hacia las venas postcapilares y luego a las vénulas mayores. Las vénulas de la pulpa tienen paredes finas, que pueden facilitar el movimiento de fluidos hacia dentro y hacia fuera del vaso; mientras que la capa muscular es fina y discontinua. Las vénulas se vuelven mayores cuando cursan hacia la región central de la pulpa y pueden alcanzar un diámetro de 20 mm, así pues, estas vénulas son considerablemente mayores que las arteriolas de la pulpa. Kramer (1968) citado por Cohen 2002, señala que el drenaje venoso principal de los dientes con múltiples raíces fluye a veces hacia abajo por un solo conducto o cursa hacia fuera, a través de un conducto accesorio en el área de la bifurcación o la trifurcación del diente. 48 59 Por su parte Gómez y Campo (2001) refieren que la circulación sanguínea de la pulpa es de tipo terminal, ya que entre los vasos aferentes y los eferentes, de menor calibre, existen comunicaciones alternativas, como anastomosis arteriovenosas que constituyen la llamada microvascularización y cuya función es la de regular el flujo sanguíneo. Basrani (1999) además refiere, que las anastomosis arteriovenosas son características, sobre todo en la porción radicular. Estas son vénulas delgadas que desempeñan un papel importante en la regulación de la circulación pulpar como fue mencionado anteriormente. El calibre de las vénulas y arteriolas es controlado por el sistema simpático, que actúa sobre las fibras musculares lisas de las paredes vasculares por medio de fibras nerviosas amielínicas. El aumento de la presión originado por una lesión pulpar, se mantiene circunscrito a su área por un mecanismo hemodinámica. Así, en un proceso inflamatorio no tan severo, el aumento de presión queda limitado al lugar de la lesión sin extenderse. Hargreaves K y Goodis H (2002) refieren que cuando ocurre un incremento localizado de la presión intersticial durante la inflamación, puede conllevar a un colapso generalizado de vénulas y cese del flujo sanguíneo. Dentro de los factores que conllevan a un aumento del volumen del fluido intersticial se encuentran: la dilatación arteriolar, constricción venular, disminución de la presión osmótica de los capilares, aumento de la presión osmótica en los compartimientos intersticiales, aumento de la permeabilidad capilar y reducción del flujo linfático. Los cuatro primeros factores provocan alteraciones en la filtración capilar; mientras que el quinto factor ocurre después de la liberación de mediadores químicos e incrementa la filtración capilar. Seltzer y Bender (1970) refieren que la función principal de la microcirculación es transportar nutrientes a los tejidos y eliminar productos metabólicos de desechos.  2-Circulación Linfática La existencia de vasos linfáticos en la pulpa dental ha sido un tema de discusión, debido a que no es fácil distinguir entre vénulas y linfáticos mediante las técnicas comunes de microscopia electrónica. 59 29 Actualmente empleando el MEB (microscopio electrónico de barrido) y las técnicas histoquímicas enzimáticas de doble tinción (5 nucleotidasa-fosfatasa alcalina), se corrobora la existencia de numerosos vasos linfáticos en la parte central de la pulpa y en menor número en la zona periférica próxima a la capa odontoblástica. 34 Los vasos linfáticos se originan de la pulpa coronaria como vasos pequeños ciegos, de paredes muy delgadas cerca de la zona pobre en células o zona olicelular de Weil y de la zona odontoblástica. Estos vasos ciegos drenan la linfa en vasos recolectores de pequeños tamaño, los que en cortes histológicos pueden diferenciarse de las vénulas por la ausencia de glóbulos rojos y porque sus paredes son discontinuas. 34 55 24 26 Con métodos especiales (linfografías) se ha evidenciado que estos vasos abandonan la región de la pulpa radicular conjuntamente con los nervios y los vasos sanguíneos y salen por el agujero apical, para drenar en los vasos linfáticos mayores del ligamento periodontal. 34 18 48. Además se ha demostrado que los capilares linfáticos miden alrededor de 8 um de diámetro, mientras que los pequeños vasos linfáticos eferentes tienen un calibre de 100 um. 34. Los linfáticos procedentes de los dientes anteriores drenan hacia los ganglios linfáticos submentonianos, mientras que los linfáticos de los dientes posteriores lo hacen en los ganglios linfáticos submandibulares cervicales profundos. Bishop y Malhotra (1990) demostraron en un estudio empleando microscopio tanto óptico como electrónico la presencia de capilares linfáticos en las pulpas dentales de humanos y gatos. Bernick y Patek (1969) y Bernick (1977) demostraron que los capilares linfáticos se originan como aberturas ciegas cerca de la zona de Weil y la capa odontoblástica. Drenan en vasos recolectores, pequeños y de paredes delgadas, que frecuentemente se comunican entre sí. Después, los vasos recolectores pasan a la pulpa por la región apical, junto con los vasos sanguíneos y nervios. Bernick (1977), además describió el aspecto de los linf'áticos en la pulpa inflamada y postuló que su función consiste en retirar el exceso de liquido y residuos que acompañan a la inflamación. Bishop (1992) citado por Mjör (2002), señala que los vasos linfáticos transportan fluidos hacia afura de la pulpa y juega un rol importante en el mantenimiento del balance de los fluidos.
Función Sensitiva. Inervación Dahl (1973) demostró empleando el microscopio electrónico y de luz que la pulpa dental humana se encuentra profundamente inervada. La pulpa dental contiene nervios sensitivos y motores para desempeñar sus funciones vasomotoras y defensivas. 62 Los nervios sensitivos (aferentes) de la pulpa son ramas de las divisiones maxilar y mandibular del quinto par craneal (trigémino). Estas ramas penetran por los agujeros apicales y se ramifican al igual que los vasos sanguíneos. Los nervios de mayor tamaño se localizan en la zona central; al avanzar hacia la corona y a la periferia se dividen en unidades cada vez más pequeñas. Por debajo de la zona celular los nervios se ramifican, formando el plexo de Raschkow. Este estrato nervioso contiene fibras mielínicas A-delta (de 2.5um de diámetro). Estás fibras son de conducción rápida (15 a100 m/sg) y su función es la transmisión del dolor. 34 55 45 18 29 24 62 59 Pashley señala que estas fibras intervienen en el dolor bien localizado, breve y agudo relacionado con la sensibilidad dentinaria y además presentan un umbral de excitación relativamente bajo. Las fibras A pueden ser beta y delta, las fibras A beta quizás sean ligeramente mas sensible a la estimulación que las A delta, pero ambos tipos se agrupan desde el punto de vista funcional. Aproximadamente el 90% de las fibras A son las delta.59 También se encuentran las fibras C amielínicas diminutas (de 0.3-1.2 um). 34 45 62 18 51 24 59 Los nervios amielínicos provienen del ganglio cervical superior y llegan a la pulpa apical para dirigirse a la túnica muscular de las arteriolas. Estas fibras son de conducción lenta (0.5 a 2 m/sg) e intervienen en el control del calibre arterial, es decir, tienen una función vasomotora. 34 45. Un subgrupo de estas fibras nerviosas (fundamentalmente amielínica) contienen neuropéptidos, Incluyendo la sustancia p, el péptido relacionado con el gen de la calcitonina (CGRP) y neurocininas. Narhi (1990) señala que las fibras C son polimodales y reaccionan ante diferentes estímulos cuando alcanzan a la pulpa propiamente dicha, además menciona que las fibras C parecen relacionarse con sensaciones dolorosas secundarias, radiantes y sordas. El mismo autor refiere que las fibras C son más resistentes a los efectos de la presión e hipoxia que las fibras A. Por ejemplo durante la inflamación pueden presentarse en la pulpa la elevación de la presión y la hipoxia. En consecuencia, se puede bloquear la función de las fibras A, por lo tanto, se liberan mediadores de la inflamación como la histamina y bradicinina que pueden activar las fibras C. Por medio de diferentes métodos, se ha demostrado que algunas fibras del plexo continúan su recorrido entre los espacios interodontoblásticos, donde pierden su vaina de mielina. Otras en cambio penetran hasta 200 um en la predentina y dentina, junto con las prolongaciones odontoblásticas o sobre las prolongaciones de estos en el interior de los túbulos dentinarios, lo hacen en forma similar a una sinapsis. Estos contactos fibra/prolongación odontoblástica actuarían como receptores sensoriales desempeñando un papel fundamental en la sensibilidad dentinaria. 34 48 Por otra parte Feaurnhead y Avery citados por Weine refieren, que se encuentran nervios intratubulares en el 10-20% de los túbulos de la región del cuerno pulpar coronal, en menos del 1% de los títulos a nivel de la unión cemento-esmalte y en contadas ocasiones en la dentina radicular. En cuanto a los nervios motores son subsidiarios de la división simpática del sistema vegetativo. Los nervios simpáticos (postganglionares) penetran por el ápice radicular con la cubierta exterior de la arteria y terminan como prolongaciones fibrilares varicosas a nivel de las células musculares de la pared arterial muscular media. Los términos vasomotor y control vasomotor son muy apropiados para designar a estas fibras simpáticas, ya que al inervar los vasos sanguíneos y su musculatura, controlan el diámetro de la luz vascular y, por consiguiente, también el volumen del flujo sanguíneo y en última instancia la presión pulpar. 62 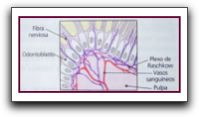 Neuropéptidos Los Neuropéptidos son una proteína involucrada en el sistema nervioso periférico y central, juegan un papel en la inflamación y transmisión de la sensación dolorosa. 61 62 Las fibras nerviosas contienen neuropéptidos, como péptido relacionado con el gen de la calcitonina (CGRP), sustancia P (SP), neuropéptido Y, neurocinina A y polipéptido intestinal vasoactivo (VIP). 59 Las sustancia P, el CGRP y la neurocinina A, son neuropéptidos sensitivos que se han encontrado en la pulpa, los cuales se originan del ganglio del trigémino y se distribuyen por una serie de fibras C amielínicas. Al excitarse, estas fibras nerviosas liberan neuropéptidos y producen una respuesta inflamatoria (vasodilatación, hiperexcitación de las terminaciones nerviosas) denominada inflamación neurógena. También se han encontrado en la pulpa dental un neuropéptido simpático, el neuropéptido Y (de efectos vasoconstrictores) y un neuropéptido parasimpático, el polipéptido intestinal vaso activo (de efecto vasodilatadores). Los neuropéptidos no sensitivos se suelen asociar a fibras nerviosas vasculares y no se encuentran en la pulpa periférica (capa dentinoblástica u odontoblástica). 59 Wakisaka (1990) por su parte l los clasifica en sensoriales, simpáticos y parasimpáticos. a- Sensoriales
b- Simpáticos
c- Parasimpáticos
Sensibilidad Dentinaria Una de las características más extraordinarias del complejo dentino-pulpar es su sensibilidad. La sensación mas percibida por este complejo es la del dolor, a menudo apreciado como difuso, haciendo difícil su localización clínica. 55 Muchos estímulos son capaces de provocar una respuesta dolorosa cuando se aplican a la dentina como: los estímulos térmicos, mecánicos. La dentina no es uniformemente sensible, se dice que la dentina es más sensible a nivel del límite amelodentinario y muy sensible cerca de la pulpa; en general su sensibilidad está aumentada cuando está sobre una pulpa inflamada.55 Existen varias teorías que pueden explicar la sensibilidad de la dentina:
Brännström y Garberoglio (1972) y Thomas (1979) realizaron exámenes al microscopio electrónico de dentina animal y humana como apoyo adicional a la teoría hidrodinámica, donde se demuestra que las prolongaciones odontoblásticas rara veces se extienden a más de un tercio de distancia de los túbulos dentinarios. El movimiento de líquido dentinario se puede acelerar a través de la deshidratación de la superficie dentinaria con la aplicación de aire comprimido o calor seco. Los productos bacterianos y otros contaminantes se pueden incorporar al líquido dentinario como consecuencia de la caries dental, de los procedimientos de restauración o por causa del crecimiento bacteriano bajo las restauraciones. Por lo tanto el líquido dentinario puede servir como un colector por medio del cual los agentes infecciosos pueden filtrarse en la pulpa y producir una respuesta inflamatoria.40 
Bernick (1964) citado por Seltzer y Bender (1970) observó que las terminaciones nerviosas de los nervios pulpares se ramifican y terminan en el estroma conectivo de lo zona pulpo-odontoblástica, pero sin penetrar en la capa odontoblástica. No obstante, se probaron terminaciones en el límite amelodentinario. -Histamina: Sicher (1953) citado por Seltzer y Bender (1970) refiere, que la histamina que se libera al ser lesionados los odontoblastos irrita los nervios sensoriales de la capa odontoblástica; parte un impulso hacia el cerebro y se siente el dolor. De esta manera se acepta al odontoblasto como receptor del dolor. Winter, Bishop y Dorman (1963) realizaron un estudio del potencial de la membrana del odontoblasto, en donde refieren, que la excitabilidad eléctrica de los odontoblastos no es compatible con la conducta de un tejido nervioso conductor de impulsos nerviosos. Anderson y Taylor (1962) citados por Seltzer y Bender (1970) corroboraron que se producía dolor al aplicar histamina a la pulpa dental. Señalan que la histamina no producía dolor al aplicarla sobre dentina recién cortada, durante 30 segundos; sin embargo, esta comprobación no descarta la producción de dolor por la histamina, pues estas u otras sustancias productoras de dolor son generadas por las células pulpares; estas sustancias pueden actuar sobre las terminaciones nerviosas sin difundirse por la dentina. -Acetilcolina y acetilcolinesterasa: se cree que desempeña un papel esencial en la transmisión de los impulsos nerviosos. Avery y Rapp (1959) refieren que estas juegan un papel muy importante en la transmisión del impulso nervioso. Realizaron un estudio para determinar la presencia sistema específico de colinesterasa en la pulpa y en la dentina, en donde hallaron colinesterasa en los nervios de la pulpa, en la región de los odontoblastos en el límite amelodentinario y en la fibra de Tomes. Los mismos autores refieren que las fibras de Tomes son la vía de transmisión de la dentina y que existe una sinapsis con las terminaciones nerviosas libres en la zona odontoblástica; también señalan que los odontoblastos funcionan en calidad nerviosa sin ser necesariamente células nerviosas. -Presión: La hipótesis de Brännström (1963) citado por Seltzer y Bender (1970) es que la evaporación del contenido del líquido de los túbulos dentinarios produce un desplazamiento de los odontoblastos hacia dentro de los túbulos. El movimiento del núcleo produce una reducción en la presión en el extremo pulpar de los túbulos dentinarios. El vacío creado , más la acumulación de iones de potasio fuera de la célula, constituye un estímulo para la célula nerviosa pulpar que es bastante intenso como para producir dolor.
Hipersensibilidad Dentinaria Se describe clínicamente como una reacción exagerada ante un estímulo sensitivo inocuo. Este es un estado crónico con exacerbaciones agudas. La cronicidad concluye cuando se restaura el defecto del esmalte o el cemento. La hipersensibilidad difiere del dolor pulpar y dentinario por lo siguiente:
La hipersensibilidad dental es similar al dolor dentinario en términos de diagnóstico diferencial en:
El mecanismo que explica la hipersensibilidad dentinaria se basa en la teoría hidrodinámica mediante el cual el estímulo causa un flujo hacia adentro o hacia fuera del contenido de los túbulos dentinarios para, a su vez, motivar una alteración mecánica o perturbación celular que excita a los nervios en el diente.22
Modificaciones de la Pulpa con la Edad El tejido pulpar y la cavidad que lo aloja sufre variaciones estructurales y funcionales en relación a la edad. Estos cambios ocasionan una disminución en la capacidad de respuesta biológica y como consecuencia de ello, el tejido pulpar con la edad no responde a los estímulos externos como la hace una pulpa joven. Los principales cambios son:
El conocimiento de todos estos cambios tiene gran importancia clínica, pues la capacidad de defensa en una pulpa joven, es mayor al contar con un número más elevado de elementos indiferenciales, capaces de neoformar odontoblastos. La capacidad de auto defensa o la posibilidad de regeneración del tejido, no sólo depende de la edad biológica, sino también del estado general de la salud del organismo y de la cantidad de daño tisular.
Respuesta del Complejo Dentino-Pulpar ante los diferentes tipos de Irritantes. Generalidades Los irritantes del complejo dentino-pulpar que pueden producir inflamación o muerte pulpar son innumerables y variables, la invasión bacteriana ocasionada por una lesión cariosa es la causa más frecuente de la inflamación pulpar. Las preparaciones, restauraciones cavitarias inadecuadas y el uso incorrecto de ciertos materiales dentales durante la ejecución de los procedimientos restauradores son también causas frecuentes de irritación del órgano dentino pulpar. 40 Los irritantes del complejo dentino pulpar los podemos clasificar en: físicos, químicos y bacterianos. En cuanto a los irritantes físicos los más conocidos son: el calor friccional, la desecación de la dentina, la extensión de la preparación, la presión de condensado del material restaurador, la contracción de polimerización del material restaurador, el trauma inducido por sobrecarga oclusal, los pernos peripulpares, los rayos láser, las impresiones dentales entre otros. Dentro de los irritantes químicos más descritos se encuentran: los antisépticos, los desecantes y desensibilidores cavitarios, los materiales de protección y restauración dental .Los irritantes bacterianos del complejo dentino-pulpar son: la caries dental, la capa de desecho, la microfiltración marginal y la desinfección y esterilización de los instrumentos. Es importante destacar que en este trabajo se van a describir los irritantes más resaltantes, sin restarle importancia a ninguno de los mencionados anteriormente. 40 Como fue mencionado anteriormente los diferentes irritantes del complejo dentino-pulpar pueden producir inflamación pulpar, la cual, se define como una lesión leve o moderada de las prolongaciones odontoblásticas, pueden producir esclerosis tubular y dentina de irritación o terciara, pero una irritación prolongada o intensa puede alterar irreversiblemente la membrana plasmática y el núcleo de los odontoblastos, constituyendo así el primer paso de una respuesta inflamatoria. 62 La inflamación es la reacción de los tejidos vivos a cualquier tipo de agresión. El proceso inflamatorio tiene los siguientes objetivos:
La consecuencia de los dos primeros objetivos pueden ser acompañados de síntomas clínicos propios de la inflamación aguda como: calor enrojecimiento (rubor), hinchazón (tumor), dolor y pérdida de la función. La inflamación y la reparación son fenómenos interdependientes, es decir, no se pueden considerar como procesos separados, sino como las fases exudativa (aguda) y proliferativa (crónica) de un mismo proceso que es la inflamación. La respuesta exudativa (aguda) constituye la respuesta inmediata inicial de los tejidos pulpares o periapicales a cualquier irritación, bien sea, mecánica, química, térmica o microbiana. Esta reacción de emergencia para tratar de neutralizar y vencer el agente nocivo se caracteriza por una afluencia de exudado líquido (edema inflamatorio) para diluirlo, y por la aparición de los leucocitos para ingerir e inmovilizar al agente lesivo. Las células que predominan en esta fase son los leucocitos polimorformos nucleares (neutrófilos). Por el contrario la respuesta proliferativa (crónica) es una reacción secundaria y tardía 62. Seltzer y Bender (1970) señala que esta respuesta ocurre cuando no se elimina el irritante por completo generando un estado de equilibrio entre las defensas de los tejidos y el irritante, se caracteriza por presentar células diferentes a las que se encuentran en la inflamación aguda. Esta respuesta representa una tentativa de los componentes del tejido conjuntivo pulpar y periapical para formas nuevas células (fibroblastos), vasos sanguíneos y fibras. Las fibras nerviosas proliferan en repuesta a lesión aguda en las zonas pulpares subyacentes a la lesión, pero también en los tejidos periapicales correspondientes antes de que la patosis progrese en dirección apical. Estos elementos constituyen el tejido de granulación, cuya función consiste en reparar y sustituir el tejido dañado., El tejido de granulomatoso incluye un gran número de linfocitos, células plasmáticas y macrófagos, por lo tanto no sólo es un tejido de cicatrización, sino también de defensa que destruye los microorganismos y los nutre. 62 54 Como fue descrito anteriormente la caries es uno de los principales irritantes del complejo dentino-pulpar. Se define como una destrucción localizada progresiva de la estructura del diente. Si se descuida constituye la causa más común de enfermedad pulpar. Los productos del metabolismo bacteriano, específicamente los orgánicos y las enzimas proteolíticas, causan la destrucción del esmalte y la dentina, generando una reacción inflamatoria pulpar. La difusión de estas sustancias tóxicas se produce a través de los túbulos dentinarios. Existen tres reacciones básicas que tienden a proteger a la pulpa contra la caries dental entre las cuales se encuentran: la disminución de la permeabilidad de la dentina, formación de nueva dentina y reacciones inflamatorias e inmunológicas. 42 Por su parte Thylstrup y Ferjerskov (1988) citados por Camejo (1998) refieren que en el caso de una progresión rápida de destrucción del esmalte por caries puede limitar las reacciones de defensas en la dentina, mientras que una progresión lenta de la lesión de caries puede ir acompañada por una respuesta defensiva muy efectiva. La respuesta inicial de defensa de la pulpa contra la caries dental es la esclerosis dentinaria, con un aumento de dentina peritubular, llenándose parcial o totalmente con depósitos minerales de apatita y otros cristales cuyo efecto es disminuir la permeabilidad dentinaria, formando así una barrera que impida el paso de los irritantes a la pulpa. Las evidencias clínicas sugieren que para que ocurra la esclerosis debe haber procesos odontoblástico vitales en los túbulos dentinarios.42 15 45 La capacidad de la pulpa para producir dentina reparadora debajo de una lesión cariosa es otro mecanismo para la limitación de la difusión de las sustancias tóxicas hacia la pulpa 46 .Esta dentina difiere de la dentina primaria y la secundaria en que se localiza exclusivamente adyacente a la zona irritada, es una dentina menos uniforme, irregular y como fue mencionado anteriormente constituye junto con la esclerosis un mecanismo de defensa contra la caries. 42 15 La cantidad de dentina reparadora formada es proporcional a la cantidad de dentina primaria destruida. La velocidad de ataque de la caries también parece ser otro factor influyente, dado que se forma más dentina en respuesta a una caries crónica que progresa con lentitud que a una caries aguda que avanza rápidamente. Por esta razón la exposición pulpar por la lesión cariosa es más probable que ocurra antes en la caries aguda que en las crónicas. 42 La formación de un tracto muerto en la dentina es otra posible reacción a la caries. Un tracto muerto es un área de dentina en que los túbulos dentinarios están desprovistos de procesos odontoblásticos. Esta formación no se considera una reacción defensiva, se cree que se forma como resultado de la muerte precoz de los odontoblastos. 40 42 Las primeras evidencias morfológica de una reacción pulpar frente a la caries se halla en la capa odontoblástica, incluso antes de la aparición de cambios inflamatorios, se observa una reducción global del número y tamaño de los cuerpos celulares de los odontoblastos y adoptan una forma plana o cuboides cuando normalmente son cilíndricos. Puede aparecer junto con estos cambios en la capa odontoblástica una línea hipercromática a lo largo del margen pulpar de la dentina. Se cree que la formación de esta línea representa una alteración en el equilibrio normal de los odontoblastos; también es posible que tal línea señale el punto en el que los odontoblastos primarios mueren y son sustituidos por células progenitoras, procedentes de la capa rica en células. A medida que las bacterias convergen en la pulpa aparecen las manifestaciones características de inflamación aguda. Entre estas se incluyen respuestas vasculares y celulares en forma de vasodilatación, incremento de la permeabilidad vascular y acumulación de leucocitos. 42 Por el contrario si la caries es un proceso prolongado o de avance lento la inflamación pulpar comienza como una respuesta crónica de bajo grado, en vez de una reacción aguda. El infiltrado celular inflamatorio inicial es principalmente de linfocitos, células plasmáticas y macrófagos; además se observa proliferación de vasos sanguíneos, fibroblastos y depósito de fibras colágenas. Este patrón de inflamación se considera un proceso inflamatorio reparador. Si la caries se elimina o se detiene, se puede producir la reparación del tejido conectivo.42 45 Torneck (1981), refiere que el tejido pulpar responde inmunológicamente a sustancias antigénicas producidas como resultado de las lesiones cariosas, las cuales viajan a través de los túbulos dentinarios. Okumura y col citados por Camejo (1998), observaron no sólo inmunoglobulinas sino también componentes del complemento en la dentina, en respuesta a estímulos provenientes de la caries y además señalan que dichas inmunoglobulinas en la dentina son capaces de reaccionar contra microorganismos invasores de la caries. En cuanto al tratamiento Mjör (2002) refiere que en el caso de caries de progresión lenta, se puede aplicar una base preventiva, siempre y cuando el operador remueva la placa, esto ha demostrado que la lesión se puede detener satisfactoriamente. Sí la caries se desarrolla todavía en esas condiciones y la lesión progresa lentamente se puede colocar una pasta fluorada, si el tratamiento preventivo adicional no es empleado la lesión en dientes permanentes puede tomar de 5 a 6 años para desarrollar un estado en donde se requiera remover el tejido dañado y la necesidad de colocar un material de restauración. En el caso de caries de avance rápido si no se detiene el proceso y los mecanismo de defensa no son suficientes se comprometerá la pulpa y será necesario la realización del tratamiento de conducto. 45
Respuesta del Complejo Dentino-Pulpar ante diferentes Procedimientos Operatorios 1-Respuesta del Complejo Dentino-Pulpar a la preparación dentaria A-Preparación de cavidades y coronas: Las respuestas del complejo dentino-pulpar ante las preparaciones de cavidades y coronas dependen de muchos factores. Entre estos se incluyen la lesión térmica, en especial el calentamiento por fricción, la sección de las prolongaciones odontoblásticas, la desecación de la dentina , la exposición de la pulpa, el barrido dentinario y el grosor de la dentina residual. A.1-Lesiones térmicas: el corte de la dentina con una fresa rotatoria produce una cantidad de calor por fricción. La cantidad de calor producido va a depender de la velocidad de rotación, el tamaño y la forma del instrumento cortante, el tiempo en el que el instrumento está en contacto con la dentina y la cantidad de presión aplicada al contrángulo.42 El calor friccional que se genera durante la preparación cavitaria o el pulido de las restauraciones puede alcanzar a la pulpa y producir daños. Si se producen altas temperaturas durante largos periodos de tiempo, los vasos y las células resultan afectados y parte de la pulpa se puede volver necrótica. 31 Zach (1972) citado por Kim S y Trowbridge H refiere que la producción de calor dentro de la pulpa representa el estrés más severo aplicado a la pulpa durante los procedimientos restauradores. Por su parte Nyborg y Brännström (1968) citado por Cohen 2002 señala que si el daño es extenso y se destruye la capa rica en células de la pulpa, es posible que no se forme dentina reparadora. La conductividad térmica de la dentina es relativamente baja, por lo tanto es mucho menos probable que el calor generado durante el tallado de una cavidad poco profunda produzca una lesión pulpar que la preparación de una cavidad profunda. En un estudio realizado por Brown, Christense y Lloyd (1978) se encontró que el calentamiento y el estrés generados durante el corte en seco de la dentina eran suficientemente intensos para producir daños en la estructura dental. Como se menciono anteriormente la cantidad de calor producido depende de la velocidad de rotación, cuan mayor sea la velocidad de corte, mayor será el calor que se genere. Es importante conocer que cuando se utilice una velocidad que supera las 4.000 rpm debe emplearse la refrigeración con un chorro de agua continuo o un rocío agua-aire dirigida al sitio donde se está colocando la fresa. La instrumentación cavitaria debe realizarse con leve presión y toques intermitentes, profundizando el piso por capas para permitir la salida de detritus y la entrada del refrigerante al fondo de la preparación. Otro factor bien importante es el buen estado de los instrumentos de corte para evitar ejercer mayor presión y ocasionar más calor. 31 45 Kim S y Trowbridge H (2002) refieren, además, que el rubor de los dientes durante y después de la preparación de la cavidad o la corona, se ha atribuido al calor generado por fricción. De forma característica la dentina coronal tiene un tono rosado después de cortada. Esta coloración rosada representa la éxtasis vascular en el plexo capilar subodontoblástico; sin embargo bajo condiciones favorables, tal reacción es reversible y la pulpa sobrevive. Sin embargo cuando se observe un color púrpura oscura esto nos puede indicar trombosis, lo cual se asocia con un peor pronóstico. A.2- Sección de los procesos odontoblásticos y su implicación en el complejo dentino-pulpar: la amputación del segmento distal de las prolongaciones odontoblásticas es con frecuencia una consecuencia de la preparación de una cavidad o una corona. La investigación histológica indica que la amputación de la parte de la prolongación no conduce invariablemente la muerte del odontoblasto. En varios estudios realizados los resultados sugieren que la amputación de la prolongación odontoblástica es seguida rápidamente por la reparación de la membrana celular; sin embargo, pareciera que la amputación del proceso odontoblástico cerca del cuerpo celular trae como consecuencia una lesión irreversible. 42 Chiego, Wang y Avery (1989) estudiaron el efecto de la preparación de una cavidad y observaron una disminución significativa de la cantidad de retículo endoplásmico rugoso y de mitocondrias, también se observó pérdida de complejos de unión entre los odontoblastos adyacentes; sin embargo los cambios que se produjeron fueron reversibles. No siempre puede ser determinada la causa exacta de la muerte de los odontoblastos, cuando estos desaparecen después de un procedimiento restaurador dado a que las células pueden estar sometidas a variedad de injurias. Tanto el calor friccional como la vibración, la amputación de los procesos, el desplazamiento debido a la desecación, la exposición a las toxinas bacterianas u otros irritantes químicos pueden ser la causa de la muerte del odontoblasto. 42 A.3- Exposición pulpar: la exposición durante la preparación de cavidades ocurre con más frecuencia durante la eliminación de la dentina cariada.También puede suceder una exposición mecánica accidental durante procedimientos operatorios, ya sea a través de instrumentos cortantes a mano o rotatorios. 42 15 45.Después que ocurre la exposición pulpar mecánica hay inflamación aguda en el sitio expuesto, sin embargo el resto del tejido no queda lastimado. La intensidad de la reacción depende de la magnitud del daño tisular. El pronóstico para la cicatrización es mucho más favorable con exposiciones mecánica que con caries, debido a que no hay inflamación e infección previa. 15 Cotton (1974) citado por Kim S y Trowbridge refiere que las pulpas expuestas durante la eliminación de una caries se infectan por bacterias que son llevadas a la pulpa con las partículas de dentina. Mjör (2002) refiere que se le ha puesto mucha atención a la bacteriología en el sitio de la exposición, él menciona que es muy importante el empleo de dique de goma para minimizar la contaminación bacterial. La exposición pulpar también puede suceder por traumatismos que produzcan la fractura del diente dejando expuesto el tejido pulpar. Cuando se expone la pulpa por traumatismo se produce una laceración y sangramiento en el sitio de la exposición. El contacto con la saliva no produce contaminación inmediata de la superficie pulpar expuesta. Sin embargo, la exposición pulpar raramente cicatriza espontáneamente y si no es tratada, la necrosis e infección son inevitables. 15 Es por esto que se debe realizar un recubrimiento pulpar directo. El recubrimiento pulpar directo es un procedimiento endodóntico que consiste en la aplicación de un medicamento sobre la pulpa expuesta, en un intento por preservar su vitalidad y lograr su cicatrización mediante la formación de un puente dentinario. Este está indicado especialmente en exposiciones por un traumatismo o por causas mecánicas y está contraindicado en exposiciones por caries, por la posibilidad que exista inflamación e infección previa a la exposición .Sin embargo Matsuo et al (1996) refiere que el recubrimiento pulpar directo no se debe contraindicar de forma absoluta en exposiciones por caries y que el éxito va a depender de la capacidad de seleccionar el caso. Para que el recubrimiento pulpar directo tenga éxito se debe cumplir ciertos requisitos:
Camp (1999) refiere que el material de elección para recubrir exposiciones pulpares e inducir la cicatrización pulpar es el hidroxido de calcio, debido a que produce necrosis por coagulación de la superficie pulpar, diferenciando el tejido subyacente en odontoblastos, los cuales elaboran una matriz que estimula la formación de un puente dentinario, el cual es ocasionado por el efecto irritante que le confiere su alta alcalinidad. Camejo (1998) señala que se ha aceptado el hidroxido de calcio como el material de elección del recubrimiento pulpar directo, debido a su capacidad de formar un puente de dentina terciaria. Además sirve de barrera protectora, bloquea los túbulos dentinarios y neutraliza el ataque de ácidos orgánicos provenientes de algunos cementos y materiales restauradores. En los últimos años se han realizado estudios utilizando sistemas adhesivos como recubridores pulpares directos. Hilton (1996) refiere que los que proponen su uso señalan los defectos del hidroxido de calcio, como la ruptura cuando se emplean agentes de grabado ácido, la disolución después de mucho tiempo de colocada la restauración, la presencia de forma de túnel de la dentina de reparación, cuyos canalículos permanecen abiertos desde la pulpa hacia la interfase con el recubrimiento permitiendo el paso de bacterias hacia la pulpa. El mismo autor concluye que la falla del hidroxido de calcio es la incapacidad de este material para brindar un sellado que evite la microfiltración a largo plazo. Prager (1994) citado por Camejo (1998), señala que los sistemas adhesivos como agentes recubridores logra un sellado efectivo y permanente que evite la invasión bacteriana, por lo tanto la pulpa se recuperará. Kitasako (1998) citado por Hung (2003) refiere estudio donde evaluaron la respuesta pulpar ante 4 sistemas de adhesivos resinosos en monos, indicaron que no hubo reacciones inflamatorias pulpares severas, como necrosis o formación de abscesos, la principal reacción fue una ligera infiltración de células inflamatorias y el área expuesta se ocluyó con la formación del puente dentinario. Gwinnett y Tay (1998) realizaron un estudio para determinar la respuesta de la pulpa a la técnica de grabado total in vivo, realizaron cavidades de 0.5mm en cavidades clase V las cuales fueron grabadas con ácido fosfórico l 10% por 20 segundos y restauradas con All-Bon 2, pudieron observar resina dentro de los túbulos dentinarios y la hibridación de las paredes de los mismos, además se observaron glóbulos rojos dentro de los túbulos. En algunos túbulos los procesos odontoblásticos habían degenerado y en otro se preservaban, a nivel de la pulpa se observó una respuesta de injuria a la pulpa, daño irreversible y muerte de los odontoblastos cercanos ala cavidad, seguido de una respuesta temprana de neutrófilos, macrófagos y fibroblastos. Los autores recomiendan mayor revisión de esta técnica antes de emplearla. De Souza et al (2001) citados por Allen et al (2002), en su estudio evidenciaron que el hidroxido de calcio en comparación con las resinas adhesivas es todavía el material de elección para las protecciones directas. Ellos evaluaron 33 pulpas de humanos expuestas mecánicamente, las pulpas fueron selladas con Clearfil Liner Bond 2 o con hidroxido de calcio. Después de 5, 30, y 120 a 300 días los dientes fueron extraídos y se observaron en el microscopio. En las pulpas que se habían sellado con resina adhesivas, la reparación pulpar fue inhibida por una respuesta pulpar de inflamación crónica provocada por el desplazamiento de fragmentos del agente adhesivo dentro del espacio pulpar. Mientras que las pulpas que fueron selladas con hidroxido de calcio se observó la formación de un puente dentinario. Existen controversias en relación a la utilización de los sistemas adhesivos como recubridores pulpares, se ha sugerido su capacidad para inducción de una cicatrización exitosa, pero se han descrito resultados pocos favorables usando una técnica de grabado total como procedimiento para el recubrimiento pulpar y se recomienda después de la exposición, colocar hidroxido de calcio fotopolimerizable con luz sobre la exposición y luego el resto de la preparación puede ser grabada y restaurada con un sistema adhesivo y un material restaurador. 40 Otro de los materiales propuestos como material de recubrimiento pulpar indirecto ha sido el MTA. Abedi y cols (1996) citados por Giuseppe (1999) refieren que el que este material es biocompatible y que presenta superior capacidad de sellado que la amalgama, el óxido de zinc eugenol y el Super EBA; así mismo es altamente alcalino con un pH de 10.2 y 12.5. Así mismo Torabinejad y Chivian (1999) refieren que el MTA estimula la formación de puentes de dentina adyacente a la pulpa dental. Los mismos autores señalan que la dentinogénesis de este material puede ser debida a su capacidad de sellado, biocompatibilidad, alcalinidad o posiblemente a otras propiedades asociadas a este material. Pitt Ford y cols (1996), Avery y cols (1996) señalan en sus estudios, que el MTA induce una respuesta más favorable sobre el tejido pulpar remanente, con la formación de un puente calcificado, además hacen referencia que se observó menos inflamación con este material que con el hidróxido de calcio y la formación de un puente dentinario contínuo en las pulpas. A.4- Desecación de la dentina: la desecación o deshidratación de la superficie de la dentina, por la instrumentación, el calor friccional y la aplicación excesiva de aire, origina una diferencia de presión en los extremos del túbulo dentinario, lo cual trae como consecuencia la remoción del contenido de los túbulos dentinarios, provocando la aspiración de los odontoblastos, estos odontoblastos desplazados se destruyen rápido y desaparecen al sufrir autólisis. 40 31 42 Brännström (1984) refiere que cuando la superficie recién cortada se seca con un chorro de aire, se produce un movimiento rápido del fluido del túbulo dentinario hacia fuera, como resultado de las fuerzas capilares dentro de los túbulos. Kim S y Trowbridge H (2002) refiere, que de acuerdo con la teoría hidrodinámica sobre la sensibilidad dentinaria, el movimiento del fluido conlleva la estimulación de los nervios sensoriales de la pulpa. Brännström (1984) señala que la desecación de la dentina por procedimientos de corte o por chorro de aire, no lesiona a la pulpa. Aunque muchas veces el clínico espere una respuesta inflamatoria al provocar la muerte del odontoblasto, pero es probable que el número de células afectadas sea demasiado pequeño para causar una reacción significativa. Kim S y Trowbridge H (2002) además refiere, que los odontoblastos destruidos se sustituyen por nuevos odontoblastos provenientes de la capa rica en células de la pulpa, y al cabo de 1-3 meses se forma dentina reparadora. A.5- Extensión de la preparación: los odontoblastos que se encuentran abajo o cerca de la cavidad preparada disminuyen la síntesis de proteínas, por lo tanto aumenta la profundidad de la preparación y mayor va hacer la aproximación al núcleo odontoblástico, por lo tanto más grave será la lesión. Pashley demostró que la reducción del grosor de la dentina aumenta considerablemente su permeabilidad. A medida que la preparación dentinaria se aproxima más a la pulpa, mayor es el número de túbulos dentinarios dañados por unidad de superficie. El diámetro de cada túbulo también aumenta cerca de la pulpa. Así mismo Kim S y Trowbridge H (2002) refiere que la permeabilidad de la dentina tiene gran importancia para determinar el grado de lesión pulpar originados por los procedimientos y los materiales restauradores. Stanley (1984) citado por Kim S y Trowbridge H (2002) refiere. que cuando el espesor de dentina remanente entre el piso de la preparación y el techo de la cámara pulpar es de 2mm o más, es difícil que el calor provocado por el tallado, la aplicación de sustancias químicas, el secado o la colocación de cualquier material de restauración ocasionen daños. Con 1.5 mm de dentina remanente aparecen modificaciones en la capa odontoblástica y a medida que disminuye el espesor de dentina va aumentar la intensidad de las respuestas pulpares. Es decir, que el aumento de la reacción inflamatoria pulpar es directamente proporcional a la profundidad de la cavidad preparada. Cuando no queda más de 0.5 mm intensifica la inflamación en forma progresiva, cuando la preparación se realiza a bajo velocidad y sin refrigeración. 31 29
Respuesta del Complejo Dentino-Pulpar a las Restauraciones y Materiales de Obturación Microfiltración y Adhesión La microfiltración marginal es el ingreso de fluidos bucales a lo largo de cualquier interfase entre la superficie dentaria y la restauración. La microfiltración marginal en torno a diversos materiales de obturación se considera como la causa de hipersensibilidad, crecimiento bacteriano hacia la pulpa, caries y trastornos pulpares. 40 Durante mucho tiempo se ha pensado que la mayor parte de los materiales para restauración u obturación son muy tóxicos para el complejo dentino-pulpar. Sin embargo en los últimos años se han realizado muchas investigaciones que han demostrado que son las bacterias las que han ocasionado la inflamación persistente de la pulpa, que por tanto tiempo se le atribuyó a los diversos recubrimientos, bases y materiales para la obturación. 41 Todo esto ha traído ciertas interrogantes, debido a que muchos no se explican como las bacterias irritan a la pulpa, si se ha colocado una restauración; la respuesta a todo esto es la microfiltración, además, a las bacterias que quedan en la capa residual que también contribuyen con el paso de toxinas si se les permite permanecer viable al proporcionarles sustrato a través de la microfiltración. 41 31 Kim S, Trowbridge H (2002) refieren que anteriormente se pensaba que las reacciones pulpares frente a los tratamientos odontológicos se debían a las agresiones mecánicas, como el calentamiento por fricción, además a los efectos químicos, como la acidez de esos materiales. Auque los efectos químicos no se pueden descartar por completo, sobre todo en una cavidad profunda, donde sólo queda una capa muy fina de dentina, actualmente al igual que los demás autores se cree que la lesión pulpar se debe sobre todo a la microfiltraciones producidas a través de los espacios entre el material de relleno y las paredes de la cavidades. Se cree que las bacterias presentes en esas hendiduras, elaboran productos capaces de difundir a través de los túbulos dentinarios e irritar a la pulpa. Brännström (1984) también apoya las opiniones de los demás autores, él refiere que el daño pulpar se causa por la infección bacteriana y no por la obturación de la cavidad con el material restaurador. Por lo tanto, las bacterias juegan el papel más importante en el desarrollo en la inflamación pulpar, que el tipo de material restaurador utilizado. De igual manera Geddes (1999) señala, que durante mucho tiempo se consideró que todos los materiales de restauración eran nocivos para la pulpa. Esta creencia fundamentó en parte la colocación de una base previa a la restauración. Los selladores dentinarios están representados por los barnices y sistemas adhesivos, con ellos se logra una película protectora de poco espesor, por lo que no actúan como aislante térmico, previenen la penetración de irritantes, actúan como una barrera, reducen la sensibilidad dentinaria y la microfiltración marginal. 31 38 Sin embargo varios investigadores y clínicos han cuestionado la utilización de bases. Con el conocimiento actual acerca de la biología pulpar y el desarrollo de la técnica de hibridación de la dentina los argumentos a favor de la necesidad de usar bases cavitarias han disminuido considerablemente.31. El mismo autor señala que la mejor protección para una preparación dentinaria realizada correctamente (sin generar calor, deshidratación, etc.) podría ser una restauración con un material permanente colocado directamente sobre la dentina, sin empleo de ninguna base, siempre y cuando esté correctamente adherida, que se encuentre libre de microfiltración marginal y no sufra de desgaste ni cambios dimensionales. Los sistemas adhesivos son resinas de bajo peso molecular en conjunto con un vehículo que puede ser acetona, alcohol o agua. Por su bajo peso molecular difunden fácilmente a través de los túbulos dentinarios y en la dentina intertubular y se forma la capa híbrida. 16 La técnica de hibridación, es el proceso en el cual, la superficie de la dentina es desmineralizada por la acción de un agente ácido y luego impregnada por un sistema adhesivo, que polimeriza entrelazándose con una red de fibras colágenas expuestas por la descalcificación. Así, se forma la capa híbrida, una mezcla de componentes dentinarios y resinas polimerizadas, que actúa como una protección pulpar, ya que sella la superficie dentinaria y reduce la microfiltración y la sensibilidad postoperatoria. 31 53 Hebling et al (1999) evaluaron la respuesta del órgano dentino pulpar al aplicar un sistema adhesivo en una preparación cavitaria profunda, ellos pudieron concluir que la aplicación de estos sistemas adhesivos sobre la dentina de una cavidad profunda ofrecía una biocompatibilidad aceptable, pero también concluyeron que la intensidad de la respuesta pulpar va ha depender del espesor de dentina remanente. Cox et al (1998) realizaron un estudio para evaluar la respuesta histológica de pulpas expuesta y no expuestas. Al aplicar los adhesivos en dichas pulpas demostraron que los sistemas adhesivos no son tóxicos ni para las pulpas expuestas ni para las que no estaban expuestas. En conclusión los autores refieren que los sistemas adhesivos son biológicamente compatibles con la pulpa y si se presenta inflamación o necrosis seria causa de la microfiltración marginal y no del material restaurador. Bouillaguet y Ciucchi citados por Camejo y cols (1999) refieren que los sistemas adhesivos proporcionan un potente sellado en las restauraciones y como consecuencia proporcionan una efectiva protección del complejo dentino pulpar. En cuanto al grabado ácido para la colocación de estos sistemas de adhesivos Camejo y cols (1999) refieren que el grabado ácido de las paredes cavitarias está diseñado especialmente para mejorar la adhesión de los materiales de restauración. La aplicación del ácido sobre la dentina aumenta la apertura de los túbulos dentinarios y desmineralizan la dentina intertubular, aumentando así la permeabilidad y la posibilidad de penetración de agentes irritantes. Stanley, Gong, Chauncey (1975), en su estudio demostraron que en cavidades profundas, el pretratamiento de la dentina con ácido cítrico al 50% o con ácido fosfórico al 50% durante 60 segundos era capaz de aumentar de aumentar significativamente la respuesta de la pulpa frente a los materiales restauradores. La técnica de grabado total no es inocua, sino que resulta un factor irritativo más, así como los estímulos provocados durante la preparación cavitaria, sin embargo, su acción no es tan nociva como se pensaba. Brännström y Nordenvall (1978) realizaron un estudio donde se realizó el grabado total de las cavidades y fueron obturadas con agentes de unión y resina compuesta en los resultados no se observó inflamación pulpar. Por otra parte Gilpatrich et al (1996), en su estudio, realizaron el grabado de la dentina con ácido fosfórico al 10% por 20 segundos, en cavidades poco profundas y evaluaron la respuesta de la pulpa observando que no hubo daño pulpar. White et al (1994) citado por Camejo M y cols (1999) señalan que el grabado con ácido fosfórico al 40% y 10% por 15 segundos en cavidades profundas no causó inflamación pulpar ni necrosis. La dentina puede ser grabada si se efectúa el sellado inmediato con un sistema adhesivo que proteja a la pulpa de la filtración.31 50. El sistema adhesivo cierra los túbulos dentinarios formando tapones de resina y penetra en la zona intertubular completando el sellado mediante la hibridización Esta técnica de grabado ácido se realiza para la eliminación de la capa de desecho. 50. La capa de desecho esa una capa amorfa, relativamente lisa, de residuos microcristalinos, cuya superficie no posee rasgos distintivos y no puede detectarse a simple vista. 41 Cuando se emplean instrumentos rotatorios y manuales sobre la superficie dentaria para realizar las preparaciones cavitarias, las virutas de detritos son diseminadas sobre la superficie del esmalte y la dentina, formando la capa de desecho. 40 Su espesor varía de 0.5 a 5 micrómetros, según el instrumento de corte empleado, la utilización de refrigeración, la velocidad de corte y la región de dentina preparada. 40 Kim S, Trowbridge H (2002) y Mjor (2002) señalan, que aunque la capa desecho puede interferir con la adaptación de materiales de restauradores, quizás no sea deseable eliminarla por completo. Si se elimina la mayor parte de la capa pero se dejan tapones de residuos del tallado en la abertura de los túbulos dentinarios, no aumenta la permeabilidad dentinaria y las paredes de la cavidad estarán relativamente limpias. Se discute hoy en día si conviene o no eliminar la capa de desecho. Algunos autores opinan que los microorganismos presentes en la capa de desecho pueden irritar a la pulpa. Al inicio existen pocas bacterias en dicha capa, sin embargo, si las condiciones son favorables para el crecimiento bacteriano, estos se multiplican, sobre todo si existe una separación entre el material restaurador y la pared dentinaria que permita la entrada de saliva. En consecuencia Brännström citado por Kim S y Trowbridge señala que la mayoría de los materiales restauradores no se adhiere a la pared dentinaria por completo, en consecuencia, se forman grietas por contracción entre tales materiales y la estructura dental adyacentes y esas grietas son invadidas por bacterias procedentes de la capa de desecho o la cavidad oral. Por lo tanto, los metabolitos bacterianos se extienden a través de los túbulos dentinarios y lesionan la pulpa. Bergenholtz (1977) en su estudio demostró que la entrada de productos bacterianos en la pulpa dental puede provocar una respuesta inflamatoria. Así pues el mejor método seria eliminar la capa de desecho. Para remover la capa de desecho se puede aplicar ácido cítrico al 50% o ácido fosfórico al 37% por 15 sg, inclusive, se pueden aplicar otros ácidos más débiles por 30-60 sg, el cual no produce daño pulpar. 40 Debido a que la preservación de la capa de desecho puede dificultar la penetración de los adhesivos, se han introducido sistemas de adhesivos que remueven, sustituyen o modifican la capa de desecho. 40 45 Es importante tomar en cuenta que a pesar de todo lo expuesto anteriormente, que los materiales presentan alguna toxicidad, que en su mayor parte contribuyen a la inflamación inmediatamente después de su colocación. Con el tiempo y cuando no hay bacterias presentes el efecto toxico desaparece, a menos que la pulpa se haya sometido a tal estrés que esté luchando por subsistir antes de que se le añada esta nueva agresión. En cualquier caso es importante al momento de colocar cualquier material de restauración o de obturación conocer todas sus propiedades, para seleccionar el más adecuado en el momento dado. 41
Bibliografía
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

