|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"Aplicación de la regeneración tisular guiada y del injerto de tejido óseo en la cirugía endodóntica" por Adriana Restifo Bonaiuto Trabajo de grado presentado ante la ilustre Universidad Central de Venezuela para optar al titulo de Especialista en Endodoncia. e-mail:
Resumen: La regeneración tisular guiada (RTG) es un procedimiento diseñado para regenerar los tejidos periodontales lesionados, a través de la diferenciación celular. Esta terapia se ha empleado desde hace décadas, con la obtención de excelentes resultados en el área de periodoncia y de cirugía. Es importante el conocimiento y la adecuada selección de los materiales a utilizar como barreras o membranas al realizar procedimientos de RTG; así como aquellos empleados al colocar injertos o rellenos óseos. Recientemente se ha evaluado y se ha demostrado que la RTG y el injerto óseo mejoran la cicatrización de los tejidos perirradiculares durante la cirugía endodóntica. Condiciones clínicas como: lesiones óseas apicales de gran tamaño, que involucren o no ambas corticales óseas; defectos óseos apicomarginales; y lesiones periapicales en comunicación con fosas nasales, o senos maxilares, se consideran indicaciones para la aplicación de los principios de RTG y de injertos óseos en la cirugía endodóntica. Sin embargo, lesiones óseas pequeñas confinadas al área apical no requieren la aplicación de este tipo de técnicas durante la cirugía endodóntica. INTRODUCCIÓN La regeneración tisular guiada es un procedimiento diseñado para regenerar el aparato de soporte dentario lesionado, a través de la diferenciación de la respuesta tisular. Las terapias de regeneración tisular guiada se han empleado en la periodoncia y en otras áreas de la odontología desde hace más de dos décadas; con la obtención de resultados favorables en la regeneración de los defectos óseos. De igual forma, se han utilizado desde hace muchos años materiales de injerto óseo con la finalidad de lograr una cicatrización más temprana de la lesión ósea en este tipo de tejidos. Actualmente existen diversos materiales que se pueden utilizar para alcanzar este objetivo, como membranas e injertos óseos; siendo algunos más beneficios que otros. Es importante conocer cada uno de estos materiales para seleccionarlos correctamente al momento de emplearlos. El objetivo principal de la cirugía endodóntica es eliminar el factor etiológico de la lesión periapical y lograr la completa regeneración de los tejidos perirradiculares. El empleo de la regeneración tisular guiada y de los materiales de injerto óseo en la cirugía endodóntica ha sido evaluado y estudiado desde hace más de diez años; considerandose que algunos casos, requieren de estas terapias para la correcta cicatrización de los tejidos perirradiculares. Las condiciones clínicas endodónticas que presentan gran pérdida de soporte óseo; necesitan la aplicación de la regeneración tisular guiada, y en algunos casos precisan el empleo adicional de materiales de relleno óseo. El presente trabajo tiene por objetivo describir la aplicación de la regeneración tisular guiada y el empleo de materiales de injerto óseo durante la cirugía endodóntica; mencionar los principios básicos de estas técnicas, junto con las características más relevantes de cada material utilizado en estos procedimientos. II.- REVISIÓN DE LA LITERATURA 1. INDICACIONES DE LA CIRUGÍA ENDODÓNTICA La cirugía endodóntica es un conjunto de técnicas quirúrgicas cuyo objetivo es el abordaje de las raíces dentarias y sus tejidos adyacentes; con la remoción y biopsia de los tejidos patológicos y la realización de los procedimientos terapéuticos en el tercio apical de dicha raíz.1 El procedimiento quirúrgico endodóntico consiste en la eliminación de la lesión perirradicular, pero conservando el diente causal; es decir, se consigue eliminar el foco infeccioso y se conserva el diente causal mediante la realización del tratamiento endodóntico pertinente y el sellado apical a través de la apicectomía y la obturación retrógrada.2 Hupp3 en el 2003, señala que la cirugía perirradicular es el manejo y prevención de patologías perirradiculares por una intervención quirúrgica. La cirugía apical ofrece las posibilidades de remover el tejido periapical inflamado y de lograr una adecuada limpieza, preparación y sellado de la porción apical del conducto.4,5 Los avances en el tratamiento endodóntico convencional producidos en los últimos años han reducido el número de casos que requieren cirugía apical. Este hecho se atribuye a: (1): los avances en los instrumentos, equipos y material endodóntico; (2): mayores conocimientos sobre la anatomía del conducto, y (3) el perfeccionamiento de la habilidad operatoria.6 A pesar de estos avances, todavía son necesarios los métodos quirúrgicos para resolver casos que no pueden solucionarse mediante un tratamiento endodóntico ortógrado.6 Se debe reconocer que son pocas las verdaderas indicaciones de una cirugía apical, y esas indicaciones deben ir dirigidas a satisfacer los principios biológicos de la terapia endodóntica convencional moderna y deben ir orientados a buscar lo mejor para el paciente.5 Entre las indicaciones verdaderas de una cirugía apical se pueden mencionar: 1. Cuando el fracaso ha sido resultado de un tratamiento endodóntico ortógrado, y la repetición del tratamiento no puede ser llevada a cabo o no se lograría obtener un mejor resultado.7-10 2. Cuando existe una alta posibilidad de fracaso con la repetición del tratamiento endodóntico ortógrado.7-10 3. Necesidad de toma de biopsia del tejido perirradicular. 7-10 Con la finalidad de tener una base para medir los resultados del tratamiento, Rubinstein y Kim en el 2002,11 sugieren una clasificación de las indicaciones para realizar una cirugía apical; posteriormente, en el 2006 Kim y Kratchamn12 proponen una clasificación de casos para la microcirugía endodóntica; un poco más detallada que la anterior. Tabla Nº I y Gráfico Nº1. 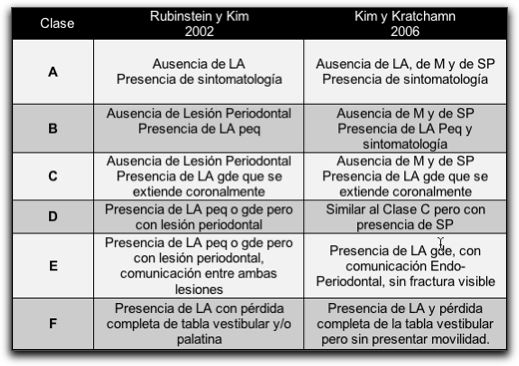
Tabla Nº I: Clasificaciones de las indicaciones para cirugía endodóntica. LA: Lesión apical, M: Movilidad, SP: Sondaje profundo, peq: pequeña, y gde: grande. Tomado de Rubinstein y Kim 200211 y Kim y Kratchamn 2006.12 Generalmente las clases A, B y C no representan ningún problema significativo al tratamiento quirúrgico, y dichas condiciones no afectan contrariamente en el resultado del procedimiento.12 Por ejemplo en el estudio de Rubinstein y Kim13 en 1999, los casos que se encontraban dentro de estas categorías, tuvieron una tasa de éxito en la cicatrización de 96,8%, un año después de la cirugía. 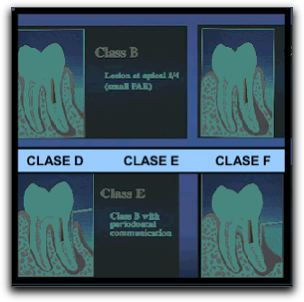
Gráfico Nº 1: Clasificación de casos para microcirugía endodóntica. Tomado Kim y Kratchman 2006.12 Sin embargo, los casos clase D, E y F, presentan dificultades serias. En estos casos no sólo se requiere de la aplicación de técnicas microquirúrgicas apropiadas y acertadas, si no también del uso simultáneo de injerto óseo y membranas como barreras.12 Diversos autores han creado otro tipo de clasificación, para destacar los casos de cirugía endodóntica que ameritan una terapia con regeneración tisular guiada y/o injerto de tejido óseo.14-16 Estas clasificaciones se describen con detalle más adelante. A continuación se describe el órgano periodontal, tomando en cuenta que sus estructuras, principalmente el ligamento periodontal; se encuentran íntimamente relacionadas con el proceso de regeneración de los defectos óseos.6 7 2. EL ÓRGANO PERIODONTAL Y LOS PROCESOS DE CICATRIZACIÓN EN LA CIRUGÍA ENDODÓNTICA El conocimiento de los tejidos involucrados en el procedimiento quirúrgico es esencial, y la cirugía endodóntica requiere una comprensión de la anatomía y fisiología de los tejidos bucales blandos, de los tejidos duros y de los tejidos dentarios que conforman el periodonto. 17 El periodonto, también llamado "aparato de inserción" o "tejido de sostén del diente", constituye una unidad de desarrollo, biológica y funcional, que experimenta determinados cambios con la edad y además está sometida a modificaciones morfológicas relacionadas con alteraciones funcionales y del medio bucal.18 Los acontecimientos traumáticos o patológicos pueden causar pérdida o daño en esta estructura anatómica. 19 2.1 El órgano periodontal. 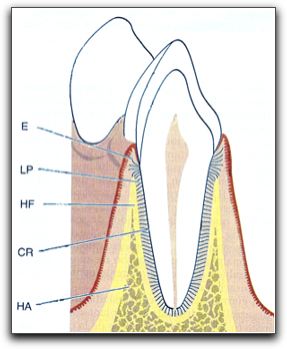
Gráfico Nº 2: Tejidos que conforman al órgano periodontal. E: encía, LP: ligamento periodontal, CR: cemento radicular y HA: hueso alveolar. El hueso alveolar se divide en HF. Hueso alveolar propiamente dicho y apófisis alveolar. Tomado Lindhe 2005.18 El periodonto como tal está dividido en dos partes: la encía, cuya función principal es proteger a los tejidos subyacentes, y el aparato de inserción, compuesto por el ligamento periodontal, el cemento y el hueso alveolar. 18,23. Se considera que el cemento es parte del periodonto dado que, junto con el hueso, sirven de soporte a las fibras del ligamento periodontal.23 La función principal del periodonto, consiste en unir y mantener el diente unido al tejido óseo de los maxilares y en mantener la integridad en la superficie de la mucosa masticatoria de la cavidad bucal.18 2.1.1. La encía. La encía es la parte de la mucosa bucal que reviste las apófisis alveolares de los maxilares y rodea el cuello de los dientes. 18,21-23 En sentido coronario, la encía termina en el margen gingival libre que tiene contorno festoneado; y en sentido apical, la encía se continúa con la mucosa alveolar laxa, de la cual está separada por una línea demarcatoria por lo general fácilmente reconocible llamada unión o línea mucogingival. Grafico Nº 3.18 Desde el punto de vista anatómico, la encía se divide en: encía marginal o libre, encía insertada o adherida y encía o papila interdental.18,21,23 Los componentes epiteliales de la encía muestran variaciones morfológicas como reflejo de la adaptación del tejido al diente y al hueso alveolar. Conformando diferentes epitelios: el epitelio gingival, el epitelio sulcular y el epitelio de unión, estos tres epitelios difieren ultraestructuralmente.21,22 
Gráfico Nº3: Partes de la encía. Línea mucogingival señalada con flechas. Tomado Lindhe 2005.18 Al igual que otros tejidos del organismo la encía cuenta con diversas fuentes de irrigación sanguínea e inervación. La irrigación sanguínea, proviene principalmente de los vasos sanguíneos supraperiósticos que son ramas terminales de diferentes arterias de la cara.18,23 La inervación gingival deriva de las fibras que surgen de los nervios presentes en el ligamento periodontal y de los nervios labiales, bucales y palatinos.18,23 2.1.2. El ligamento periodontal. El ligamento periodontal es el tejido conjuntivo que rodea la raíz y la conecta con el hueso,24 uniendo el cemento radicular con la pared del alvéolo.18,25 GraficoNº4 En sentido coronal, se continúa con la lámina propia de la encía y se comunica con los espacios medulares a través de los conductos vasculares del hueso.18,24 El ligamento periodontal consta de tres elementos: fibras periodontales, elementos celulares y sustancia fundamental. 24 
Gráfico Nº4: Ligamento periodontal. Micrografía de luz de ligamento periodontal humano. Mostrando la red de fibras colágenas que se interpone entre el cemento radicular (C) y la pared del surco periodontal (B). Tomado de Beertsen 1997 El ligamento periodontal es un tejido conjuntivo único, insustituíble, que puede dar origen a diferentes tipos de células,25 presentando un gran potencial de regeneración para diferentes tejidos.22,24,25 Por lo tanto, este tejido se considera de gran importancia en la cicatrización de los procedimientos quirúrgicos endodónticos y se describe con más detalle. Las fibras periodontales principales son los elementos más importantes del ligamento periodontal, son de colágeno, están dispuestas en haces y siguen una trayectoria sinuosa en cortes longitudinales. Estas fibras principales emiten prolongaciones hacia el cemento radicular y el hueso alveolar, denominándose fibras de Sharpey. Las fibras principales del ligamento periodontal están dispuestas en cuatro grupos, generalmente: las fibras crestoalveolares, las fibras horizontales, las fibras oblícuas y las fibras apicales;18,24 además de las fibras transeptales y las fibras interradiculares.24 Entre los elementos celulares del ligamento periodontal, se encuentran: 1-. Células del tejido conjuntivo: los fibroblastos, localizados en mayor cantidad y alineados paralelos a las fibras principales; los osteoblastos y osteoclastos, ubicados recubriendo la superficie ósea; y los cementoblastos y cementoclastos, recubriendo la superficie del cemento.18,24 Además contiene células indiferenciadas con el potencial de transformarse en cualquiera de las mencionadas anteriormente dependiendo de las necesidades. 22 2-. Restos epiteliales de Malassez: se distribuyen cerca del cemento a través del ligamento periodontal de casi todos los dientes y son más numerosos en las regiones apical y cervical. Estos al ser estimulados, crecen e intervienen en la formación de quistes radicuales.22,24 Grafico Nº5 3-. Células de defensa: también están presentes en el ligamento periodontal células como neutrófilos, linfocitos, macrófagos, mastocitos y eosinófilos. 24 
Gráfico Nº5: Resto epitelial de Malassez. Célula ubicada en el ligamento periodontal. Tomado Lindhe 2005.18 En el ligamento periodontal los espacios entre las fibras y las células son ocupados o rellenados por una porción considerable de sustancia fundamental, la cual, consta de dos componentes principales: glucosaminoglicanos (ácido hialurónico y proteoglicanos) y glucoproteínas (fibronectina y laminita); además la sustancia fundamental contiene alrededor de un 70% de agua.24 Entre las funciones que cumple el ligamento periodontal se encuentran: 1-. Función física: unión del diente al hueso, protección de vasos y nervios, amortiguación, transmisión de fuerzas oclusivas al hueso y conservación de los tejidos gingivales en relación adecuada con los dientes.24,25 2-. Función de formación y remodelación: interviene en la formación y resorción de cemento y hueso. Los fibroblastos elaboran las fibras de colágena y las células mesenquimatosas residuales se convierten en osteoblastos y cementoblastos.22,24,25 3-. Funciones sensitiva y nutricional: aporta nutrientes al cemento, hueso y encía por medio de los vasos sanguíneos, además de proveer drenaje linfático.18,24 El ligamento periodontal recibe irrigación sanguínea de ramas de diferentes arterias; la mayor parte de los vasos sanguíneos del ligamento periodontal se hayan cerca del hueso alveolar; estos vasos al entrar en el ligamento periodontal se anastomosan y forman una red poliédrica que rodea la raíz. En el periodonto, los nervios delgados siguen casi el mismo recorrido que los vasos sanguíneos. Los nervios ingresan en el ligamento periodontal a través de perforaciones, conocidas como conductos de Volkmann, de la pared alveolar; estos nervios se unen en fascículos mayores que adoptan un recorrido paralelo al eje mayor del diente.18 En el ligamento periodontal, se han identificado diferentes tipos de terminaciones nerviosas libres y corpúsculos de Ruffini.18 Es decir, el ligamento periodontal se encuentra inervado por fibras nerviosas con capacidad para transmitir sensaciones táctiles, de presión y dolor por las vías trigeminales.24 2.1.3. El cemento radicular. El cemento radicular es el tejido mesenquimatoso 24 que forma la cubierta exterior de la raíz anatómica.22,24 Se considera un tejido conjuntivo mineralizado,18,20,22 que en ocasiones además de recubrir la superficie radicular también cubre pequeñas porciones de la corona de los dientes.18 El cemento forma la interfase entre la dentina radicular y el ligamento periodontal.20,22 Existen varios tipos de cemento radicular, clasificados dependiendo de la presencia de cementocitos en el cemento;22 el cemento acelular (primario) y el celular (secundario).18,24,26 Grafico Nº6. 
Gráfico Nº6: Cemento celular. Cementocitos en sus lagunas. Que se comunican entre sí. Indicados con las flechas. Tomado Lindhe 2005.18 El mecanismo de depósito de cemento es continuo a lo largo de la vida, siendo la formación de cemento más rápida en las zonas apicales, compensando la erupción del diente.20,24 El cemento posee muchas características en común con el tejido óseo; sin embargo, no contiene vasos sanguíneos ni linfáticos, carece de inervación, no experimenta remodelado o resorción fisiológica y se caracteriza porque se deposita durante toda la vida.18,20,22,26 Siendo una de las funciones principales del cemento radicular, servir de anclaje para las fibras colágenas principales del ligamento periodontal, brindándole soporte al diente.26 2.1.4. El hueso alveolar. En los individuos humanos el hueso del maxilar superior y del maxilar inferior puede dividirse en dos porciones: el hueso alveolar propiamente dicho y la apófisis (proceso) alveolar.18,22 El hueso alveolar propiamente dicho se continúa con la apófisis alveolar y forma la placa de hueso que reviste el alvéolo dental. 18, 27 El proceso alveolar es la porción del maxilar y mandíbula que forma y sostiene a los alvéolos dentarios.18,22,24 El hueso alveolar, está compuesto por los siguientes elementos: la tabla externa de hueso cortical formado por hueso haversiano y laminillas óseas compactadas,18,22 también denominado hueso cortical externo(vestibular o lingual);18,22,27 la pared interna del alveolo, constituida por hueso compacto delgado llamado hueso alveolar,22,24,27 o hueso fasciculado18 y las trabéculas esponjosas, ubicadas entre esas dos capas compactas que operan como hueso alveolar de soporte24, conocido como hueso esponjoso.18,22,27 Grafico Nº7. Las fibras colágenas del ligamento periodontal se insertan en el hueso fasciculado, el cual posee una alta tasa de recambio; las porciones de estas fibras colágenas se llaman fibras de Sharpey. Grafico Nº8 Los haces de estas fibras que se insertan en el hueso suelen ser de mayor diámetro y menos numerosos que los que se insertan en el cemento, en el lado opuesto del ligamento periodontal. 18 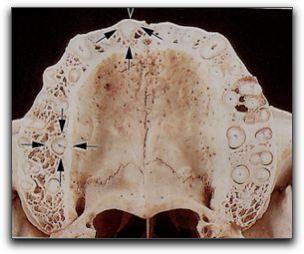
Gráfico Nº7: Hueso alveolar. Elementos que componen el hueso alveolar. Hueso cortical que rodea los alvéolos indicado con flechas. Tomado Lindhe 2005. El hueso posee dos terceras partes de materia inorgánica y una parte de matriz orgánica. La primera está compuesta por minerales como calcio y fosfato; además de sales minerales en forma de cristales de hidroxiapatita, que constituyen alrededor de dos tercios de la estructura ósea. 24 Hay que tomar en cuenta que el tamaño, la forma, la localización y la función del diente, que el hueso alveolar soporta, se modifica la estructura interna del mismo. 22,27 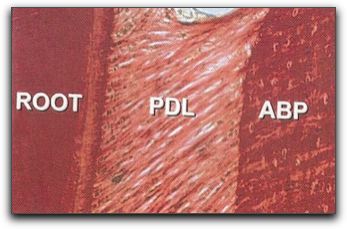
Gráfico Nº8: Fibras de Sharpey. Terminaciones de colágenas del ligamento periodontal (PDL), que se insertan en la raíz dentaria (ROOT) a través del cemento radicular y en el hueso alveolar (ABP). Tomado de Lindhe 200518 La irrigación sanguínea del hueso alveolar proviene de numerosas anastomosis existentes entre las distintas arterias; por lo que se debe considerar que todo un sistema de vasos sanguíneos y no un grupo de vasos individuales conforman una unidad que irriga los tejidos duros y blandos del maxilar superior e inferior. 18 2.2. Conceptos básicos de cicatrización. En el organismo existen tres grupos de células clasificadas según su capacidad proliferativa y su relación con el ciclo celular; estas se denominan: células lábiles, células estables y células permanentes. Las células lábiles, proliferan durante toda la vida y tienen un gran potencial de regeneración; ellas se encuentran en el epitelio de la cavidad bucal entre otros tejidos del cuerpo, como la médula ósea y los tejidos hematopoyéticos.28 Las células estables, muestran una actividad mitótica escasa, pero proliferan ante ciertos estímulos; ellas se encuentran en el tejido conjuntivo, fibroblastos, células endoteliales de los vasos, osteocitos, condrocitos, entre otros. Las células permanentes, no se dividen luego del nacimiento, entre estas se encuentran las células nerviosas, del miocardio y las musculares.28 Las células que se encuentran en los tejidos que conforman el periodonto pueden regenerarse luego de un acto quirúrgico, siendo la dentina, el único tejido de los involucrados en la cirugía endodóntica que no tiene la capacidad de regenerarse.3 Para comprender los sucesos que ocurren en el órgano periodontal, luego de realizada una cirugía endodóntica es importante describir los procesos que se dan durante la curación de la herida; y mencionar conceptos básicos como cicatrización, reparación y regeneración.29 Un concepto sencillo de cicatrización sería curación de una herida u otro proceso patológico, que da como resultado una cicatriz o marca.30 La cicatrización, es un fenómeno complejo que consta de varias fases que coexisten y se continúan una con la otra, como formación de la herida, formación del coágulo e inflamación, cicatrización del tejido epitelial, cicatrización del tejido conjuntivo, proliferación, maduración y remodelado.28,31-34 La capacidad de cicatrización de los tejidos bucales es excelente. Sólo en pocos casos ocurren complicaciones post-quirúrgicas serias, como necrosis de los tejidos, daño a nervios, hemorragias profundas o infecciones serias.33 La regeneración es la renovación natural de una estructura.30 La regeneración; tiene lugar cuando los tejidos que existían previamente, destruidos por una patología, son reemplazados por un tejido del mismo origen, el cual es idéntico tanto en la conformación celular como en su composición, estructura y forma de reaccionar.29,35 Tanto en endodoncia como en periodoncia, la restauración de ese tejido de soporte perdido, implica la formación de nuevo hueso, nuevo cemento, y nuevo ligamento, es decir, la formación de un nuevo soporte periodontal.29, 36,37 Desde un punto de vista biológico, la formación de un nuevo aparato de soporte puede ofrecer ventajas en comparación con la reparación. 29 Para la regeneración periodontal, se requieren muchos acontecimientos los cuales son similares a los sucedidos durante la formación de los tejidos peridontales. Sin embargo, la fase inicial de la regeneración, donde ocurre la formación del coágulo, la respuesta inflamatoria y la formación del tejido de granulación difiere completamente de la fase inicial del desarrollo de los tejidos periodontales; pero ambos procesos tienen en común que finalizan con la migración de células progenitoras, las cuales se diferencian para dar origen a los tejidos que conforman el periodonto. 38 Los procedimientos destinados a reestablecer el aparato de soporte periodontal perdido, se describen como procedimientos de nueva inserción o de reinserción. 39 La nueva inserción es definida como el desarrollo de un nuevo tejido conjuntivo sobre la superficie radicular, con la formación de un nuevo cemento y la inserción de nuevas fibras colágenas.37,39,40 El termino "reinserción" se utiliza para describir la regeneración de la inserción fibrosa a la superficie radicular desprovista de su ligamento periodontal, a través de métodos quirúrgicos o mecánicos. 39 La reparación, es el restablecimiento físico o mecánico de los tejidos lesionados por crecimiento de nuevas células sanas. 30 En la reparación, la restauración del tejido destruido ocurre con un nuevo tejido, conformado por células diferentes a las células originales. 35 Las células y estructuras de este nuevo tejido reaccionan de manera diferente al tejido original, ante la presencia de algún estímulo patológico. 29,35 El mecanismo de cicatrización dentoalveolar se piensa que viene dado por participación de las células mesenquimatosas indiferenciadas que se encuentran en el ligamento periodontal y en el hueso alveolar; esas células se transforman en fibroblastos maduros, cementoblastos y osteoblastos, que forman nuevamente el aparato dentoalveolar apical. 31 Es de fundamental importancia entender como cicatriza la herida luego de una cirugía, y de esta manera aplicar los conceptos y las técnicas quirúrgicas basadas en el conocimiento de los factores que promueven una rápida y completa cicatrización.31 2.3. Cicatrización de los tejidos posterior a una cirugía endodóntica. La cicatrización de una herida después de una cirugía es diferente en cada tejido, aunque estos se encuentren muy cercanos; por ejemplo, difiere entre la mucosa alveolar y la encía; entre el hueso interdental y el hueso radicular y entre el cemento y la dentina.17 La mucosa alveolar tiene excelente capacidad de cicatrización de la herida quirúrgica, debido a su combinación de alto contenido celular, rápida síntesis de colágeno y alta actividad mitótica de la superficie epitelial.17 La mucosa del paladar combina las mejores características de la mucosa alveolar y de la encía adherida, teniendo una gran fuerza estructural, resiliencia, una capa epitelial gruesa y un buen suplemento sanguíneo. La encía marginal debe protegerse ya que es más frágil que la encía adherida. 17 Por su parte, el ligamento periodontal tiene un notable potencial de reparación para todos los tejidos del periodonto; siendo la fuente primaria de tejido de granulación que efectúa la reparación o regeneración.17 El cemento posee buenas habilidades para cicatrizar, logrando formar una capa de cemento alrededor de la dentina, después de realizada la resección apical durante el proceso quirúrgico. 17 Finalmente, el hueso radicular en ciertas áreas es muy delgado y muestra capacidades regenerativas limitadas; generalmente el hueso cortical y el hueso esponjoso tienen un buen potencial de reparación; pero, si la cortical vestibular o lingual se encuentran destruidas en un área dada, la reparación produce una cicatriz en el tejido óseo. 17 Como se mencionó anteriormente el ligamento periodontal posee varias funciones; y en relación a la cicatrización de los tejidos se ha demostrado que las células del ligamento periodontal, poseen la capacidad de formar el cemento y la capacidad de reestablecer una nueva inserción de tejido conjuntivo.41 El proceso de cicatrización de una herida después de una cirugía periapical varía dependiendo de las características particulares de cada caso. Kim y Kratchman en el 200612 mencionan que el resultado de la cirugía endodóntica, depende de la condición prequirúrgica del diente y del órgano periodontal; y la probabilidad de éxito se modifica en cada situación.12 La descripción del proceso de cicatrización luego de una cirugía periapical se encuentra definida en la literatura dependiendo de la condición periodontal del diente, antes del acto quirúrgico. Este proceso de cicatrización es variable y generalmente sucede en tres grupos; el primer grupo describe la cicatrización en dientes con ausencia de lesiones apicales o en presencia de defectos óseos pequeños;32,33 el segundo grupo explica que ocurre en los casos donde hay presencia de lesiones apicales grandes sin comunicación con la cresta alveolar 42-45, y el tercer grupo describe la cicatrización de lesiones apicales comunicadas con la cresta alveolar, defectos apico-marginales, y/o dehiscencias. 36, 46,47 2.3.1. Cicatrización en ausencia de una lesión ósea apical. Luego de realizar la cirugía endodóntica en estos casos; tenemos que entre los principales acontecimientos ocurre: a las 24 horas los polimorfonucleares y los macrófagos comienzan a migrar hacia el coagulo de sangre. Simultáneamente los macrófagos intervienen estimulando la angiogénesis y la nueva síntesis de colágeno.31 La angiogénesis, es también, una característica muy importante de la cicatrización, las células endoteliales son las responsables de que ocurran los acontecimientos en la revascularización.33 La función de las células inflamatorias en la cicatrización de la herida, es la secreción de mediadores que atraen las células para el proceso de reparación.33 A los 2 días se empieza a observar el crecimiento epitelial y a los 4 días ya se ha formado una barrera epitelial. Posteriormente, a los 14 días el proceso de cicatrización epitelial en el surco ha finalizado y se logra la completa cicatrización de la herida a los 28 días.32 La cicatrización y reinserción del colgajo en la cortical ósea es un proceso más lento. El tejido de granulación sustituye al coágulo de fibrina, que se encuentra entre el colgajo y el hueso cortical, después de 4 días y el tejido conjuntivo reemplaza al tejido de granulación a los 14 días. Este proceso continua por varios meses con la maduración, la fase de remodelado finaliza entre las 16 y 20 semanas. Los eventos de este proceso resultan en la cicatrización apical dentoalveolar y la cicatrización ósea. 31 Al iniciarse el proceso de cicatrización para restablecer la función del aparato apical dentoalveolar, las células mesenquimatosas pluripotenciales indiferenciadas se diferencian en fibroblastos funcionales, con síntesis de colágeno, formación de cementoblastos y osteoblastos, los cuales iniciaran la formación de nuevo cemento y hueso. En cuanto a la cicatrización ósea, al cuarto día de la cirugía el tejido endostial que recubre el trabeculado óseo en la profundidad de la herida comienza a proliferar y migra dentro del coágulo. Este tejido pronto reemplaza el interior del coágulo, recubre el interior de la herida y protege el tejido de granulación encapsulado en la terminación apical. A los seis días de la cirugía inicia la formación de tejido óseo, y entre la tercera o cuarta semana, se puede observar que ? o 4/5 partes de la herida se encuentran rellenos de trabeculado óseo con un periostio activo reparando la tabla cortical. En la semana 16, se puede apreciar la reparación completa de la herida excisional, excepto la cortical ósea. El período de tiempo necesario para que la tabla cortical complete su reparación no es conocido con precisión y depende en gran parte del estado del tejido óseo antes de realizar el acto quirúrgico. 31 El éxito de la cirugía endodóntica periapical depende de una infinidad de factores; entre estos uno de los más importantes es la respuesta de cicatrización al tratamiento realizado. 31 Al revisar la literatura se pueden encontrar diversos porcentajes de éxito de este procedimiento, que van desde un 37% de éxito publicado por Rahbaran et al.,48 en el 2001, hasta unos más elevados como los publicados por Taschieri et al.,49 en el 2006, con un 94,9% de éxito al realizar microcirugía periapical. Pero cada estudio evalúa diferentes factores por lo que no pueden ser comparados directamente. Sin embargo, varios autores coinciden en que si el procedimiento quirúrgico endodóntico es realizado en casos con lesiones periapicales de gran tamaño; es decir, con un diámetro de 5 mm o más; la tasa de éxito disminuye en comparación a cuando no existe lesión apical o esta presenta un diámetro menor; 45,50,51 y si hay pérdida de la tabla ósea vestibular o palatina, o naturalmente hay una dehiscencia, el porcentaje de éxito también disminuye dramáticamente, llegando a ser hasta del 27%.44 2.3.2. Cicatrización en presencia de una lesión periapical, sin comunicación con la cresta alveolar. Diversos autores consideran que el pronóstico de una cirugía endodóntica disminuye cuando el diente presenta una lesión apical de gran tamaño, debido a que en estos casos ocurre una cicatrización ósea incompleta.45,50,51 Considerándose una lesión grande aquella con un diámetro mayor a 5mm.50 Rud et al.42, en 1972 evaluaron el patrón de cicatrización ósea radiográfica un año luego de la cirugía perapical en 1000 casos, describiendo 4 grupos diferentes; dentro de los cuales se encontró una categoría denominada "cicatrización incompleta o apical". Este grupo se caracterizó por presentar una imagen radiolúcida con bordes irregulares extendiéndose angularmente en el espacio periodontal. Esta imagen se pudo localizar asimétricamente al ápice radicular, y con o sin estructuras óseas internas visibles.42 La cicatrización incompleta estuvo relacionada especialmente con lesiones que involucraban pérdida de la cortical vestibular y palatina en una misma área; y se presentó con mayor frecuencia en los incisivos laterales superiores. 43,44,52 En 1972, Andreasen y Rud53 estudiaron los cambios histológicos en 70 muestras de biopsias periapicales de 1 a 14 años después de la cirugía perirradicular en tejidos humanos. Según los resultados, obtenidos dividieron la cicatrización luego de una cirugía apical en tres grupos: (1): cicatrización con nueva formación de la membrana periodontal o anquilosis; (2): cicatrización con un tejido fibroso (cicatriz apical) con varios grados de inflamación; y (3): inflamación periapical moderada o severa sin cicatriz apical. Los autores concluyen que la cicatriz apical probablemente se forma por una rápida proliferación de las células del tejido epitelial y del tejido conjuntivo, mientras que la regeneración periodontal y ósea ocurren más lentamente dentro de la cavidad. 53 Se entiende entonces, que la formación de la cicatriz apical ocurre cuando el tejido fibroso prolifera en presencia de la destrucción considerable de las placas corticales vestibulares o palatinas. El periostio se encuentra bastante destruido, y el tejido conjuntivo denso prolifera dentro de la cavidad.4,35,54 La formación ósea no ocurrirá dentro de este tejido, ya que este no presenta potencial osteogénico.4 Histológicamente la cicatriz apical está compuesta por una masa densa de tejido conjuntivo fibroso con gruesos haces de colágeno y fibrocitos fusiformes.6 La razón del limitado éxito de estos casos ha sido el crecimiento de tejido no osteogénico dentro de esta área quirúrgica periapical formando una cicatriz apical.55 En el 2007, von Arx et al.,45 realizaron un estudio prospectivo de un año, y con una cohorte de 183 dientes, para evaluar la relación entre las dimensiones del defecto óseo y el resultado de la cicatrización luego de una cirugía apical. Los resultados fueron divididos en dos grupos, cicatrizados y no cicatrizados; y la tasa general de éxito, casos cicatrizados, fue del 83%. Los autores evaluaron las diferentes medidas del defecto óseo y concluyeron que los casos que no cicatrizaron, presentaron al momento de la cirugía apical, criptas óseas más grandes y distancias de acceso al conducto radicular (F1, F2) mayores que los casos cicatrizados. Los investigadores no encontraron una diferencia estadísticamente significativa entre los casos cicatrizados y los no cicatrizados. Sin embargo, el único parámetro que resultó significativo en relación al proceso de cicatrización fue la longitud mesio-distal de la ventana de acceso de la cripta ósea (D). Grafico Nº 9 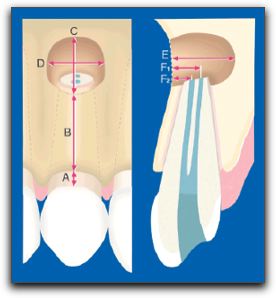
Gráfico Nº 9: Representación esquemática de las medidas tomadas intraoperatoriamente. (A) Nivel marginal del hueso vestibular, (B) altura de la tabla ósea vestibular, (C) altura de la ventana de acceso de la cripta ósea, (D) longitud de la ventana de acceso de la cripta ósea, (E) defecto de la cripta ósea, y (F1, F2) distancias de acceso a los conductos radiculares. Tomado von Arx 2007.45 2.3.3. Cicatrización en presencia de una lesión periapical en comunicación con la cresta alveolar, defecto apico-marginal, y/o dehiscencia. Cuando la lesión ósea periapical se comunica con la cresta alveolar se puede producir una pérdida completa o parcial de la tabla ósea o córtical vestibular y/o palatina,36 la cual se encuentra denominada en la literatura como defecto apico-marginal.14-16,56 Este tipo de defecto apico-marginal generalmente es uno de los signos clínicos y/o radiográficos de una lesión endo-periodontal combinada. 47,57, 58 La presencia de periodontitis marginal y/o la pérdida de la cresta ósea alveolar, también se han identificado como un factor que puede afectar profundamente el pronóstico de la cirugía apical.36 La pérdida de hueso puede comprometer la cicatrización periodontal, por la invaginación de tejido epitelial a lo largo de la superficie radicular.55 Y como consecuencia las bacterias presentes en el surco periodontal invaden la zona periapical evitando la cicatrización. 43,44 En los casos donde existe un defecto apicomarginal, el modo más frecuente de cicatrización de la herida quirúrgica consiste en el desarrollo de una unión epitelial larga y la adhesión de tejido conjuntivo. La prevención de la migración apical de las células epiteliales durante las etapas iniciales de la cicatrización de la herida, puede permitir la repoblación de la superficie radicular por las células del ligamento periodontal. 36 La calidad de la cicatrización y el pronóstico del diente también se ven afectados por la localización de la lesión. De hecho, el pronóstico varia sí, después de la cirugía, la lesión permanece en el área apical o está localizada en el tercio medio de la raíz, o si hay comunicación entre la lesión endodóntica y la lesión periodontal. En este último caso, se espera una regeneración más compleja y menos fiable. Desafortunadamente, en el área marginal, por razones biomecánicas y microbiológicas, es indispensable una nueva y completa inserción. Mientras que un diente puede sobrevivir con el ápice rodeado de tejido conjuntivo, un defecto apicomarginal con una cicatrización incorrecta, permitirá pérdida recurrente de tejido óseo, facilitando el acceso a la infección.29 El objetivo final de la cirugía endodóntica es obtener una predecible regeneración de los tejidos periapicales, incluyendo una completa reparación de los defectos óseos.59 A pesar que los estados perirradiculares mencionados anteriormente disminuyen las probabilidades de lograr la completa regeneración de los tejidos; con la introducción de la regeneración tisular guiada en la cirugía oral y periodontal, una opción de tratamiento se encuentra disponible para tales defectos.56 Diferentes investigadores han demostrado que un correcto diagnóstico, seguido de la remoción de los factores etiológicos y el uso la técnicas de regeneración tisular guiada en conjunto o no, con injertos óseos, pueden restaurar la función de un diente con una pérdida severa de soporte óseo causada por: (a)lesiones periapicales de más de 5 mm de diámetro que involucren o no, la tabla ósea vestibular y palatina 29, 59, 60-62 y (b) en casos con lesiones endo-periodontales combinadas, con presencia de defectos apico-marginales o dehiscencias.36,46,47,56, 62-65 Para emplear correctamente las técnicas de regeneración tisular guiada y colocar injertos óseos en la cirugía endodóntica, es importante conocer sus principios biológicos, las características de los materiales ideales y los diferentes materiales de barreras y de relleno que se pueden utilizar. 3. REGENERACIÓN TISULAR GUIADA (RTG) El tratamiento periodontal regenerador comprende procedimientos diseñados y utilizados especialmente para restaurar las partes del aparato de sostén dentario perdidas durante la lesión del órgano periodontal. 66,37 La repoblación celular guiada o regeneración tisular guiada (RTG) describe procedimientos diseñados para la manipulación de las células, con el fin de lograr la cicatrización de la herida a través de un mecanismo de regeneración.37 3.1. Principio biológico. La RTG es un proceso empleado para regenerar el aparato de soporte perdido o dañado a través de la diferenciación de la respuesta tisular; 35 considerándose el tratamiento actual para los defectos óseos periodontales.67,68 La técnica impide la migración epitelial a lo largo de la pared cementaria del saco periodontal.39 Nyman et al,.40 en 1982, fueron los primeros en reportar el uso de RTG en defectos periodontales humanos. Esta técnica, se basa en la presuposición de que sólo las células del ligamento periodontal poseen el potencial de regenerar el aparato de inserción del diente.41 El principio biológico de la RTG consiste en evitar la proliferación del tejido conjuntivo gingival y el epitelio dentogingival durante la cicatrización, en la zona adyacente a la superficie radicular y, simultáneamente, la creación de un espacio para dar preferencia a la proliferación y migración coronal de las células del ligamento periodontal.14,39,41,59,69 Esto se logra con la colocación de una barrera física para cubrir el hueso y el ligamento periodontal, separándolos de forma temporal del epitelio gingival.39,66. Gráfico Nº 10. 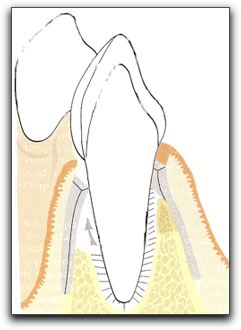
Gráfico Nº 10: Inserción de una barrera física. Esquema que ilustra la inserción de una barrera física que evita el contacto del epitelio y del tejido conjuntivo gingival con la superficie radicular durante la cicatrización. Permitiendo la migración coronal de las células del ligamento periodontal (flecha).Tomado de Lindhe 2005. Al colocar la barrera física se logra la conservación de la interfaz entre la superficie radicular y el coágulo de fibrina, lo que impide la migración apical del epitelio gingival y evita la inserción del tejido conjuntivo gingival durante un periodo temprano de la cicatrización de la herida.66,14 La RTG permite restaurar la arquitectura original de los tejidos periodontales; la calidad de los resultados obtenidos va a depender de las variaciones clínicas entre un caso y otro.70 También existe el término de regeneración ósea guiada (ROG), la cual se considera como al aplicación de los conceptos de RTG en los defectos óseos.71 En presencia de un defecto óseo, el mecanismo de cicatrización se lleva a cabo con las células óseas en competencia con las células del tejido conjuntivo gingival, para colonizar y llenar el área. Se ha demostrado que la existencia de un obstáculo mecánico para la proliferación del tejido conjuntivo dentro del defecto puede ser de gran importancia para la cicatrización ósea sin dificultades.54 Según el principio de "osteopromoción", la proliferación del tejido conjuntivo se puede detener, permitiendo el crecimiento de las células óseas, conduciendo de esta manera, a la regeneración ósea.72 3.2. Características de una membrana ideal. Para que una membrana sea empleada como barrera y pueda generar los resultados esperados, debe cumplir con varias características, entre estas: A. Biocompatibilidad: para permitir una buena aceptación tisular es indispensable que el material sea biocompatible; evitando que provoque algún tipo de respuesta inmune, sensibilización ni inflamación crónica; que puedan interferir con el proceso de cicatrización.46,66 B. Barrera celular: el material debe actuar como una barrera para evitar el paso de algunas células, de modo que no penetren en el espacio cerrado adyacente a la superficie radicular. También es ventajoso que permita el paso de nutrientes y gases.66 C. Adhesión celular: idealmente las barreras deberían facilitar la adhesión celular y promover la migración de las células progenitoras, con el fin de que estas células progenitoras osteoblásticas procedan con la cicatrización de la herida. 72 D. Integración tisular: el objetivo de la integración del tejido es evitar el rápido crecimiento en profundidad sobre la superficie externa del material o su encapsulado, y otorgar estabilidad al colgajo suprayacente. Cuando hay falta de integración tisular, las membranas se rodean de una capa epitelial, se encapsulan y posteriormente son exfoliadas. 66 E. Óptima consistencia: es esencial que el material de barrera sea capaz de crear y mantener un espacio adyacente a la superficie radicular. Esto permitirá el crecimiento del ligamento periodontal. Algunos materiales pueden ser tan blandos y flexibles que se colapsarían dentro del defecto. Otros materiales son tan rígidos que pueden perforar el tejido suprayacente. 46, 66 F. Diseño: finalmente existen necesidades clínicas para el diseño de una barrera. Deberían fabricarse en configuraciones que sean fáciles de recortar y colocar. 66 Existen otros factores que intervienen en el comportamiento y función de una barrera, entre estos se encuentran los componentes de la membrana, la forma de la misma, su capacidad de unión a las proteínas plasmáticas, las sustancias liberadas por la barrera durante su degradación, la textura de la superficie de la membrana, el tamaño de las perforaciones o poros, y el tiempo que permanezca la membrana en la zona colocada.72 3.3. Barreras o membranas utilizadas en la RTG. Uno de los primeros estudios, diseñados con la finalidad de regenerar los tejidos periodontales perdidos, fue realizado en monos a inicios de la década de los 80 por Nyman et al.40, los autores realizaron una incisión semilunar en la superficie vestibular de dos caninos y crearon una fenestración ósea, preservando la porción marginal del periodonto. La superficie radicular fue raspada, y sobre ella fue colocada una barrera mecánica confeccionada de filtro Millipore®, para impedir el contacto del tejido conjuntivo gingival con la superficie radicular. El colgajo fue reposicionado y suturado. Luego de seis meses, se observó, histológicamente, la formación de nuevo cemento con inserción de fibras perpendicularmente; lo que confirmó la capacidad de las células del ligamento periodontal de restaurar la inserción de tejido conjuntivo, con la ayuda de una barrera. Probablemente la regeneración del tejido óseo puede estar influenciada por la naturaleza de la membrana o barrera utilizada.73 En los primeros intentos de regeneración tisular guiada, como se mencionó anteriormente, se empleó un filtro bacteriano producido del acetato de celulosa (Millipore®) como membrana oclusiva. 40 Aunque este tipo de membrana cumplió su propósito, no fue ideal para su aplicación clínica. Los investigadores están en constante búsqueda del material ideal, o el material que reúna las mejores características para ser utilizado como barrera en los procedimientos de RTG. Se han empleado diferentes tipos de membranas, pero estas pueden ser clasificadas en dos grandes grupos para su estudio, membranas reabsorbibles y membranas no reabsorbibles.14,29 Tabla NºII 
Tabla Nº II: Tipos de Barreras. Tomado de Pecora 1991 y de Rankow 1996.14 Generalmente las membranas reabsorbibles son permeables y permiten el libre intercambio de fluidos tisulares y macromoléculas; evitando el paso de células no deseadas; y las membranas no reabsorbibles no son permeables, por lo tanto no permiten este intercambio. La ausencia del suplemento vascular perióstico causa una disminución de oxígeno, lo que puede originar la proliferación de un tejido cartilaginoso en el defecto. La formación de cartílago durante la regeneración ósea ocurre debido a la baja tensión de oxígeno en el tejido. 67 Grafico Nº11 Marinucci et al. 73, en el 2001, realizaron una comparación in Vitro entre las membranas bioreabsorbibles y las no reabsorbibles; observando una mayor proliferación de osteoblastos cuando se utilizaron membranas reabsorbibles como la de colágeno; ellos concluyen que las membranas biorreabsorbibles son más adecuadas que las no reabsorbibles y favorecen la regeneración y reparación ósea. 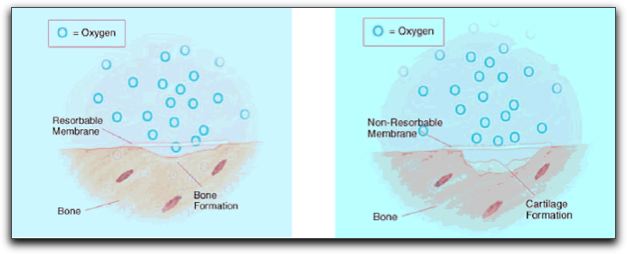
Gráfico Nº 11: Membranas reabsorbibles y no reabsorbibles. Tomado de Asian et al. 2004. 3.3.1. Membranas no reabsorbibles. Las primeras membranas creadas fueron las no reabsorbibles, las cuales necesitan una segunda intervención, para ser retiradas. Esta operación se practica después de las etapas iniciales de cicatrización, generalmente entre 3 y 6 semanas luego de la intervención. La cual a pesar de ser muy simple, es una complicación notoria de esta técnica y es por ello que se crearon las membranas reabsorbibles.39 El primer tipo de membrana comercialmente disponible fue una de politetrafluoretileno expandido (ePTFE) material llamado GoreTex Material Periodontal®. Esta barrera denominada también membrana de teflón, es químicamente inerte.54 Es un tipo de barrera no reabsorbible y requiere de una segunda intervención quirúrgica para ser retirada.14 Las barreras de e-PTFE fueron diseñadas específicamente para la regeneración periodontal. Están fabricadas con una estructura de titanio.70 La molécula básica de este material consiste en un enlace carbono-carbono con cuatro átomos de flúor incorporados, para formar un polímero. Es inerte y no genera ninguna reacción tisular cuando se implanta en el tejido óseo.66 Este material está disponible en diferentes formas y tamaños, para adaptarse a los espacios interproximales y superficies vestibulares y linguales. 39 Salata et al.,74 en el 2001, realizaron una investigación compuesta por un estudio animal y otro in vitro, donde comparan la biocompatibilidad de las membranas de e-PTFE con otras membranas no reabsorbibles, las formadas de alcali-celulosa. La regeneración ósea asociada con membranas alcali-celulosa fue predominantemente de tipo endocondral en contraste con la e-PTFE que indujo la formación directa de hueso (osificación intramembranosa). La cantidad de hueso formado fue similar con ambas membranas pero las de alcali-celulosa indujeron una respuesta inflamatoria significativamente mayor; caracterizada por linfocitos, macrófagos y células gigantes multinucleadas. Los autores recomiendan que si se debe elegir una membrana no reabsorbible para realizar procesos de regeneración, esta sea la de e-PTFE ya que, proporciona resultados más predecibles. Diversos autores han reportado un resultado exitoso al emplear técnicas de RTG, utilizando barreras de e-PTFE con o sin la colocación adicional de un material de relleno. Observando formación de hueso en el lugar donde se encontraba el defecto óseo.47,62, 71, 74 Las membranas de e-PTFE han sido estudiadas y comparadas con membranas reabsorbibles; para observar cual tipo de membrana provee mejores beneficios a la terapia con RTG. En este punto hay discrepancias entre los resultados de varios estudios; donde unos autores apoyan la idea de que las membranas reabsorbibles proporcionan mejores resultados que las de e-PTFE;59,75 y otros investigadores consideran que las membranas de e-PTFE son más efectivas en los procesos de regeneración ósea que las membranas reabsorbibles.71 Recientemente se ha estudiado la alternativa de utilizar una membrana de politetrafluoretileno de alta densidad (d-PTFE), para reconstruir defectos óseos de gran tamaño, entre otras aplicaciones. En comparación con la e-PTFE, la membrana de d-PTFE puede exponerse a la cavidad bucal, sin la posibilidad que ocurran complicaciones, como la contaminación bacteriana.77 Barber et al.,76 en el 2007, consideran que el uso de la membrana de d-PTFE proporciona una opción ideal de tratamiento, debido a la simplicidad de su colocación y eliminación, la previsible regeneración del tejido óseo y de los tejidos suaves, y preservación del tejido queratinizado, todo, sin comprometer la calidad de la regeneración, la vascularización de la zona quirúrgica, o los tejidos blandos y las preocupaciones estéticas del paciente y el clínico. 3.3.2. Membranas reabsorbibles. Se han introducido materiales biorreabsorbibles, sintéticos o naturales para barreras aplicadas en RTG, con el fin de evitar una segunda cirugía para retirar la membrana. Las membranas biorreabsorbibles se consideran de segunda generación y no necesitan una segunda intervención para ser retiradas.77 Entre los diferentes tipos de materiales reabsorbibles evaluados por los investigadores, se encuentran: periostio, colágeno, sulfato de calcio, hidroxiapatita, y algunos polímeros como el ácido poliláctico, y el ácido poligláctico, entre otros. Las barreras de periostio se pueden obtener fácilmente, son relativamente abundantes, y la cicatrización de la zona donadora es bien tolerada por los pacientes. Además la configuración del periostio puede ajustarse al receptor. Pero tiene como desventanja que durante la cirugía pueden generarse hemorragias profusas y además el grado de dificultad de este tratamiento es moderado.46 El periostio se considera un regenerador de alto potencial debido a que posee una estructura rica en células osteoprogenitoras.78 El injerto autógeno de periostio representa una atractiva alternativa para los materiales de barrera, ya que se considera que reúne los requisitos de una barrera ideal. Además, tiene la capacidad de estimular la osteogénesis en la zona del defecto óseo.79 Tobón-Arroyave et al.,46 en el 2004, sugieren que el uso de injertos óseos como barreras en la terapia de lesiones endo-periodontales combinadas puede contribuir con el éxito clínico del resultado. En el gráfico Nº 12 se puede observar los procedimientos quirúrgicos realizados por los autores en su estudio. 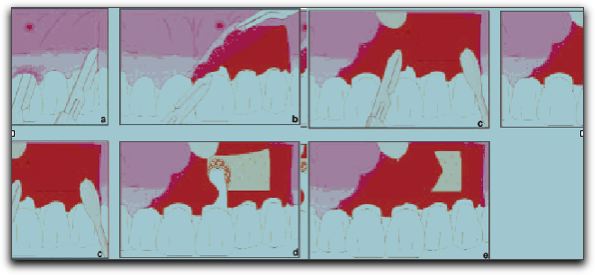
GráficoNº 12: Ilustración de los procedimientos quirúrgicos realizados en un incisivo central con una lesión endo-periodontal. (a) Diseño y localización del colgajo. (b) Levantamiento del colgajo de espesor medio. (c) Incisión perióstica para eliminar el tejido patológico y obtener el injerto de periostio. (d) Exposición quirúrgica de la tabla ósea vestibular y de la raíz dentaria. (e) Colocación lateral del injerto de periostio. Tomado de Tobón-Arroyave et al. 2004.46 Entre las barreras reabsorbibles más empleadas, se encuentran las mebranas de colágeno. El colágeno es la principal proteína que compone estructuralmente al tejido conjuntivo, y constituye la mayoría de las proteínas del cuerpo.80 Además, el colágeno tipo I, colágeno tipo II, III y V; pueden inducir a la agregación plaquetaria, acelerando el proceso de cicatrización;80,81 y tiene la capacidad de presentar una función hemostática.81 Se ha confirmado que el colágeno es un material no tóxico y biocompatible, que es completamente tolerado por el organismo.83 Gungormus83 en el 2004, evaluó el efecto del colágeno tipo I sobre la cicatrización de los defectos óseos. El autor trabajó con 6 conejos machos adultos; utilizó anestesia general, y posteriormente expuso quirúrgicamente las superficie anterior de las tibias de los conejos; preparando dos agujeros en cada tibia para la investigación. Un agujero de cada tibia lo llenó con Colágeno Tipo I, en esponja; y el otro lo dejó vació para ser utilizado como control. Luego de 28 días los análisis histopatológicos mostraron en el grupo donde se utilizó colágeno tipo I, un relleno completo con nuevo hueso en la cavidad creada. Las diferencias fueron estadísticamente significativas en comparación con el grupo control. Esta investigación demuestra que el colágeno tipo I, puede promover una rápida regeneración de los defectos óseos, acelerando el proceso de cicatrización. Los resultados de este estudio coinciden con los obtenidos por Cobb et al.84 en 1976 y por Mehlish et al.82 en 1990. Recientemente se ha aplicado la membrana biorreabsorbible de colágeno, también conocida comercialmente como BioGuide®, como barrera para terapias con RTG, en diferentes casos; entre estos en el tratamiento de lesiones endo-periodontales o de defectos apicomarginales; resultando en una mayor formación de tejido conjuntivo y de hueso radicular.56,85 El sulfato de calcio (CaS), conocido también como yeso parís; es utilizado principalmente como injerto o relleno óseo. Se conoce también que el sulfato de calcio puede ser utilizado como una barrera; algunas ventajas o características de este material son: es inexpansible, fácil de aplicar, no produce reacción inflamatoria, ni complicaciones posquirúrgicas, se puede lograr una cicatrización de los tejidos a pesar que el material se haya expuesto, estabiliza el coagulo de sangre, es biocompatible y completamente bioreabsorbible.35 La resorción del sulfato de calcio empieza a producirse, aproximadamente a las dos semanas de colocado; siendo uno de los materiales que se reabsorbe con mayor rapidez. 86 La membrana de ácido poliláctico conocida comercialmente como Guidor® y EpiGuide® entre otros nombres comerciales; es una membrana que se reabsorbe lentamente; la cual al ser colocada sobre los tejidos, mantiene su estabilidad funcional por un mínimo de 6 semanas; y posteriormente es hidrolizada; la completa hidrólisis de la barrera se produce entre los 6 y 12 meses posterior a su colocación.63,77 Así como los otros tipos de membranas, las barreras de ácido poliláctico también han sido estudiadas por los investigadores; colocadas en diversos casos, y comparadas con otros tipos de materiales; observándose que muestran resultados similares a las otras barreras biorreabsorbibles.36,63,72,87,88 Se considera que el uso de membranas biorreabsorbibles de ácido poliláctico, mejora la regeneración ósea al momento de realizar una cirugía periapical cuando existe un defecto óseo vestibular de gran tamaño.36 Si embargo; se ha demostrado que en los casos donde las lesiones óseas presentes no son de gran tamaño, no amerita la colocación de una barrera.88 Garret et al.88, en el 2002, en un estudio clínico prospectivo; concluyeron que en los casos donde existe un defecto óseo con cuatro paredes el cual se encuentra confinado a la región apical; la colocación de una membrana reabsorbible no representa ninguna ventaja y más bien es un gasto adicional para el paciente, coincidiendo con los resultados obtenidos por Maguire et al., en 1998.87 Como se mencionó anteriormente, entre las características de una barrera ideal, se encuentran que estas deberían facilitar la adhesión celular y promover la migración de las células progenitoras. Wang et al. 72 en el 2002, evaluaron la habilidad de los osteoblastos para la adhesión inicial cuando se aplican diferentes barreras para la regeneración ósea guiada. Utilizaron 6 tipos de membranas diferentes: Millipore® (MP), conformada de una mezcla de éster y celulosa; BioMend® (BM), de colágeno; GoreTex® (GT), de e-PTFE; Resolut® (RL), de polímeros de poliláctico y poliglicólico; y EpiGuide® (EG) y Guidor® (GD) de ácido poliláctico. Los resultados de este estudio mostraron que las barreras de MP, BM, RL y EG presentaron una adhesión inicial de osteoblastos mayor. Baek y Kim 59 en el 2001, también compararon el comportamiento de tres membranas y su efecto sobre la regeneración en lesiones de tejido óseo que involucran ambas corticales óseas. Los autores observaron que la mayor cantidad de regeneración ósea se observó al utilizar una barrera de ácido poligláctico, también conocida comercialmente como Vicryl®; donde el defecto óseo se llenó casi completamente por hueso laminar, y la reacción inflamatoria causada por la reabsorción de la membrana fue muy leve. Al utilizar una barrera GoreTex® se observó algo de regeneración ósea a pesar de la exposición de la membrana al medio bucal; y finalmente el grupo de casos donde se colocó una membrana Guidor® presentó una regeneración ósea limitada con una gran inflamación causada por la resorción de la membrana. También se ha evaluado el efecto antibacterial de las membranas utilizadas en la RTG; observándose que las barreras de ácido poliláctico pueden prevenir la infección posquirúrgica mejor que las barreras de hueso laminar o de sulfato cálcico. Esto puede ser debido a los componentes antimicrobianos que se encuentran en la barrera de ácido poliláctico.89 Pecora et al.,35 en 1997, mencionan que durante el empleo de las barreras es importante recordar que:
3.4. Factores que afectan el resultado de la RTG. Gran cantidad de variables pueden influir o no, en el resultado del tratamiento regenerador tisular guiado, estas variables pueden estar relacionadas con el operador, experiencia y capacitación; relacionadas con el paciente, estado sistémico, hábito de fumar, control de placa, respuesta de los tejidos y edad; factores relacionados con el defecto óseo, como la altura ósea, el acceso, la morfología del diente y del defecto, el mantenimiento del espacio y la estabilidad dentaria; consideraciones quirúrgicas, como el diseño y la manipulación del colgajo, la preparación de la raíz y la posible biomodificación, los materiales regenerativos empleados, y el control de infección; y relacionadas con el tratamiento postquirúrgico, y la terapia de mantenimiento. 39 El hábito del cigarrillo es una de las variables que afecta fuerte y negativamente el resultado de los tratamientos con RTG.75,90,91 Stavropoulos et al.,90 en el 2004, realizaron un análisis retrospectivo, donde evaluaron la influencia del hábito del cigarrillo sobre los resultados de RTG en tratamientos de defectos intraóseos utilizando membranas biorreabsorbibles. Ellos observaron, que al realizar el sondeo de los sacos periodontales, los pacientes fumadores mostraron una reducción de sacos menor que los pacientes no fumadores, con una diferencia estadísticamente significativa. Los resultados de este estudio, apoyan la opinión de que el hecho de fumar cigarrillo perjudica la cicatrización, y por ende los resultados de los procedimientos realizados con RTG; además los autores mencionan que los pacientes que reciban dicho tratamiento deben ser informados sobre las posibles consecuencias de fumar en el período postquirúrgico.90 Sólo en pocos estudios el hecho de que el paciente tuviera el hábito del cigarrillo, no influyó sobre el tratamiento de la RTG.56 No se conoce el mecanismo preciso por el cual el fumar interfiere en el resultado de la terapia con RTG; pero se ha investigado el efecto del cigarrillo sobre los procesos de cicatrización, observándose que las partículas y los componentes gaseosos presentes en el humo del cigarrillo tienen un notable efecto inhibitorio sobre la cicatrización de las heridas.92 Los efectos de la nicotina, el monóxido de carbono y el cianuro de hidrógeno se combinan para causar anoxia en el tejido, hipoxia celular, prevención de la proliferación de las células epiteliales y una vasoconstricción que disminuye la capacidad de transporte de oxígeno en la sangre; y el envenenamiento de los sistemas enzimáticos necesarios para la cicatrización de la herida.92 Además se considera relevante que algunos autores han demostrado que la nicotina y los subproductos del humo del cigarrillo, tienen un efecto adverso sobre la proliferación, adhesión y quimiotáxis de las células del ligamento periodontal.93,94 Otro factor que parece influenciar en el tratamiento con RTG es la exposición de la membrana o barrera luego de la cirugía. 68,91 Ling et al.,68 en el 2003 concluyen que la exposición de la membrana es un factor que afecta el resultado de la RTG, mencionando que tiende a disminuir la ganancia de soporte y, aumenta significativamente la recesión gingival. La exposición de la membrana puede alojar un mayor número de A. actinomycetemcomitans, siendo este uno de los patógenos más importantes relacionados con el fracaso de la RTG; durante su investigación los autores utilizaron una membrana de e-PFFE. De igual forma, otros autores han observado que la exposición de la membrana no ha sido una variable predecible en la ganancia de soporte óseo; en este caso utilizaron una membrana de ácido poliláctico, la cual aparentemente es menos susceptible a la adhesión bacteriana que las membranas de e-PTEF.75 Se ha observado que la contaminación de la herida debido a la exposición de la membrana de e-PTFE a la cavidad bucal, resulta en una resorción ósea.59 Asian et al.,67 en su estudio, sumergieron la membrana de e-PTFE en solución fisiológica con ampicilina/sulbactam durante 1 hora (antes de la intervención), para evitar la contaminación bacteriana, y controlar la infección; en los resultados de su estudio los autores no observaron infección primaria ni secundaria. La acumulación de la placa bacteriana también ha sido evaluada como un factor determinante en el resultado de la terapia de RTG; encontrándose que la acumulación de placa, en la zona dento-alevolar adyacente o cercana al defecto óseo tratado; tiene una influencia directa sobre los procedimientos regenerativos.91 Por lo tanto, es imprescindible proveer educación constante al paciente tratado con RTG, para que mantenga una correcta higiene bucal. Así como otros factores, la presencia de infecciones subgingivales persistentes de P. gingivalis tienen un efecto negativo sobre el resultado del tratamiento con RTG. 75 Algunas variables como la edad, el sexo, el estado periodontal, el tamaño y el tipo de defecto óseo presente; parecen no influir de manera significativa en el resultado del tratamiento; al realizar el sondaje del defecto periodontal y al evaluar los niveles clínicos de soporte óseo; luego de aplicarse procedimientos con RTG.56,91 Sin embargo, se ha demostrado que en los defectos óseos con una configuración más profunda y estrecha, se obtienen mejores resultados, ue en los defectos óseos con otra configuración.75 Se puede considerar que la selección del paciente es fundamental para el éxito de la terapia con RTG. Los defectos intraóseos profundos y estrechos, logran resultados más beneficiosos; y la movilidad dentaria severa puede desvirtuar los resultados clínicos. Además es relevante realizar un cuidadoso diseño del colgajo, una inserción correcta del material, un buen cierre de la herida y un óptimo control postoperatorio de la placa bacteriana, para obtener resultados satisfactorios con las terapias de RTG.66 4. INJERTOS O RELLENOS ÓSEOS La sustitución de los tejidos perdidos, con la aplicación de injertos o rellenos óseos, ha sido y sigue siendo una de las estrategias terapéuticas más ampliamente utilizadas para la corrección de defectos óseos.95 La colocación de un material de relleno en el defecto óseo puede inducir a las células progenitoras indiferenciadas del hospedero ubicadas en la zona periapical, a diferenciarse en células óseas, o estimular a los osteoblastos para la nueva formación ósea.96 4.1. Características del material de injerto óseo ideal Las características del injerto o relleno óseo ideal se han tomado en cuenta desde antes de 1964; entre estas se encuentran: A.Biocompatibilidad: debe ser aceptado por el organismo sin producir ninguna reacción adversa;86 y ser inmunológicamente neutro. 97 B.Revascularización: el tejido óseo debe ser rápidamente revascularizado. 86 C.Reabsorción: el material debe ser reabsorbido y sustituido por el nuevo tejido óseo del hospedero; la velocidad de reabsorción debe permitir la incorporación del injerto al tejido óseo, sin afectar negativamente los tejidos adyacentes.86,98 D.Restauración: el injerto óseo debe tener la habilidad para restaurar la forma y/o la función del tejido sano, que se encontraba antes de formarse el defecto óseo; proporcionando cualquier elemento que estimule o apoye el crecimiento de hueso nuevo. 97 E.Esterilización: el material utilizado como relleno óseo debe tener la capacidad de ser esterilizable y poseer una vida útil larga. Preferiblemente no debe ser muy costoso y debe haber disponibilidad del mismo en el mercado. 97 El sistema de reemplazo óseo ideal debe inducir la osteogénesis, permitir la cementogénesis, y facilitar la formación de un ligamento periodontal funcional. 99,100 Es difícil encontrar un material que presente todas las característicasantes mencionadas, y aún no existe ni el material ni la técnica perfecta, si no los que se adaptan mejor a cada caso.39 Entre las consideraciones que rigen la selección de un material se encuentran: aceptabilidad biológica, predicción, perspectiva clínica, riesgos operatorios mínimos, secuelas postoperatorias mínimas, y aceptación del paciente.101 4.2. Tipos de injertos Se han investigado muchas modalidades de injertos terapéuticos para restaurar los defectos óseos periodontales.39 Los materiales utilizados para injertos se clasifican de acuerdo a la fuente donadora y a la fuente receptora.102 Cuando el material de injerto es obtenido de la misma persona se denomina autoinjerto; si es de un sujeto diferente pero de la misma especie, recibe el nombre de aloinjerto; y si el individuo donador es de una especie distinta, se denomina xenoinjerto o heteroinjerto.39,66,103 También se pueden utilizar injertos sintéticos o inorgánicos denominados materiales aloplásticos.66 Entre las clasificaciones de los injertos óseos disponibles se encuentra la realizada por Narsh et al.,103 en 1999; Tabla Nº.3 Los materiales de injerto óseo suelen valorarse sobre la base de su potencial osteógeno, osteoinductor y osteoconductor. Tomando en cuenta que osteogénesis es la formación o desarrollo de tejido óseo nuevo a cargo de las células contenidas en el injerto; osteoinducción es un mecanismo químico por el cual las moléculas contenidas en el injerto, proteínas morfogenéticas óseas, convierten las células vecinas en osteoblástos, que a su vez, forman tejido óseo; y osteoconducción es un efecto físico por el cual la matriz del injerto forma un andamio que facilita que las células externas penetren en el injerto y formen un nuevo tejido óseo. 39,103 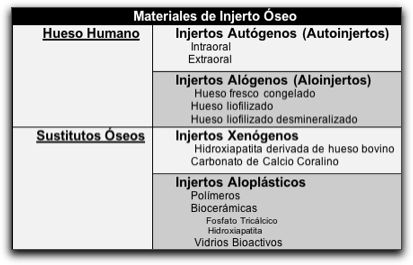
Tabla Nº 3: Materiales de Injerto Óseo. Tomado de Nasr et al. 1999103
Desde hace algún tiempo, se ha demostrado que en los casos con defectos óseos que son tratados con materiales de relleno, se logra una cicatrización del defecto más temprano que en casos en los cuales no se coloca ningún tipo de injerto óseo. 104 La regeneración completa del aparato de inserción periodontal tras los procedimientos de injerto implica que las células derivadas del ligamento poseen la capacidad de formar nuevo cemento con inserción de fibras colágenas sobre la superficie radicular antes afectada por el defecto óseo.105 La morfología de los injertos óseos, parece intervenir en su capacidad osteoconductiva, principalmente debido a la influencia del tamaño de las partículas, la forma de resorción de las mismas y el fenómeno de sustitución; así como la influencia del espacio interparticular, espacio para la filtración de los elementos celulares y vasculares y al formación de hueso. Al parecer las partículas de mayor tamaño se reabsorben a un ritmo más lento y ofrecen una reducción superficial; mientras que las más pequeñas pueden inducir la inflamación, siendo rápidamente reabsorbidas o fagocitadas, y dando lugar a un espacio interparticular muy reducido, lo cual no seria ventajoso para la migración y el crecimiento celular. Esto a pesar de parecer completamente racional, no se ha comprobado científicamente.103 4.2.1. Injertos óseos autógenos o autoinjertos. Los injertos autógenos, también denominados autoinjertos; son injertos transferidos de una posición a otra dentro del mismo individuo. Este tipo de injertos comprende el hueso cortical o el hueso esponjoso y la médula; y los sitios donantes pueden ser intrabucales o extrabucales.39,66 Los autoinjertos pueden conservar algunas células viables, y se consideran, que promueven la cicatrización ósea principalmente a través de la osteogénesis y/o la osteoconducción. Se reabsorben de forma gradual y son reemplazados por hueso nuevo viable; además con este tipo de injerto se eliminan los problemas de compatibilidad y transmisión de enfermedades.66 Entre las zonas intrabucales más comúnmente utilizadas se encuentran: las zonas edéntulas de los maxilares, el área retromolar del maxilar inferior y la tuberosidad del maxilar superior.66 El injerto autógeno extrabucal utilizado con mayor frecuencia es la cresta ilíaca, conformado por médula ósea esponjosa, con alto material osteogénico. 39,66 Dragoo y Sullivan106 en 1973, observaron formación de una nueva inserción con una orientación funcional de las fibras principales del ligamento periodontal y cementogénesis; luego de 12 semanas de un procedimiento quirúrgico endodóntico, donde utilizaron un injerto óseo autógeno de cresta ilíaca antero superior. El hueso esponjoso aumenta las posibilidades de una rápida revascularización del injerto; y además que la médula hematopoyética puede aumentar la inducción ósea debido a su alto contenido de células indiferenciadas. Froum et al.,107 en 1975, observaron que los procedimientos que combinan coágulo óseo y mezcla de hueso, son igualmente efectivos que los autoinjertos ilíacos; ya que obtuvieron los mismos resultados que Dragoo y Sullivan106 en 1973. Es importante mencionar que el coágulo óseo es una técnica que emplea la mezcla de polvo o partículas de hueso, y sangre;107 este método a pesar de presentar muchas ventajas, dificulta su uso en defectos óseos de gran tamaño. La técnica de la mezcla ósea emplea hueso triturado convertido en una masa, que se puede modelar y colocar con mayor facilidad sobre los defectos.39 Diversos estudios indican, que el uso de injertos óseos autógenos favorece la cicatrización de los defectos óseos.106,107,108 Pero la necesidad de una zona donadora, el traumatismo quirúrgico adicional y además la insuficiencia de material de injerto, conduce a la búsqueda de métodos alternativos;109 destacando que debido a la morbilidad asociada con el sitio donante y la frecuente resorción radicular, ya no se emplean injertos de médula de cresta ilíaca en el tratamiento periodontal regenerador. 39,66 4.2.2. Injertos óseos alógenos o aloinjertos. Los aloinjertos se utilizan para estimular la formación de hueso en los defectos óseos, con la finalidad de evitar el daño quirúrgico adicional asociado con el uso de autoinjertos. El empleo de aloinjertos conlleva cierto riesgo de antigenicidad, por lo que, para suprimir las reacciones por cuerpo extraño, y la transmisión de enferemedades; a este tipo de materiales se los suele tratar previamente mediante congelamiento, irradiación o sustancias químicas. 66 Uno de los métodos más comúnmente utilizados para la preparación de los injertos alógenos es la liofilización; definida, como la creación de un preparado estable de alguna sustancia biológica, mediante procedimientos de rápida congelación y deshidratación del producto al vacío.30 El hecho de que el injerto óseo sea congelado y luego secado o deshidratado, reduce marcadamente tanto la respuesta humoral y como la celular, en comparación con las respuestas que ocurren cuando se coloca un injerto óseo fresco. 96 Entre los tipos de aloinjertos empleados se encuentran: el hueso esponjoso y la médula de cresta ilíaca66; el injerto de hueso liofilizado mineralizado, 66,110 también denominado, aloinjerto óseo deshidratado y congelado y no descalcificado;39 y el injerto de hueso liofilizado desmineralizado, 66,110 conocido igualmente como aloinjerto óseo descalcificado, congelado y deshidratado. 39 El injerto de hueso liofilizado mineralizado (FDBA, por sus iniciales en inglés) y el injerto óseo liofilizado desmineralizado (DFDBA, por sus iniciales en inglés) trabajan bajo diferentes mecanismos. El FDBA provoca osteoconducción y andamiaje y suscita a su reabsorción cuando es implantado en tejidos mesenquimatosos. El DFDBA generalmente proporciona osteoinducción; aportando una fuente de factores osteoinductivos. Por lo tanto, promueve la migración de las células mesenquimatosas y la osteogénesis, cuando se implanta en un tejido óseo bien vascularizado. 110 Saad y Abdellatief96 en 1991, fueron los primeros que utilizaron injerto de FDBA en la cirugía endodóntica. Durante el procedimiento quirúrgico, luego de eliminar la lesión periapical y realizar los procedimientos relacionados con la raíz dentaria, se colocó injerto de FDBA en el defecto óseo. La evaluación a largo plazo reveló que la cicatrización se produjo en un período de 6 a 9 meses. La cual aparentemente ocurrió en dos fases: una fase de reabsorción seguida por una de sustitución ósea. Los resultados de este estudio indican que el FDBA es un material biocompatible de potencial osteogénico y puede utilizarse de manera eficaz en el tratamiento de defectos óseos asociados con lesiones periapicales en dientes con fracaso del tratamiento endodóntico. De igual forma, se ha demostrado que el DFDBA es un material de injerto con alto potencial osteogénico, y es superior al FDBA y a los injertos autógenos utilizados con la técnica de coágulo óseo y/o mezcla ósea. La desmineralización de un aloinjerto mejora su potencial osteogénico al exponer las proteínas morfogenéticas del hueso, las cuales posiblemente poseen la capacidad de inducir la diferenciación celular en osteoblastos.111,112 Tseng et al.,47 en 1996, reportan que la aplicación de injerto DFDBA, mezclado con polvo de tetraciclina, en conjunto con una membrana no reabsorbible de e-PTFE , es efectiva en el tratamiento de un caso con lesión endo-periodotal combinada. La decisión acerca de que tipo de aloinjerto utilizar, debe basarse en la condición clínica del defecto óseo; el injerto FDBA posee mejores características físicas, debido a que se encuentra mineralizado. Sin embargo, el FDBA no es osteoinductivo; y el DFDBA si lo es, por lo que este último es más recomendado.39,110-112 Existen controversias en la eficiencia del aloinjerto en la regeneración de defectos óseos. A pesar de que diversos autores consideran beneficioso la aplicación de injertos óseos alógenos para la cicatrización de defectos óseos;96,111,112 otros no encontraron resultados satisfactorios al utilizar este tipo de material de relleno para el tratamiento de lesiones óseas en la cavidad bucal.113 Además el riesgo de transmisión de enfermedades, aunque mínimo, ha despertado dudas acerca de la aplicación clínica de los injertos alógenos.39,66 4.2.3. Injertos óseos heterógenos o xenoinjertos. Los xenoinjertos son injertos compartidos entre diferentes especies. Hay disponibles dos fuentes de xenoinjertos utilizados como material de sustitución ósea en la terapia periodontal regeneradora; el hueso bovino y el coral natural. Ambas fuentes, a través de diferentes técnicas de procesamiento, proporcionan productos que son biocompatibles y estructuralmente similares a los huesos humanos. Los xenoinjertos son osteoconductivos y se encuentran fácilmente disponibles, y aparentemente libres de riesgo de transmisión de enfermedades. 103 Históricamente, los injertos bovinos han fracasado debido al rechazo que ocurre aparentemente, por los materiales detergentes utilizados anteriormente para la extracción química; los cuales dejaban residuos de proteínas, produciendo reacciones adversas, y resultados clínicamente inaceptables. 102 En los últimos años se han utilizado nuevos métodos de procesado y purificación, posibilitando la eliminación de todos los componentes orgánicos de una fuente de hueso bovino y dejando la matriz ósea inorgánica sin generar cambios en ella.66,104 Una posible ventaja de estos productos, es que proporcionan componentes estructurales similares al hueso humano, mejorando la capacidad osteoconductiva en comparación con los materiales obtenidos sintéticamente. 103 El hueso bovino inorgánico es el esqueleto de la hidroxiapatita, que conserva la estructura micro y macroporosa del hueso cortical y esponjoso, que se mantienen luego de la extracción del componente orgánico; bien sea por mecanismos químicos o térmicos. 103 Entre las marcas registradas comercialmente de hueso bovino inorgánico, se encuentran: Bio-Oss®, Endobone®, Laddec®, y Bon-Apatite®, entre otros. 66 Arzti et al.,109 en el 2001, mencionan que el hueso bovino poroso mineralizado (PBBM) en partículas, es un material de injerto biocompatible, coincidiendo en que es osteoconductivo, que permite la formación de nuevo hueso en los diferentes tipos de deficiencias óseas en la cavidad oral. Diversos autores han demostrado que el tratamiento de defectos apicomarginales y/o lesiones endoperiodontales combinadas, con terapias de RTG aplicando injerto óseo bovino inorgánico, aumenta la cantidad de hueso, ligamento periodontal y nuevo cemento radicular formado durante el proceso de cicatrización, posterior al procedimiento quirúrgico; mejorando los resultados a largo plazo.56,85 Sin embargo, Taschieri et al.,114 en el 2007, concluyen que la aplicación de esta terapia de RTG con injerto bovino inorgánico; en el tratamiento de grandes lesiones perirradiculares de origen estrictamente endodóntico; no genera un efecto beneficioso en el resultado del tratamiento. 4.2.4. Materiales aloplásticos Los materiales aloplásticos son sustitutos sintéticos, inorgánicos, biocompatibles y/o bioactivos, de injertos óseos, que promueven la cicatrización mediante la osteoconducción. Entre los tipos de materiales aloplásticos empleados habitualmente en cirugía periodontal regeneradora, se encuentran: la hidroxiapatita (HA), el fosfato tricálcico ? (?-FTC), los polímeros y los vidrios bioactivos.66,103 Además, se han probado otros tipos de materiales entre estos el sulfato cálcico.39 La HA, cuya formula química es Ca10 (PO4)6 (OH)2, es el principal componente mineral del hueso. La HA sintética ha sido comercializada en una variedad de formas, principalmente como una forma porosa no reabsorbible, una densa o sólida no reabsorbible, y una reabsorbible.103 Entre las marcas comerciales de HA utilizadas como relleno óseo se encuentran: Periograft®, Calcitite® y OsteoGraft®, entre otras.66 Beck-Coon et al.,97 en 1991, realizaron un estudio in vivo en monos, donde evaluaron el comportamiento de la HA, en una forma densa y no reabsorbible, la Durapatite®; al ser utilizada como material de injerto en la cirugía endodóntica. Dividieron la muestra en dos grupos; un primer grupo denominado grupo control, donde rellenaron la cavidad ósea sólo con sangre; y un segundo grupo, denominado grupo experimental, donde llenaron la cavidad ósea con cristales de Durapatite®. Evaluaron los resultados, radiográfica e histológicamente, 2 y 6 meses después del procedimiento quirúrgico; sin observar diferencias significativas en la cicatrización ósea de ambos grupos. Los autores concluyeron que como injerto para ser utilizado en los defectos óseos tratados durante la cirugía endodóntica, la Durapatite® es biológicamente inerte, sin embargo; no mejora el proceso de cicatrización. A diferencia del estudio anterior; Tobon et al.,62 en el 2002, observaron que el uso simultáneo de una membrana no reabsorbible, y un injerto de HA sintética reabsorbible y bioactiva, promovió la completa regeneración ósea. Este resultado fue obtenido luego de evaluar ocho casos, clínica, radiográfica e histopatológicamente; doce meses después de realizar una cirugía endodóntica aplicando una terapia de RTG e injerto óseo con los materiales mencionados. El fosfato tricálcico (FTC) es una forma porosa del fosfato de calcio, y la más comúnmente usada es el ?-FTC.103 Este material posee una proporción de calcio-fosfato de 1:5; a nivel mineralógico es una whitlockita.39 Al ser utilizado biológicamente como relleno óseo, es parcialmente reabsorbible y permite ser sustituido por hueso.66 La matriz cerámica del FTC, al ser colocado en estrecha aposición con el hueso vital, sirve como canal para la formación inicial de tejido óseo, que posteriormente es seguida por la reabsorción del material y la formación completa de hueso.103,115 El FTC ha sido utilizado como sustituto de hueso, pero los resultados observados no siempre son previsibles; ya que, a menudo las partículas del FTC son encapsuladas por el tejido conjuntivo, evitando la estimulación del crecimiento óseo.39,66,103 El Sulfato de Calcio (CaS), mencionado anteriormente entre los materiales utilizados como membranas; representa uno de los biomateriales más antiguamente conocidos, y es uno de los primeros sustitutos óseos utilizados en la ortopedia y en la odontología. Entre las indicaciones para la aplicación del CaS se encuentran: los defectos periodontales, la cirugía endodóntica, el levantamiento del seno maxilar, el tratamiento de las fenestraciones y las deshicencias, y como una membrana o barrera.116 Existen discrepancias acerca del efecto del injerto de CaS, sobre la regeneración en defectos óseos perirradiculares. Varios investigadores coinciden en que el uso del CaS como injerto óseo, es efectivo en la regeneración de grandes defectos óseos, que involucran o no ambas corticales; mejorando los resultados clínicos.29,61,116 Sin embargo, no demuestra ser muy efectivo en la regeneración ósea de defectos apicomarginales. 61,117 5. APLICACIÓN CLÍNICA DE LA REGENERACIÓN TISULAR GUIADA E INJERTO DE TEJIDO ÓSEO EN LA CIRUGÍA ENDODÓNTICA Los objetivos de la aplicación de la RTG en endodoncia se asemejan a los de la periodoncia, cirugía e implantología: (1) facilitar la regeneración de los tejidos mediante la creación de un entorno óptimo, con la protección de la herida; y (2) excluir la rápida proliferación de células que interfieran con la regeneración de los tejidos deseados.15 Los siguientes argumentos deben tomarse en cuenta antes de la aplicación de los principios de RTG en endodoncia:15
Uno de los objetivos de la RTG en la cirugía endodóntica, es mejorar la calidad y aumentar la cantidad de regeneración ósea en la región periapical, acelerando el crecimiento de hueso en los defectos óseos presentes luego de la cirugía endodóntica.35 El fracaso del procedimiento quirúrgico puede ser causado por el crecimiento de tejido no osteogénico en el defecto apical y el crecimiento de epitelio a lo largo de una dehiscencia. En estas situaciones, el principio de la RTG puede utilizarse para crear un entorno más favorable para la cicatrización del órgano periodontal. 14 5.1. Indicaciones para la aplicación de RTG en la cirugía endodóntica. Diversos autores mencionan los casos o las condiciones clínicas en las cuales se debe aplicar una terapia de RTG en la cirugía endodóntica.14-16, 35,70 La mayoría de los investigadores coinciden con estas condiciones clínicas. Rankow y Krasner14 en 1996, enumeran las condiciones clínicas para la aplicación de la RTG, considerándose ésta, una de las primeras y más adecuada categorización. Los autores la enuncian de la siguiente manera: A.Lesión apical sin comunicación con la cresta alveolar. B.Lesión apical con comunicación de la cresta alveolar: 1.Dehiscencia, vestibular o palatina. 2.Pérdida ósea interproximal. 3.Presencia de surcos de desarrollo. C.Pérdida del hueso de la furcación radicular causado por una perforación: 1.Perforación de la furcación sin comunicación de la cresta alveolar 2.Perforación de la furcación con comunicación de la cresta alveolar 3.Perforación radicular con pérdida ósea que se extiende hasta la cresta alveolar. D.Resorción radicular cervical. E.Fractura radicular oblicua. F.Aumento de la cresta ósea, junto con resección radicular o extracción dentaria. Gagnon y Morand70 en 1999, coinciden con Rankow y Krasner14 en las categorías A, B y C; y mencionan otras condiciones clínicas que deben considerarse al emplear procedimientos de RTG en la cirugía endodóntica; estas son: una lesión apical en comunicación con el seno maxilar o con el piso de las fosas nasales y una lesión apical que involucre ambas corticales óseas. Los autores ilustran en su publicación cuatro de las indicaciones que mencionan en su artículo. Gráfico Nº 13 
Gráfico Nº 13: Lesiones que requieren de RTG en la cirugía endodóntica. 1: dehiscencia, 2: patología apical en comunicación con el seno maxilar, 3: patología apical en comunicación con las fosas nasales, 4: lesión apical de gran tamaño. Gagnon y Morand. 1999.70 En el 2001, von Arx y Cochran15; realizan una publicación donde expresan las razones por las cuales se deben aplicar los principios de RTG en la cirugía endodóntica; proponiendo una clasificación basada en la típica lesión perirradicular, que se distingue según su localización, extensión y vías de infección; además explican cual es el objetivo del empleo de la RTG en cada categoría de esta clasificación. Grafico Nº 14 Según von Arx y Cochran15, en el 2001; los objetivos de la aplicación de la RTG en las diferentes lesiones son los siguientes:
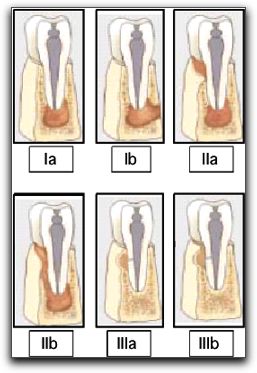
Grafico Nº 14: Clasificación de la aplicación de RTG en la cirugía endodóntica. Ia: defecto óseo confinado a la región periapical, Ib: defecto óseo apical con erosión de la tabla palatina o lingual, IIa: lesión periapical y marginal simultáneas pero sin comunicación, IIb: lesión periapical y marginal simultáneas y comunicadas, IIIa: lesión perirradicular lateral, IIIb: lesión perirradicular lateral en comunicación con lesión marginal. Tomado de von Arx y Cochran. 2001. 5.2. Pronóstico y expectativas de resultado de la aplicación de RTG y/o injerto óseo en la cirugía endodóntica. Se ha demostrado que luego de realizar un procedimiento quirúrgico endodóntico en casos donde hay presencia de una lesión apical de gran tamaño, o en casos donde el defecto óseo apical involucra una o ambas corticales óseas, puede ocurrir la formación de una cicatriz ósea durante el proceso de cicatrización. 4,6,31,35,54,55 Es importante entonces, la aplicación de las terapias de RTG con injerto óseo en el tratamiento de estas condiciones, para evitar la formación de una cicatriz apical; y a su vez prevenir situaciones en las que el clínico, vuelva a realizar un procedimiento quirúrgico innecesario, para tratar una infección aparente en el tejido óseo apical, que no es más que una cicatriz,15 conformada por tejido conjuntivo fibroso.6 En 1996, Rankow y Krasner14 trataron con cirugía endodóntica, seis casos, obteniendo excelentes resultados en la regeneración del órgano periodontal y del soporte óseo perdido. Aplicaron diferentes tipos de membranas y rellenos óseos en casos de: resorción radicular cervical, perforación radicular, dehiscencia, surco de desarrollo, fractura radicular oblicua y colocaron una barrera sin relleno óseo en el caso de una lesión apical pequeña. Estos autores consideran que los principios de RTG y sus procedimientos, pueden ser adaptados para utilizarse en la cirugía endodóntica, con la finalidad de obtener éxito en los casos que anteriormente presentaban un mal pronóstico. Variadas publicaciones han reportado el beneficio de la aplicación de la RTG, en la cicatrización de lesiones apicales con más de 5mm de diámetro, especialmente en aquellos defectos que involucran ambas corticales óseas; obteniéndose resultados más predecibles y satisfactorios.29,59,60-62 También se han reportado resultados que contradicen lo anteriormente expuesto.114 Baek et al.,59 en el 2001, realizaron un estudio en mamíferos con la finalidad de evaluar la regeneración ósea, al utilizar diferentes barreras, en defectos que involucran ambas corticales óseas. Dividieron la muestra en 4 grupos; en el grupo 1, no colocaron ningún material para cubrir los defectos óseos, siendo este el grupo control; en el grupo 2, utilizaron una membrana no reabsorbible de e-PTFE, Gore-Tex®; en el grupo 3, utilizaron una membrana reabsorbible de ácido poliláctico, Guidor® y en el grupo 4, utilizaron una membrana reabsorbible de copolímero y ácido láctico, Vicryl®. Se evaluaron los resultados radiográfica e histológicamente a las 6 y a las 12 semanas después del procedimiento. El grupo control no mostró ninguna regeneración ósea. De los otros 3 grupos, el grupo 4 fue el que mostró la mayor cantidad de regeneración ósea; el defecto se llenó casi completamente con hueso laminar, y la respuesta inflamatoria producida por la resorción de la membrana fue muy leve. Los resultados de este estudio sugieren que la colocación de barreras en defectos que involucran ambas corticales, generalmente mejora la regeneración ósea, optimizando los resultados obtenidos en estas condiciones clínicas. Se considera que la aplicación de estas técnicas de RTG, en lesiones o defectos óseos pequeñas, confinadas al área apical, no refleja un beneficio significativo en el proceso cicatrizacional, si no más bien un gasto adicional para el paciente, en este caso no necesario. 88, 117 La aplicación de terapias con barreras en defectos apicomarginales, probablemente sea la más difícil en la cirugía endodóntica. A menudo la verdadera magnitud de la pérdida ósea de las lesiones endo-periodontales combinadas sólo se determina luego de realizar el levantamiento del colgajo durante el procedimiento quirúrgico; por lo tanto el clínico debe planificar cuidadosamente la cirugía y prepararse para el tratamiento de un defecto óseo de gran tamaño.15 Dietrich et al.,16 en el 2002; examinan la etiología, patogenia y morfología de los defectos apicomarginales encontrados al realizar una cirugía perirradicular en 24 pacientes tratados consecutivamente. Sobre la base de estas observaciones y las consideraciones teóricas, los autores desarrollan un sistema de clasificación de los defectos apicomarginales; analizando los criterios para el diagnóstico diferencial y las implicaciones terapéuticas. Esto con la finalidad de que el clínico logre un correcto diagnóstico de la lesión antes de efectuar el procedimiento quirúrgico; y de esta manera realizar una planificación del plan de tratamiento ideal, para el manejo adecuado de cada caso, y además evitar hacer modificaciones en el presupuesto inicial ofrecido al paciente. El empleo de diferentes tipos de membranas como barrera, con o sin la colocación de un material de relleno en el defecto óseo, ha mostrado ser beneficioso en el tratamiento de lesiones apicomarginales, durante el procedimiento quirúrgico endodóntico; principalmente en términos de cicatrización periapical, ganancia del soporte periodontal, reducción de la profundidad de los sacos y disminución de la recesión gingival.36,46,62,64,65 De igual forma, el uso de terapias de RTG en dientes que presentan dehiscencia, incrementa el porcentaje de éxito en los resultados del tratamiento, aumentando la retención y soporte del diente, el cual forma parte de la dentición natural del individuo.63,119 Marín-Botero et al.,64 en el 2006, realizaron un estudio para comparar la respuesta cicatrizacional al emplear dos técnicas de RTG en la cirugía perirradicular. Utilizaron una muestra de 30 pacientes con lesiones apicomarginales; la muestra fue dividida equitativamente en dos grupos: en uno utilizaron injerto óseo de periostio, y en el otro emplearon una membrana biorreabsorbible. Evaluaron los resultados cada 3 meses después de la cirugía y hasta cumplir 12 meses. No hubo diferencias relevantes en los resultados observados en cada grupo. Ambos mostraron una reducción significativa en la profundidad de los sacos periodontales, y en el tamaño de la lesión periapical. Los autores concluyen que con la aplicación de un injerto de periostio o con la colocación de una barrera reabsorbible, mejoran los resultados clínicos de la cirugía perirradicular; en los casos de defectos óseos apico-marginales. El diagnóstico y la posterior remoción de los factores etiológicos, junto con la aplicación de la RTG, combinada o no con técnicas de injertos óseos; puede restablecer la función de un diente con pérdida del soporte óseo a causa de una lesión endo-periodontal combinada.73,85 Las perforaciones radiculares iatrogénicas, originan una comunicación entre el sistema de conductos radiculares y los tejidos periodontales adyacentes; causando a menudo una lesión endo-periodontal combinada.57 Se ha demostrado que el manejo quirúrgico de las perforaciones a nivel de las furcaciones radiculares, con la colocación de una membrana, que funciona como matriz interna; produce mejores resultados en el proceso de cicatrización del tejido óseo; además la respuesta inflamatoria inicial es menos severa cuando se coloca la barrera y el material sellador, que cuando se coloca el material sellador sólo. 119 Se ha recomendado el empleo una membrana como matriz en conjunto con un material de relleno óseo, en los casos donde la lesión ósea, producto de la perforación, es de gran tamaño. El injerto óseo, se coloca con la finalidad de prevenir que la barrera colapse dentro del defecto; además dependiendo del material utilizado, puede tener un efecto osteoinductor u osteoconductor.120
III. DISCUSION La RTG es un proceso empleado para regenerar el aparato de soporte perdido o lesionado,35 formando parte del tratamiento actual para los defectos óseos periodontales.67,68 Esta técnica se basa en la hipótesis de que sólo las células del ligamento periodontal, poseen el potencial de regenerar el aparato de inserción del diente.41 En presencia de un defecto óseo, el mecanismo de cicatrización se lleva a cabo con las células óseas en competencia con las células del tejido conjuntivo, para colonizar y llenar el área del defecto.54 El principio biológico de la RTG; consiste en evitar la proliferación del tejido conjuntivo gingival y del epitelio dentogingival durante la cicatrización, dando preferencia a la proliferación de las células del ligamento periodontal.14,39,40,59,69 Esto se logra con la colocación de una barrera física, que cubre el hueso y el ligamento radicular, separandolos, temporalmente del epitelio gingival.14,39,66 La presencia de un obstáculo mecánico para la proliferación del tejido conjuntivo dentro del defecto, puede ser de gran importancia para la cicatrización ósea sin dificultades.54 La barrera física que se emplea en los procedimientos de RTG debe cumplir con ciertas características para lograr la obtención de resultados más predecibles. El material utilizado debe: ser biocompatible, evitar el paso de tipos celulares indeseables, permitir el paso de gases y nutrientes; facilitar la adhesión celular y promover la migración de las células progenitoras, lograr una integración celular, tener una consistencia óptima y poseer un diseño que se adapte a las necesidades de cada condición a tratar.46, 66,72 Probablemente la regeneración del tejido óseo puede estar influenciada por la naturaleza de la barrera o el tipo de membrana utilizada durante los procedimientos de RTG.73 Es por esto que constantemente los investigadores se encuentran buscando el material que reúna las mejores características para ser utilizado como barrera. Se han empleado diversos tipos de membranas, pero estas pueden ser clasificadas en dos grandes grupos para su estudio, membranas no reabsorbibles y membranas reabsorbibles. Las primeras membranas creadas fueron las no reabsorbibles, estas necesitan una segunda intervención para ser retiradas, la cual se realiza 3 a 6 semanas luego de la cirugía inicial.39 El primer tipo de membrana no reabsorbible comercialmente disponible fue la de ePTFE, diseñada específicamente para la regeneración periodontal. 70 Salata et al.,74 recomiendan que si se debe elegir una membrana no reabsorbible para realizar procesos de regeneración, esta sea la de e-PTFE ya que, proporciona resultados más predecibles que las de álcali-celulosa. Diversos autores han reportado un resultado exitoso al emplear técnicas de RTG, utilizando barreras de e-PTFE con o sin la colocación adicional de un injerto óseo.47,62,71,74 Además, recientemente se ha estudiado la alternativa de utilizar una membrana de d-PTFE, para reconstruir defectos óseos de gran tamaño entre otras aplicaciones.76 Las membranas de e-PTFE han sido comparadas con las membranas reabsorbibles, y hasta los momentos existen discrepancias acerca de cual proporciona mejores resultados. Sin embargo, la idea de que las membranas reabsorbibles proveen más ventajas que las membranas de e-PTFE, se encuentra más apoyada actualmente.59,75 Las membranas reabsorbibles o biorreabsorbibles se consideran de segunda generación y no requieren de una segunda intervención para ser retiradas.88 Entre los diferentes tipos de materiales reabsorbibles evaluados y aplicados como barreras en los procedimientos de RTG se encuentran membranas de: periostio, colágeno, sulfato de calcio, hidroxiapatita, y algunos polímeros como el ácido poliláctico, y el ácido poligláctico. De las membranas reabsorbibles, las barreras de colágeno representan una excelente opción; y han demostrado buenos resultados al ser empleadas en el tratamiento quirúrgico de lesiones endo-periodontales combinadas o de defectos apicomariginales.56,85 Además se ha demostrado que el colágeno tipo I puede promover una rápida regeneración de los defectos óseo, acelerando el proceso de cicatrización.82-84 Gran cantidad de variables pueden influir en el resultado del tratamiento con la RTG. A pesar de haber, diversidad de opiniones entre los investigadores; la mayoría de los autores coinciden, en que el hábito del cigarrillo es uno de los factores que influye negativamente sobre el proceso de cicatrización de los tejidos y de las terapias con la RTG.75,90-94 Otras variables como la exposición de la membrana al medio bucal,59,68,91 y la acumulación de placa bacteriana sobre la zona tratada, también influyen de forma negativa en los tratamientos con la RTG.91 La aplicación de los principios de la RTG, para lograr la cicatrización de defectos óseos, se denomina ROG; y en algunos casos implica el empleo de un material de relleno óseo. El material de injerto óseo ideal debe ser biocompatible y esterilizable, permitir la revascularización del tejido óseo y la reabsorción del material sin interferir en el proceso de cicatrización.86,97 Se han investigado muchas modalidades de injertos terapéuticos para restaurar los defectos óseos periodontales. Los materiales utilizados como relleno óseo se pueden clasificar en 4 grandes grupos: (1) injertos autógenos, (2) injertos alógenos, (3) injertos xenógenos, e (4) injertos alopláticos. 103 Los materiales de injerto óseo suelen valorarse según su capacidad osteogénica, osteoinductora y osteoconductora. Los injertos autógenos promueven la cicatrización ósea principalmente a través de la osteogénesis y/o la osteoconducción. 66 Se ha demostrado que el empleo de injertos óseos autógenos favorece a la cicatrización de los defectos óseos.106,107,108 Sin embargo, presentan varias desventajas, y actualmente no son empleados con mucha frecuencia. Los injertos óseos alógenos mejoran algunas de las desventajas de los injertos autógenos. Siendo el DFDBA el que proporciona mejores resultados y por lo tanto el más recomendado.39,110-112 Uno de los xenoijnertos más empleados es el hueso bovino inorgánico y se ha demostrado que resulta beneficioso en el proceso de cicatrización al ser utilizado en terapias de RTG, durante el tratamiento quirúrgico de lesiones apicomarginales.56,85 Entre los materiales aloplásticos el FTC es el considerado menos efectivo; ya que a menudo las partículas de FTC son encapsuladas por el tejido conjuntivo, evitando la estimulación del crecimiento óseo. 39,66,103 El injerto óseo; se utiliza principalmente con la finalidad de prevenir que la barrera colapse dentro del defecto óseo; además dependiendo del material utilizado, puede tener un efecto osteoinductor u osteoconductor. 120 Los procedimientos de RTG y el empleo de los injertos óseos, han demostrado ser exitoso al emplearse durante la cirugía endodóntica. Uno de los objetivos de la RTG en la cirugía endodóntica es mejorar la calidad y aumentar la cantidad de regeneración ósea en la región periapical, acelerando el crecimiento de hueso en los defectos óseos remanentes luego de la cirugía endodóntica.35 Las indicaciones de la aplicación de RTG en la cirugía endodótica varían ligeramente dependiendo del criterio de los autores; pero la mayoría coincide en las siguientes condiciones clínicas: (1):lesiones apicales con un diámetro mayor a 5mm; (2):lesiones apicales que involucran ambas corticales óseas; (3):lesiones apicales en comunicación con la cresta alveolar; (4):lesiones apicales en comunicación con las fosas nasales o el seno maxilar; y (5): perforaciones radiculares con defectos en el tejido óseo adyacente.14-16, 35,70 Numerosos y variados estudios han reportado el beneficio de la aplicación de la RTG, en la cirugía endodóntica, durante el tratamiento de las condiciones clínicas mencionadas anteriormente como indicaciones.29,36,46,59,60-65,118 Y pocos autores han observado resultados menos favorables.114 Sin embargo, se considera que la aplicación de estas técnicas de RTG, en lesiones o defectos óseos pequeños, confinados al área apical, no reflejan un beneficio significativo en el proceso cicatrizacional, si no más bien un gasto adicional para el paciente, en este caso no necesario. 88, 117 IV.- CONCLUSIONES 1. La regeneración tisular guiada es un procedimiento empleado para lograr la completa regeneración del aparato de soporte perdido, evitando, con la colocación de una barrera física, la proliferación temprana del tejido conjuntivo gingival y del epitelio dentogingival durante la cicatrización, dando preferencia a la proliferación de las células del ligamento periodontal. 2. El material de relleno óseo, se utiliza principalmente para prevenir que la barrera colapse dentro del defecto óseo y además puede tener propiedades de osteogénesis, osteoinductoras u osteoconductoras; dependiendo del tipo de injerto óseo que se emplee. 3. El objetivo de la aplicación de la regeneración tisular guiada en la cirugía endodóntica es mejorar la calidad y aumentar la cantidad de regeneración ósea en la región perirradicular, acelerando el crecimiento de hueso en los defectos óseos remanentes, luego del procedimiento quirúrgico. 4. Se ha demostrado que al emplear los procedimientos de regeneración tisular guiada y de injerto óseo durante la cirugía endodóntica; se mejora la cicatrización de los tejidos perirradiculares, obteniéndose una mayor cantidad de regeneración ósea, con la formación de tejido óseo laminar. 5. Las principales indicaciones para la aplicación de la regeneración tisular guiada en la cirugía endodóntica son: lesiones apicales con más de 5 mm de diámetro, lesiones apicales que involucran ambas corticales óseas, lesiones apicales en comunicación con la cresta alveolar, lesiones apicales en comunicación con las fosas nasales o el seno maxilar, y perforaciones radiculares con defectos en el tejido óseo adyacente. 6. El empleo de los principios de regeneración tisular guiada, ha mostrado ser beneficioso en el tratamiento quirúrgico de lesiones apicomarginales; principalmente en términos de cicatrización periapical, ganancia de soporte periodontal, reducción de la profundidad de los sacos y disminución de la recesión gingival; aumentando la retención y el soporte del diente afectado. 7. No está indicado el empleo de membranas y/o injertos óseos, en casos de defectos óseos apicales con cuatro paredes, y que se encuentren confinados al área apical; ya que no refleja un beneficio significativo en el proceso de cicatrización del tejido de soporte. V. REFERENCIAS
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

