|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópic71.-o en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
" Aspectos relevantes de Enterococcus Faecalis y su participación en las infecciones de origen endodóntico " por Alejandra Carolina Díaz Odontólogo. Universidad Santa María. 2002 Especialista en Endodoncia. Universidad Central de Venezuela 2008 e-mail:alediaz50@hotmail.com
Resumen: Las bacterias y sus productos participan de manera importante en el desarrollo de las lesiones perirradiculares. Saber como estos microorganismos son capaces de sobrevivir dentro del sistema de conductos radiculares es una premisa fundamental para lograr la completa erradicación de los mismos y así el éxito de la terapia endodóntica. Enterococcus Faecalis ha sido el microorganismo mayormente aislado de las lesiones periradiculares persistentes. Gracias a la presencia de factores de virulencia como la sustancia de agregación y las proteínas de superficie entre otros, así como también por la capacidad de formación de biopelículas, éste microorganismo puede penetrar profundamente en el interior de los túbulos dentinarios, adherirse al colágeno de las paredes de dentina radicular y así sobrevivir a los protocolos de irrigación y de medicación intraconducto utilizados en la terapia endodóntica. Actualmente se está empleando el uso de irradiación con laser para la desinfección del sistema de conductos radiculares.
Introducción: La literatura endodóntica ha establecido claramente la participación de los microorganismos y sus productos en el desarrollo de la periodontitis apical. La periodontitis apical persistente se origina cuando la terapia endodóntica per se no elimina adecuadamente la infección intrarradicular. Actualmente, la ciencia de la microbiología bucal está atravesando un período de cambios, donde se deja atrás la era de cultivos bacterianos para adentrrse en la nueva era de métodos y técnicas genéticas moleculares, mediante la cuales se han podido detectar e identificar numerosas especies de microorganismos que no son cultivables y que tienen una parte fundamental en el desarrollo de las infecciones endodónticas, bien sea primarias o persistentes. Tal es el caso de Enterococcus Faecalis, microorganismo preponderante en las infecciones endodónticas persistentes, el cual gracias a sus características fenotipicas y microbiológicas particulares es capaz desobrevivir en medios ambientes áridos con poca cantidad de oxígeno y nutrientes, así como también es capaz de formar biopelículas entre microorganismos de su misma especie o con otros microorganismos y de sobrevivir frente a protocolos de irrigación, medicaciones intraconducto y materiales de obturación. Por todas estas características presentes en Enterococcus faecalis y por la necesidad de cumplir con el objetivo biológico principal de la terapia endodóntica, es decir, la eliminación de la infección o la prevención de la misma, es importante conocer la acción de cada medicamento intraconducto, irrigante o material de obturación sobre este microorganismo. El objetivo de este trabajo especial de grado es analizar los aspectos relevantes de Enterococcus faecalis, sus características microbiológicas, sus factores de virulencia y su capacidad de formación de biopelículas, así como también su participación en las nfecciones de origen endodóntico y su control durante la terapia endodóntica.
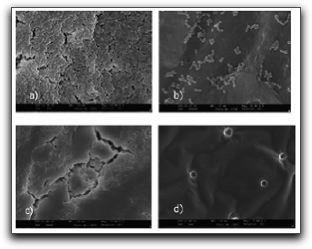
1. Características generales de los Enterococos Los enterococos son microorganismos que forman parte de la flora normal en la cavidad bucal y el tracto gastrointestinal y han sido reconocidos como potenciales patógenos humanos causando el 12% de las infecciones nosocomiales, entre éstas se incluyen las infecciones del tracto urinario, infecciones intra-abdominales y endocarditis infecciosa.(1,2) Su naturaleza le permite crecer y sobrevivir en medios ambientes áridos; de esta manera lo podemos encontrar en el suelo, la comida, el agua, las plantas y los animales como pájaros e insectos. (3) Hasta mediados de 1980, los enterococos no eran considerados como un género bacteriano separado, a pesar de sus características particulares que lo diferenciaban de los estreptococos. Características como su teñido, forma y disposición celular, así como la ausencia de catalasa, lo ubicaban dentro del Género Streptococcus. Con la clasificación serológica de Lancefield y el descubrimiento del antígeno del grupo D, los enterococos fueron clasificados como estreptococos del grupo D tolerante a la sal. Sin embargo, el antígeno del grupo D es un ácido lipoteicoico, uno de los componentes que se encuentra en casi todas las bacterias Gram positivas, y difiere del antígeno de los carbohidratos de la pared celular de los otros estreptococos.(1) Fue en 1984 cuando los enterococos obtuvieron un género formal luego de estudios de hibridización ADN-ADN o ADN-ARN demostrando mayores diferencias en comparación con los estreptococos; en ese momento se introdujeron dos nuevos Géneros: Enterococcus y Lactococcus.(1) Para que los enterococos puedan actuar como patógenos primero deben adherirse a los tejidos del hospedero; éstos pueden hacerlo a través de ligandos adhesivos específicos a la matriz extracelular de los mismos. Durante el proceso de invasión a los tejidos, los enterococos deben encontrarse en un medio ambiente con potenciales de óxido reducción elevados, nutrientes esenciales limitados, leucocitos fagocíticos y otras defensas del hospedero. Todos estos factores ayudan a que se expresen genes que favorecen el crecimiento del microorganismo. (4) Los enterococos poseen habilidades únicas y potenciales de intercambiar material genético entre ellos mismos y con otros microorganismos. Existen al menos tres sistemas de conjugación a través de los cuales los enterococos pueden transferir naturalmente elementos genéticos. El primero, la presencia de plásmidos que poseen información genética para la receptividad de las feromonas únicamente descritos para los enterococos. Segundo, una variedad de plásmidos que fácilmente son transferidos a baja frecuencia entre enterococos, especies de Streptococcus, Staphylococcus aureus, especies de Lactobacillus entre otras; y tercero, el intercambio genético conjugativo que ocurre entre factores que se encuentran en la membrana de numerosas bacterias Gram negativas y Gram positivas. (4) Existen 23 especies pertenecientes al Genero Enterococcus y éstas a su vez se dividen en 5 grupos basados en su interacción con el manitol, el sorbitol y la arginina. Enterococcus faecalis pertenece al mismo grupo del Enterococcus faecium, Enterococcus casseliflavus, Enterococcus mundtii y Enterococcus gallinarum. E. faecalis responde negativamente a la arabinosa y excepto por algunas variantes atípicas, es el único miembro del grupo que utiliza el piruvato y tolera el telurito. (5) Por su parte, E. faecalis ha sido el microorganismo patógeno más asociado a las infecciones endodónticas persistentes, siendo aislado frecuentemente de la flora microbiana mixta o de monocultivos. Probablemente este microorganismo es el que mejor se adapta y tolera las condiciones ecológicas existentes en los conductos radiculares obturados, gracias a ciertas características microbiológicas como sus factores devirulencia y su capacidad de formar biopelículas. Por ello, es importante profundizar en dichas características microbiológicas y entender cuál es el papel que desempeña cada una de ellas en el desarrollo, crecimiento y supervivencia del mismo dentro del sistema de conductos radiculares (SCR). 1.1 Características microbiológicas de Enterococcus faecalis E. faecalis es un coco Gram positivo que puede aparecer solo, en pares o en cadenas; éstas células pueden aparecer como coco-bacilos cuando se realiza la tinción de Gram en muestras provenientes de placas de Agar o pueden aparecer ovales o en cadenas cuando se realiza la tinción de Gram en muestras provenientes de caldo de tioglicolato. Éste es un microorganismo anaerobio facultativo y su crecimiento óptimo ocurre a 35°C; sin embargo, también se ha observado crecimiento entre 10 y 45°C. Todas las cepas pueden crecer en caldos que contengan cloruro de sodio al 6,5% y esculina hidrolizada en presencia de sales biliares al 40% (medio de bilis-esculina). Casi todas las cepas de este microorganismo son homofermentativas, no producen gas, no contienen enzimas citocrómicas y el ácido láctico resulta el producto final de la fermentación de la glucosa. (1,3) Por su parte, E. faecalis posee una pared celular con antígenos del grupo D, el cual es un ácido lipoteicoico glicerol intracelular asociado con la membrana citoplasmática. La pared celular está constituída por una gran cantidad de peptidoglicanos y ácido teicoico. (1) Una característica importante de E. faecalis es su habilidad de crecer en medios con pH ácido y alcalino, donde este último normalmente inhibe el crecimiento y supervivencia de muchos otros microorganismos. Con relación a esto, McHugh et al (6) evaluaron el pH necesario para inhibir su crecimiento y el experimento in vitro demostró que se necesita un pH mayor de 11,0 para la erradicación de este microorganismo. Estos autores refieren que el hidróxido de calcio como medicación intraconducto puede alcanzar un pH crítico dentro del SCR. Sin embargo, la ubicación de este microorganismo dentro de los túbulos dentinarios es incierta. Aparentemente, el pH crítico mayor de 11,0, también conocido como umbral de erradicación no se logra en la dentina luego de la aplicación del hidróxido de calcio. Esto hace suponer que E. faecalis puede persistir en los túbulos dentinarios y quizás volver a infectar el conducto radicular. (6) Nakajo et al (7), en este mismo sentido, evaluaron las propiedades bioquímicas de E. faecalis que le confieren la resistencia ácido-alcalina, comparándola con la de Streptococcus mutans. E. faecalis mostró una ácido-resistencia similar a S. mutans y una mayor alcalino-resistencia. Estos autores sugieren que la resistencia al pH de E. faecalis se puede atribuir a la resistencia de la membrana citoplasmática frente a medios ácidos o alcalinos junto con el sistema de transporte de protones vinculado al ATP. Junto con la propiedad de sobrevivir a medios ambientes con pH ácidos o alcalinos, E. faecalis ha demostrado también ser capaz de formar comunidades microbianas adheridas a superficies o "biopelículas" Las biopelículas pueden ser definidas como comunidades de microorganismos adheridas a una superficie y embebidas en una matriz de polisacáridos y proteínas formando una capa viscosa. La matriz representa generalmente el 85% del volumen de la biopelícula. (1) En relación a esto, se han realizado numerosas investigaciones donde se afirma la capacidad de E. faecalis de formar biopelículas y así poder sobrevivir a ciertas medicaciones intraconducto y a diversos protocolos de irrigación. Uno de ellos es el trabajo realizado por George et al (8), quienes evaluaron la influencia de distintas condiciones ambientales y nutricionales en las características de las biopelículas formadas por E. faecalis en el SCR y su penetración dentro de los túbulos dentinarios. Las condiciones ambientales estudiadas fueron medios ambientes aerobios y anaerobios ricos y pobres en nutrientes. Bajo el microscopio electrónico de barrido se pudo evidenciar la formación de distintos tipos de biopelículas dependiendo del tipo de medio ambiente y nutrición. Cuando E. faecalis creció en un medio ambiente aeróbico y rico en nutrientes, se pudo observar formación de biopelículas y penetración profunda de los microorganismos dentro de los túbulos dentinarios. Cuando creció bajo condiciones anaeróbicas y ricas en nutrientes, se pudo observar la formación de una biopelícula con forma característica de "hongo", con canales de fluidos a su alrededor. (8) (Gráfico 1) Por el contrario, cuando las condiciones fueron aeróbicas pero con bajo nivel de nutrientes, no hubo formación de biopelícula en forma de hongos, sino que se pudieron evidenciar crecimientos discontinuos de grupos celulares adheridos. En este grupo experimental no se observó ninguna bacteria dentro de los túbulos dentinarios, lo que resultaba en una morfología dentinaria superficial irregular. En el grupo donde las condiciones eran anaeróbicas, sí se pudo observar la formación de biopelículas con células bacterianas adheridas a la superficie de la pared dentinaria del conducto radicular. (8) En general, los investigadores señalan que la población bacteriana observada fue mayor cuando las condiciones ambientales eran ricas en nutrientes, que cuando eran escasos, por lo que se puede afirmar que el desarrollo y modificación de las biopelículas formadas por E. faecalis en el conducto radicular y su penetración dentro de los túbulos dentinarios se ve modulada por las condiciones ambientales prevalentes. (8) Contrario a los resultados de la investigación descrita anteriormente, Duggan y Sedgley (9) evaluaron cuantitativamente la formación de biopelículas por parte de cepas aisladas de E. faecalis, provenientes de conductos radiculares y de la cavidad oral. Sus resultados señalan que no existe diferencia significativa entre la habilidad de E. faecalis de formar biopelículas y la fuente de aislamiento, así como también pudieron concluir que las cepas aisladas del microorganismo provenientes de la cavidad oral y conductos radiculares poseen una baja capacidad inherente de formar biopelículas, comparadas con cepas aisladas del mismo en enfermedades como la endocarditis infecciosa. Al conocerse la capacidad de E. faecalis de formar biopelículas dentro del SCR, muchos investigadores se vieron en la necesidad de evaluar el efecto antimicrobiano de ciertas soluciones irrigantes, quelantes, medicaciones intraconducto e incluso antibióticos sobre estas biopelículas. Así lo demuestran Giardino et al (10) quienes compararon el efecto antimicrobiano del hipoclorito de sodio al 5,25%, Biopure MTAD® y Tetraclean® sobre biopelículas formadas por E. faecalis generadas en filtros de membranas de nitrato celuloso. Los tiempos de evaluación fueron a los 5, 30 y 60 minutos. Contrario a los resultados de la investigación descrita anteriormente, Duggan y Sedgley (9) evaluaron cuantitativamente la formación de biopelículas por parte de cepas aisladas de E. faecalis, provenientes de conductos radiculares y de la cavidad oral. Sus resultados señalan que no existe diferencia significativa entre la habilidad de E. faecalis de formar biopelículas y la fuente de aislamiento, así como también pudieron concluir que las cepas aisladas del microorganismo provenientes de la cavidad oral y conductos radiculares poseen una baja capacidad inherente de formar biopelículas, comparadas con cepas aisladas del mismo en enfermedades como la endocarditis infecciosa. Al conocerse la capacidad de E. faecalis de formar biopelículas dentro del SCR, muchos investigadores se vieron en la necesidad de evaluar el efecto antimicrobiano de ciertas soluciones irrigantes, quelantes, medicaciones intraconducto e incluso antibióticos sobre estas biopelículas. Así lo demuestran Giardino et al (10) quienes compararon el efecto antimicrobiano del hipoclorito de sodio al 5,25%, Biopure MTAD® y Tetraclean® sobre biopelículas formadas por E. faecalis generadas en filtros de membranas de nitrato celuloso. Los tiempos de evaluación fueron a los 5, 30 y 60 minutos. Los resultados señalan que el hipoclorito de sodio al 5,25% fue el único irrigante probado capaz de remover la biopelícula luego de 5 minutos de exposición, mientras que el Tetraclean® lo hizo a los 60 minutos. El MTAD Biopure® no pudo remover la biopelícula en ninguno de los tiempos evaluados.(10) (Gráfico 2) Estos autores afirman que el Tetraclean® mostró mejor acción antibacteriana comparado con el Biopure MTAD®, pero el objetivo de la remoción total de la biopelícula se consiguió sólo luego de 30 o 60 minutos de irrigación, lo cual es considerado un tiempo prolongado durante la terapia endodóntica.(10)
Por su parte, Dunavant et al (11) compararon la eficacia del hipoclorito de sodio al 1 y 6%, Biopure MTAD®, clorhexidina al 2%, REDTA® y Smearclear® sobre biopelículas de E. faecalis elaboradas in vitro. Los períodos de tiempo fueron de 1 o 5 minutos, y al igual que Giardino et al (10) sus resultados indican que el hipoclorito de sodio al 6 y al 1% es un agente capaz de eliminar casi el 100% de la totalidad de la biopelícula, seguido del Smearclear®, la clorhexidina al 2%, el REDTA® y por último el Biopure MTAD®. (11) Estos autores señalan que al reconocer que el medio ambiente anaeróbico del SCR y la consecuente limitación de oxígeno molecular pueden aumentar la resistencia de la biopelícula a los agentes antimicrobianos, se requieren de más estudios donde se puedan reproducir estas condiciones anaeróbicas y así evaluar la sensibilidad antimicrobiana.(11) Con relación a la capacidad antibacteriana de ciertos antibióticos sobre biopelículas formadas por E. faecalis, Lima et al (12) evaluaron la efectividad de medicamentos basados en antibióticos y en clorhexidina, en la eliminación de estas biopelículas. Las mismas fueron inducidas en filtros de membranas de nitrato celuloso con 1 día o 3 días de formación y quedaron embebidas por los medicamentos durante un día a 37°C. Los medicamentos utilizados en este estudio se probaron en forma de gel y fueron los siguientes: (1) gluconato de clorhexidina al 2% con natrozole al 2% en agua destilada, (2) gluconato de clorhexidina al 2%, sulfato sódico dietilen-glicol al 1,25% y natrozole al 2% en agua destilada, (3) clindamicina al 2% con natrozole al 2% en agua destilada, (4) clindamicina al 2%, sulfato sódico dietilen-glicol al 1,25% y natrozole al 2% en agua destilada, (5) gluconato de clorhexidina al 2%, óxido de zinc al 15%, sulfato sódico dietilen-glicol al 1,25% y natrozole al 2% en agua destilada y (6) clindamicina al 2%, metronidazol al 10%, sulfato sódico dietilen-glicol al 1,25% y natrozole al 2% en agua destilada.(12) En sus resultados pudieron observar que la asociación entre la clindamicina y el metronidazol redujo significativamente el número de células en la biopelícula formada en un día y, con relación a todos los medicamentos probados, aquellos que contenían clorhexidina al 2% fueron los únicos capaces de reducir en gran cantidad el número de células bacterianas de E. faecalis en ambas biopelículas. (12) Estos autores señalan que la clorhexidina es una molécula catiónica que ejerce su efecto antibacterial interrumpiendo la integridad de la membrana citoplasmática bacteriana, causando filtración de los contenidos intracelulares. En altas concentraciones, la precipitación del citoplasma bacteriano ocurre como resultado de la interacción entre la clorhexidina y las entidades fosfatadas, como adenosín trifosfato y los ácidos nucleicos. De allí que los medicamentos que contienen clorhexidina sean capaces de eliminar casi la totalidad de microorganismos presentes en las biopelículas.(12) Portenier et al (1) señalan que existen tres hipótesis que pueden explicar la resistencia de estas biopelículas a los antibióticos. La primera hipótesis se refiere a la reducción o baja penetración del medicamento a través de la misma; la segunda se basa en los posibles cambios en el medio ambiente químico de la biopelícula y la tercera todavía está en discusión, pero sugiere que las sub-poblaciones de bacterias dentro de la biopelícula adquieren capacidad fenotípica diferente. Muchos son los estudios que reflejan la presencia de E. faecalis en las infecciones endodónticas; sin embargo, el porcentaje de prevalencia de este microorganismo puede variar considerablemente si se utilizan métodos de cultivo tradicional o las nuevas técnicas de detección microbiológica como la Reacción en Cadena de la Polimerasa (PCR por sus siglas en inglés) entre otras. A continuación se expondrán con más detenimiento cada uno de los métodos de detección que han sido utilizados para evidenciar la presencia de E. faecalis en las infecciones endodónticas, así como los estudios que soportan los distintos porcentajes de prevalencia del mismo. 1.2 Métodos de detección de Enterococcus faecalis Los primeros estudios microbiológicos de infecciones endodónticas fueron llevados alrededor de los años '60 usando el microscopio, técnicas de cultivo aeróbicas, y reacciones bioquímicas, para poder detectar e identificar los microorganismos preponderantes en dichas lesiones. Así han sido cultivadas más de 500 especies bacterianas provenientes de la cavidad oral. (13) Numerosas investigaciones han revelado que las infecciones endodónticas son polimicrobianas constituídas, aproximadamente, por 3 a 12 especies de microorganismos cultivables de conductos radiculares infectados o abscesos periapicales.(1,13,14) Actualmente, las nuevas técnicas de detección molecular son capaces de identificar numerosas especies adicionales de microorganismos asociados con dichas infecciones endodónticas. Estos métodos proporcionan una identificación precisa de los microorganismos a nivel del ADN y la detección de aquellos que no han podido ser cultivados.(13) 1.2.1 Cultivo y Observación Microscópica Esta técnica tradicional consiste en sembrar las muestras del conducto radicular utilizando medios para cultivo de microorganismos anaerobios estrictos y anaerobios facultativos, que indiquen las proporciones relativas de cepas presentes. Sin embargo, muy poco se sabe acerca de los factores específicos de crecimiento que son utilizados por numerosos microorganismos para sobrevivir, en cualquier medio ambiente, incluyendo el cuerpo humano, por lo que no se puede determinar con exactitud si se replican exactamente las condiciones necesarias para su crecimiento.(14) Las principales ventajas de las técnicas tradicionales de cultivo están relacionadas con su naturaleza de amplio rango, lo cual hace posible la identificación de una gran cantidad de especies microbianas en una muestra. Además, el cultivo hace posible la determinación de la sensibilidad antimicrobiana de los microorganismos aislados, estudiar su fisiología y patogenicidad. (14) Sin embargo, las propuestas de identificación basadas en cultivo presentan numerosas limitaciones: (1) toma una cantidad determinada de tiempo identificar algunas cepas de microorganismos anaerobios, lo cual puede retrasar el tratamiento antimicrobiano, (2) presenta una baja sensibilidad, particularmente para aquellas cepas de microorganismos anaerobios, (3) su especificidad es baja y dependiente de la experiencia del microbiólogo, (4) presenta dependencia estricta en el modo de transporte de la muestra y (5) es laborioso y requiere de tiempo. (13,14,15) A pesar de las condiciones dadas en los métodos de cultivo tradicionales para la detección de la microbiota endodóntica, algunos microorganismos no pueden ser cultivados por numerosas razones; entre ellas: (1) la ausencia de nutrientes esenciales o factores de crecimiento en los medios de cultivo artificiales, (2) la toxicidad del medio de cultivo per se, lo cual puede inhibir el crecimiento de algunos microorganismos, (3) la producción de sustancias inhibitorias del microorganismo solicitado por parte de otros microorganismos presentes en el medio ambiente mixto, (4) la dependencia metabólica de otras especies para el crecimiento y (5) el reposo bacteriano, el cual es un estado de baja actividad metabólica que desarrollan algunas bacterias bajo ciertas condiciones de estrés, como la falta de nutrientes. (1,3,14,15) Una de las ventajas más importantes del microscopio es que provee una rápida y poco costosa información, pero las características morfológicas no son comúnmente adecuadas para identificar un microorganismo en cuanto a su especie. Además de esto, el microscopio tiene una sensibilidad y especificidad limitada para detectar microorganismos en muestras clínicas; esto se refiere a que se necesita de un número relativamente grande de células microbianas para que puedan ser observadas bajo el microscopio.(13,14) Por todo esto, numerosos investigadores se vieron en la necesidad de ir mas allá en la búsqueda y detección de microoganismos presentes en las infecciones endodónticas; junto con el avance de la ciencia y la tecnología, la identificación de estos microorganismos a través de métodos moleculares se ha hecho un procedimiento mucho más certero, exacto y específico donde se han podido detectar, además de las especies prevalentes hasta el momento, nuevas especies que también están involucradas en dichas infecciones endodónticas y que tienen una participación importante en la persistencia de las lesiones perirradiculares. 1.2.2 Métodos moleculares Las técnicas moleculares han reducido la dependencia de los laboratorios microbiológicos clínicos a los métodos basados en cultivos, dando paso a nuevas oportunidades de estudios microbiológicos. Para dichos métodos, los objetivos fundamentales para el procesamiento de la muestra son la liberación del ácido nucleico del microorganismo, mantener la integridad del mismo, mantener la muestra no infectada y remover las sustancias inhibitorias.(13) Los métodos de diagnóstico moleculares presentan numerosas ventajas sobre otros métodos de identificación microbiana. Entre éstas tenemos: (1) detección no sólo de las especies cultivables sino también de las no cultivables, (2) alta especificidad e identificación precisa de variedades microbianas con comportamientos fenotípicos ambiguos, incluyendo especies convergentes y divergentes, (3) detección de especies de microorganismos en muestras sencillas, sin la necesidad de cultivo, (4) alta sensibilidad, (5) menos tiempo de preparación para el estudio, (6) ofrecen un diagnóstico rápido, el cual es particularmente ventajoso en casos de enfermedades mortales o enfermedades causadas por el crecimiento lento de microorganismos, (7) no requieren de condiciones anaeróbicas cuidadosamente controladas durante su muestreo y transporte, lo cual es ventajoso desde que algunas bacterias anaerobias y otros microorganismos frágiles perdían la viabilidad durante su transporte y (8) pueden ser usados durante el tratamiento antimicrobiano. (14,15) Las propuestas moleculares de identificación microbiana parten de la premisa de que ciertos genes contienen información relevante acerca de la identidad microbiana. Idealmente, el gen que va a ser usado como blanco para la identificación microbiana debe contener regiones que son únicas para su especie.(14) El gen 16S ADN-r está presente en casi todas las bacterias; éste presenta algunas regiones que son casi idénticas en todas las bacterias denominadas regiones conservadas, y otras regiones que varían en secuencia de una especie a otra denominadas regiones variables. Las regiones variables en el gen 16S ADN-r son los únicos detalles que permiten la identificación bacteriana.(15) (Gráfico 3) 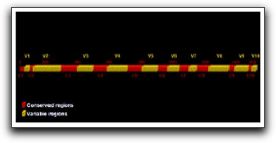 Gráfico 3. Dibujo esquemático del gen de ARNr 16S (ADNr). Las áreas amarillas corresponden a las regiones variables, las cuales contienen información acerca del género y la especie. Las áreas rojas corresponden a las regiones conservadas del gen. Tomado de Siqueira y Rocas. 2005. Entre los métodos moleculares que han sido empleados para la detección del E. faecalis se encuentran la Reacción en Cadena de la Polimerasa (PCR) y algunas variantes o ensayos derivados de esta tecnología como la transcriptasa reversa, entre otros. Todos ellos basados en la replicación in vitro del ADN del microorganismo. 1.2.2.1 Reacción en Cadena de la Polimerasa (PCR) El método molecular PCR está basado en la replicación in vitro del ADN a través de ciclos repetitivos de desnaturalización, reunión de los cebadores y pasos de extensión. Así, el ADN blanco que sirve como plantilla se funde a temperaturas suficientemente altas como para desligar los puentes de hidrógeno pero manteniendo las cadenas juntas y de esta manera son liberadas cadenas simples de ADN. Posteriormente, dos oligonucleótidos cortos (cebadores) se reúnen en secuencias complementarias de cadenas opuestas del ADN blanco.(14,15,19,20) El cebador (oligonucleótido) es una pequeña porción de ADN sintetizado, cuya función es complementar la secuencia de ADN de los genes microbianos que van a ser estudiados.(13) Los cebadores son seleccionados para rodear el material genético deseado, definiendo los dos puntos finales del fragmento de ADN que va a ser copiado. A una temperatura ligeramente mayor, la enzima ADN polimerasa se une a los cebadores y añade nucleótidos para extender la segunda cadena. En ciclos subsecuentes, se repiten los pasos de desnaturalización, reunión y extensión para hacer copias adicionales de ADN. Cada copia nueva sirve como plantilla para la amplificación en ciclos futuros. Luego de 30 ciclos, se han producido millones de copias de la secuencia blanco provenientes de una simple molécula inicial.(14,15,19,20) (Gráfico 4) 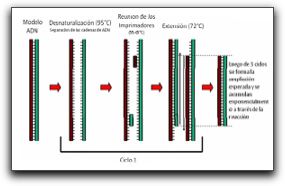
En esta técnica molecular de detección microbiológica, son utilizados cebadores específicos para cada gen microbiano que va a ser estudiado y así obtener resultados más específicos y certeros. Con relación a esto, Fouad(16) comparó la sensibilidad de tres cebadores diferentes usados en la literatura endodóntica para la detección de E. faecalis a través del método molecular PCR. Los cebadores utilizados fueron: grupo 1, cebadores basados en el gen tuf con una sensibilidad a nivel del género; y grupo 2 y 3, cebadores basados en el gen 16S ADN-r que son específicos para E. faecalis. Sus resultados señalan que los cebadores del grupo 1 presentaron la mayor sensibilidad, detectando las 3 cepas de E. faecalis a una baja concentración de 102 cel/mL en todas las reacciones. El grupo 2 también detectó las 3 cepas del microorganismo pero a una concentración mayor, mientras que el grupo 3 fue el menos sensible e igual pudo detectar todas las cepas de E. faecalis pero a una concentración de 106 cel/mL. Este autor señala que la sensibilidad de los cebadores usados en los estudios de prevalencia de microorganismos endódonticos es importante, sobre todo en casos de repetición de tratamiento, donde el número de microorganismos accesibles en el SCR suele ser bajo y un gran número de células microbianas pueden ser eliminadas durante la remoción del material de obturación.(16) Por su parte, investigadores como Molander et al(17) desarrollaron un protocolo para la detección de E. faecalis y E. faecium a través de PCR. En este estudio fueron utilizados cebadores específicos de PCR sobre la región intergénica del 16S ADN-r y reacciones de PCR. La sensibilidad del sistema de PCR fue estudiada usando disoluciones seriadas de ADN bacteriano y células bacterianas de E. faecalis. En sus resultados apuntan que todas las cepas de E. faecalis y E. faecium producen perfiles de ampliación idénticos a las dos bandas mayores en posiciones correspondientes a los pares de base 320 y 420; y que cuando se amplifica el ADN o hay una mayor purificación, se puede evidenciar una banda de 600 pares de bases. Gracias a sus resultados, estos autores apoyan el uso potencial de la tecnología PCR para la detección de E. faecalis y E. faecium en muestras de conductos radiculares. En relación con E. faecalis, son diversos los resultados obtenidos con PCR en cuanto a su prevalencia en dientes con periodontitis apical persistente. Ejemplo de ello es el estudio realizado por Fouad et al(18), donde utilizando el método PCR y secuencias moleculares, se pudieron evidenciar cepas de E. faecalis en 8 (22%) de 37 muestras, mientras que el estudio llevado a cabo por Siqueira y Rocas(19), utilizando los mismos métodos de detección microbiológica, mostró dicho microorganismo en 17 (77%) de 22 muestras. Así mismo, numerosos investigadores han estudiado la prevalencia de E. faecalis comparando métodos moleculares con técnicas de cultivo microbiológico tradicional. Autores como Sedgley et al(20) compararon el método de cultivo tradicional con PCR cuantitativo en Tiempo Real para detectar y cuantificar cepas de E. faecalis. Las muestras fueron obtenidas de conductos radiculares de dientes referidos a tratamiento endodóntico por sospecha de una infección endodóntica persistente o en dientes donde ya había sido iniciado el tratamiento. Sus resultados señalan que este microorganismo fue detectado en 9 (10,2%) de 88 muestras endodónticas a través del cultivo, y en 70 (79,5%) de 88 muestras a través de PCR cuantitativo en tiempo real. Estos autores señalan que aunque la data indica que el análisis microbiológico de muestras endodónticas por cultivo tradicional para E. faecalis puede ser insensible, la técnica de PCR cuantitativa en tiempo real sólo identifica la presencia de secuencias específicas de ADN, y como consecuencia, el número de microorganismos intactos y viables es desconocido. Además afirman que a pesar de la alta capacidad de detección de los métodos moleculares mostrada en este estudio, se requiere de la combinación de ambas técnicas para un entendimiento completo del papel de E. faecalis en el proceso infeccioso del SCR. (20) Por su parte, Gomes et al(21) y Sedgley et al(22) señalan haber detectado al microorganismo en cuestión en 23 de 100 muestras (23%) y en 3 de 41 muestras (7,3%) por métodos de cultivo respectivamente; mientras que a través del método PCR se encontraron en 79 de 100 muestras (79%) y en 29 de 41muestras (70%) respectivamente. Estos autores demuestran la alta sensibilidad de la técnica de PCR sobre el cultivo para la detección de E. faecalis. 1.2.2.2 Transcriptasa reversa PCR El método de transcriptasa reversa PCR fue desarrollado para amplificar los ARN blanco y aumentar el uso de la enzima transcriptasa reversa, la cual puede sintetizar una cadena de ADN complementaria de un modelo de ARN. La mayoría de los ensayos de transcriptasa reversa PCR proponen dos pasos. En el primero, la transcriptasa reversa convierte el ARN en una simple cadena complementaria de ADN. En el segundo paso se añaden los cebadores para PCR, el ADN polimerasa y los nucleótidos para crear la segunda cadena complementaria de ADN. Una vez que la doble cadena complementaria de ADN está formada, ésta puede ser utilizada como modelo para la amplificación como un PCR convencional.(14) Esta variación o ensayo de la técnica original PCR también ha sido utilizada para la detección de microorganismos presentes en el SCR, entre ellos E. faecalis. Williams et al(23) compararon la presencia de este microorganismo utilizando tres métodos de detección microbiológica: cultivo, PCR cuantitativo en tiempo real y Transcriptasa reversa PCR. Se tomaron tres muestras: S1, luego del acceso coronal, S2, luego de la instrumentación e irrigación y S3, luego de la medicación intraconducto con hidróxido de calcio, de 29 dientes a estudiar, es decir, 87 muestras en total. Los resultados señalan que E. faecalis fue hallado en 3 dientes (10,3%) por el método de cultivo tradicional, y en 16 dientes (55,1%) por la técnica molecular PCR cuantitativo en tiempo real. A su vez, todas las cepas de E. faecalis halladas por PCR cuantitativo fueron positivas al examen con transcriptasa reversa PCR. Estos autores concluyen que ambos métodos de detección molecular son mucho más sensibles que el cultivo tradicional para la detección de microorganismos en muestras clínicas endodónticas.(23) Sin embargo, estos ensayos moleculares derivados del PCR presentan algunas limitaciones: (1) la mayoría de los ensayos de PCR usados con propósitos de identificación cualitativa, detectan al microorganismo en cuestión, más no su nivel en la muestra. Los resultados cuantitativos, sin embargo, pueden ser obtenidos por ensayos de PCR en tiempo real, (2) en aquellos microorganismos con paredes celulares gruesas, como los hongos, pueden llegar a ser difíciles de romper y podrían requerirse pasos adicionales para la lisis y consecuente liberación de ADN, (3) existe una alta posibilidad de que se obtengan resultados falsos positivos, debido a la amplificación por PCR de un ADN contaminado y (4) pueden ocurrir falsos negativos debido a la presencia de enzimas inhibitorias o nucleasas en las muestras clínicas, lo cual podría retrasar la reacción de amplificación y degradar la plantilla de ADN, respectivamente. (14,15,19) A pesar de dichas limitaciones está demostrado que las técnicas moleculares y los ensayos derivados de las mismas, son herramientas importantes en la nueva era de detección microbiológica, donde se conoce la existencia de microorganismos que no son cultivables y que sólo pueden ser detectados a través de técnicas más específicas y sensibles como el PCR. Por ende, al identificar los principales microorganismos asociados a las infecciones endodónticas, se pueden agotar todos los recursos indispensables para la erradicación de los mismos y así garantizar una terapia mucho más predecible con resultados más acertados. 1.3 Factores de virulencia de Enterococcus faecalis La virulencia es la capacidad relativa de un microorganismo para producir alteraciones patológicas en el hospedero; esta propiedad se relaciona con la capacidad del mismo para colonizar al hospedero y con la de producir un daño tisular. La virulencia depende pues de diversos aspectos que afectan a estas capacidades y se denominan factores de virulencia.(34) (Gráfico 5)
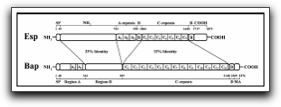
E. faecalis posee un gran número de factores de virulencia que le permiten la colonización del hospedero y de la matriz extracelular, la competencia con otras bacterias, resistencia en contra de los mecanismos de defensa del hospedero, y la producción de cambios patológicos directamente a través de la producción de enzimas tóxicas o indirectamente a través de la inducción de inflamación. (1,2) Entre los factores de virulencia más importantes presentes en E. faecalis se encuentran: la sustancia de agregación, las adhesinas o proteínas de superficie, las feromonas sexuales, el ácido lipoteicoico, el superóxido extracelular, la gelatinasa, la hialuronidasa y la citolisina, entre otros. Cada uno de estos factores de virulencia desempeña un papel específico dentro del crecimiento, desarrollo y supervivencia de E. faecalis en medios ambientes hostiles y con poca cantidad de nutrientes y oxígeno, por lo que a continuación se profundizará en cada uno de estos factores y se describirán sus funciones específicas. 1.3.1 Sustancia de agregación La sustancia de agregación es una adhesina bacteriana plásmido-codificada receptiva a las feromonas que media el contacto eficiente entre el donador y la bacteria receptora; ésta sustancia convierte la superficie de la bacteria donadora en una superficie adherente potencial para las células receptoras, causando agregación o agrupación y a su vez facilitando el intercambio de plásmidos.(1,2,4) Mientras que la sustancia de agregación es expresada por la célula donadora, el proceso de conjugación bacteriana requiere que la "sustancia vinculante" sea expresada en la superficie de la célula receptora. En este sentido, tanto el material genético como la resistencia antibiótica pueden ser transferidos de las cepas de E. faecalis a otras especies.(1,2) La sustancia de agregación puede servir como determinante de virulencia a E. faecalis en, al menos, cuatro formas: (1) juega un papel importante en la diseminación de los factores de virulencia codificados por plásmidos, como la citolisina enterocóccica y determinadas resistencias antibióticas, entre las especies, (2) esta sustancia de agregación facilita la adherencia de E. faecalis a las células epiteliales renales e intestinales, y a la colonización de estas superficies, (3) protege al microorganismo contra los leucocitos polimorfonucleares y de la lisis mediada por macrófagos. El mecanismo para esta protección puede deberse a una modificación de la maduración fagosomal y (4) la sustancia de agregación y las citolisinas tienen acciones sinérgicas, lo cual aumenta la virulencia; esto resulta en daño tisular e invasión tisular profunda. (1,24) Además de su función adhesiva durante el proceso de conjugación bacteriana, ésta media la adhesión de E. faecalis a numerosas células eucariotas como las células renales tubulares y las células epiteliales intestinales. Igualmente, se ha comprobado que promueve directamente la vinculación independiente a las opsoninas de E. faecalis a los neutrófilos humanos mediante el sistema del complemento mediado por el receptor. Como consecuencia de este tipo especial de unión, la relación E. faecalis &endash; sustancia de agregación ha mostrado ser resistente a la lisis por parte de los neutrófilos humanos, a pesar de la fagocitosis y la activación de los mismos. (2,24) 1.3.2 Adhesinas o proteínas de superficie E. faecalis presenta en su pared celular numerosas proteínas de superficie, cada una cumpliendo una función especifica. Las más importantes son la proteína de superficie Esp y la Ace, ambas relacionadas con la formación de biopelículas y con la adherencia del microorganismo a las proteínas de la matriz extracelular y al colágeno tipo I y IV. La proteína de superficie Esp es una proteína superficial larga de 1873 aminoácidos, sin ningún parecido estructural a las otras proteínas de superficie reconocidas.(25,26) Fue en 1999 cuando Shankar et al(23) reportaron la identificación de esta proteína asociada a la pared celular de E. faecalis. Su nombre, Esp, se deriva de sus siglas en inglés Enterococcal surface protein. Estos autores sugieren que la presencia de la Esp pudiera ser la responsable del aumento de la capacidad hidrofóbica y así facilitar las interacciones de este tipo entre moléculas. Dos años más tarde, en el 2001, Toledo-Arana et al(26) realizan un estudio donde evaluaron la acción de la proteína de superficie Esp en diferentes cepas aisladas de E. faecalis y analizaron los efectos producidos en los diferentes pasos de formación de la biopelícula a niveles microscópicos y macroscópicos. A su vez, compararon la proteína de superficie Bap, cuyo nombre proviene de Biofilm associated protein, que se encuentra en la pared celular de S. aureus con la Esp de E. faecalis, en cuanto a su influencia en la formación de biopelículas. Esta proteína Bap, en un estudio previo de los mismos investigadores, demostró ser una pieza fundamental en la formación de biopelículas por parte de este microorganismo. Los resultados de esta investigación señalan que ambas proteínas de superficie (Bap y Esp) comparten el 33% de igualdad secuencial y 50% de similitud secuencial a lo largo de toda la alineación.(26) (Gráfico 6)
Grafico 6. Similitud estructural entre las proteínas de superficie Bap y Esp. Se muestra el porcentaje de igualdad entre distintas regiones de estas proteínas. Tomado de Toledo-Arana et al. 2001 Por lo tanto, en cuanto a la habilidad en la formación de biopelículas, se evidencia una importante asociación entre la similitud de ambas proteínas y la presencia de la Esp en la pared celular de E. faecalis. La formación de biopelículas se vió restringida a las cepas aisladas de E. faecalis que presentaban Esp. Ochenta y siete (87) de 93 cepas de E. faecalis que presentaban Esp, fueron capaces de formar biopelículas in vitro. Por el contrario, ninguna de las cepas de este microorganismo que no poseían Esp en su superficie fueron capaces de formar biopelículas, indicando una asociación genética entre la presencia de la Esp y la presencia de adhesinas. Igualmente, estos autores apuntan que la Esp pudiese jugar un papel importante en la actividad de vinculación de los ligandos con la matriz extracelular o tener una influencia indirecta en la modulación de ésta actividad en otras moléculas.(26) Otra de las proteínas de superficie que se encuentra presente en la pared celular de E. faecalis es la proteína de Superficie Ace; ésta es una proteína vinculada al colágeno, es una molécula adherida a la matriz extracelular reconocida como un componente microbiano superficial, la cual media la adherencia a las proteínas de la matriz extracelular, al colágeno tipo I y IV y a la Laminina.(27) Una investigación importante relacionada con la función de esta proteína es la realizada por Nallapareddy et al(27) quienes evaluaron la capacidad de mediar la adhesión de la proteína de superficie Ace de E. faecalis a las proteínas de la matriz extracelular como el colágeno tipo IV y la Laminina. Ellos utilizaron cepas de E. faecalis mutadas y evidenciaron que la proteína de superficie Ace si interviene en la adhesión de la cepa OG1RF de E. faecalis al colágeno tipo IV y a la Laminina, así como también al colágeno tipo I. Además señalan que se pudiera pensar que esta proteína de superficie es la responsable de la adhesión a estas tres proteínas de la matriz extracelular, debido a la reducción importante en la adhesión.(27) Igualmente, Hubble et al(28) realizaron un estudio donde evaluaron la pérdida de adhesión de las cepas de E. faecalis a la dentina radicular cuando era mutada la proteína de superficie Ace. Ellos señalan que la dentina de los conductos radiculares está constituída por colágeno y por otras proteínas, por lo tanto debe existir una participación importante de esta proteína de superficie en la adhesión bacteriana, y a su vez, en la colonización del SCR. Sus resultados sugieren que la adherencia de la cepa de E. faecalis no mutada (OG1RF) fue significativamente mayor que la adhesión de las otras tres cepas de E. faecalis mutadas, por lo que se confirma la participación importante de la proteína de superficie Ace en la adhesión de E. faecalis en la dentina. 1.3.3 Feromonas sexuales Las feromonas sexuales son péptidos hidrofóbicos pequeños codificados cromosomalmente, a lo largo de 7 u 8 aminoácidos, los cuales promueven la transferencia conjugativa de plásmidos de ADN entre las cepas. (2,4) Se describen como feromonas porque ellas obtienen una respuesta específica de unión de las células donadoras transportadoras de plásmidos.(4) Normalmente, son secretadas simultáneamente múltiples feromonas por una cepa de E. faecalis. Adicionalmente a las feromonas, cada plásmido receptor de feromonas codifica un péptido secretado que actúa como inhibidor competitivo de su feromona correspondiente. (4) Se ha señalado que algunas feromonas y sus péptidos inhibidores poseen el potencial de ofrecer funciones adicionales como quimiorreceptor a los neutrófilos, causando secreción enzimática granular e induciendo a una explosión respiratoria. A pesar de que E. faecalis secreta normalmente múltiples feromonas y los efectos quimiotácticos de las feromonas aparecen en bajas concentraciones, se desconoce por qué estos péptidos y sus inhibidores modulan significativamente la respuesta inflamatoria in vivo. (4) 1.3.4 Acido lipoteicoico Los ácidos lipoteicoicos son un grupo de moléculas o polímeros anfipáticos íntimamente relacionados y asociados con la pared celular, que están constituídos por una columna central de poliglicerolfosfato unida covalentemente a una porción glicolipídica hidrofóbica. (2,4) Se ha reportado que los ácidos lipoteicoicos aislados de cepas de E. faecalis o de otras bacterias Gram positivas pueden estimular a los leucocitos a liberar numerosos mediadores, los cuales juegan un papel importante en varias fases de la respuesta inflamatoria. Entre ellos se incluyen la liberación del factor de necrosis tumoral alfa (TNF-?), la interleucina 1 beta (IL-1?), la interleucina 6 (IL-6), la interleucina 8 (IL-8), la prostaglandina E2 (PGE2) y la liberación de enzimas lisosomales. (2) Ehrenfeld et al(29) señalan que los ácidos lipoteicoicos han sido considerados como un componente de la sustancia vinculante de E. faecalis, los cuales actúan como un receptor en la célula receptora para la sustancia de agregación producida por la célula donadora. Esta conclusión proviene de experimentos donde ácidos lipoteicoicos libres aislados de E. faecalis inhiben grupos celulares inducidos por feromonas actuando como un inhibidor competitivo de la sustancia vinculante celular. Por esto, los ácidos lipoteicoicos son considerados moléculas que ayudan a la virulencia de E. faecalis a través de la facilitación de formación agregada y la transferencia de plásmidos. (29) 1.3.5 Superóxido extracelular Los aniones superóxidos son radicales de oxígeno altamente reactivos relacionados con el daño tisular y celular en una gran variedad de desórdenes, incluyendo las enfermedades inflamatorias.(2) Huycke et al(30) señalan que E. faecalis produce superóxido extracelular sustancial y especies derivadas del oxígeno reactivo como el H2O2 y radicales hidroxilos. Ellos evaluaron el daño producido por E. faecalis sobre el ADN de las células eucariotas, y observaron que las cepas de microorganismo donde hubo presencia de superóxido extracelular produjeron mayor daño sobre el ADN que aquellas cepas mutadas. Estos hallazgos sugieren que la producción de radicales libres extracelulares por parte de E. faecalis promueve la inestabilidad cromosomal y el daño causado en el ADN. 1.3.6 Gelatinasa La gelatinasa es una metaloproteinasa extracelular que contiene cinc, presente en E. faecalis, y fue descrita por primera vez en 1964. Puede hidrolizar gelatina, colágeno, fibrinógeno, caseína, hemoglobina, inulina, algunos péptidos relacionados con las feromonas sexuales y otros péptidos bioactivos. (2,4) Con relación a esto, Hubble et al(28) realizaron un estudio donde evaluaron la pérdida de adhesión de las cepas de E. faecalis a la dentina radicular cuando eran mutadas fracciones de las proteasas serinas y la gelatinasa. Sus resultados señalan que se desconoce la participación independiente de la gelatinasa en la adhesión a la dentina radicular, debido a que en este estudio las cepas que mutaron por la acción de la gelatinasa también mutaron por la acción de la proteasa serina. Sin embargo, los péptidos y aminoácidos producidos tanto por la gelatinasa, como por la proteasa serina, pudieran ser una fuente importante de nutrientes para el crecimiento bacteriano dentro del SCR. 1.3.7 Hialuronidasa La hialuronidasa es un término general usado para describir enzimas que son capaces de descomponer el sustrato hialuronidato (acido hialurónico o hialuronano).(31) La hialuronidasa actúa como un ácido hialurónico, y es principalmente, una enzima degradativa que está asociada con daño tisular como consecuencia de su función.(2) Otra función importante de esta enzima podría ser abastecer de nutrientes a los microorganismos, debido a que los productos de degradación de los sustratos son los disacáridos, los cuales pueden ser transportados y metabolizados intracelularmente por las bacterias.(31) La hialuronidasa es considerada como facilitador de la proliferación bacteriana, así como de sus toxinas, a través de los tejidos del hospedero. Además de su propio efecto dañino, también es capaz de permitir los efectos deleatorios de otras toxinas bacterianas, incrementando así la magnitud del daño.(2) 1.3.8 Citolisina (Hemolisina) La hemolisina, una enzima tóxica codificada por plásmidos, es producida por las cepas ?-hemolíticas de E. faecalis. Es capaz de destruir eritrocitos, neutrófilos polimorfonucleares y macrófagos, matar células bacterianas y reducir el acto de la fagocitosis. (1) Jett et al(32) señalan que si las cepas de E. faecalis producen citolisinas, el efecto beneficioso combinado de la terapia antimicrobiana y anti-inflamatoria se vería completamente contrarrestado debido a la actividad organotóxica de esta sustancia, la cual destruye completamente el órgano a pesar de que los otros aspectos importantes de la infección estén satisfactoriamente controlados. Estos autores demuestran que aún en un órgano con respuesta inmune limitada, la enfermedad enterocóccica cuenta con un componente inflamatorio importante, así como con un componente organotóxico si el organismo agresor es productor de citolisina. Kayaoglu y Ørstavik (2) realizan un gráfico resumen que agrupa a los distintos factores de virulencia de E. faecalis, de acuerdo a la función que cumplen en la pared celular de dicho microorganismo. (Gráfico 7) 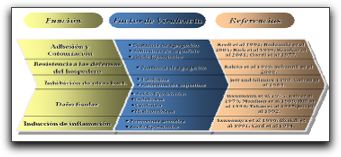
Gráfico 7. Tomado de Kayaoglu y Ørstavik. 2004 Af Geijersstam et al(33) evaluaron las cepas de E. faecalis de SCR de dos poblaciones humanas diferentes, Lituania y Finlandia, comparando las propiedades de los factores de virulencia presentes en cada cepa. Se detectaron las proteínas de superficie Esp, Ace y efaA por PCR mientras que la presencia de citolisina y la gelatinasa fueron determinadas por la hidrólisis en agar sangre de caballo y agar gelatina, respectivamente. En sus resultados señalan que no hubo diferencias significativas entre las dos cepas de E. faecalis en cuanto a la presencia de proteína de superficie Esp, Ace, efaA y citolisina, mientras que fue mayor la producción de gelatinasa en el grupo de cepas finlandesas. Estos autores señalan que la incidencia mayor de gelatinasa en las cepas provenientes de Finlandia, podría ser debido a que las muestras tomadas en esta población humana provenían de pacientes que presentaban síntomas clínicos o subjetivos al momento de la toma de muestra, a diferencia de las cepas de E. faecalis tomadas en la población humana de Lituania, cuya procedencia era de pacientes que presentaban periodontitis apical asintomática. Sin embargo, no presentan referencias bibliográficas que soporten esta teoría.(33)
2. MODULACIÓN DE LA RESPUESTA INMUNE DEL HOSPEDERO Los encargados de proveer defensas al hospedero no específicas pero importantes contra patógenos de cualquier tipo, son los fagocitos como neutrófilos, monocitos y macrófagos. Los neutrófilos, en particular, migran eficientemente hacia los sitios de la infección en respuesta a señales quimiotácticas, activan el sistema de complemento y los anticuerpos para el reconocimiento de los patógenos y causan la lisis de los microorganismos a través de su ingesta por mecanismos oxidativos y no oxidativos.(1,4) Numerosos autores han investigado los mecanismos inmunológicos asociados con la resistencia a infecciones por los enterococos. Así, Harvey et al(35) investigaron los factores asociados a la susceptibilidad a infecciones por los enterococos presentes en el hospedero, especialmente en neonatales. Ellos utilizaron fuentes de suero y linfocitos polimorfonucleares en un ensayo bactericida de neutrófilos, para poder evaluar la contribución relativa de los anticuerpos y del sistema del complemento, así como sus interacciones, en la lisis de los enterococos mediada por neutrófilos. Entre sus resultados señalan que: (1) el sistema del complemento desempeña un papel importante en la opsonización y fagocitosis de los enterococos, (2) los linfocitos polimorfonucleares de un neonatal sano son tan efectivos en la lisis de los enterococos mediada por neutrófilos como un linfocito polimorfonuclear de un adulto, (3) la actividad bactericida del neutrófilo mediada por el sistema de complemento sobre los enterococos puede proceder eficientemente por la vía alterna y (4) los anticuerpos específicos para los enterococos desempeñan un papel importante en la lisis del microorganismo mediada por neutrófilos, a través del aumento y aceleración del proceso. (35) Estos autores señalan que la lisis de los enterococos por neutrofilos está mediada principalmente por el sistema del complemento, y que los anticuerpos desempeñan un papel menos esencial pero potencialmente importante. Los linfocitos polimorfonucleares de adultos y de infantes sanos funcionan de la misma manera en cuanto a eficiencia en la lisis de los enterococos por neutrofilos.(35) Igualmente lo aseguran Gaglani et al(36) y Arduino et al(37) quienes estudiaron la interacción entre los enterococos y el sistema de defensa del hospedero, así como la capacidad del sistema de complemento y de los anticuerpos en promover la lisis mediada por neutrófilos. Ambos grupos de autores concluyen que la lisis de los enterococos mediada por polimorfonucleares depende principalmente del sistema de complemento y que algunos anticuerpos específicos para este microorganismo, de humanos y de conejos, promueven la muerte celular mediada por polimorfonucleares aunque en menor grado; así mismo aseguran que los anticuerpos no son capaces de promover por sí mismos la lisis de los enterococos mediada por polimorfonucleares. Arduino et al(37) señalan que existe una diferencia en cuanto a la sensibilidad a la lisis celular entre las dos especies de Enterococcus estudiadas, siendo las dos cepas de E. faecium más resistentes a la lisis mediada por neutrófilos. Esto es debido, según los autores, a factores asociados con la activación del sistema de complemento, la unión a los polimorfonucleares y a los sistemas intrafagosomales del microorganismo. La lisis celular bacteriana mediada por el ataque complejo a la membrana no desempeña un papel importante en la respuesta inmune de los enterococos, debido a la ausencia de membrana externa de todas las bacterias Gram positivas. (1) Sin embargo, ha sido estudiada la presencia de factores de virulencia como la sustancia de agregación y su relación con los componentes del sistema inmune humano. Así, Vanek et al(38) evaluaron la interacción entre la sustancia de agregación presente en E. faecalis con los neutrófilos humanos, componente importante en el sistema de defensa del hospedero. Estos autores señalan que la sustancia de agregación promueve un incremento marcado en lo que respecta a la unión bacteriana independiente de las opsoninas a los polimorfonucleares. Estos autores afirman que la adhesión va a ser dependiente de la expresión de la proteína Asc10 ubicada en la superficie de los enterococos. Además, señalan que la CR3, anticuerpo monoclonal ubicado en la superficie de los linfocitos polimorfonucleares, desempeña un papel importante en la adhesión bacteriana mediada por la sustancia de agregación, disminuyendo la adhesión en un 85%.(38)
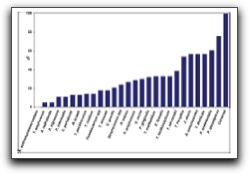
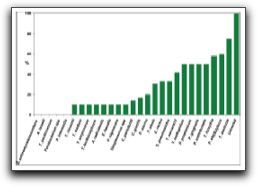
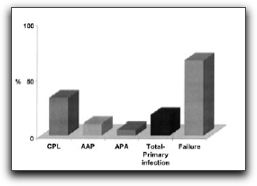
3. INCIDENCIA DE ENTEROCOCCUS FAECALIS EN LAS INFECCIONES ENDODÓNTICAS Hace más de 4 décadas, Kakehashi et al(39) reportaron que las bacterias y sus productos eran considerados como los agentes etiológicos primarios de la necrosis pulpar y de las lesiones periapicales. Ellos observaron que no se desarrolló periodontitis apical en ratas gnotobióticas (libres de gérmenes) cuando expusieron las pulpas de los molares a la cavidad oral, en comparación con las ratas controles con microflora oral convencional, donde si hubo desarrollo de lesiones periapicales. Una gran cantidad de estudios e investigaciones indican que las enfermedades perirradiculares son desórdenes de tipo infeccioso. La lista de microorganismos involucrados en las enfermedades perirradiculares aumenta día a día, y tiene el potencial de aumentar más en los próximos años gracias a los avances de los métodos moleculares en cuanto a identificación y detección de microorganismos.(13,14,15,19,40) Sundqvist y Figdor(41) señalan que un microorganismo patógeno endodóntico está definido como aquel capaz de inducir destrucción de tejidos en la periodontitis apical. Los dientes con periodontitis apical se caracterizan por presentar una infección polimicrobiana y, mientras algunos microorganismos específicos desempeñan diferentes funciones o dominan los distintos estadíos de la infección, no existe evidencia de que existan otros que no se encuentren involucrados en la patogénesis de la periodontitis apical. En esencia, una infección endodóntica no es más que la infección del SCR del diente, siendo ésta el agente etiológico primario de las diferentes formas de enfermedades inflamatorias perirradiculares. Luego que se ha establecido la infección endodóntica, estos microorganismos entran en contacto directo con los tejidos perirradiculares a través del foramen apical o foraminas accesorias, ocasionando daño a estos tejidos y a la vez suscitando cambios inflamatorios.(14) Distintos autores en sus investigaciones señalan la presencia de E. faecalis en las infecciones endodónticas, bien sean infecciones primarias o infecciones persistentes; por ello, se revisarán a continuación aquellos estudios que soportan la prevalencia del mismo en ambos tipos de infección. 3.1 Dientes con infección primaria La infección del SCR es un proceso dinámico y distintas especies microbianas dominan los diferentes estadíos del mismo. Los factores más importantes que manejan el desarrollo de este proceso son la disponibilidad de nutrición, los niveles de oxígeno molecular y el pH local dentro del SCR. Los nutrientes exógenos, como los carbohidratos fermentados, pueden afectar la ecología microbiana de la porción coronal del conducto radicular expuesto, pero las proteínas y glicoproteínas endógenas son los principales nutrientes dentro del SCR.(41) Las infecciones endodónticas primarias o los dientes no tratados endodónticamente con necrosis pulpar, se caracterizan por presentar una microbiota mixta o polimicrobiana, compuesta principalmente por microorganismos Gram positivos y Gram negativos, con predominio de bacterias anaerobias. Generalmente se pueden encontrar más de tres especies distintas de microorganismos dentro de un conducto radicular.(42,43,44) Baumgartner y Falkler(45) cultivaron e identificaron los microorganismos que se encontraban presentes en los 5mm apicales de los conductos radiculares, de dientes con caries coronal y en las lesiones periapicales inflamatorias asociadas a estos. Realizaron cultivos aeróbicos y anaeróbicos y concluyeron que hay mayor predominio de microorganismos anaerobios en los últimos 5mm apicales. La presencia de E. faecalis se evidenció en 4 de las 10 muestras (40%). Siqueira y Rocas(43) analizaron una recopilación de estudios que evalúan la microbiota presente en infecciones endodónticas primarias, tomando en cuenta la sintomatología presente. Especies de microorganismos como Pseudoramibacter alactolyticus, Porphyromonas endodontalis, Treponema dentícola, Dialister pneumosintes, Filifactor alocis, Tanerella forsythia, entre otros, fueron los que se encontraron en mayor porcentaje en las infecciones endodónticas primarias. Cepas de E. faecalis también fueron observadas en dichos estudios. Los porcentajes de prevalencia varían desde 30% aproximadamente en infecciones endodónticas asociadas con lesiones perirradiculares asintomáticas (Gráfico 8), hasta 5% aproximadamente en infecciones endodónticas asociadas con periodontitis apical aguda. (Gráfico 9)
El análisis de presencia del microorganismo y su prevalencia en los distintos estadíos fue realizado mediante el método PCR; en casos de infecciones endodónticas primarias, la detección de E. faecalis fue de 33% (7 de 21) de los conductos radiculares asociados con lesiones perirradiculares crónicas asintomáticas, en 10% (1 de 10) de los conductos con periodontitis apical aguda y en 5% (1 de 19) de las muestras tomadas de abscesos perirradiculares agudos. Estos resultados demuestran que E. faecalis estuvo significativamente más asociado con casos asintomáticos que los sintomáticos. En general, E. faecalis estuvo presente en 18% (9 de 50) de los casos con infección endodóntica primaria.(49) (Gráfico 10)
3.2 Dientes con periodontitis apical persistente Para que los microorganismos puedan mantener una periodontitis apical y causar una enfermedad post-tratamiento, ellos deben, además de poder sobrevivir dentro de los conductos radiculares ya obturados, poseer las propiedades patogénicas necesarias para perpetuar la inflamación externa del SCR. En general, los microorganismos involucrados en infecciones persistentes implementan una de las tres estrategias para evadir la respuesta inmune: secuestración, evasión celular o evasión humoral. La secuestración constituye una barrera física entre el microorganismo y el hospedero. La evasión celular significa que los microorganismos evaden los mecanismos antibacterianos dependientes de los leucocitos y la evasión humoral significa que la bacteria extracelular evade los anticuerpos y el sistema de complemento del hospedero.(41) Los microorganismos persistentes en los conductos radiculares son aquellos que se encuentran en las pulpas necróticas y sobreviven a los procedimientos biomecánicos, los cuales pueden estar ubicados en conductos no localizados o áreas no instrumentadas de los conductos. Así mismo, las bacterias provenientes de la cavidad bucal pueden colonizar el interior de los conductos radiculares durante el tratamiento por un inadecuado control aséptico, o invadir la obturación de los mismos por filtración coronal luego de la terapia endodóntica.(42) Estudios recientes, usando técnicas microbiológicas avanzadas para especies anaerobias, han demostrado que la composición microbiana del SCR luego de un fracaso de tratamiento de conducto, difiere de aquella encontrada en dientes con necrosis pulpar no tratados. La microbiota encontrada en dientes con tratamiento de conductos previo y periodontitis apical se caracteriza por una monoinfección (presencia de 1 o dos especies) con predominio de microorganismos Gram positivos, y mayormente especies anaerobias facultativas.(42,43,44) Molander et al(50) señalan que los microorganismos anaerobios facultativos son menos sensibles a las terapias antimicrobianas que los microorganismos anaerobios estrictos, y gracias a esto persisten con mayor frecuencia en el SCR luego de procedimientos endodónticos inadecuados. Estos microorganismos pueden sobrevivir, en una fase inactiva, con una actividad metabólica baja por un período determinado de tiempo, y factores como la filtración coronal durante o después del tratamiento de conducto pudiesen cambiar las condiciones nutricionales y desencadenar el crecimiento bacteriano. Algunos de los rasgos fisiológicos requeridos por el microorganismo para entrar y establecerse por primera vez, son similares a los de los microorganismos que habitan una pulpa necrótica en un conducto no tratado, como por ejemplo la habilidad para encontrar nutrientes, competir con otros microorganismos y evadir las defensas iniciales del hospedero.(41) (Gráfico 11) 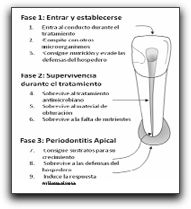
Gráfico 11. Estadíos importantes para el microorganismo involucrado en una infección persistente. Tomado de Sundqvist y Figdor.2003 Numerosos estudios señalan a E. faecalis como el microorganismo prevalente de las lesiones endodónticas persistentes, con porcentajes que varían desde 12 a 77%.(43,49,51,52,53,54,55) La habilidad de E. faecalis de causar enfermedades periapicales y fracasos crónicos en un diente tratado endodónticamente puede deberse a la habilidad de invadir los túbulos dentinarios y mantenerse viable dentro de ellos. Así lo comprueba Love(56) quien trata de identificar el posible mecanismo que explique cómo E. faecalis puede sobrevivir y crecer dentro de los túbulos dentinarios, y a la vez reinfectar un conducto radicular obturado. Este autor colocó muestras del microorganismo en un caldo de infusión cerebro-corazón que contenía distintas cantidades de suero humano por un período de 56 días. La habilidad del microorganismo de penetrar en los túbulos dentinarios y de adherirse al colágeno tipo I presente en la dentina fue evaluado mediante la invasión dentinaria. Este autor señala que los enterococos poseen numerosos factores de virulencia que lo ayudan a que pueda ocurrir esto, incluyendo la adherencia a las células del hospedero, la expresión de proteínas para asegurar su supervivencia celular como resultado de una fuente de nutrientes alterada, la habilidad de competir con otras células bacterianas y alterar la respuesta del hospedero y el medio ambiente.(56) Los resultados de este estudio afirman que las células de E. faecalis se mantienen viables y mantienen su capacidad de invadir túbulos dentinarios y adherirse al colágeno en presencia de suero humano. Este mecanismo puede explicar por qué las células de E. faecalis dentro de los túbulos dentinarios actúan como patógenos en fracasos de dientes tratados endodónticamente.(56) La prevalencia de E. faecalis en infecciones endodónticas persistentes ha sido demostrada a través de numerosos estudios como se mencionó anteriormente. Algunos de estos estudios utilizan métodos de cultivo tradicionales para su detección, variando los porcentajes de prevalencia desde 30% hasta 70%.(42,51,52,53,55,57) Es importante destacar el estudio realizado por Peciuliene et al(52) donde la muestra seleccionada de dientes con lesiones periapicales persistentes, fue tomada una primera vez cuando fue retirado el material de obturación presente en el SCR, y una segunda muestra tomada después de la preparación e irrigación con hipoclorito de sodio y EDTA. Del análisis de la primera muestra, de los 20 casos con presencia de microorganismos, E. faecalis estuvo presente en 14 dientes (70%); del análisis de la segunda, de los 7 casos con presencia de microorganismos, E. faecalis estuvo presente en 5 dientes (71%). Estos autores señalan que, más que el tratamiento químico llevado a cabo en los conductos, son verdaderamente importantes para la presencia y desarrollo de E. faecalis las condiciones ecológicas presentes en conductos radiculares incompletamente obturados. Otros estudios, en lugar de utilizar el método de cultivo tradicional, ponen en funcionamiento técnicas moleculares como PCR para la detección e identificación de E. faecalis, obteniendo rangos de prevalencia que van desde 12.1% a 77%.(49,54,58) Kaufman et al(54) compararon la presencia de E. faecalis en dientes tratados endodónticamente con lesiones periapicales con aquellos dientes que también requieren de retratamiento, pero que no presentaban lesiones perirradiculares. Este segundo grupo de dientes iba a ser sometido a la repetición del tratamiento de conductos por presentar sospechas de filtración coronal o debido a la presencia de una restauración extensa donde la calidad del tratamiento anterior fuese cuestionable. La muestra consistió en 58 dientes en total, donde 22 no presentaban lesiones periapicales y 36 si las presentaban. Sus resultados señalan que E. faecalis fue encontrado en 7 de los 58 casos (12.1%); cinco de ellos fueron encontrados en dientes sin lesiones y dos en dientes con lesión apical. Estos autores afirman que cuando ciertos factores inadvertidos son controlados, existe un número estadísticamente mayor de dientes sin lesiones perirradiculares que albergan a este microorganismo comparándolo con dientes con lesiones perirradiculares. Una explicación a esto podría ser que los dientes sin lesiones perirradiculares pueden estar en el proceso de formación de la misma, o éstas no son perceptibles radiográficamente.(54) Por el contrario, autores como Siqueira y Rocas(58) realizaron un estudio donde investigaron las especies de microorganismos más frecuentemente aisladas de dientes con fracaso de la terapia endodóntica a través de PCR. Ellos encontraron que E. faecalis fue la especie más prevalente, detectada en el 77% de los casos. Las otras especies prevalentes fueron P. alactolyticus, D. pneumosintes y F. alocis. (Gráfico 12) 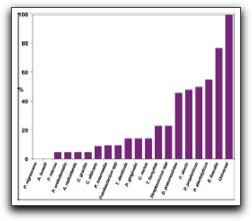
Gráfico 12. Especies prevalentes en dientes con tratamiento de conductos y lesiones perirradiculares crónicas. Data tomada de Siqueira y Rocas 2004. Imagen tomada de Siquiera y Rôcas. 2005 Así mismo, Rôcas et al(49) realizaron un estudio donde investigaron la prevalencia de E. faecalis en infecciones endodónticas y su asociación con las diferentes formas de enfermedades perirradiculares. E. faecalis fue detectado en 20 de 30 casos de infecciones endodónticas persistentes asociadas con dientes obturados (67%). Cuando se comparó la frecuencia de esta especie en 30 casos de infección persistente con 50 casos de infecciones primarias, los análisis estadísticos mostraron que estaba fuertemente asociado con la infección persistente. Se han realizado numerosos estudios basados en la comparación de la prevalencia de E. faecalis cuando éste es detectado e identificado por métodos de cultivo tradicionales o por técnicas moleculares como PCR, así como también su presencia en infecciones endodónticas primarias o persistentes. E. faecalis ha sido mayormente asociado a infecciones endodónticas persistentes, siendo mayor el número de detección del microorganismo si se utilizan técnicas moleculares. Así lo demuestran Gomes et al(59) quienes investigaron la presencia de E. faecalis en 50 dientes con infección endodóntica primaria y 50 dientes con infección endodóntica persistente mediante el cultivo tradicional y análisis por PCR. Los resultados señalan que E. faecalis fue detectado mediante cultivo en 2 (4%) de las 50 muestras de dientes con infección primaria y en 21 (42%) de las 50 muestras de dientes con infección persistente. En las infecciones primarias, E. faecalis estuvo presente como parte de las especies polimicrobianas, constituyendo un pequeño porcentaje de la microbiota total bacteriana. En las infecciones persistentes, en 14 de los 21 casos donde se evidenció su presencia, se encontró como única especie microbiana. Los resultados por técnicas moleculares PCR señalan la presencia de E. faecalis en 41 (80%) de las 50 muestras en infecciones primarias y 38 (76%) de las 50 muestras en infecciones persistentes. E. faecalis fue detectado en 23 de 100 muestras por técnicas de cultivo y en 79 de 100 muestras por PCR, mostrando la alta sensibilidad de PCR sobre los cultivos tradicionales. Los autores señalan que una de las razones por la que la detección del microorganismo fue tan elevada cuando se utilizó PCR fue la filtración coronal. En este estudio, la mayoría de los dientes con necrosis pulpar (49 de 50) presentaban filtración coronal por restauraciones defectuosas, caries o dientes no sellados coronalmente. La microfiltración coronal es una de las vías de penetración del E. faecalis hacia el espacio pulpar, si éste está presente en otra región de la cavidad bucal.(59) (Gráfico 13) 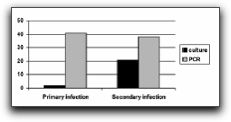
Grafico 13. Detección de E. faecalis usando las técnicas de cultivo y PCR. Tomado de Gomes et al. 2006. Otro de los métodos moleculares utilizados para la detección de E. faecalis es el método PCR cuantitativo en tiempo real. Williams et al(22) y Sedgley et al(23) utilizaron este método y lo compararon con el cultivo tradicional, concluyendo que es una prueba con mayor sensibilidad al microorganismo que las técnicas tradicionales. Los resultados de ambos grupos de investigadores señalan prevalencia de E. faecalis de 10% por cultivo y de 55-80% por PCR cuantitativo en tiempo real. Así mismo, corroboran la mayor incidencia de este microorganismo en dientes con infecciones endodónticas persistentes comparados con dientes con infecciones endodónticas primarias.(22,23) Es importante destacar la investigación de Gomes et al(44) donde además de evaluar la presencia de E. faecalis en infecciones endodónticas primarias y persistentes, se asocia al microorganismo con signos y síntomas específicos de estas infecciones. Las muestras fueron tomadas de 60 conductos radiculares, 41 con necrosis pulpar (infecciones primarias) y 19 con fracasos endodónticos (infecciones persistentes). Los resultados señalan que E. faecalis se evidenció en 2 dientes con infección primaria y en 6 dientes con infecciones persistentes.
4. CONTROL MICROBIOLÓGICO DE ENTEROCOCCUS FAECALIS Uno de los objetivos biológicos de la terapia endodóntica es la eliminación de los microorganismos del SCR(1,5,12,14,39,40,50). Debido a la anatomía compleja del mismo, una desinfección efectiva sólo se logra con una adecuada preparación biomecánica junto con la acción de los irrigantes antimicrobianos. Como se ha mencionado anteriormente, E. faecalis ha sido asociado a las lesiones periapicales persistentes, y gracias a sus características fenotípicas y a la presencia de determinados factores de virulencia, este microorganismo es capaz de sobrevivir en medios con pocos o escasos nutrientes, así como de invadir espacios o aberraciones anatómicas donde acciones como la preparación biomecánica, la colocación de medicación intraconducto o la utilización de irrigantes no son capaces de actuar y eliminarlo.(1,2,5) A continuación se expondrán diversos estudios donde se trata de controlar la presencia de E. faecalis bien sea con medicación local como irrigantes o medicación intraconducto, con productos añadidos al momento de la obturación definitiva o con medicación sistémica como la utilización de antibióticos. También se revisarán algunos estudios experimentales donde se investiga el uso de terapias con irradiación con láser para la eliminación satisfactoria del microorganismo. 4.1 Control microbiológico con medicación local 4.1.1 Irrigantes Muchos han sido los protocolos de irrigación utilizados para la erradicación de E. faecalis del SCR infectado. Entre los irrigantes mayormente usados se encuentra el hipoclorito de sodio (NaOCl), el ácido disódico etilendiaminotetraacético (EDTA), el MTAD®, el digluconato de clorhexidina y el ácido cítrico entre otros. A continuación los estudios que se han llevado a cabo para comprobar la efectividad antimicrobiana sobre E. faecalis de cada uno de ellos. 4.1.1.1 Hipoclorito de sodio El hipoclorito de sodio (NaOCl) ha sido utilizado como el irrigante de elección para la limpieza del SCR desde hace varias décadas, y en varias concentraciones, al 0,5%, 1%, 2% y 5,25%. Las principales ventajas que ha demostrado tener el NaOCl son su habilidad de disolución de tejidos orgánicos y su propiedad antibacteriana contra la mayoría de los microorganismos. Siqueira et al(60) evaluaron in vitro la efectividad del NaOCl al 4% usando tres métodos de irrigación en la eliminación de E. faecalis del SCR. Los tres métodos fueron los siguientes: a) irrigación con 2ml de NaOCl y agitación con limas manuales; b) irrigación con 2ml de NaOCl y agitación ultrasónica; c) irrigación con NaOCl alternado con peróxido de hidrógeno; y el grupo control fue irrigado con solución salina. Sus resultados señalan que no hubo diferencias significativas entre los grupos experimentales; sin embargo, estos autores afirman que el NaOCl, utilizado en cualquiera de estos tres métodos, fue significativamente más efectivo que la solución salina, al desinfectar los conductos radiculares. A pesar de que está demostrado que el efecto mecánico de la irrigación reduce el número de bacterias en el conducto radicular, los hallazgos de este estudio sugieren que se requiere de una solución irrigante que posea acción antibacterial para maximizar la desinfección del SCR. De igual forma demuestran que no existe diferencia significativa entre los protocolos de irrigación utilizados. Los efectos observados en este estudio son dependientes del NaOCl más que del método de irrigación empleado.(60) Otro grupo de autores como Abdullah et al(61) evaluaron la acción antimicrobiana del NaOCl al 3% en fenotipos diferentes de E. faecalis, como son una biopelícula y una suspensión planktónica. Cada una de las muestras del microorganismo fue expuesta al NaOCl en períodos de tiempo de 1,2,4,8,15,30 y 60 minutos. Los resultados señalan que el NaOCl fue capaz de lograr una reducción bacteriana al 100% cuando estuvo en contacto por 1 minuto con el microorganismo en su forma de suspensión planktónica y en 2 minutos cuando se encontraba formando una biopelícula. Estos autores apuntan que es difícil la erradicación de cualquier microorganismo que se encuentre en una biopelícula o en una suspensión planktónica in vitro si el agente antimicrobiano a utilizar no posee propiedades de disolución de tejido orgánico. Los mecanismos utilizados para la erradicación de las infecciones por biopelículas de E. faecalis se basan en la interrupción mecánica de la estructura multicelular, gracias a la instrumentación y disolución de los polímeros de la matriz utilizando NaOCl al 3% como protocolo principal de irrigación.(61) En este mismo sentido, Sena et al(62) evaluaron la efectividad del NaOCl al 2,5% y al 5,25% sobre biopelículas de E. faecalis, así como biopelículas de S. aureus, P. endodontalis y F. nucleatum. Estas biopelículas eran inmersas en la solución irrigadora por 30 segundos, y luego por períodos de tiempo de 5,10,15,30 y 60 minutos, con y sin agitación mecánica. En sus resultados señalan que se necesitaron 30 segundos de contacto, con agitación mecánica, entre la biopelícula de E. faecalis y el NaOCl al 5,25% para lograr su erradicación. Por otro lado, sin agitación mecánica, el NaOCl al 5,25% actuó sobre este microorganismo en la misma cantidad de tiempo, pero a una concentración de 2,5% tardó 60 minutos en lograr la erradicación del mismo. Sena et al(62) afirman que los microorganismos Gram positivos anaerobios facultativos como los enterococos, son más resistentes a la instrumentación y a los agentes antisépticos, por lo que se puede esperar su persistencia dentro del SCR luego de una preparación biomecánica y obturación inadecuadas. Por su parte, Vianna et al(63) y Gomes et al(64) evaluaron la efectividad antimicrobiana del NaOCl en concentraciones de 0,5, 1, 2,5, 4 y 5,25%, sobre E. faecalis. Ambos grupos de investigadores señalan que el tiempo requerido para la erradicación total del microorganismo fue inversamente proporcional a la concentración del mismo; así, el NaOCl al 5,25% erradicó a E. faecalis en 15-30 segundos de contacto y a una concentración de 0,5% tardó 30 minutos. 4.1.1.2 Digluconato de clorhexidina El digluconato de clorhexidina (CH) ha sido recomendado para la irrigación del SCR de dientes infectados debido a su acción antimicrobiana y a su absorción por parte de los tejidos dentarios duros con una liberación gradual y prolongada a niveles terapéuticos, llamado frecuentemente efecto residual o sustantividad. Sin embargo, la inhabilidad de la clorhexidina de disolver tejido orgánico ha sido un problema.(65) En un estudio realizado por Dametto et al(65) se evaluó la actividad antimicrobiana del gel de CH al 2% sobre E. faecalis, comparándolo con otros irrigantes como la CH líquida al 2% y el NaOCl al 5,25%. Para evaluar la acción antibacteriana de dichos irrigantes, se tomaron tres muestras microbiológicas, una muestra inicial antes de la preparación biomecánica, una muestra intermedia inmediatamente después de la preparación y una muestra final 7 días después de la misma. Los resultados señalan que al momento de la muestra intermedia, no hubo diferencias significativas en cuanto al irrigante utilizado y el número de colonias detectadas de E. faecalis; sin embargo, a los 7 días de la preparación biomecánica, ambos tipos de CH mostraron la menor cantidad de colonias formadas, muy por encima del NaOCl. Estos autores también apuntan que la CH, tanto en presentación líquida como en gel, es absorbida por el esmalte y la dentina luego de 7 días de la instrumentación e irrigación de los conductos radiculares, y a pesar de que el NaOCl fue igualmente efectivo en la exposición inicial, éste no presenta la propiedad de sustantividad. (65) En este mismo sentido, Vianna et al(63) y Gomes et al(64) realizaron un estudio donde evalúan la efectividad antimicrobiana de la CH al 0,2%, 1% y 2% en líquido y gel sobre E. faecalis. Ambos coinciden en afirmar que el tiempo requerido para la erradicación total del microorganismo fue inversamente proporcional a la concentración del mismo; así, el gel de CH al 2% detuvo el crecimiento del microorganismo al minuto, y el líquido de CH al 2 % necesitó solo 15-30 segundos de contacto para su erradicación. Sena et al(62) coinciden con los estudios de Vianna et al(63) y Gomes et al(64) en cuanto al tiempo de contacto que se requiere entre la CH y E. faecalis, para su erradicación. Estos autores evaluaron la acción antimicrobiana de la CH sobre una biopelícula del microorganismo en cuestión, y a los 30 segundos, se consiguió la eliminación total de E. faecalis. 4.1.1.3 MTAD® El MTAD, cuyo nombre se origina de las palabras en inglés Mixture of Tetracycline Acid and Detergent, es un irrigante final del SCR constituído por una mezcla de un isómero de tetraciclina (doxiciclina), un ácido, y un detergente amonio cuaternario. Su presentación comercial se conoce como Biopure MTAD® (66,67) Kho y Baumgartner(68) evaluaron y compararon la acción antimicrobiana de la irrigación con NaOCl al 1,3% y Biopure MTAD® y de NaOCl al 5,25% y EDTA en los 5mm apicales de dientes infectados con E. faecalis. El tiempo de irrigación final para ambos grupos fue de 2 minutos. En sus resultados no obtuvieron diferencias significativas en cuanto al número de colonias formadas cuando se utilizaron los dos tipos de irrigación final. A pesar de que los irrigantes pueden penetrar dentro de los túbulos dentinarios, no significa que la concentración de dichos irrigantes sea suficiente para eliminar todo tipo de microorganismo presente, y que la preparación biomecánica por sí sola no es capaz de erradicar al 100% la microbiota existente.(68) Shabahang y Torabinejad(66) y Torabinejad et al(67) no obtienen los mismos resultados obtenidos por Kho y Baumgartner(68); ambos grupos de investigadores utilizaron la misma metodología de estudio y en sus resultados obtuvieron que ninguna de las 15 muestras pertenecientes al grupo donde la irrigación final se hizo con Biopure MTAD® mostró crecimiento bacteriano luego de una semana. Estos autores atribuyen estos resultados a la porción de doxiciclina presente en el Biopure MTAD®, entre cuyas propiedades están la actividad anticolagenasa, su bajo pH, su capacidad de adherirse a la dentina y su capacidad de ser liberada con el tiempo. (66,67) Con relación a las propiedades que presenta cada uno de los componentes del Biopure MTAD®, Krause et al(69) evaluaron el efecto antimicrobiano que presenta el Biopure MTAD® y dos de sus componentes por separado, la doxiciclina y el ácido cítrico, sobre E. faecalis. Utilizaron dos modelos de estudio in vitro, un modelo de diente bovino y un modelo de zonas de inhibición. Las muestras fueron irrigadas con 60µL durante un tiempo de 10 minutos. Entre sus resultados señalan que en ambos modelos de evaluación, la doxiciclina fue el irrigante que mostró mejor efecto antimicrobiano sobre E. faecalis, en comparación con el ácido cítrico y el Biopure MTAD®. También acotan que la concentración de doxiciclina utilizada en el estudio fue al 10%, una concentración mayor que la que se encuentra presente en el Biopure MTAD® que es al 3%.(69) A pesar de esto, los resultados de este estudio sugieren que la porción de doxiciclina presente en el Biopure MTAD® es la que provee el efecto antimicrobiano del irrigante, debido a que el ácido cítrico no fue lo suficientemente bactericida en ninguno de los dos modelos de estudio.(69) Así mismo lo afirman Portenier et al(70) y Davis et al(71) quienes compararon la acción antimicrobiana del Biopure MTAD® con la CH al 2% sobre E. faecalis, resultando más efectivo el Biopure MTAD® en un período de 5 minutos. Davis et al(71) señalan que en su estudio no se evaluó la propiedad de sustantividad de la CH, sólo su habilidad de inhibir el crecimiento del microorganismo. Por tal razón, quizás clínicamente, la CH pudiera presentar mayor espectro antimicrobiano. 4.1.2 Medicación intraconducto E. faecalis se ha caracterizado por tener la capacidad de sobrevivir en medios ambientes áridos y a numerosos protocolos de irrigación y medicaciones intraconductos. Muchos han sido los medicamentos probados para la erradicación del mismo, entre ellos el hidróxido de calcio (Ca(OH)2), el digluconato de clorhexidina (CH) y el paramonoclorofenol alcanforado. 4.1.2.1 Hidróxido de calcio El hidróxido de calcio (Ca(OH)2), descubierto por Herman en 1920(1,5), ha sido la medicación intraconducto de elección para los dientes con lesiones perirradiculares persistentes. Sin embargo, numerosos estudios revelan la resistencia de E. faecalis a los efectos antibacterianos de dicha medicación. (72,73,74,75) Con relación a esto, Evans et al(76) evaluaron los mecanismos a través de los cuales E. faecalis es capaz de sobrevivir al alto pH del Ca(OH)2. Estos autores analizaron la respuesta de estrés de E. faecalis frente a agentes antimicrobianos exponiendo las células a concentraciones sub-letales de NaOCl y Ca(OH)2. Sus resultados señalan que frente al Ca(OH)2 a un pH de 11,1 por 30 minutos, sólo el 0,4% de las células lograron sobrevivir; sin embargo, el aumento de los valores de pH a 11,5 resultó en una lisis celular completa. La capacidad de ciertos microorganismos de producir una respuesta de estrés con síntesis de proteínas generales o específicas inducidas por la misma, forma parte de los mecanismos de supervivencia más importantes. La producción de estas proteínas es una respuesta biológica fundamental en numerosas especies bacterianas y protege a las células de situaciones adversas. Para comprobar la función de estas proteínas en la supervivencia de E. faecalis frente al pH alcalino del Ca(OH)2, la producción de éstas fue bloqueada con cloranfenicol durante el pretratamiento y fue removido con la colocación del Ca(OH)2. (76) Estos autores refieren que el bloqueo de la producción de las proteínas inducidas por el estrés no tuvo efecto en la supervivencia celular, lo cual señala que la producción de proteínas inducidas por estrés no es realmente importante para la supervivencia de E. faecalis a un alto valor de pH. (76) Por el contrario, Evans et al(76) señalan que el sistema de transporte de protones, lo cual lleva a los protones al interior de la célula para acidificar el citoplasma, sí cumple una función critica en la supervivencia de E. faecalis frente a medios ambientes con pH alcalino. (76) El Ca(OH)2 ha sido mezclado con diferentes vehículos con el fin de lograr aumentar sus propiedades antibacterianas y así erradicar los microorganismos prevalentes de las infecciones endodónticas persistentes. Con relación a esto, Cwikla et al(77) evaluaron la actividad antimicrobiana del Ca(OH)2 en tres presentaciones contra E. faecalis. Se utilizaron tres vehículos, agua destilada, potasio iodado y Metapex® compuesto por iodoformo y aceite de silicona. El período de estudio fue de una semana y sus resultados señalan que el grupo donde se evidenció la menor reducción bacteriana fue donde se utilizó el Ca(OH)2 solo. Estos autores señalan que el Ca(OH)2 por sí mismo no fue efectivo en la erradicación del microorganismo a profundidades de 250µm dentro de los túbulos dentinarios; esto quizás es debido a la inhabilidad de la pasta de Ca(OH)2 de penetrar efectivamente dentro de ellos, resultando en una dosis sub-letal de agente antimicrobiano a esa profundidad.(77) Sin embargo, Lynne et al(78) no concuerdan con los resultados de los estudios mencionados anteriormente. Estos autores evaluaron la actividad antimicrobiana del Ca(OH)2 en polvo por un período de 24 horas, comparándolo con la CH al 0,12% a distintas profundidades en túbulos dentinarios infectados con E. faecalis, y señalan que el grupo donde se utilizó Ca(OH)2 al 10% combinado con agua estéril fue el grupo donde se evidenció la menor cantidad de microorganismos en las tres profundidades estudiadas (de 89 a 94% de erradicación bacteriana). Estos autores señalan que en su estudio queda demostrado que E. faecalis es capaz de penetrar profundamente dentro de los túbulos dentinarios luego de 24 horas. También señalan que las propiedades presentes en el Ca(OH)2 pueden verse afectadas por el vehículo utilizado; así, refieren que cuando es mezclado con CH, puede reducir la actividad antibacteriana del mismo afectando sus propiedades físicas y químicas.(78) Siqueira et al(79) realizaron una serie de tres estudios donde evalúan el potencial de la irrigación con NaOCl al 2,5% y la utilización de tres medicaciones intraconducto diferentes. El primer estudio clínico se basó en la determinación de la reducción bacteriana luego de la preparación químico-mecánica con NaOCl al 2,5% y medicación intraconducto con Ca(OH)2. Se tomaron tres muestras, la primera al momento de iniciar la terapia endodóntica, la segunda luego de la preparación químico-mecánica con NaOCl, y la tercera luego de 7 días de medicación intraconducto con Ca(OH)2 mezclado con glicerina. Los resultados de este estudio señalan que al momento de la primera muestra, todos los conductos radiculares presentaban microorganismos; en la segunda muestra, el 45,5% de los casos presentaban bacterias cultivables, mientras que en la tercera muestra sólo 2 casos (18,2%) resultaron positivos. Estos porcentajes confirman la reducción significativa en el número de bacterias de conductos radiculares infectados luego del protocolo usado y, a pesar de no considerarse una diferencia estadísticamente significativa entre las últimas dos muestras, una disminución de 30% en el número de casos con cultivos negativos hace razonable el uso del Ca(OH)2 como medicación intraconducto.(79) Muchos son los estudios donde se compara la efectividad antimicrobiana del Ca(OH)2 con la CH como medicación intraconducto sobre E. faecalis, logrando con ésta última, mejores tasas de erradicación en dientes con lesiones perirradiculares persistentes. A continuación se presentan dichos estudios con el fin de analizar mejor las propiedades que posee la CH para lograr la erradicación de dicho microorganismo. 4.1.2.2 Digluconato de clorhexidina El digluconato de clorhexidina (CH) a distintas concentraciones ha sido empleado como irrigante del SCR o como medicación intraconducto, sólo o combinado con Ca(OH)2 entre otros. Numerosos estudios coinciden en afirmar que la CH posee mayor poder de erradicación de E. faecalis que el Ca(OH)2.(72,73,74,75) Autores como Lin et al(72), Schafer et al(73), Basrani et al(74) y Gomes et al(75) utilizaron la CH como medicación intraconducto por períodos de tiempo de 1 a 15 días y la compararon con muestras donde se utilizó el Ca(OH)2 solo o donde se combinaban ambas medicaciones, logrando la erradicación total del microorganismo en aquellos grupos donde se utilizaba la CH sola. Igualmente, evaluaron la presentación en la que se encontraba el medicamento, en gel o líquido, y no encontraron diferencias significativas en cuanto a su efectividad. Gomes et al(75) señalan que la combinación de ambas medicaciones fue efectiva sólo en cortos períodos de tiempo; esto se atribuye a su alto pH, sugiriendo un incremento en la capacidad iónica de la molécula de CH. Sin embargo, aunque la combinación incrementa el pH, el Ca(OH)2 puede disminuir la actividad antibacteriana de la CH posiblemente debido a la pérdida en su capacidad de adherirse a la pared celular de la bacteria. Con relación a la capacidad antimicrobiana que presenta la combinación entre el Ca(OH)2 y la CH como medicación intraconducto, el segundo estudio realizado por Siqueira et al(80) confirma su potencial antibacteriano. Ellos evaluaron la reducción bacteriana luego de la preparación químico-mecánica usando CH al 0,12% y de la colocación de Ca(OH)2mezclado con CH al 0,12% como medicación intraconducto. Igualmente tomaron tres muestras a lo largo de toda la terapia endodóntica, y evidenciaron que luego de la preparación químico-mecánica hubo una disminución de 46,2% en el número de bacterias presentes, y luego de la medicación disminuyó a 7,7%. Estos autores apuntan que la diferencia en cuanto al número de bacterias contadas entre la segunda y la tercera muestra fue estadísticamente significativa, por lo que sugieren el uso de otros antisépticos en conjunto con el Ca(OH)2 para aumentar su actividad antimicrobiana dentro del SCR.(80) Las propiedades de la CH dentro de los túbulos dentinarios pueden verse aumentadas cuando se retira la capa de desecho de los mismos, gracias a la acción de quelantes que permitan su paso a través de ellos. Así lo demuestran Yan et al(81) quienes evaluaron la adhesión de E. faecalis a bloques de dentina que fueron tratados con EDTA al 17% y CH al 2% por 7 días y evidenciaron menor adhesión del mismos a las paredes dentinarias. Yan et al(81) señalan que la CH a sido empleada como medicación intraconducto gracias a su propiedad de sustantividad, la cual se da por la liberación de moléculas cargadas positivamente provenientes de la dentina tratada con CH. Estas moléculas liberadas se adhieren a la bacteria, interfiriendo así con su adhesión a la dentina y causando daño en la membrana celular. Mas recientemente, Paquette et al(82) en el 2007, evaluaron la eficiencia antibacteriana de la CH al 2% como medicación intraconducto in vivo. En este estudio se utilizaron 22 dientes con periodontitis apical persistente, se instrumentaron en una primera sesión y se medicaron con CH para ser evaluados 7 y 15 días después. Las muestras fueron obtenidas antes de acceder a la cámara pulpar y luego de la preparación biomecánica en una primera sesión, y antes y después de la irrigación con CH en una segunda sesión. Sus resultados señalan que a los 7 días de medicación se evidenció una disminución en el número de colonias formadas de un 3%, y a los 14 días de un 19%, lo cual no es una diferencia estadísticamente significativa. Estos autores afirman que la CH líquida al 2% aplicada in vivo como medicación intraconducto de 7 a 15 días no disminuye el número de dientes con cultivos negativos o no reduce el número de bacterias contadas luego de haber realizado la preparación biomecánica en una primera sesión. A pesar de que el crecimiento bacteriano es menor comparado con otros estudios, los beneficios potenciales de la CH indicadas en estudios in vitro, no pudo ser demostrada in vivo.(82) 4.1.2.3 Paramonoclorofenol alcanforado Los compuestos fenólicos han sido utilizados ampliamente en los tratamientos dentales como antisépticos y sedantes en aplicaciones tópicas en dentina y tejido pulpar. El paraclorofenol es sólido a temperatura ambiente y líquido en alcanfor. La adición del alcanfor causa una liberación lenta del paraclorofenol; esto hace que el medicamento sea menos caústico. Se ha encontrado que el paramonoclorofenol es citotóxico para las células del ligamento periodontal inhibiendo su viabilidad y proliferación, así como también es tóxico para las células pulpares y macrófagos causando inflamación tisular.(83) Con relación al uso de compuestos fenólicos con otras medicaciones intraconducto, Sukawat y Srisuwan(84) compararon el efecto antibacteriano de tres fórmulas distintas de Ca(OH)2 sobre E. faecalis. Las mezclas utilizadas fueron Ca(OH)2 con agua destilada, Ca(OH)2 con CH al 0,2% y Ca(OH)2 mezclado con paramonoclorofenol (CMCP), en un período de tiempo de 7 días. Ellos concluyen que la pasta de Ca(OH)2 mezclado con CMCP fue la medicación intraconducto más efectiva en este estudio. Luego de que el Ca(OH)2 se mezcla con CMCP, la sal cálcica paramonoclorofenolada libera paramonoclorofenol e iones hidroxilos, ambos bactericidas. Los compuestos fenólicos tienen una baja tensión superficial, por lo que fluyen fácilmente dentro de los túbulos dentinarios. En el tercer estudio realizado por Siqueira et al(85) evaluaron la reducción bacteriana luego de la instrumentación e irrigación con NaOCl al 2,5% y medicación intraconducto con Ca(OH)2 mezclado con CMCP. Igualmente se tomaron tres muestras, y sus resultados señalan que si hubo diferencia estadísticamente significativa entre la muestra tomada luego de la irrigación y preparación biomecánica y la muestra luego de 7 días de medicación intraconducto, 54,5 y 9,1% respectivamente. Estos autores afirman que a pesar de la citotoxicidad conocida de los compuestos fenólicos, la respuesta de los tejidos periapicales a la medicación de Ca(OH)2 con CMCP es favorable. Ellos señalan que esta asociación probablemente deba su biocompatibilidad a la liberación lenta de CMCP de la pasta medicamentosa; el efecto desnaturalizante del Ca(OH)2 sobre los tejidos conectivos, el cual previene la penetración tisular del CMCP, reduce su toxicidad.(85) 4.1.3 Durante la obturación Se ha evaluado la actividad antimicrobiana de ciertos componentes que pueden ser utilizados al momento de la obturación definitiva del SCR, todo ello con la intención de erradicar la presencia de E. faecalis del interior de los mismos, bien sea añadido a los cementos selladores o a las puntas de gutapercha ya conocidas comercialmente. 4.1.3.1 Puntas de gutapercha Las puntas de gutapercha con medicaciones en su composición han sido probadas en la erradicación de diversos microorganismos, dando resultados no muy satisfactorios. Así lo comprueban Lui et al(86) y Dartan et al(87) quienes evaluaron la sensibilidad in vitro de E. faecalis a puntas de gutapercha que contienen Ca(OH)2 y CH. En ambos estudios, los resultados señalan la existencia de colonias bacterianas luego de 14 días de colocación de las puntas de gutapercha con medicamentos, lo que confirma la poca o nula actividad antimicrobiana que cumplen estos medicamentos dentro de las puntas de gutapercha. Lui et al(86) señalan que las puntas impregnadas con CH no poseen una actividad inhibitoria suficiente para eliminar microorganismos patógenos como es E. faecalis del interior de los túbulos dentinarios. 4.1.3.2 Cementos selladores Distintos cementos selladores han sido estudiados para comprobar su actividad antimicrobiana sobre E. faecalis. Así lo reportan en el 2003 Mickel et al(88) quienes evaluaron 4 cementos selladores, entre ellos el Roth 811®, el Kerr EWT®, el Sealapex® y el AH Plus®. El efecto antibacteriano fue medido por zonas de inhibición creadas por los cementos selladores sobre el microorganismo. En sus resultados señalan que los cementos selladores que mostraron evidencia de zonas de inhibición fueron el Roth 811®, el Sealapex® y el Kerr EWT®. Por el contrario, el AH Plus® no mostró zonas de inhibición sobre E. faecalis. Estos autores señalan que los estudios in vitro no son la forma más adecuada de demostrar la eficacia antimicrobiana de los cementos selladores, ya que el ambiente dentro de los túbulos dentinarios es diferente a las placas de agar donde se llevaron a cabo los experimentos. Está comprobado que las bacterias pueden colonizar el interior de los túbulos dentinarios, por lo que el cemento sellador de elección debe poseer una alta capacidad de difusión para actuar como un agente antimicrobiano efectivo.(88) Contrario a los resultados obtenidos por Mickel et al(88), el grupo de investigadores encabezado por Saleh et al(89) señalan que el cemento sellador AH Plus® es efectivo en la erradicación de E. faecalis en un período de tiempo de 7 días, al igual que el cemento sellador de Grossman®. Estos resultados muestran que el uso de estos cementos selladores erradica in vitro todos los microorganismos de los túbulos dentinarios en un perímetro de 300µm dentro del conducto radicular.(88) 4.1.4 Métodos experimentales Numerosos investigadores se han visto en la necesidad de buscar nuevas herramientas para la erradicación total de E. faecalis, entre las que destacan la utilización del láser y la desinfección fotoactivada no invasiva avanzada, entre otras. Así lo demuestran George y Kishen(90) quienes evaluaron la citotoxicidad y selectividad de la desinfección fotoactivada no invasiva avanzada (ANILAD) sobre E. faecalis y los fibroblastos localizados adyacentes al foramen apical. El ANILAD, según señalan los autores es una terapia fotoactivada antimicrobiana avanzada que se lleva a cabo en dos pasos y se utiliza para la desinfección del SCR. En el primer paso, es aplicado el fotosensibilizador que facilita la difusión dentro de las complejidades anatómicas y los túbulos dentinarios. En el segundo paso, el medio de irradiación que contiene fluordecahidronaftaleno reemplaza parcialmente al fotosensibilizador en el conducto radicular. Cuando se irradia con una longitud de onda apropiada, el medio de irradiación sirve como ducto óptico para transmitir la energía eléctrica a través del SCR.(90) Los resultados in vitro y ex vivo mostraron que la citotoxicidad fue menor comparada con el NaOCl. Una dosis de radiación produjo un 97,7% de erradicación microbiana, mostrando sólo un 30% de disfunción de los fibroblastos. El ANILAD mostró un efecto bactericida dependiente de la concentración utilizada, con menores efectos tóxicos sobre las células fibroblásticas. Esta disminución en la citotoxicidad pudiese ser atribuída al corto tiempo de vida y la distancia mínima de difusión de los radicales libres de oxígeno.(90) Por su parte, Eldeniz et al(91) compararon la eficacia antimicrobiana del NaOCl al 3% con la irradiación con láser Er,Cr:YSGG (erbium, chromium: yttrium-scandium-gallium-garnet) en conductos radiculares infectados con E. faecalis. Este láser usa puntas de fibra endodónticas delgadas y flexibles de varios diámetros y longitudes, lo cual le facilita el acceso a los tejidos pulpares y a la estructura dentaria, así como también prepara el conducto radicular para su obturación. El tiempo de contacto con el NaOCl fue de 15 minutos. Estos autores concluyeron que la irradiación con laser Er,Cr:YSGG redujo la población microbiana en un 96%, es decir, no logró erradicar la totalidad de los microorganismos presentes en los conductos radiculares; mientras que el NaOCl al 3% a los 15 minutos, inhibió completamente el crecimiento de E. faecalis y desinfectó todos los conductos radiculares. Ellos atribuyen la desinfección con la irradiación de láser a las puntas de fibra con un diámetro endodóntico de 200µm, la cual mejora la dirección de la luz del láser dentro de los conductos radiculares.(91) Otro tipo de terapia con láser probada en el campo endodóntico es el láser rojo o terapia fotodinámica. Silva et al(92) evaluaron la acción de este tipo de láser en la reducción de E. faecalis en el SCR in vitro. La muestra fue dividida en dos grupos, el grupo químico fue irrigado con NaOCl al 0,5% durante 30 minutos, mientras que en el grupo del laser, la pasta fotosensibilizadora se mantuvo en los conductos radiculares por 5 minutos y luego fue irradiado con la luz de láser durante 3 minutos. Los resultados de este estudio señalan que el fotosensibilizador o el laser por sí mismos no lograron tener efecto bactericida; sin embargo, cuando fueron probados en conjunto, se logró una reducción bacteriana del 99,2% en comparación con la solución química que redujo la población microbiana en un 93,25%. Esta diferencia es estadísticamente significativa, lo que comprueba la efectividad de la terapia con láser como coadyuvante en la terapia endodóntica para la erradicación de E. faecalis del SCR.(92) 4.2 Control microbiológico con medicación sistémica utilizada como medicación intraconducto Los antibióticos no son considerados como parte del procedimiento de rutina en la terapia endodóntica. Además el efecto de los antibióticos sistémicos sobre las bacterias que habitan el SCR, parece ser escaso. Sin embargo, en las infecciones endodónticas, se han combinado el uso de antibióticos con las medicaciones intraconducto como el Ca(OH)2 y con los cementos selladores, para aumentar el espectro antimicrobiano de los mismos. Muestra de ello es el estudio realizado por Hoelscher et al(93) quienes evaluaron el efecto antimicrobiano de 5 compuestos: la amoxicilina, la penicilina, la clindamicina, el metronidazol y la doxiciclina, mezclados con el cemento sellador Kerr EWT® sobre E. faecalis. Los resultados señalan que la combinación entre el cemento sellador y la amoxicilina, la penicilina, la clindamicina y la doxiciclina muestran una diferencia significativa en cuanto a zonas de inhibición cuando se compara con el cemento sellador solo. Sin embargo, no hubo diferencias entre el cemento sellador solo y la combinación con metronidazol. Estas diferencias pueden ser producto de la baja sensibilidad de E. faecalis al metronidazol, el tipo específico de microorganismo utilizado y su resistencia potencial, o a la poca solubilidad y difusión del metronidazol en el medio de agar. Por su parte, Molander y Dalhén(94) realizaron un estudio donde evaluaron el potencial antibacteriano de la tetraciclina y la eritromicina mezclada con Ca(OH)2 como medicación intraconducto sobre E. faecalis in vivo. El tiempo de contacto con la medicación intraconducto fue de 30 días, y obtuvieron que la mezcla con tetraciclina fue efectiva contra E. faecalis en un 79% de los casos (22 de 28); en 7 dientes se pudieron observar otras especies de microorganismos, por lo que el efecto antibacteriano total fue de un 54%. Con relación a la mezcla con eritromicina, fue efectiva en un 96% de los casos (26 de 27); en 11 dientes se pudieron observar otras especies de microorganismos, por lo que su efecto antibacteriano total fue de 56%. Ellos concluyen que el tratamiento antimicrobiano de Ca(OH)2 con eritromicina o tetraciclina tuvo un efecto significativo sobre E. faecalis, pero el efecto antimicrobiano total fue poco convincente. También se han realizado investigaciones donde se evalúa el espectro antimicrobiano de los antibióticos como medicación intraconducto. Así, Pinheiro et al(95) realizan un estudio donde evalúan la sensibilidad de E. faecalis aislados de conductos radiculares con lesiones periapicales, frente a diversos antimicrobianos, entre los cuales se encuentran bencil-penicilina, amoxicilina, ácido clavulánico, eritromicina, azitromicina, vancomicina, cloranfenicol, tetraciclina, doxiciclina, ciprofloxacina y moxifloxacina. Ellos obtuvieron como resultado que cepas aisladas de E. faecalis fueron completamente sensibles in vitro a la amoxicilina, amoxicilina con ácido clavulánico, vancomicina y moxifloxacina. Una menor cantidad de estos microorganismos fueron sensibles al cloranfenicol, tetraciclina, doxiciclina o ciprofloxacina. La eritromicina y la azitromicina fueron los antibióticos menos efectivos.
DISCUSION La importante participación de los microorganismos en la etiopatogenia de las patologías pulpares y periapicales está claramente establecida desde mediados de los años '60, cuando quedó demostrado por el estudio de Kakehashi et al(39) que las bacterias y sus productos eran considerados como los agentes etiológicos primarios de la necrosis pulpar y de las lesiones periapicales. Esta premisa ha sido corroborada por numerosas investigaciones desde 1960 hasta nuestros días(13,14,15,19,40,43,58) Gracias al perfeccionamiento y descubrimiento de nuevos métodos moleculares de detección e identificación de la microbiota endodóntica, se han podido evidenciar numerosas especies de microorganismos que actúan de manera importante en el desarrollo de las lesiones perirradiculares. Así lo demuestran Siqueira y Rocas(14,43,58) junto a otros investigadores(13,15,19,41,44,48,50,53), quienes analizaron una recopilación de estudios evaluando la microbiota presente en las infecciones endodónticas primarias y persistentes, observando especies de microorganismos como T. forsythia, D. pneumosintes, F. alocis y E. faecalis entre otras, nunca antes detectadas a través de cultivos microbiológicos tradicionales. Un gran número de estudios coinciden en afirmar que E. faecalis es el microorganismo mayormente aislado de las infecciones endodónticas persistentes.(43,49,51-55,58) Diversas investigaciones han tratado de establecer y comprobar el mecanismo de resistencia de E. faecalis a todo lo concerniente con la terapia endodóntica(1,2,5,7,8,9,10,24,26,27,28,56); a pesar de ello, el mecanismo exacto de supervivencia sigue siendo incierto. Numerosos autores relacionan su capacidad de sobrevivir en medios ambientes áridos con la presencia de factores de virulencia como la sustancia de agregación(1,2,5,24) y las proteínas de superficie(26,27,28), entre otros factores presentes en el microorganismo. Así mismo se ha documentado la capacidad de E. faecalis de formar biopelículas(1,5,8,9,10), lo cual aumenta su resistencia a los protocolos de irrigación y medicación intraconducto gracias a la unión con otros microorganismos. Portenier et al (1) señalan que existen tres hipótesis que pueden explicar la resistencia de estas biopelículas de E. faecalis a los medicamentos. La primera hipótesis se refiere a la reducción o baja penetración del medicamento a través de la misma; la segunda se basa en los posibles cambios en el medio ambiente químico de la biopelícula y la tercera todavía en discusión, pero sugiere que las sub-poblaciones de bacterias dentro de la biopelícula adquieren capacidad fenotípica diferente. Love(56) por su parte, señala que E. faecalis posee la habilidad de invadir los túbulos dentinarios y mantenerse viable dentro de ellos y también de adherirse al colágeno presente en la dentina, gracias a la presencia de factores de virulencia que le permiten expresar proteínas para asegurar su supervivencia celular y de competir con otras células bacterianas alterando la respuesta del hospedero y el medio ambiente. En cuanto a la capacidad de sobrevivir a irrigantes y medicaciones intraconducto, numerosos autores se han dado a la tarea de evaluar en profundidad la acción de dichos medicamentos sobre la virulencia y supervivencia del microorganismo(60-89). E. faecalis es el microorganismo más resistente a los efectos antibacterianos del hidróxido de calcio(72-75). Evans et al(76) señalan que la síntesis de proteínas inducidas por el estrés no participa de manera importante en la supervivencia del microorganismo a altos valores de pH; sin embargo, el transporte de protones al interior de la célula si cumple una función critica en la supervivencia frente a estos medios ambientes. Por el contrario, E. faecalis ha demostrado cierta debilidad ante la presencia de medicación intraconducto con clorhexidina(72-75). Yan et al(81) señalan que la CH posee la capacidad de sustantividad, la cual se da por la liberación de moléculas cargadas positivamente provenientes de la dentina tratada con CH estas moléculas liberadas se adhieren a la bacteria, interfiriendo así con su adhesión a la dentina y causando daño en la membrana citoplasmática. Igualmente, numerosas investigaciones apoyan el poder antimicrobiano de irrigantes como el hipoclorito de sodio y la clorhexidina sobre E. faecalis(60,62,63,64,65). Estos irrigantes, a diferentes concentraciones y presentaciones, han demostrado ser capaces de erradicar a este microorganismo del interior del SCR, gracias a sus numerosas propiedades antibacterianas. Mas recientemente, se ha tratado de erradicar a E. faecalis del interior del SCR mediante terapias basadas en la irradiación con láser(90,91,92). Aunque todavía es muy pronto para verificar los beneficios de estas terapias con láser, los resultados obtenidos por estos autores(90,91,92) han resultado ser satisfactorios no sólo sobre E. faecalis, sino sobre otros microorganismos presentes, apuntando hacia una nueva era en la desinfección del SCR.
CONCLUSIONES 1. La microbiota encontrada en dientes con tratamiento de conductos previo y periodontitis apical se caracteriza por una monoinfección (presencia de 1 o tres especies) con predominio de microorganismos Gram positivos, y mayormente especies anaerobias facultativas, siendo el microorganismo más aislado Enterococcus faecalis. 2. Enterococcus faecalis posee numerosos factores de virulencia, entre los que se encuentran la sustancia de agregación, las proteínas de superficie, el ácido lipoteicoico, la gelatinasa y la hemolisina entre otros, todos ellos importantes y fundamentales para su supervivencia y crecimiento dentro del sistema de conductos radiculares previamente obturado, donde las condiciones ambientales son pobres y la cantidad de oxígeno molecular y nutrientes son escasos o nulos. 3. Enterococcus faecalis ha demostrado poseer la capacidad de formar biopelículas entre especies del mismo género o con otros microorganismos, lo que lo hace ser más resistente a los protocolos de limpieza y conformación del sistema de conductos radiculares durante la terapia endodóntica. 4. Muchos han sido los protocolos de irrigación utilizados para la erradicación de este microorganismo; sin embargo, la combinación entre el irrigante de elección en la terapia endodóntica, el hipoclorito de sodio, y la clorhexidina al 2% han demostrado ser capaces de lograr la erradicación total de Enterococcus faecalis. 5. Gracias a su capacidad de penetración dentro de los túbulos dentinarios y de adherirse a las paredes de colágeno de la dentina radicular, Enterococcus faecalis es capaz de resistir medicaciones intraconducto con altos valores de pH como el hidróxido de calcio. Sin embargo, al combinar las propiedades antibacterianas del hidróxido de calcio con la sustantividad de la clorhexidina al 2%, las tasas de erradicación del microorganismo son un poco más elevadas. 6. Actualmente se han empleado diversas terapias basadas en el uso de la irradiación con láser dentro del sistema de conductos radiculares para la eliminación total de Enterococcus faecalis. Aunque todavía es muy pronto para verificar los beneficios de éstas, los resultados de los estudios apuntan a una desinfección más completa y segura de los conductos radiculares infectados, no sólo al actuar sobre este microorganismo, sino sobre toda la microbiota presente en ellos.
REFERENCIAS
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||