|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"Evaluación de Un Protocolo de Atención Endodóntica en Dientes con Diagnóstico de Necrosis Pulpar" por: Dr. Luis Felipe Jiménez Rojas Odontólogo. Universidad Central de Venezuela. 2010 Especialista en Endodoncia. Universidad Central de Venezuela 2015 e-mail: luisfelipe_jimenez@hotmail.com
INTRODUCCIÓN La tendencia reflejada a nivel mundial según datos de la Organización Mundial de la Salud (OMS), sumados a los resultados expuestos por el Instituto Nacional de Estadística (INE), coinciden en indicar que "en los últimos decenios la esperanza de vida ha mejorado mucho en el mundo", motivo por el cual el ciudadano en general debe hacer lo posible para mantener la calidad de vida, concientizando entre otros aspectos, lo referente a la salud bucal, dentro de la cual, la terapia endodóntica juega un papel preponderante 1, 2. Algunos autores han establecido la sintomatología y las características clínicas y radiográficas como criterios para evaluar la evolución de los tratamientos endodónticos. Se puede señalar como evidencia de éxito la ausencia de dolor, de edema o fístula, el mantenimiento de la función y la disminución o resolución radiográfica de lesiones periapicales preexistentes. En cuanto a los criterios de fracaso, se puede mencionar: presencia de dolor, edema, fístula, pérdida de la función e incremento o desarrollo de una lesión periapical que no existía previamente 3, 4. Chevigny et al. (2008) han realizado un amplio proyecto en el cual plantearon criterios para definir el éxito y el fracaso de los tratamientos de conductos, algunos de los cuales serán empleados en la elaboración del presente trabajo. Estos autores encontraron un 86% de éxito reflejado por ausencia de signos, síntomas y lesiones periapicales 5. Chevigny et al. (2008) indicaron que el 95% de los tratamientos fueron catalogados como funcionales debido a la ausencia de síntomas y signos, independientemente de su valor en la escala del Índice Periapical 5. En Venezuela, existen reportes epidemiológicos sobre resultados de los tratamientos endodónticos a corto, mediano y largo plazo, realizado en pacientes con infección por VIH y/o hepatitis que acudieron al centro de atención de personas con enfermedades infectocontagiosas "Dra. Elsa La Corte" (CAPEI) de la Facultad de Odontología de la Universidad Central de Venezuela 6, 7; sin embargo, no se han reportado datos epidemiológicos actualizados a nivel nacional de pacientes que no posean enfermedades infectocontagiosas. Se plantea diseñar y aplicar un protocolo clínico estandarizado de atención endodóntica, en un estudio prospectivo, para evaluar la evolución de los tratamientos de conductos en dientes con diagnóstico de necrosis pulpar, realizados en el Postgrado de Endodoncia (PE) de la Facultad de Odontología (FO) de la Universidad Central de Venezuela (UCV), en el período comprendido entre Abril a Julio de 2014; cuyos resultados permitirán comparar con datos epidemiológicos obtenidos a nivel mundial, pudiendo servir de base para futuras investigaciones relacionadas con la evaluación de los tratamientos de conductos radiculares realizados en dientes con diversas patologías.
OBJETIVO GENERAL Evaluar un protocolo clínico de atención endodóntica en dientes con diagnóstico de necrosis pulpar, por medio de resultados clínicos y radiográficos obtenidos de los tratamientos de conductos realizados en el Postgrado de Endodoncia (PE) de la Facultad de Odontología (FO) de la Universidad Central de Venezuela (UCV) en el periodo comprendido entre Abril a Julio de 2014.
OBJETIVOS ESPECÍFICOS
MARCO TEORICO La endodoncia es la especialidad odontológica que permite diagnosticar y tratar las enfermedades del órgano dentino-pulpar, así como la consecuente afección de los tejidos periodontales circundantes 8, por lo que los objetivos fundamentales del tratamiento endodóntico consisten:
Para lograr estos objetivos, es imprescindible la eliminación de los microorganismos que constituyen el principal factor etiológico de las lesiones pulpares y periapicales, durante los procedimientos de limpieza y conformación del sistema de conductos radiculares (SCR), lo cual ha sido ampliamente comprobado desde mediados del siglo XX 8. Desde los inicios de la práctica endodóntica, los clínicos han tenido interés en la estandarización de la técnica usada para la realización de los tratamientos de conducto y de esta manera obtener resultados predecibles a largo plazo y que luego puedan ser comparados entre si, como lo indicó Ingle en 1961 y 10 Kerekes y Tronstad en 1979 11.
NECROSIS PULPAR La literatura reporta diferentes definiciones de necrosis pulpar basados en características clínicas e histológicas, algunas de las cuales serán expuestas a continuación: Según Seltzer (1979) la necrosis pulpar ha sido atribuida a una "autocompresión" u obstrucción de su aporte sanguíneo como resultado de la presión de los vasos apicales ejercida por el edema inflamatorio presente, sin embargo, el drenaje de la pulpa no se realiza directamente a través del foramen apical sino a través de una red en forma de canasto que envuelve toda la raíz, de tal manera que la obstrucción de uno o más vasos apicales, no resultaría en un cierre completo del sistema de drenaje 12. Lasala (1992) la denomina como muerte de la pulpa, con el cese de todo metabolismo y, por tanto, de toda capacidad reactiva. De manera particular emplea el término de necrosis cuando la muerte pulpar es rápida y aséptica, y denomina necrobiosis si se produce lentamente como resultado de un proceso degenerativo o atrófico 13. El término de necrobiosis propuesto por Grossman (1981) y señalado por Lasala (1992) es aplicado cuando el tejido pulpar está tanto inflamado como necrótico e infectado. El factor principal en este proceso degenerativo es la presencia de bacterias en la parte necrótica de la pulpa, que puede estar localizado tanto en la porción coronal de la pulpa cameral acompañado del tejido apical inflamado, como en los diferentes conductos de un diente multirradicular 14. Abbott y Yu (2007) consideran que se puede sospechar de necrosis pulpar cuando el diente no responde a las pruebas de sensibilidad. Sin embargo, esto no siempre es determinante, ya que se ha observado dientes con calcificación de la pulpa dental, obturaciones previas o pulpotomías que tampoco responden a estas pruebas 14. La Asociación Americana de Endodoncia, en el año 2009, publica una nueva terminología para el diagnóstico clínico, en la cual se indica que la necrosis pulpar se refiere a una categoría de diagnóstico clínico que indica la muerte de la pulpa dental, la cual no responde a las pruebas pulpares de sensibilidad 15, 16. La necrosis es una afección posterior a la pulpitis irreversible sintomática o asintomática, o a una lesión traumática del diente, que puede impedir la falta de respuesta a las pruebas pulpares 17, 18. Según Milgram (2009), la necrosis pulpar total es ocasionada por la actuación conjunta de varios factores tales como el aumento en la presión del tejido, la incapacidad de la pulpa para expandirse y la falta de circulación colateral, siendo producto de la acumulación de varias necrosis locales, y enfermedad perirradicular 19. La Facultad de Odontología de la Universidad Central de Venezuela utiliza, basada en la clasificación propuesta por Baume y Fiore-Donno (1962) y Morse (1977), la siguiente clasificación 19:
Por su parte Grossman (1981), citado por Lasala (1992) 14 clasifica la necrosis en dos variables histológicas:
Entre las causas principales de la necrosis se destaca la invasión microbiana producida por caries profunda o traumatismo. Siendo menos frecuentes los procesos degenerativos, atróficos y periodontales avanzados 13, 20. Debido a que raramente ocurre de repente, excepto en casos de traumatismo dental, la necrosis pulpar puede ocurrir en un lapso variable de tiempo en el cual la pulpa se encontraría parcialmente necrótica. La zona de muerte celular se expande hasta lograr la necrosis total de la pulpa. La posterior invasión bacteriana en última instancia, da lugar a un SCR infectado, y sin tratamiento a una periodontitis apical 18. Si la pulpa dental se encuentra en comunicación con la cavidad bucal, se desarrolla un intercambio de fluidos, por lo que el tejido pulpar apical puede permanecer o no inflamado crónicamente. A diferencia, si la apertura dentaria comienza a cerrarse, por empaquetamiento de comida o debido a una restauración, la pulpa en su totalidad se puede necrosar con más rapidez 12.
CARACTERÍSTICAS CLÍNICAS DE LA NECROSIS PULPAR La necrosis pulpar puede ser parcial o completa pudiendo afectar a uno o todos los conductos de un diente multirradicular. Por dicha razón, el diente puede dar lugar a síntomas confusos, en los que las pruebas pulpares sobre una raíz pueden no evocar ninguna respuesta mientras que en otra pueden dar una respuesta de vitalidad. El diente puede mostrar también síntomas de una pulpitis irreversible 17. Se puede dificultar el diagnóstico de los dientes con esta condición debido a la presencia de una mezcla de signos y síntomas tanto de pulpitis como de necrosis séptica. Los síntomas pueden cursar con episodios de dolor punzante, agudo y espontáneo, por varias semanas o meses 14, 18. Es por esta razón que las pruebas clínicas son necesarias para establecer un diagnóstico presuntivo y diferencial, conjuntamente con los signos y síntomas que se obtienen del paciente. Los métodos clínicos disponibles para evaluar el grado de salud o enfermedad del tejido pulpar no son concluyentes si se aplican individualmente, por lo que las pruebas pulpares deberían incluir una combinación de todos los métodos diagnósticos, tales como: (1) Reporte de la historia del diente del paciente, (2) Evaluación radiográfica del contorno de la cavidad pulpar, (3) Examen de la estructura dentaria y sus tejidos, y (4) Respuesta del diente a estímulos térmicos y físicos 19. A través del tiempo, se ha usado la estimulación térmica como medio para determinar la vitalidad de un diente. Las pruebas tanto de calor como de frío se utilizan como auxiliares diagnósticos para distinguir entre una pulpa normal y una pulpa inflamada o necrótica, siendo las respuestas anormales aquellas en la cual el dolor persiste después de retirado el estímulo; en cambio, la falta de respuesta a las pruebas térmicas permite presumir la presencia de necrosis pulpar 19. Las pruebas perirradiculares o mecánicas no son pruebas de vitalidad pulpar, mas bien son indicativos de inflamación del ligamento periodontal, y su objetivo consiste en determinar la presencia o ausencia de inflamación en el espacio periapical, y así es un método indirecto para evaluar el estado de la pulpa. La información obtenida con las pruebas mecánicas positiva, indica una inflamación de los tejidos perirradiculares; sin embargo, la respuesta negativa no es indicativo de una ausencia de inflamación. El dolor a la percusión, tanto vertical como horizontal, sí como a la palpación sobre apical, pueden manifestarse en todas las condiciones pulpares en las que esté presente una necrosis total o parcial 19. Las pruebas de sensibilidad pulpar resultan en una mezcla de respuestas y frecuentemente el paciente describe de una manera confusa o inconsistente los síntomas 14, pudiendo manifestar sensibilidad a la oclusión debido a una hiperoclusión 18. Usualmente los dientes con este diagnóstico no responden a las pruebas de sensibilidad y pueden dar falso positivo (+) en dientes multirradiculares en los que no existe necrosis total de la pulpa dental dentro de los conductos por la presencia de fibras nerviosas remanentes en apical y la estimulación de las fibras del periodonto con dichas pruebas 21. Los dientes con necrobiosis son muy difíciles de diagnosticar, especialmente los multirradiculares, los cuales pueden presentar diferentes condiciones pulpares en las raíces de un mismo diente 18, pudiendo manifestar una periodontitis apical con evidencia radiográfica de ensanchamiento del espacio del ligamento periodontal apical; esta manifestación resultaría inesperada puesto que el paciente puede responder a las pruebas de sensibilidad a estímulos calientes y/o fríos 14, 18. A la evaluación clínica del diente con necrosis pulpar, se puede observar una coloración oscura, que puede ser de matiz pardo, verdoso o grisáceo. A la transiluminación presenta pérdida de la translucidez y la opacidad se extiende a toda la corona 13, 18, 21 resultado de la hemólisis de las células sanguíneas rojas durante la descomposición pulpar 18. Cuando la necrosis pulpar está presente, el paciente puede referir episodios previos de dolor o historia de caries y restauración del diente 14. Un aspecto que puede distinguir la necrosis pulpar de otras condiciones pulpares es la ausencia de sensibilidad a las pruebas pulpares térmicas y eléctricas. Sin embargo, si el calor se prolonga más tiempo, el diente puede responder a este estimulo 13, 14, 17, 18, pudiéndose obtener alivio con la colocación de sustancia líquida fría sobre el diente 14. Esta respuesta podría estar relacionada con restos de líquidos o gases en el espacio del conducto radicular, producidos por microorganismos que infectan la pulpa necrótica. Los gases al expandirse, se extienden a los tejidos periapicales actuando sobre las terminaciones nerviosas que se encuentran funcionales, particularmente en la porción apical del conducto; de igual forma, el contenido líquido del conducto puede dar una respuesta positiva a la corriente eléctrica 13, 14, 17, 20. Sin embargo, el alivio otorgado por el agua fría colocada en la zona afectada es solo temporal y el dolor retorna cuando el diente vuelve a aumentar su temperatura y los gases se expanden. Esta situación ocurre debido a que la parte apical de los nervios pulpares es la que se necrosa más tardiamente. Dichos nervios apicales mantienen cierta viabilidad por el aporte sanguíneo, mientras que el resto de la pulpa ha muerto 14. El diente puede presentar ligera movilidad 13, 21, puede volverse hipersensible al calor, e incluso a la temperatura de la cavidad bucal, y a menudo se alivia mediante aplicaciones de hielo 17. Cuando la pulpa esta totalmente necrosada, el diente suele estar asintomático hasta que por extensión de la enfermedad a los tejidos perirradiculares aparecen los síntomas 17. Seltzer (2004) sugiere la presencia de factores microbianos como causa de dolor en endodoncia, explicando que los microorganismos anaerobios encontrados en las infecciones del conducto radicular, la producción de enzimas y endotoxinas, inhibición de quimiotaxis y fagocitosis, e interferencia de la actividad antibiótica, resultando en la persistencia de lesiones periapicales dolorosas. Una relación parece existir entre la presencia de algunos microorganismos y destrucción periapical y dolor 22. La actividad colagenolítica y fibrinolítica generada por diversos microorganismos pueden producir endotoxinas, las cuales activan el factor Hageman, produciendo bradiquinina, un potente mediador del dolor. Seguidamente, la endotoxina puede activar el sistema de complemento alternativo al nivel C3, siendo un productor de dolor. Además, las endotoxinas provenientes de los conductos radiculares infectados pueden contribuir al incremento de sustancias vasoactivas y transmitir sustancias a las terminaciones nerviosas de las lesiones periapicales inflamadas. Las endotoxinas bacterianas poseen propiedades neurotóxicas. Las endotoxinas actúan sobre las terminales nerviosas presinapticas, causando, en respuesta al estímulo aplicado, para liberar una mayor cantidad de neurotransmisor 22.
CARACTERÍSTICAS HISTOPATOLÓGICAS DE LA NECROSIS PULPAR Se considera el estadío de necrosis pulpar o pulpa desvitalizada cuando la vascularización pulpar es inexistente y los nervios pulpares no son funcionales, constituyendo la única clasificación clínica de las patologías pulpares que describe el estado histológico pulpar o su ausencia 17. Conforme avanza la inflamación de la pulpa, el tejido sigue desintegrándose desde el centro para formar una región progresiva de necrosis por licuefacción 23, que continua hacia la necrosis total de la misma 12, dada la alta circulación colateral y la rigidez de las paredes de dentina, se generan elevaciones localizadas en las presiones de los tejidos, dando lugar a la destrucción progresiva e inadvertida hasta que toda la pulpa se necrosa 23. Las bacterias pueden seguir creciendo en el interior del conducto una vez que la pulpa se necrosa 14, 17. La pulpa necrótica sirve como una fuente de nutrientes para las bacterias que ingieren el tejido necrótico y dejan al diente despulpado. Esto puede ocurrir entre 1-2 meses posteriores a la invasión bacteriana inicial 14; cuando dicha infección o las toxinas bacterianas se extienden hacia el espacio del ligamento periodontal, el diente puede comenzar a ser sintomático a la percusión o mostrar dolor espontáneo 14, 17. Las células que constituyen las pulpas dentales de los dientes y que mueren como resultado de coagulación o de licuefacción se definen como necróticas 12. En la necrosis por licuefacción desaparece el contorno íntegro de la célula 12. Histologicamente, la necrosis parcial pulpar exhibe una zona de licuefacción, rodeada de una zona densa de leucocitos polimorfonucleares muertos y vivos. Algunas porciones y remanentes de tejido pulpar coronal se convierten en tejido de granulación rico en células de la serie inflamatoria crónica, linfocitos, células plasmáticas y macrófagos 12, 20. En este momento, el tejido pulpar radicular sucumbe y el tejido de granulación se encuentra en la porción apical del conducto radicular y en el ligamento periodontal 20. Adyacente a la zona de necrosis por licuefacción, se encuentra una zona de inflamación crónica. Aunque es variable la amplitud de ésta, por lo general es bastante estrecha. La inflamación perirradicular tal vez no se desarrolle sino hasta que la pulpa esté totalmente necrótica 23. En la necrosis por coagulación, las células pulpares se encuentran reducidas de tamaño y presentan un núcleo picnótico 12, 20, 23. Histológicamente, es posible reconocer una masa celular coagulada, pero ha desaparecido su detalle intracelular 12. Las fibras colágenas persisten, pero pueden estar fuertemente mineralizadas. Los nervios y vasos sanguíneos son también sitios para mineralizaciones distróficas. Los cálculos pulpares son abundantes, y las paredes dentinarias, tanto coronal como radicularmente, están cubiertas con grandes cantidades de dentina reparativa y amorfa, la cual tiende a la obliteración de la pulpa 20, 23. La zona de necrosis contiene irritantes provenientes de la destrucción de los tejidos y los microorganismos, tanto anaeróbicos como aeróbicos. Estos factores irritantes establecen contacto con el tejido vital periférico y continúan ejerciendo daño. Las bacterias penetran hasta los límites de la necrosis, pero no se observan en el tejido inflamado adyacente. Sin embargo, en todo momento sus toxinas y enzimas penetran en los tejidos circundantes y estimulan la inflamación. En los sitios en los que la necrosis por licuefacción hace contacto con la dentina, se pierde la predentina por la acción de la colagenasa 23. Durante la inflamación crónica de toda la pulpa, la pared del conducto radicular puede estar sujeta a resorción 12.
CARACTERÍSTICAS RADIOGRÁFICAS DE LA NECROSIS PULPAR La imagen radiográfica de la necrosis pulpar puede variar desde una aparente normalidad periapical hasta mostrar cambios radiológicos tales como el engrosamiento del espacio del ligamento periodontal, o la aparición de una radiolucencia periapical de gran tamaño, lo cual solo ocurre cuando el tejido necrótico comienza a infectarse, y esto es debido a que las pulpas necróticas invariablemente causan inflamación periapical con diferentes grados de destrucción ósea sin necesidad de visualizarce radiograficamente 13, 14, 17, 18, 21, 24, 25. La presencia de signos radiográficos empieza cuando el tejido pulpar se encuentra completamente necrótico hasta la salida del conducto en el foramen apical 26. Radiográficamente un diente con necrosis pulpar puede presentar algún signo como lesión de caries no tratada, restauración extensa, recubrimiento pulpar previo 14, 19, 21, o no presentarlo, como en los casos de trauma. El trauma de un diente puede causar una necrosis pulpar como resultado de daño al aporte sanguíneo apical si el diente ha sido desplazado de su posición normal (luxación, avulsión) o si ha sufrido un daño significativo o inflamación del espacio del ligamento periodontal (subluxación) 14.
PERIODONTITIS APICAL La literatura especializada reporta una serie de estudios que abordan el tema de la periodontitis apical, enfocándolo desde varios aspectos. Algunos de estos trabajos serán descritos brevemente y expuestos a continuación.
DEFINICIÓN DE PERIODONTITIS APICAL Abbott (2004) indica que la periodontitis apical es un término generalmente usado para describir el proceso inflamatorio periapical que ocurre en respuesta a la presencia de microorganismos y otros irritantes dentro del SCR del diente. El proceso involucra una naturaleza dinámica e incluye muchas interacciones tisulares complejas. En el estadío de necrosis, no hay suplemento sanguíneo dentro del diente que pueda transportar las células de defensa que normalmente serían activadas en respuesta a una infección. Por esa razón, las bacterias pueden penetrar el tejido necrótico pulpar a través de la porción apical final del conducto radicular 27. La Asociación Americana de Endodoncia en el 2009, clasifica la periodontitis apical en dos categorías 15, 16:
Kakehashi et al. (1965) demostraron la relación causal entre la infección de la pulpa dental y la formación de una lesión periapical; la exposición mecánica de la pulpa y su infección por bacterias provenientes de la cavidad bucal produjo lesiones periapicales en ratas mantenidas en un ambiente convencional. En contraste, animales con exposiciones pulpares mantenidas en un ambiente libre de gérmenes no desarrollaron lesiones periapicales y formaron puentes de dentina en el lugar de la exposición, demostrando el potencial que posee la pulpa de auto repararse en ausencia de infección 28. Por su parte Sundqvist (1976) referido por Stashenko et al. (1992), confirmó la relación entre la infección y el desarrollo de la lesión periapical, donde se aislan bacterias solo en dientes necróticos traumatizados cuyas coronas clínicas permanecieron intactas que posteriormente desarrollaron una lesión periapical 29. Morse et al. (1977) citado por Milgran (2009) expresan que el término periodontitis apical implica la presencia de una inflamación en el tejido periapical. Así como la inflamación pulpar, la periapical puede ser asintomática y solo ser diagnosticada radiográficamente, sin embargo es muy importante apreciar que las lesiones periapicales son mayormente causadas por una infección del SCR, independientemente de la historia del paciente o si se encuentra asintomático 19. Neville et al. (2001) citado por Gutmann y et al. (2009) refieren que la periodontitis apical aguda se produce cuando las fibras del ligamento periodontal periapical exhiben inflamación aguda sin formación de absceso, en un diente vital o no vital 30. Desde el punto de vista histopatológico, se destacan los estudios de Nair (2004), quien define la periodontitis apical como una consecuencia de la infección endodóntica que incluye una relación dinámica entre los factores microbianos y los de defensa del hospedero 31. La patología periapical es una enfermedad multifactorial la cual representa la interacción entre el agente microbiano y la respuesta inmune, lo que resulta en una activación de macrófagos y citoquinas, produciendo expansión de la lesión periapical y resorción ósea 29. Por su parte, Ricucci et al. 26, Stashenko et al. 29, Velickovic et al. 32 y Morsani et al. 33 consideran que la infección de la pulpa dental estimula una respuesta inmune de los tejidos en la región periapical con la resorción concomitante de hueso. Dicha resorción se encuentra asociada al incremento de interleuquina ST2 y otros mediadores químicos relacionados al proceso inflamatorio de las lesiones periapicales y a la respuesta inmune mejorada de células Th1/Th17 mediando el aumento de la osteoclastogénesis. Las células Th1 generalmente predominan en lesiones periapicales y potencian la infamación y resorción ósea, mientras que las TH17 están relacionadas con la exacerbación de la inflamación en las lesiones periapicales, asociada tanto a la fase aguda como a la crónica de la lesión periapical 32. Lin y Huang (2011) refieren que la periodontitis apical es una extensión directa de la pulpitis apical en los tejidos periapicales antes de la necrosis total de la pulpa causada por la infección del conducto radicular 34. Una variedad de factores pueden estar implicados en la patogenia de la periodontitis apical, los cuales pueden ser agrupados en varias categorías 27:
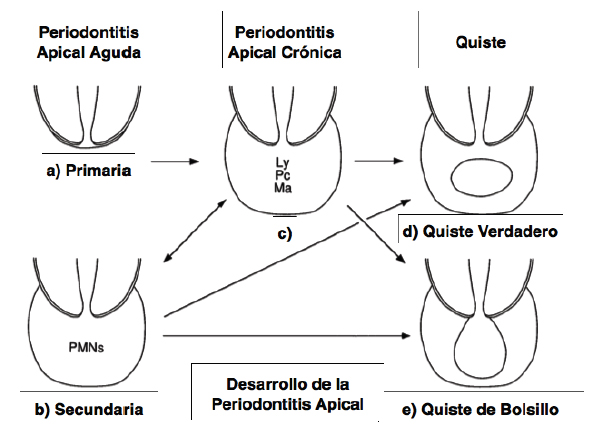
Existe acuerdo entre los autores en que la necrosis pulpar es el ambiente ideal para el crecimiento de microorganismos, los cuales desechan sus toxinas en el tejido periapical, induciendo una reacción inflamatoria que origina la formación de la lesión periapical 35. El tejido del hospedero intenta reparar y regenerar el daño al tejido, pero este objetivo empieza a fallar debido a la continua producción de toxinas bacterianas, de tal manera que la periodontitis apical es sostenida por la infección del conducto radicular, la cual nunca terminará hasta que se implemente un adecuado tratamiento clínico que ayude a eliminar el agente infeccioso 8, 9, 11, 26, 27, 36, sin embargo, esto no siempre se logra, debido a las limitaciones que ofrece la compleja anatomía radicular y los posibles mecanismos de resistencia de microorganismos específicos 8. Mientras más crónica sea la lesión, mayor es la probabilidad que las bacterias avancen hasta el foramen apical o incluso la superficie externa de la raíz 26. La inflamación periapical crónica representa un balance entre las bacterias en el diente y la respuesta del hospedero. Una vez que este balance es perturbado, una reacción inflamatoria aguda se puede desarrollar con severos síntomas 37. Puede ocurrir espontáneamente como resultado de diferentes factores producidos localmente en el sitio de la reacción inflamatoria en curso, o como resultado de una reacción inmune 27. Motivo por el cual la periodontitis apical puede comportarse de manera protectora o destructora, dependiendo de la interacción dinámica entre la agresión microbiana y las defensas del hospedero en los tejidos periapicales 34. En la figura 1 se explica esquemáticamente el proceso de desarrollo de la periodontitis apical.
El término biopelícula define una organización sésil de varias especies de microorganismos en una suspensión fluida ubicada en la superficie interna del conducto radicular 31. La microbiota conformada por la agregación bacteriana en el SCR esta protegida de las defensas del hospedero y del tratamiento antibiótico por la ausencia de circulación sanguínea en el SCR. Por lo tanto, cualquier intento de reparación o regeneración de los tejidos perirradiculares dañados es inútil, ya que las toxinas bacterianas y los productos de degradación tóxicos del SCR van saliendo continuamente hacia la zona periapical e irritan los tejidos circundantes 34.
CARACTERÍSTICAS CLÍNICAS DE LA PERIODONTITIS APICAL Gran parte de los tratamientos que se realizan en la clínica son debidos a patologías que afectan la pulpa y el periapice. La pulpa dental es un tejido ricamente vascularizado e inervado, delimitado por un entorno inextensible como es la dentina, con una circulación sanguínea terminal y con una zona de acceso circulatorio a nivel apical de pequeño calibre. Todo ello, hace que la capacidad defensiva del tejido pulpar sea muy limitada ante las diversas agresiones que pueda sufrir. La patología periapical va casi siempre precedida de una afectación de la pulpa, ocasionada tanto por la presencia de microorganismos que ingresan al diente por medio de diversas vías tales como caries, fisuras o fracturas dentaria, enfermedad periodontal, anacoresis, traumatismo, alteraciones oclusales como bruxismo, sobrecarga oclusal, maloclusiones, además de sobreinstrumentación o sobreobturación en los tratamientos de conductos radiculares. Se han descrito distintas clasificaciones por diversos autores para las patologías periapicales, según su etiología, anatomía patológica o sus manifestaciones clínicas, pero, como afirma Lasala, casi todas son clasificaciones histopatológicas, que no son prácticas para la aplicación clínica , diagnóstico y el establecimiento de un tratamiento adecuado 13. Las características clínicas de la periodontitis apical dependen de su evolución y serán descritas a continuación: Los dientes con periodontitis apical aguda o sintomática suelen ser dolorosos al morder y a la percusión, siendo el dolor el hallazgo más común, característicamente constante, espontáneo, pulsátil y fuerte, el cual puede ser insoportable y durar días, y manifestarse presión en el área periapical como consecuencia de la presión mecánica. Puede incrementar su movilidad y el paciente puede referir que el diente se encuentra extruido, produce síntomas clínicos, los cuales incluyen una respuesta dolorosa a la percusión y/o palpación 15, 21, 27, 30, 35, 38. Con respecto a la periodontitis apical crónica o asintomática, el paciente usualmente no presenta síntomas asociados a la lesión, y se diagnostica como un hallazgo radiográfico en un examen de rutina. La pulpa dental puede estar necrótica e infectada y el conducto radicular pudiera estar despulpado, o previamente obturado e infectado. No responderá a las pruebas de sensibilidad pulpar ni eléctricas. El diente no esta doloroso a la percusión, presión o palpación, sin embargo, pudieran presentar respuesta positiva ante tales estímulos y poseer ligera movilidad 15, 21, 27.
CARACTERÍSTICAS RADIOGRÁFICAS DE LA PERIODONTITIS APICAL Conjuntamente con el examen clínico minucioso de los dientes afectados con periodontitis apical, su estudio radiográfico es de suma importancia para obtener un diagnóstico correcto. Tradicionalmente, la literatura reporta que la ausencia de imagen radiolúcida perirradicular en la radiografía de diagnóstico ha sido usada para evaluar salud periapical 39. Las pulpas necróticas e infectadas pueden causar un incremento gradual de la lesión inflamatoria en el tejido periapical, acompañada por cambios estructurales en el hueso periapical, con rasgos característicos en las radiografías periapicales de diagnóstico 40. Estas radiografías son reconocidas como esenciales para las decisiones de tratamiento clínico y para la evaluación de los resultados del tratamiento, así como para los estudios clínicos y epidemiológicos 40. En la periodontitis apical sintomática o aguda, el ligamento periodontal y la lámina dura a nivel apical pueden tener una apariencia radiográfica normal, sin embargo, en ciertas ocasiones se puede apreciar un ligero ensanchamiento del espacio del ligamento periodontal y la pérdida de la lámina dura en el diente afectado pudiendo o no estar asociado a una radiolucidez apical 27, 34, 38. En la periodontitis apical asintomática o crónica, radiográficamente puede observarse una zona radiolúcida apical de origen pulpar 21, 27.
CARACTERÍSTICAS HISTOPATOLÓGICAS DE LA PERIODONTITIS APICAL Fava (1998) conceptualiza la periodontitis apical aguda como una inflamación del periodonto apical, originada principalmente por la pulpa no vital. La necrosis del tejido y/o derivación de sus productos pueden provocar inflamación del tejido perirradicular a través del SCR o por traumatismo de la corona del diente. Las características de esta patología son microscópicas y sintomáticas 38. Fava (1998) investigó la respuesta histológica de la periodontitis apical, refiriendo que en la forma aguda se produce una reacción periapical inflamatoria típica con hiperemia, incremento en la permeabilidad vascular, exudado inflamatorio y presencia de polimorfonucleares neutrófilos. Las bacterias no suelen estar presentes en las lesiones agudas de la peridontitis apical 38. La periodontitis apical crónica, presenta en las lesiones periapicales una mezcla de células tipo linfocitos T, B, células plasmáticas, macrófagos, leucocitos polimorfonucleares y células cebadas, que denotan la naturaleza crónica de la lesión 29, 30, 32. Cuando se trata de establecer una relación entre la imagen radiográfica periapical y la evolución histológica, algunos autores opinan que un diente con una apariencia radiográfica normal, revela una reacción histológica periapical normal, sin embargo, Bender, Seltzer y Soltanoff (1966) indicaron que las lesiones apicales radiográficas siempre serán más pequeñas en relación a la lesión histológica, debido a que la lesión solo puede ser vista radiográficamente si se ubica en el área de unión o la cortical ósea 25.
CLASIFICACIÓN DE LA PERIODONTITIS APICAL En general, la clasificación consiste en agrupar casos similares con la finalidad de propiciar la comunicación entre los clínicos con el propósito de facilitar la comparación. La literatura reporta diferentes clasificaciones de las periodontitis apical, tanto desde el punto de vista clínico como histológico, algunas de las cuales serán descritas brevemente, sin embargo es conveniente señalar que en la Facultad de Odontología de la Universidad Central de Venezuela se emplea la clasificación descrita por Milgran (2009), basada en la propuesta por Baume y Fiore-Donno (1962) y por Morse (1977), con respecto a los aspectos clínicos de la enfermedad 19. Nair, Pajarola y Schroeder (1996) propusieron una clasificación basados en los aspectos histológicos de la periodontitis apical 41. Ricucci y Bergenholtz (2004) utilizan una clasificación simplificada, la cual categoriza la periodontitis apical en sub-grupos, entre los que se cuentan absceso periapical (lesiones exudativas), granuloma periapical y quiste periapical. Entre estas formas cursa una variedad de estados de transición y configuraciones tisulares y la respuesta puede aplicar a cualquier tipo de irritante proveniente del interior del diente 26. La Organización Mundial de la Salud en 1995, clasificó la periodontitis apical en cinco categorías 42:
Nair, Pajarola y Schroeder (1996) propusieron una clasificación con la categorización histológica basados en la distribución de células inflamatorias dentro de las lesiones y la presencia o ausencia de células epiteliales. También determinan si las lesiones se han desarrollado en quiste y si hay relación de la cavidad quística con el foramen y conductos apicales 41.
La clasificación clínica del estado de los tejidos perirradiculares propuesta por Abbott en el 2004 comprende 27:
La Asociación Americana de Endodoncia (2009) clasifica la periodontitis apical en varias etapas, entre las cuales encontramos 15:
Milgram (2009) indicó la clasificación periapical de la Facultad de Odontología de la Universidad Central de Venezuela, la cual comprende 19:
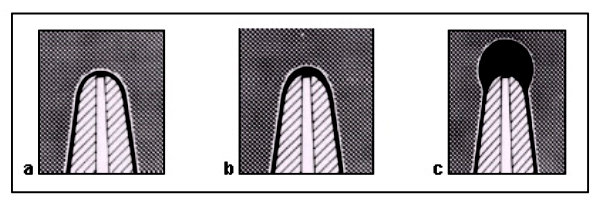
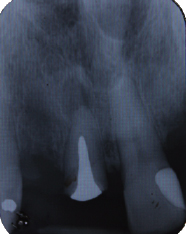
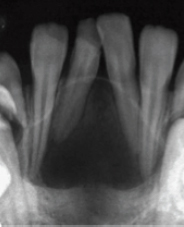
CRITERIOS DE EVALUACIÓN DE LA CONDICIÓN PERIAPICAL El diagnóstico de la periodontitis apical aguda y crónica se basa principalmente en la comparación de los cambios entre la anatomía apical normal y las desviaciones de la misma, evaluadas con radiografías periapicales 43. Existen criterios de diagnóstico y evaluación periapical 44, los cuales han sido ampliamente utilizados en estudios epidemiológicos y en investigaciones de reevaluación o seguimiento de dientes tratados endodónticamente 43, 45, 46 y entre ellos se pueden mencionar: A) Una clasificación basada en la apariencia radiográfica del espacio del ligamento periodontal, la cual consta de tres categorías o estadíos, clasificadas como periápice con características de normalidad, ensanchamiento del espacio del ligamento periodontal y periodontitis apical crónica 44. Estas categorías de evaluación fueron sugeridas y utilizada por Halse y Molven 45, 46. Las cuales están representadas en la figura 2.
B) La presencia y ausencia de imagen radiolúcida apical se ha utilizado rutinariamente en la práctica para diagnosticar y evaluar el éxito o fracaso de los tratamientos de conducto, sin embargo, la ausencia o deficiente calibración entre los observadores clínicos, ha dado como resultado falsos y verdaderos positivos, razón por la cual Reit y Gröndahl (1983) recomiendan la aplicación de la teoría de decisión estadística considerando los siguientes criterios 47:
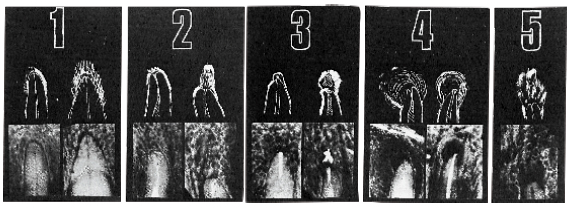
Al definir criterios estrictos, se considera la presencia de lesión apical y solo cuando se esta absolutamente seguro, se reporta como hallazgo positivo, demostrando el carácter subjetivo relacionado con esta evaluación, ya que depende en gran medida de los criterios individuales de cada evaluador 47. C) Ørstavik. Kerekes y Eriksen (1986), propusieron un sistema de calificación de la periodontitis apical observada en radiografías, denominado Índice Periapical (IP), el cual categoriza en 5 escalas numeradas desde 1 (salud) hasta 5 (periodontitis severa con exacerbantes asociados), siendo validado al comparar radiográficamente en dientes cuya condición periapical fue evaluada mediante estudio histológico. Este índice es una versión simplificada del método radiográfico de interpretación usada por Brynolf 40 citado por Sankarsingh (2002) y Mendoza (2015), que establece la comparación de la apariencia periapical y cambios histológicos, utilizando material de autopsia humano en 142 individuos, realizando un estudio correlativo de 292 incisivos superiores a manera de determinar cómo estos cambios son reflejados en imágenes de radiografías con la posibilidad de hacer un diagnóstico exacto 46, 48. Los autores consideran que este sistema de Índice Periapical es razonablemente exacto, reproducible y capaz de discriminar entre subpoblaciones. Motivo por el cual sus resultados pueden ser usados para evaluar los tratamientos endodónticos en diferentes investigaciones epidemiológicas, clínicas y análisis retrospectivos para determinar el éxito y/o el fracaso de los tratamientos de conductos 40. En teoría, la cuantificación de la inflamación periapical del Índice Periapical se hace en base a puntuaciones y tres categorías: la categoría 1 significa que la zona periapical se encuentra saludable, la categoría 2 y 3 indican un diagnóstico periapical dudoso y la categoría 4 y 5 expresan enfermedad. A continuación se definen los criterios usados en este IP 40:
La figura 3 expresa un gráfico con las imágenes de referencia de criterios que servirán para comparar con las radiografías periapicales obtenidas del paciente y de esa manera poder realizar el diagnóstico correspondiente.
Tanto las radiografías preoperatorias como las de control postoperatorio, deben ser comparadas con las cinco imágenes de referencia, para de esa manera asignar un puntaje de acuerdo a los criterios establecidos 40, 43. La evaluación del espacio del ligamento periodontal y la integridad de la lámina dura son considerados parámetros importantes para evaluar la periodontitis apical 40. Los observadores deben estar previamente calibrados; se debe asignar el puntaje más alto en casos de duda, es decir, la categoría 5, periodontitis severa con agravantes, y para dientes multirradiculares, se debe catalogar con el puntaje más alto encontrado en cualquiera de las raíces del diente a evaluar 40.
ABSCESO PERIODÓNTICO APICAL Desde el siglo XIX, diversos autores han tenido la preocupación de definir el proceso denominado absceso periodóntico apical. La literatura reporta diferentes definiciones y en tal sentido puede destacarse Harris (1839) citado por Gutmann et al. (2009), quien define como absceso alveolar a la enfermedad de los tejidos profundos, palpitante y dolorosa, que en ocasiones es insoportable y con interrupciones ocasionales hasta que se forma el contenido del mismo, cuando, en gran medida, desaparece el dolor, pero se presentan crisis leves con el calor y frío, puede estar abierto al medio bucal posterior a la resorción ósea sin proporcionar una designación específica de fístula o tracto sinusal 30. Tomes y Nowell (1906) citado por Gutmann et al. (2009) describe la enfermedad en dos categorías 30:
Marshall (1926) citado por Gutmann et al. (2009) también diferencia entre absceso apical agudo y crónico basado en la virulencia del organismo involucrado, la resistencia del paciente y la relativa extensión de la proliferación del tejido 30:
Algunos autores consideran que el absceso es una colección localizada de exudado purulento de un órgano o tejido, de forma aguda y crónica 27, 32, 49, y el absceso apical agudo es secundario a una lesión de caries o traumatismo 27, 49 o del propio tratamiento endodóntico 49. Nair, Pajarola y Schroeder (1996) y Nair (1997) indican que el absceso periapical es un foco de inflamación aguda caracterizada por la presencia de distintas colecciones de leucocitos polimorfonucleares dentro y alrededor de un granuloma crónico existente y dependiendo de la presencia o ausencia de hebras de epitelio, estas lesiones serían subdivididas en absceso epitelializado y no epitelializado 37, 42. La Academia Americana de Periodontología (2001) indica que el absceso apical es una condición inflamatoria caracterizada por la formación de exudado purulento proveniente de la pulpa dental o remanente pulpar y de los tejidos que rodean el ápice de un diente. Cuando se considera el curso de la patología, la condición "aguda" define un absceso de relativa duración, el cual típicamente produce dolor e inflamación local; mientras que el "crónico" es una lesión de desarrollo comparativamente más lento con poca evidencia de inflamación. Puede presentar un drenaje intermitente de material purulento y/o seroso 50. Para Neville et al. (2001) citado por Gutmann et al. (2009) el absceso periodóntico apical se define como la acumulación de células inflamatorias agudas a nivel apical de un diente no vital, pudiendo estar sintomático o asintomático 30. Por su parte, la Asociación Americana de Endodoncia (2009) indica que el absceso es una reacción inflamatoria por infección y necrosis pulpar 15, 16. El diente responsable de un absceso puede poseer una pulpa necrótica, diente despulpado, infectado, o pudiera tener un tratamiento endodóntico previo con la subsecuente infección del SCR 27. El progreso de un absceso dental a una lesión periodóntico apical se debe, probablemente, a la invasión de una combinación de bacterias piogénicas específicas en los tejidos periapicales y endodónticos inflamados 51, 52, 53. Los leucocitos neutrófilos son las células predominantes en la periodontitis apical aguda con formación de un absceso. El absceso comienza como una feroz batalla entre patógenos muy virulentos y un ejército de leucocitos neutrófilos. Los patógenos producen toxinas masivas para matar los neutrófilos. Cuando los neutrófilos atacan a los patógenos, segregan enzimas lisosomales que digieren no solo las células muertas, sino también algunas vivas. Muchos neutrófilos mueren combatiendo los patógenos y el líquido purulento resultante esta mal oxigenado y tiene un pH bajo. La capacidad bactericida de los leucocitos parece deteriorarse por la privación de oxígeno y la interferencia del estallido respiratorio, cuyo propósito es generar agentes bactericidas. No obstante, la actividad fagocítica de los leucocitos no se deteriora en condiciones aerobias 32.
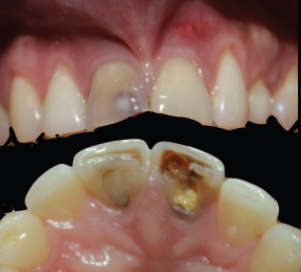
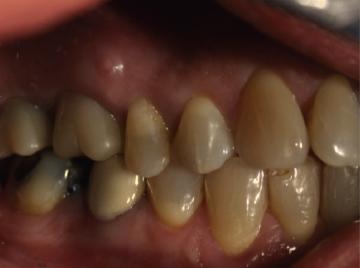
CARACTERÍSTICAS CLÍNICAS DEL ABSCESO PERIODÓNTICO APICAL Un diente con un absceso periodóntico apical agudo esta caracterizado por un comienzo rápido, dolor espontáneo, intenso a la presión al morder (sensación de diente extruido), a la percusión y a la palpación, de tipo localizado y persitente, constante y/o pulsátil y formación de exudado purulento. El diente no responde a ninguna de las pruebas de vitalidad pulpar y podrá exhibir diversos grados de movilidad. El pliegue mucobucal y los tejidos faciales próximos al diente casi siempre muestran cierto grado de tumefacción intraoral y extraoral, respectivamente. Es frecuente que el paciente presente malestar general, fiebre y que los ganglios linfáticos cervicales y submandibulares sean sensibles a la palpación. Una inflamación intraoral o extraoral puede estar presente y ser fluctuante, así como dolorosa a la presión y palpación 15, 16, 17, 21, 27, 30, 32. En la figura 4 y 5 se presentan imágenes clínicas extraorales e intraorales, respectivamente, de una paciente con absceso periodontico apical.
Cuando se produce la salida súbita de exudado purulento hacia el exterior en la zona periapical, la presión tisular aumenta de forma que los estímulos mecánicos son capaces de activar a las terminaciones nerviosas nociceptivas en los tejidos periapicales infectados, lo cual podría explicar el dolor intenso de un absceso apical agudo 31. El exudado purulento periapical se puede drenar a través del conducto radicular, o a través de una incisión y drenaje cuando esté indicado, durante el tratamiento de conducto radicular y en este caso el paciente suele experimentar un alivio inmediato del dolor agudo 32. Un diente con un absceso periodóntico apical crónico generalmente no presenta síntomas clínicos y no está usualmente asociado a dolor. Se caracteriza por ser un progreso gradual. El diente no responde a las pruebas de vitalidad pulpar, no está sensible a la oclusión pero el paciente puede notarlo "diferente" a la percusión 15, 16, 17, 21, 27, 30, 32. Puede presentar un exudado intermitente a través del trayecto fistuloso asociado, el cual puede estar o no activo al momento del examen 30 con drenaje intraoral o extraoral, por lo cual no suele haber tumefacción y el drenaje puede ocurrir generalmente solo cuando se aplica presión a nivel de la zona periapical 15, 16, 17, 21, 27, 30, 32. En ocasiones, el absceso no controlado se puede dispersar siguiendo los planos de la fascia de la cabeza y el cuello para desarrollar una grave celulitis 32, 54. En la figura 6 se observa presencia de fístula activa al momento del examen clínico asociado al diente a evaluar.
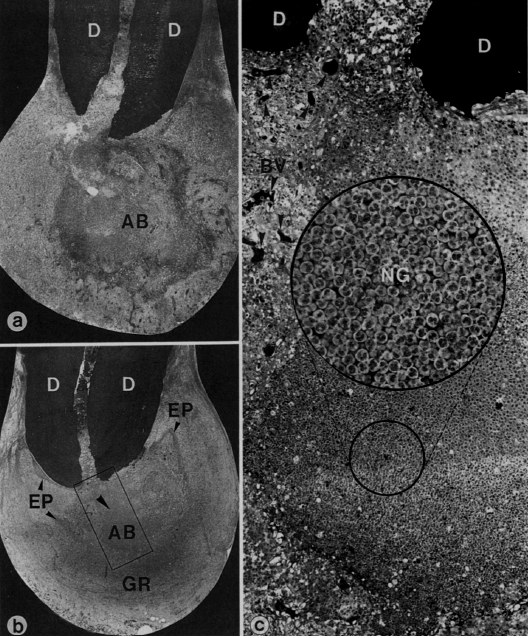
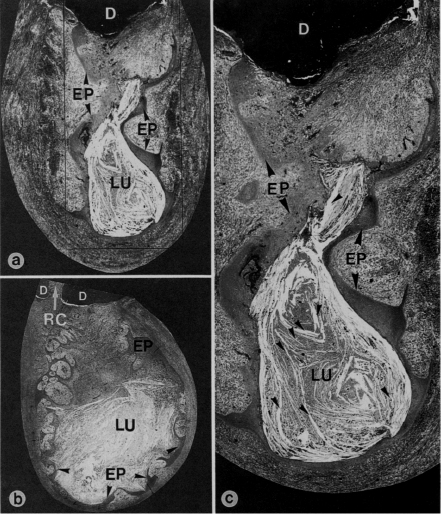
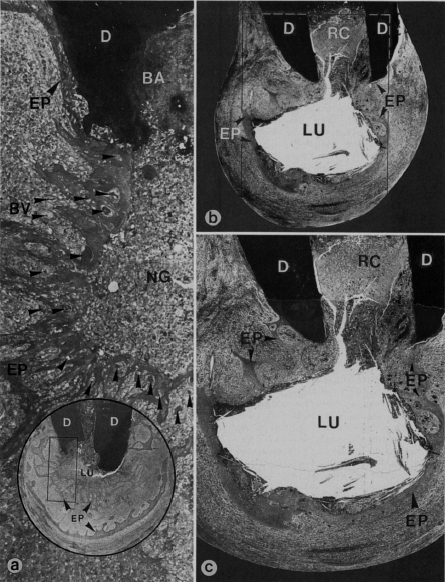
CARACTERÍSTICAS HISTOPATOLÓGICAS DEL ABSCESO PERIODÓNTICO APICAL Histológicamente, la formación de un absceso apical se caracteriza por la colección local de exudado purulento o seroso, observándose un infiltrado de células inflamatorias compuesto de leucocitos neutrófilos vivos y muertos, células tisulares desintegradas, matriz extracelular degradada, enzimas lisosomales liberadas por los leucocitos, neutrófilos muertos y ocasionalmente linfocitos. También contiene bacterias muertas y vivas y toxinas bacterianas liberadas por las bacterias muertas en los tejidos periapicales inflamados. La formación del absceso también implica la destrucción del ligamento periodontal y, a veces, del hueso periapical, especialmente en la periodontitis apical crónica con formación de un absceso, una capa circundante de leucocitos neutrófilos viables y una banda de tejido fibrovascular de granulación. Ambas capas parecen servir como barreras protectoras para prevenir la dispersión de la infección. La proliferación de las células epiteliales es escasa en la periodontitis apical aguda con formación de un absceso. Los vasos sanguíneos pueden presentarse dilatados 32, 49. En la figura 7, se grafica por medio de cortes histológicos las características histopatológicas de un absceso periodóntico apical. Ricucci et al. (2006) demostraron por medio del estudio histológico de 50 especímenes humanos, de los cuales 14 lesiones fueron diagnosticadas como abscesos, que las bacterias estaban ubicadas en la áreas necróticas de las lesiones periapicales. Todas las lesiones contienen una acumulación densa de leucocitos polimorfonucleares, delimitado por tejido granulomatoso con linfocitos, macrófagos y células plasmáticas. Estas lesiones poseen una apariencia de un granuloma preexistente con un área de inflamación aguda de extensión variable. En algunos casos, la concentración de polimorfonucleares fue obervada en varias micro-cavidades. En algunos casos, al análisis de secciones seriadas contínuas, las micro-cavidades empiezan a ser más largas y contienen restos. Al final de la lesión, están presentes fibras colágenas 36.
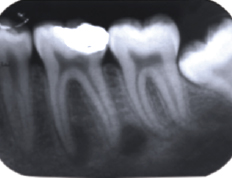
CARACTERÍSTICAS RADIOGRÁFICAS DEL ABSCESO PERIODÓNTICO APICAL El absceso periodóntico apical agudo radiográficamente puede no revelar cambios en el tejido circundante periapical o evidenciar desde un ensanchamiento del espacio del ligamento peridontal, hasta pérdida de la lámina dura, debido a que la inflamación periapical y el fluido causan extrusión del diente de su posición normal en el alveolo, así como una zona radiolúcida periapical asociada a una resorción ósea apical 17, 21, 27, 30, 49. En el caso de presentarse un absceso periodóntico apical crónico, se observa una zona radiolúcida perirradicular de contornos difusos y evidencia de factores causales (caries). Siendo la destrucción ósea evidente a nivel radiográfico. El tamaño del área y el grado de radiolucidez de la misma son consecuentes a la desmineralización o lisis ósea. Si un cono de gutapercha puede ser colocado dentro de la fístula antes de la toma radiográfica, podrá indicar fácilmente al diente causal, sin embargo, lo útil de este diagnóstico depende si el tracto sinusal se encuentra permeable al momento de realizar el examen 17, 21, 27, 30, 32, 49. Caracteristicas que se pueden evidenciar en la figura 8.
GRANULOMA PERIODÓNTICO APICAL El granuloma periapical es un proceso patológico crónico que se origina de la transformación de los tejidos periapicales en tejido de granulación 49 parecida a un tumor 12 predominantemente infiltrado con linfocitos, células plasmáticas y macrófagos; esta lesión puede estar epitelializada o no epitelializada como especifica Nair, Pajarola y Schroeder (1996) y Nair (1997) 37, 42. El término tejido granulomatoso podría ser más apropiado, sin embargo el término granuloma ha sido usado por muchos años y ha persistido en la literatura 12. Kronfeld (1939) citado por Ricucci et al. (2006) cita "un granuloma no es un área en la cual la bacteria vive, pero si en la que se destruyen" 33. La Academia Americana de Periodontología (2001) indica que el granuloma periodóntico apical es un nódulo reactivo que consta de macrófagos modificados que se asemejan a células epiteliales rodeadas por un borde de células mononucleares, linfocitos y a menudo contiene células gigantes, circunscrito al ápice adyacente al diente 50. Neville et al. (2001) citado por Gutmann et al. (2009) agrega que posterior a un absceso periapical la lesión puede transformarse en un granuloma periodóntico apical 30. Su etiología está asociada a una reacción ante varios tipos de irritantes que pueden ser microbianos (a consecuencia de la caries dental o de la enfermedad periodontal), mecánicos, térmicos o químicos (como resultado de procedimientos operatorios, endodónticos o de trauma) 12. Si el tratamiento de conductos no es realizado y persisten estos irritantes en la porción apical del SCR, la inflamación aguda inicial se transforma gradualmente en una reacción inflamatoria crónica, conocida histológicamente como granuloma periapical 27. Se produce también la resorción del hueso que los rodea, dando como resultado el ensanchamiento del espacio periodontal 12. Resumiendo, el tejido de granulación es circundado por una cápsula de tejido fibroso, adherida a la raíz del diente 49 y la presencia de un granuloma indica que la inflamación ha estado presente por un largo tiempo de manera crónica. Simultáneamente con el desarrollo del tejido granulomatoso en el complejo tisular pulpo-periodontal, en apical se produce la resorción de cemento, dentina y hueso 12. El granuloma periapical, durante su evolución, parece encontrar un balance entre reparación/regeneración y fuerzas destructoras de tejido 26. El tejido granulomatoso posee una función de defensa y no se deja infectar debido a su rica vascularidad y a la presencia de grandes cantidades de células inflamatorias cuya función es la de combatir los microorganismos y otros irritantes en el conducto radicular, así como también ayudar en el proceso de reparación 12. En este sentido Iwu et al. (1990) confirman la presencia de microorganismos en 88% de los granulomas periapicales estudiados 55, mientras que Shindel (1961) considera que el tejido granulomatoso en las zonas periapicales alrededor de los dientes sin pulpa puede estar estéril 56. El diagnóstico de granuloma se basa en la apariencia radiográfica de la radiolucencia periapical. Sin embargo, su diagnóstico definitivo se hace por medio de una biopsia quirúrgica y su estudio histopatológico 27. Los granulomas son las lesiones periapicales mas frecuentemente encontradas. Su frecuencia puede variar entre un 46-84% 12. Bhaskar (1966), en un estudio de 2.308 lesiones periapicales, determinó que el 48% eran granulomas; también notó que se producen en igual frecuencia en ambos sexos, pero se presentaban casi tres veces más en el maxilar que en la mandíbula. Siendo la mayor incidencia la tercera década de vida 57. El tejido granulomatoso que rodea el ápice dentario esta invariablemente asociado con la resorción de la dentina apical y, a veces, del cemento apical, ambos dentro del conducto radicular y a lo largo de los lados de la raíz. El cemento y la dentina se erosionan a distintas profundidades. En algunos dientes, el foramen apical esta tan ensanchado que tiene apariencia de un túnel. En otros, la terminación de la raíz aparece festoneada y roída. Dentro del tejido granulomatoso de algunas pulpas hay regiones de necrosis por licuefacción. En otros, no hay evidencia de este tipo de necrosis 12.
CARACTERÍSTICAS CLÍNICAS DEL GRANULOMA PERIODÓNTICO APICAL Una vez que se han desarrollado las lesiones granulomatosas periapicales, puede transcurrir largos periodos de tiempo durante los cuales el paciente no manifiesta síntomas 12, 27, o ligera molestia cuando se aplica presión 27. En otros casos se puede producir episodios de dolor y tumefacción sin razón aparente. Las pruebas pulpares de los dientes con pequeños granulomas, frecuentemente evocan respuestas positivas, ya que los dientes contienen tejido vital e inflamado 12; a diferencia, Abbott (2004) indica que no responden a las pruebas de sensibilidad pulpar 27. Los procedimientos operativos adicionales sobre esos dientes, pueden producir síntomas violentos como resultado de la ulterior formación de necrosis por licuefacción. El pus, limitado e incapaz de ser evacuado, induce presión sobre las terminaciones nerviosas dando como resultado un dolor severo y tumefacción. Una vez que ha sido drenado, los síntomas remiten y se restablece el estado en que se encontraba anteriormente 12.
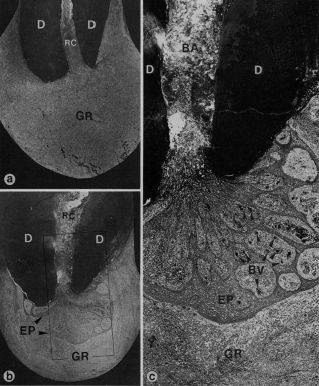
CARACTERÍSTICAS HISTOPATOLÓGICAS DEL GRANULOMA PERIODÓNTICO APICAL En cortes histológicos, se observa tejido de granulación, con numerosos capilares, fibroblastos, fibras colágenas y reticulares. A través de la mayoría de estas lesiones, se encuentran los restos celulares de Malassez o cordones proliferados de epitelio, derivados de la vaina radicular epitelial de Hertwig. En cuanto a su cápsula, está constituida por fibras colágenas y reticulares presentándose como una prolongación del ligamento periodontal 12, 25, 49, 58. El estroma del tejido conjuntivo fibroso está edematoso y se encuentra infiltrado con linfocitos, células plasmáticas, neutrófilos y macrófagos 12, 25, 49, 58. Debido a los numerosos capilares, puede observarse sangramiento periódico en la lesión con extravasación de eritrocitos y hemosiderina 12, 58. Los leucocitos polimorfonucleares pueden también encontrarse dispersos por la lesión y especialmente rodeando zonas de necrosis por licuefacción (absceso), las que son encontradas con frecuencia dentro del granuloma y en una localización opuesta a la foramina apical 12. El granuloma está encapsulado por fibras colágenas densas 12, 25. Posteriormente los remanentes epiteliales pueden proliferar y el granuloma periapical se transforma en quiste periapical. Sin embargo, la distinción entre quiste y granuloma se puede ofrecer solo por un estudio histopatológico 25. Ricucci et al. (2006) demostraron por medio de estudio histológico de 50 especímenes humanos, de los cuales 20 lesiones fueron diagnosticadas como granuloma periodóntico apical, que las bacterias estaban confinadas en el conducto radicular en la mayoría de los casos y no en la áreas necróticas de las lesiones periapicales. Todas las lesiones contenían células inflamatorias crónicas. Todos los tipos de células inflamatorias crónicas se observaron en un número y distribución variable dentro del granuloma: linfocitos, células plasmáticas, macrófagos y células de cuerpo extraño. El tejido fibroso con baja concentración de células inflamatorias esta presente en la periferia. Los leucocitos neutrófilos siempre infiltran el tejido epitelial presente. Ocasionalmente cuando el epitelio esta presente cerca del foramen se puede observar en el conducto. Las hebras de epitelio están generalmente organizadas en islas que contienen tejido granulomatoso con leucocitos neutrófilos, linfocitos, células plasmáticas y rica vascularización 36. En la figura 9 se grafica por medio de cortes histológicos las características histopatológicas de un granuloma periodóntico apical.
CARACTERÍSTICAS RADIOGRÁFICAS DEL GRANULOMA PERIODÓNTICO APICAL El granuloma periodóntico apical se presenta radiográficamente como una lesión radiolúcida unilocular y circunscrita, de contorno definido, de forma oval o esférica, cuyo diámetro normalmente no sobrepasa los 10 mm; está siempre asociada al ápice de un diente desvitalizado. Normalmente se puede observar vestigios del patrón de tejido óseo esponjoso, por ser una cavidad rellena de tejido de granulación, el cual posee una mayor densidad si se compara con líquido o aire existente en la cavidad 49. Al inicio del desarrollo de la lesión puede no apreciarse ningún cambio radiográfico. Gradualmente puede observarse un ensanchamiento del espacio del ligamento periodontal, siendo la inflamación y la destrucción del tejido mayores que las reflejadas radiográficamente. Con el tiempo, aparece una zona radiolúcida de mayor tamaño que envuelve la porción apical del diente y se observa pérdida de la lámina dura 12, 27. El tamaño de la lesión granulomatosa esta parcialmente relacionado a la intensidad del irritante. En casos de irritantes destructivos como restauraciones profundas que contengan silicatos, las células afectadas originalmente comienzan a necrosarse y elaboran toxinas, produciendo una reacción en cadena, dando como resultado granulomas de gran tamaño a nivel apical de los dientes involucrados 12. Esta definición de los límites ocurre por tratarse de un proceso inflamatorio de baja intensidad y de larga duración, dando la oportunidad al organismo de defenderse a través de la mineralización de los espacios intertrabeculares 49. El granuloma generalmente es una lesión mas pequeña que el quiste periodóntico apical, y presenta una imagen radiopaca en la periferia de la lesión 12. Caracteristicas radiográficas observadas en la figura 10.
QUISTE PERIODÓNTICO APICAL La Academia Americana de Periodontología (2001) y Neville et al. (2001) citado por Gutmann et al. (2009) consideran que el quiste periodóntico apical comprende una cavidad patológica cubierta por epitelio, que usualmente contiene material fluido o semisólido ubicado en el ápice de un diente no vital 30, 50 en una proporción de 42-44% según Shaik et al. 2013 59. Para establecer el diagnóstico diferencial entre un granuloma y un quiste periodóntico apical es importante realizar una biopsia que abarque el tejido blando y ápice radicular, debido a que la presencia de epitelio no es un criterio suficiente para el diagnóstico de quiste según Nair et al. (1996) 41. Así mismo Morse, Wolfson y Schacterle (1975) demostraron que es posible diferenciar un quiste radicular de un granuloma periapical por la realización de electroforesis de gel poliacrilamida, de la aspiración de fluidos del conducto radicular. Por lo que se propuso a este método de diagnóstico para dientes a los cuales se les realizaría tratamiento de conductos no quirúrgico 60. Cotti et al. (2002) utilizaron la técnica de imagen de ultrasonido en tiempo real (ecografía) para el estudio de lesiones perirradiculares, determinando que es posible medir el tamaño de las lesiones, evaluar su contenido y observar la vascularización en diferentes regiones de la boca, por lo que consideran que es una técnica diagnóstica prometedora 61. Algunos autores consideran que los quistes periapicales son una secuela directa de un granuloma periapical, sin embargo no todos los granulomas se transforman en quiste 27, 37, 49, 59. De acuerdo a sus características histológicas y morfológicas, el quiste periodóntico apical puede ser clasificado en dos tipos según la relación de la lesión con el foramen apical del diente involucrado 26, 27, 33, 48, 62. Simon (1980) fue el primero en describir las características morfológicas de estas dos categorías de quiste y confirmado posteriormente por Nair (1996) en a) quiste periodóntico apical verdadero o también denominado quiste no conectado al foramen, y b) quiste periodóntico apical de bahía 63 o también llamado de bolsillo 26, 27, 33, 41, 48, 62, 63 cuyas características son:
En relación a la patogénesis del quiste periodóntico apical, se han formulado diversas teorías que tratan de explicar el origen de ambos tipos de quistes.
El líquido del quiste puede fluir bajo presión y humedecer continuamente el SCR posterior a la instrumentación, por lo cual no responde al tratamiento endodóntico convencional. Sin embargo, la medicación intraconductos con hidróxido de calcio puede solucionar este problema 26. Caliskan (2004) indica que la medicación con hidróxido de calcio debe ser cambiada con un intervalo de dos o tres semanas hasta completar un lapso de 3 meses 62. En ocasiones, las lesiones pueden alcanzar un gran tamaño. Los quistes son casi siempre estériles, pero pueden infectarse y el líquido comienza a ser mucopurulento 12, 59. Cuando los quistes son enucleados o penetrados con un instrumento usado en el conducto radicular, exudan un líquido viscoso amarillento rico en colesterol, el cual es un ácido graso monatómico que se forma por degeneración grasa de larga data liberada de las células adiposas 12, 62. Existen diferencias en relación al tratamiento de ambas formas de quiste periapical, de tal manera que un quiste en bahía o en bolsillo abierto al conducto radicular puede sanar posterior al tratamiento de conducto radicular convencional debido a que se remueven los irritantes intraconductos. Mientras que un quiste verdadero, que es autosustentable e independiente a la presencia o ausencia de irritantes en el conducto radicular, aunque contienen cristales de colesterol, requiere además del tratamiento de conducto convencional, una fase quirúrgica para la remoción del mismo, sobre todo si es de grandes dimensiones, para asegurar su completa remisión 62. Bhaskar (1972) sugiere que si se instrumenta mas allá del foramen apical, la reacción inflamatoria puede favorecer la destrucción del recubrimiento del quiste y la lesión se convierte en granuloma. Una vez que el factor causal es eliminado, el granuloma se regenera espontáneamente 57. Lin et al. (2009) basados en la patogénesis, histología y biología celular molecular, indican que los quistes periodóntico apicales verdaderos no son diferentes de los quistes de bolsillo o bahía y pueden regenerarse posterior al tratamiento de conductos radicular por el mecanismo de apoptosis o muerte celular programada. Considerando que las lesiones periodóntico apicales, ya sean absceso, granuloma o quiste, son causadas primariamente por la infección del SCR, el objetivo del tratamiento a realizar debe ser la eliminación completa de la infección para favorecer su remisión y evitar así la infección recurrente en el SCR 64.
CARACTERÍSTICAS CLÍNICAS DEL QUISTE PERIODÓNTICO APICAL Los quistes radiculares generalmente son asintomáticos, pero si se infectan, el paciente puede presentar dolor; se descubre cuando se toman radiografías de rutina en dientes no vitales. Algunos pacientes pueden quejarse de inflamación en la zona. Presentan crecimiento lento pero progresivo y pueden producir engrosamiento de las corticales. Se pueden observar varios quistes en un mismo paciente 49, 59. Según Bhaskar (1966), los quistes radiculares son dos veces mas frecuentes en hombres que en mujeres y 10 veces más en el maxilar que en la mandíbula, siendo la mayor incidencia en la tercera década de la vida 12, 57, 62. Existe una alta incidencia en la región anterior maxilar, presumiblemente como resultado de traumas 62.
CARACTERÍSTICAS HISTOPATOLÓGICAS DEL QUISTE PERIODÓNTICO APICAL En un corte histológico de un quiste periodóntico apical se observa una lesión granulomatosa en la cual hay una luz limitada por epitelio escamoso estratificado cubierto por tejido fibroso, generalmente contiene epitelio proliferado en una disposición "arqueada", con espículas óseas o hueso y presencia de infiltrado de células inflamatorias, predominantemente linfocitos y células plasmáticas. Internamente presenta un contenido líquido o semilíquido, constituido por restos de células epiteliales descamadas, cristales de colesterol y células inflamatorias. Los leucocitos polimorfonucleares por lo común se ven en la lesión y están dentro del epitelio cuando está proliferando. A menudo hay células gigantes y también eritrocitos y hemosiderina, típico de todas las lesiones granulomatosas 12, 25, 49, 58, 59, 65. Ricucci et al. (2006) demuestran por medio del estudio histológico de 50 especímenes humanos, de los cuales 16 lesiones fueron diagnosticadas como quistes, que las bacterias estaban ubicadas en la áreas necróticas de las lesiones periapicales. Las lesiones clasificadas como quiste verdadero están caracterizadas por la presencia de una cavidad rodeada por una pared epitelial la cual no continua con el conducto radicular en ninguno de los cortes histológicos seriados. La cavidad quística contiene una masa de células en diferentes estados de descomposición, restos necróticos, y algunos cristales de colesterol rodeados por leucocitos neutrófilos. La pared epitelial de la cavidad varía en espesor y siempre infiltrada por leucocitos neutrófilos. La capa interna de células en la pared quística demostró signos de descamación. Las fibras colágenas se organizan en una pseudo cápsula que rodea la pared quística. Se observan células inflamatorias sobre las fibras colágenas en el borde de la lesión 36. En el caso del quiste en bolsillo, Ricucci et al. (2006) observaron que el espacio quístico esta rodeado por una pared epitelial que se une a la superficie externa radicular formando un "saco". La cavidad quística está directamente abierta dentro del espacio del conducto. La pared de epitelio escamoso estratificado mostró signos de descamación celular la cual está infiltrada por polimorfonucleares. Algunos restos están presentes dentro del espacio quístico y la cavidad está rodeada por tejido conectivo inflamado 36. El espesor del tejido epitelial del quiste varía dependiendo de su ubicación, de tal manera que es mas gruesa en la zona cercana a la superficie radicular y se va adelgazando a medida que se aleja, Valderhaug (1972) describe esta relación entre el epitelio del quiste y la pared radicular 65. Los quistes pueden presentar o no cristales de colesterol y cuerpos de Rushton, los cuales son unas estructuras presentes en los revestimientos epiteliales, de color rosa vítreo, cuyo origen esta relacionado con la hemorragia presente dentro de la pared del quiste inflamado; otra hipótesis sería que los cristales de colesterol de los restos celulares presentes en el quiste podrían estimular a las células epiteliales a secretar sustancias amorfas, las cuales luego se calcifican 59. En la figura 11 y 12 se grafica por medio de cortes histológicos las características histopatológicas de un quiste periodóntico apical verdadero y en bolsillo, respectivamente.
CARACTERÍSTICAS RADIOGRÁFICAS DEL QUISTE PERIODÓNTICO APICAL Radiográficamente un quiste periodóntico apical presenta una imagen radiolúcida, circunscrita por una imagen radiopaca de forma esférica asociada al ápice de un diente desvitalizado compatible con la cortical ósea debido a una osteogénesis reaccional que delimita la lesión quística como consecuencia de la defensa orgánica, que circunscribe el proceso inflamatorio crónico y está asociado a la mineralización de los espacios intertrabeculares y a la compresión de finas trabécula óseas, por el crecimiento de expansión del quiste. Generalmente son lesiones grandes, de mas de 10 mm de diámetro 12, 49. En algunos casos puede haber desaparecido la línea radiopaca de osteogénesis reaccional, como generalmente ocurre cuando una de las corticales óseas es destruida y el quiste se exterioriza, bien sea por reagudización del proceso inflamatorio, por descompresión intraósea del quiste o por un defecto radiográfico 49. Las lesiones periapicales no pueden ser identificadas como quistes o granulomas apicales solo basados en la evidencia radiográfica 12, 48. Varios estudios han encontrado que las lesiones radiológicas mayores de 200 mm2, poseen una incidencia de ser quistes en un 92% 48, 62. Caracteristicas radiográficas observadas en la figura 13. Es imposible distinguir clínica y radiográficamente entre un quiste de bolsillo y un quiste verdadero 48, 62.
Una vez realizado el diagnóstico de la lesión periapical, se procederá a realizar el tratamiento correspondiente, el cual consistirá en tratamiento de conductos o exodoncia del diente, por las siguientes razones 12:
MEDICACIÓN INTRACONDUCTO Una vez iniciada la preparación mecánica del SCR y dependiendo del diagnóstico pulpar y periapical evaluado previamente, se procede a realizar control antimicrobiano como parte esencial del tratamiento endodóntico, colocando medicación intraconductos, que consiste en la aplicación tópica de medicamentos dentro del SCR con la intención de lograr efectos terapéuticos locales y no a nivel sistémico. Estos medicamentos pueden ser de diferentes tipos, tales como antisépticos, antibióticos, corticosteriodes y pastas de hidróxido de calcio para tratar el dolor, inflamación o para reducir la hemorragia. Además el empleo local de sustancias irrigantes y quelantes, los cuales son coadyuvantes químicos en el proceso de instrumentación del SCR. Los antisépticos constituyen la medicación tópica más empleada en endodoncia 22, 66. La completa preparación químico-mecánica es considerada un paso esencial en la desinfección del SCR; la eliminación total de las bacterias es difícil de lograr solo con la instrumentación mecánica, motivo por el cual, la medicación intraconductos entre consultas es usada para eliminar el remanente bacterial, desinfectando el conducto radicular después de la instrumentación e irrigación, ayudando a reducir dolor postoperatorio, disminuyendo inflamación periapical e induciendo la sanación de los tejidos periapicales 66, 67, 68, 69, 70, 71. Los desinfectantes utilizados como medicamentos intraconductos han sido divididos en 69:
El medicamento intraconducto cumple función de barrera física per se, así como barrera química debido a las propiedades antibacteriales que poseen 66. Es importante considerar que el SCR puede recontaminarse cuando el número de células bacterianas excede la actividad antibacteriana del medicamento. Adicionalmente, la saliva puede diluir el medicamento neutralizando sus efectos, permitiendo la invasión de los microorganismos 66. La habilidad del medicamento intraconductos de disolver el tejido remanente y difundir en el SCR será esencial para que su acción sea exitosa 66.
OBJETIVOS DE LA MEDICACIÓN EN CASOS DE PULPA NECRÓTICA En caso de infecciones, se requiere el uso de un agente antimicrobiano (antibióticos o antisépticos) como medicamento dentro del conducto radicular o, en ciertas circunstancias, sistémicamente. Los conductos infectados causan inflamación en el tejido periapical adyacente, motivo por el cual un agente antiinflamatorio combinado con un agente antimicrobial como medicamento intraconductos debe ser considerado. La habilidad del medicamento intraconductos de disolver y difundir en el SCR será esencial para que su acción sea exitosa, segun lo reporta Siqueira et al. (1997) y Abbott y Yu (2007) 14, 66. Diversos estudios indican que el objetivo principal de la medicación intraconducto entre sesiones consiste en erradicar la mayor cantidad de bacterias y microorganismos, que probablemente con la preparación químico-mecánica, no se logran eliminar 66, 72, 73, 74, 75. Autores como Estrela et al. (1999) y Kusgoz et al. (2007), han demostrado que el diente con necrosis pulpar y lesión periapical tratado con medicación intraconductos, demuestra menor reacción inflamatoria periapical y puede crear un ambiente más favorable para sanar y estimular la reparación ósea 48, 76, 77, 78. La Asociación Americana de Endodoncia (2011) indica que la colocación de medicación intraconductos no posee un efecto significativo en la prevención del dolor 69. Adicionalmente, algunos autores refieren que el uso rutinario de la medicación por largos períodos de tiempo no es aceptable en la práctica de la endodoncia 66. Como se mencionó anteriormente, existe una amplia gama de medicamentos que pueden ser empleados en la preparación química del SCR, pero a efectos de la presente investigación se revisará ampliamente lo relativo al uso del hidróxido de calcio.
HIDRÓXIDO DE CALCIO Desde su introducción en la práctica odontológica, realizado por Hermann en 1920, el hidróxido de calcio (Ca(OH)2) ha sido usado ampliamente en la endodoncia. Los reportes de la literatura indican que Nygren (1938) lo usó para el tratamiento de una fístula dental, mientras que Codman (1851) fue el primero en tratar de preservar la pulpa dental con el uso de este medicamento como recubrimiento pulpar directo 48, 76, 79. Es una sustancia fuertemente alcalina, con un pH de aproximadamente 12.5 en una solución acuosa. El hidróxido de calcio se disocia en iones hidroxilo (OH-) e iones de calcio (Ca+) 48, 79. Se le atribuyen varias propiedades biológicas tales como:
Diversos autores han demostrado que el hidróxido de calcio posee un efecto letal sobre las células bacterianas 76, 86. Este efecto fue observado solo cuando la sustancia esta en contacto directo con la bacteria. En estas condiciones, la concentraciones de iones hidroxilo son bastante altas, siendo niveles incompatibles para la supervivencia bacteriana. Clínicamente este contacto directo no siempre es posible, pero para que el hidróxido de calcio actúe efectivamente como medicamento intraconducto, los iones hidroxilo deben difundirse a través de los remanentes dentinales y de tejido pulpar 66. Debido a las propiedades antes expuestas, su citotóxicidad es limitada al área de contacto directo con el tejido 66. La extrusión del material dentro del tejido periapical puede causar necrosis del tejido y dolor en el paciente 69. Por otro lado, su baja solubilidad y difusibilidad, puede hacer que sea difícil llegar a un aumento rápido y significativo en el pH que sea capaz de eliminar las bacterias localizadas dentro de los túbulos dentinales y encerradas en las variaciones anatómicas 66. En cuanto al tiempo requerido para que el hidróxido de calcio pueda realizar una óptima desinfección, existen diferentes opiniones en la literatura 66. Sjögren et al. (1991) demostraron que el uso por una semana elimina efectivamente las bacterias del conducto radicular 75. A diferencia, Castillo (2011) concluye que el tiempo mínimo requerido para lograr el efecto antimicrobiano del Ca(OH)2, es de 10 días, demostrándose una completa eficacia en la eliminación del Enterococcus faecalis del SCR, siendo su acción ineficaz con respecto a la erradicación bacteriana cuando es utilizada por cortos periodos de tiempo 72. De igual manera Ørstavik y Haapasalo (1990) observaron que el hidróxido de calcio puede tomar 10 días para desinfectar los túbulos dentinales infectados por bacterias facultativas 87. Se ha demostrado que el tratamiento con hidróxido de calcio, presenta una alta tasa de reparación periapical y de algunas lesiones, particularmente en individuos jóvenes, las cuales decrecen o incluso desaparecen en un período de 1-4 meses después del tratamiento 48. Diferentes vehículos han sido añadidos al hidróxido de calcio en un intento de mejorar su actividad antimicrobiana, biocompatibilidad, disociación iónica y difusión. Un factor controversial a la hora de elegir un vehículo es la comparación del efecto antimicrobiano del Ca(OH)2 en asociación con vehículos hidrosolubles (agua destilada, solución salina, anestésico local) y vehículos oleosos (paramonoclorofenol alcanforado, glicerina) 69, 73, 79, 80. El Ca(OH)2 ha demostrado una superioridad antimicrobiana durante el tratamiento de conductos radiculares infectados al compararlo con paramonoclorofenol alcanforado y el fenol alcanforado, evaluándolos bajo métodos bacteriológicos. Sin embargo, el Ca(OH)2 mezclado en pequeñas cantidades con paramonoclorofenol alcanforado, aumenta tanto la penetración en dentina como su período de acción debido a la formación de paraclorofenolato de calcio. Algunos autores han descrito que la mezcla de estos dos medicamentos es más potente para la eliminación del E. faecalis cuando se encuentra presente en altas concentraciones; sin embargo, Heling et al. (1992) y Siqueira et al. (2007) indican que el hidróxido de calcio no actúa contra el E. faecalis ubicados en los túbulos dentinales, fallando en esterilizar la dentina o prevenir infección secundaria, pero con el uso combinado con Hipoclorito de Sodio (NaOCl) como líquido irrigante, disminuye la microbiota del SCR 66, 73, 80, 83, 88, 89, 90. De igual manera, a las pastas de Ca(OH)2 se le pueden adicionar otros componentes que potencien la acción antimicrobiana como soluciones antibióticas-corticosteroides y antibióticas solas 66, 79, igualmente sustancias que facilitan el contraste radiográfico, para que de esta manera se pueda identificar radiográficamente conductos accesorios y laterales, defectos resortivos, fracturas y otras estructuras 79. Estudios sobre la acción antimicrobiana e inducción en la reparación de tejidos ha demostrado que el Ca(OH)2 es la mejor opción comparado con otros agentes antimicrobianos 66, 73, 76. Debido a lo antes descrito, ha sido recomendado para el uso en diversas situaciones clínicas 38, 48, 91; siendo el medicamento intraconductos más utilizado 71, 76, 91.
MECANISMO DE ACCIÓN DEL HIDRÓXIDO DE CALCIO La función principal del Ca(OH)2 como medicamento intraconductos consiste en proveer actividad antimicrobial, sin embargo, algunas propiedades físico-químicas de esta sustancia puede limitar su efectividad de desinfección del SCR 66, 79. Muchos de los patógenos no pueden sobrevivir en el ambiente altamente alcalino provisto por el hidróxido de calcio. Su alto pH, aproximadamente 12.5, hace que varias especies bacterianas comúnmente encontradas en conductos radiculares infectados sean eliminadas después de cortos períodos de tiempo en contacto directo con esta sustancia debido a que inhibe actividades esenciales tales como metabolismo, crecimiento y división celular y actúa sobre la membrana citoplasmática bacteriana, mediante la interrupción de componentes orgánicos (proteínas, fosfolípidos) y transporte de nutrientes, lo que conduce a un efecto antimicrobiano y a la activación enzimática de los tejidos, determinado por su acción sobre la fosfatasa alcalina que origina un efecto mineralizador 66, 73, 79, 80, 83, 88, 91, el cual puede conducir a una inactivación reversible o irreversible de microorganismos aerobios, anaerobios, Gram-positivo y Gram-negativos 73. El efecto antimicrobiano depende de la velocidad de liberación de iones hidroxilo, disponibilidad y tiempo de contacto de la acción directa o indirecta 73, 79. Los iones hidroxilos pueden penetrar o tener difusibilidad en la dentina para degradar los microorganismos dentro del túbulo dentinario 70, 73, 79, causando daño al ADN de las células bacterianas, debido a que inhibe la replicación y la actividad celular 66. Su baja solubilidad en agua es una característica útil debido a que se necesita que el medicamento permanezca largos períodos de tiempo en contacto directo con los tejidos vitales 80.
TÉCNICAS PARA LA COLOCACIÓN DE LA MEDICACIÓN INTRACONDUCTOS Idealmente el Ca(OH)2 debe ser colocado de manera que abarque completamente la región apical del SCR y en cantidad suficiente que permita lograr el efecto biológico al estar en proximidad con los tejidos apropiados. Sigurdsson (1991) y Texeira et al. (2005), compararon diferentes tipos de técnicas para llevar el medicamento al interior del SCR, logrando mejores resultados con el uso del instrumento tipo léntulo en espiral 72, 92. Además, Texeira et al. (2005) indicaron que se obtenían mayores valores de pH de la dentina 92. Sin embargo, debido a su toxicidad, la Asociación Americana de Endodoncia (2011) indica que el Ca(OH)2 pudiera ser colocado dentro del conducto radicular con la ayuda de una lima 69.
PARÁMETROS DE EVALUACIÓN DE LOS TRATAMIENTOS ENDODÓNTICOS En la practica clínica endodontica, la evolución de los tratamientos de conductos se evalua usando parámetros clínicos y radiográficos, que definen criterios de éxito y fracaso. La literatura especializada reporta numerosos trabajos que tratan el tema, sin embargo es bueno acotar que la variación observada entre los autores, se basa principalmente en la forma de clasificarlos. Sankarsingh (2002) indica que el éxito y fracaso son términos usualmenteempleados para la evaluación del resultado de la terapia endodóntica. La ausencia de criterios uniformes de evaluación es el problema principal cuando se trata de comparar los resultados de los tratamientos de conductos 46. Investigadores y asociaciones de especialistas han tratado de unificar criterios en relación a la determinación del resultado del tratamiento de conducto, sin embargo, aún no existe consenso en el éxito y fracaso 46. Para obtener un diagnóstico apropiado se requiere de la integración estrecha de la información subjetiva manifestada por el paciente y los datos objetivos obtenidos durante el examen clínico y radiográfico. La determinación de éxito o fracaso endodóntico dicta las pautas en relación al tratamiento a instaurar 46. Bender, Seltzer y Soltanoff (1966), refieren que el éxito en la reevaluación se determina cuando radiográficamente el área radiolúcida persiste pero sin aumento de tamaño y sin síntomas clínicos asociados como dolor, inflamación y desarrollo de fístula. Por otro lado, si a la reevaluación radiográfica la imagen radiolúcida periapical se observa más grande y el diente no presenta síntomas asociados, el tratamiento es considerado como fracaso 25. Los criterios utilizados por Bender, Seltzer y Soltanoff (1966) para categorizar el éxito de la terapia endodóntica son 25:
Harty, Parkins y Wengraf (1970), consideraron como criterio de éxito aquellos dientes que permanecieron clínicamente funcionales por 2 o más años y presentaron una apariencia radiográfica normal con completa remisión de la radiolucencia ósea y la presencia de un ligamento periodontal de apariencia normal 93. Morse, Wolfson y Schacterle (1975) consideraron que un tratamiento de conductos es exitoso cuando se cumplieron criterios clínicos y radiográficos específicos como: ausencia de manifestaciones clínicas, sin dolor, inflamación, fístula o sensibilidad a la percusión o palpación, y evidencia de la disminución del diámetro radiográfico de la lesión periapical 60. Kerekes y Tronstad (1979) evaluaron radiográficamente los tratamientos de conductos, clasificandolos en 11:
Molven et al. (2002) dividen en tres grupos la evaluación radiográfica: sin lesión, espacio del ligamento periodontal aumentado o lesión evidente 44. Friedman et al. (2003), Farzaneh et al. (2004), Marquis et al. (2006) y Chevigny et al. (2008), los clasifican en 5, 94, 95, 96:
Caliscan (2004) clasificó los criterios de evaluación en 62:
Por otra parte, Doyle et al. (2006) indican éxito en el tratamiento endodóntico, cuando los datos clínicos y radiográficos demuestren que el diente está en boca sin presencia de periodontitis apical o síntomas, usando como referencia la escala de Índice Periapical 4. Siqueira et al. (2008) acordaron categorizar las evaluaciones como 89:
Por lo antes expuesto, se puede resumir que la ausencia de unificación de criterios para la evaluación de los tratamientos de conductos representa una dificultad al momento de comparar estudios y metodologías de trabajo.
MARCO METODOLÓGICO.- DISEÑO DE LA INVESTIGACIÓN Para cumplir con los objetivos y dar respuesta a las preguntas planteadas en la presente investigación, se realizó un estudio combinado, es decir, un estudio exploratorio, descriptivo, prospectivo y longitudinal y posteriormente se realizó un levantamiento epidemiológico de prevalencia de dientes con diagnóstico de necrosis pulpar de los pacientes atendidos en el Postgrado de Endodoncia de la Facultad de Odontología de la Universidad Central de Venezuela en el período de Abril a Julio de 2014. Un estudio epidemiológico es aquel que describe la distribución y los determinantes de las enfermedades en una población determinada 97. Los estudios de prevalencia se usan para registrar la presencia de enfermedades o características de una población, lo cual permite determinar la carga de enfermedades y condiciones 97. Los estudios exploratorios se realizan cuando no existen investigaciones previas o cuando el conocimiento del tema es vago e impreciso, de tal manera que impide obtener conclusiones sobre aspectos relevantes, por lo que se requiere, en primer término, explorar e indagar 98. Edmonds y Kennedy (2013) explican que la investigación exploratoria termina cuando, a partir de los datos recolectados, haya sido posible crear un marco teórico y epistemológico lo suficientemente fuerte como para determinar qué factores son relevantes al problema y, por lo tanto, deben ser investigados 98. Un estudio descriptivo es aquel en el que se seleccionan una serie de conceptos o variables y se mide cada una de ellas independientemente de las otras, con el fin de describirlas. Estos estudios buscan especificar las propiedades importantes de cualquier fenómeno. Su propósito es la delimitación de los hechos que conforman el problema de investigación 98. Los estudios prospectivos son aquellos cuyo inicio es anterior a los hechos estudiados y los datos se recogen a medida que van sucediendo 98. Un estudio longitudinal es aquel en el que las variables de estudio son medidas en dos o más ocasiones, y por ello, las comparaciones antes y después se realizan entre muestras relacionadas. En estos estudios existe un tiempo entre las distintas mediciones, de forma tal que pueda establecerse una secuencia temporal entre estas 98.
POBLACIÓN Todos los pacientes referidos al Postgrado de Endodoncia de la Facultad de Odontología de la Universidad Central de Venezuela para realización de tratamiento endodóntico en el período comprendido entre Abril a Julio del año 2014.
MUESTRA Todos los pacientes que asistieron al Postgrado de Endodoncia de la Facultad de Odontología de la Universidad Central de Venezuela en el período de estudio, con diagnóstico de necrosis pulpar, que cumplan los criterios de inclusión descritos.
ASPECTOS ÉTICOS Este protocolo de investigación clínica se basó en la implementación de procedimientos éticos para la atención del paciente, basados en los principios de no maleficiencia y benevolencia siempre orientados a la aplicación del plan de tratamiento indicado para cada caso en particular, procurando no causar daños al paciente. Se le informó al paciente el propósito del estudio, de manera clara y precisa, así como la importancia científica y epidemiológica de su participación, sin coacción y con libertad de abandonar en el proyecto sin sanción alguna. Se explicó el procedimiento, el cual consistió en la evaluación de un protocolo clínico de atención endodóntica en dientes con diagnóstico de necrosis pulpar; se le informó que si el diente no recibe el tratamiento correspondiente, no se podrá recuperar la salud bucal. Se indicaron los riesgos que puede conllevar dicho tratamiento y que se corresponden con la actividad clínica diaria de la especialidad de Endodoncia, los cuales son: toma de radiografías bucales (Rayos ionizantes) en mínimas cantidades, agudización como respuesta biológica al tratamiento, perforación dentaria, fractura de instrumentos dentro del sistema de conductos radiculares, imposibilidad de permeabilizar la totalidad del conducto y reacciones de alergia al latex, entre otros factores de riesgo. El proyecto fue sometido a consideración por parte del Comité de Bioética de la Facultad de Odontología de la Universidad Central de Venezuela, desarrollándose un consentimiento informado para participar como sujeto de estudio en el proyecto evaluación de los tratamientos endodónticos, y posterior aprobación y otorgación del aval por parte de este comité. (Anexo 1).
CRITERIOS DE INCLUSIÓN
CRITERIOS DE EXCLUSIÓN
OBTENCIÓN DE PROCESAMIENTOS DE LOS DATOS.- PROCEDIMIENTO OPERATORIO
ANÁLISIS RADIOGRÁFICO Las radiografías que se tomaron en cuenta para esta evaluación fueron: radiografía inicial del tratamiento, radiografía final del tratamiento y radiografía de control postoperatorio a los 180 días por cada uno de los dientes tratados. Se escogieron 3 examinadores, de los cuales dos especialistas en el área de endodoncia y uno en el área de radiología. En reunión previa, se calibró el instrumento para recolección de datos, al estandarizar los métodos de recolección y datos, los métodos de medición y explicar con claridad las definiciones operativas de las variables a evaluar en el Índice Periapical de Ørstavik, Kerekes y Eriksen (1986) 40:
El Índice Periapical agrupa la inflamación periapical en una escala de 3 categorías: 1 = saludable, 2-3 = dudoso, 4-5 = enfermo 40. Los examinadores procedieron a evaluar las radiografías en un ambiente adecuado y acondicionado cómodamente bajo luz tenue, en cual contó con un negatoscopio de tamaño necesario, con iluminación brillante, suficiente, uniforme y de intensidad variable. Se empleó lentes de aumento (lupas) que permitieron el estudio detallado de las regiones más importantes de la película radiográfica. Las radiografías de cada diente fueron revisadas por 3 examinadores que se calibraron según el Índice Periapical (IP) para evaluar la presencia o ausencia de periodontitis apical. En caso de dientes multirradiculares se tomó la imagen periapical de mayor tamaño presente en cualquier raíz. La evaluación radiográfica realizada por los examinadores fue realizada en dos sesiones, con un intervalo de tiempo de 8 días. Los datos fueron registrados en un instrumento de recolección de datos (Anexo 7, 8, 9).
INSTRUMENTO DE RECOLECCIÓN DE DATOS Todos los pacientes que asistieron al servicio del PE de la FO de la UCV para evaluación y realización de tratamiento de conductos fueron registrados en un cuadro de control de pacientes (Anexo 10), con un número determinado. Todos los datos fueron recolectados en un instrumento ad hoc, creado específicamente para este estudio. Los pacientes fueron asignados bajo un orden específico a cada uno de los estudiantes del postgrado de endodoncia y cumplieron con los siguientes parámetros:
VARIABLES Las variables que se tomaron en cuenta para el análisis de los datos en el presente estudio están expresadas en la siguiente tabla, la cual las agrupa dependiendo de su dimensión, sub-dimensión, indicador, sub-indicador, escala e instrumento (Tabla I): 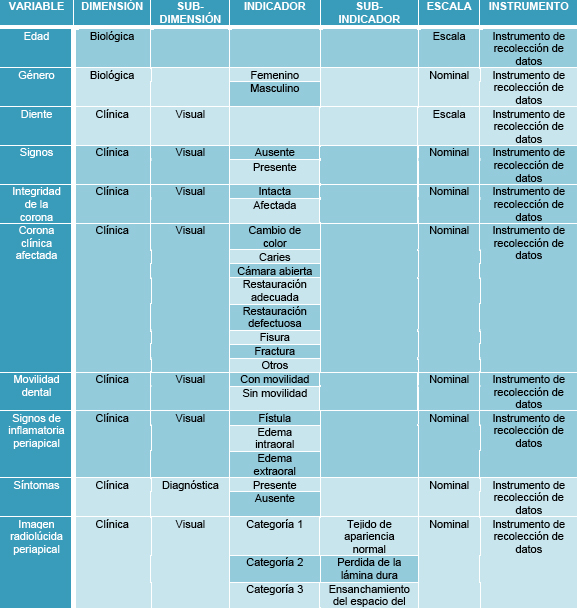
Tabla I. Definición operacional de las variables. Jiménez 2015.
TÉCNICAS DE PROCESAMIENTO Y ANÁLISIS DE LOS DATOS Los datos recolectados en los instrumentos utilizados para el estudio fueron introducidos en la base de datos del Paquete Estadístico SPSS® (Statistical Package for the Social Sciences) versión 21.0. Con la finalidad de dar respuesta a las preguntas de la investigación y cumplir con los objetivos del presente estudio, se decidió realizar 5 tipos de análisis de los datos obtenidos:
Todos los análisis se realizaron con un Intervalo de Confianza del 95%.
RESULTADOS.- ANÁLISIS DE CONFIABILIDAD DE LOS OBSERVADORES Para verificar la confiabilidad de lo obtenido por medio del proceso de observación y del instrumento utilizado, se realizó un análisis de confiabilidad por medio del Coeficiente Alfa de Cronbach. El Coeficiente Alfa de Cronbach, al no ser un estadístico, no se acompaña de ningún p-valor que permita rechazar o asumir la hipótesis de fiabilidad. Este coeficiente toma como base que su valor aumenta cuando las correlaciones ítem-total son altas y, por ello, mejores correlaciones dan mayor fiabilidad, es decir, cuanto más se aproxime a 1 mayor es la fiabilidad, asumiéndose que valores de ? superiores a 0,7 o 0,8 son suficientes para garantizar la fiabilidad del proceso y de la escala. Los resultados obtenidos por medio del Coeficiente Alfa de Cronbach a partir de las varianzas (?) y a partir de las correlaciones de los ítems (?e), se muestran en la Tabla II. Se puede observar un ?= 0,910 y un ?e= 0,823, lo cual denota una alta consistencia, coherencia y confiabilidad del instrumento y del proceso de observación. 
Tabla II. Análisis de confiabilidad del instrumento y del proceso de observación.
Con la finalidad de evaluar la confiabilidad de los observadores, se decidió realizar un análisis intra e inter observadores. Al obtener datos categóricos, las pruebas sobre los sesgos entre observadores y las medidas de acuerdo entre ellos se obtuvieron a partir del modelo ANOVA por medio del Índice Kappa de Cohen (K). El Índice Kappa es un estadístico de concordancia que corrige el azar. Este índice fue utilizado para demostrar la precisión de los observadores, agrupando los datos en una sola tabla y calculando e interpretando un único valor, así valores entre 0,40 y 0,60 se consideran malos, valores entre 0,60 y 0,75 buenos y por encima de 0,75 excelentes.
En la Tabla III se muestra el resultado obtenido para el Índice de Kappa, en ella se observa, por medio del modelo ANOVA un valor K= 0,751 con una significancia estadística <0,05, demostrando una precisión intra e inter observadores excelente. 
Tabla III. Análisis del Índice Kappa de Cohen intra e inter observadores.
ANÁLISIS EPIDEMIOLÓGICO Con la finalidad de realizar el análisis epidemiológico de la prevalencia de dientes con diagnóstico de necrosis pulpar en la muestra analizada en el PE de la FO de la UCV durante el periodo Abril-Julio del año 2014 se utilizó la ecuación de Prevalencia (P). La prevalencia total de dientes con diagnóstico de necrosis pulpar fue determinada con los siguientes datos: número de dientes evaluados para tratamiento endodóntico y el total de dientes con este diagnóstico. 
Esto significa que del total de pacientes evaluados para tratamiento endodóntico en el PE de la FO de la UCV durante el período Abril-Julio del año 2014, el 41,17% presentó diagnóstico de necrosis pulpar. Se procedió a excluir de la muestra total de dientes con diagnóstico de necrosis pulpar a todos aquellos que presentaron accidentes antes o durante el tratamiento de conductos y los dientes para retratamiento endodóntico. Luego de esto, la muestra específica quedó constituida por 15 dientes con diagnóstico de necrosis pulpar, correspondiendo al 29% de los dientes evaluados para tratamiento endodóntico en el PE de la FO de la UCV. De la muestra total atendida, asistieron a la revaluación clínica y radiográfica 40 dientes, lo que corresponde con el 78.43%. De la muestra específica, comprendida por 15 dientes con diagnóstico de necrosis pulpar, asistieron a la revaluación clínica y radiográfica 13 dientes, comprendiendo un 86.66%. A partir de esta muestra específica se calculó la prevalencia de diagnóstico periapical sano, dudoso y enfermo de esos dientes con diagnóstico de necrosis pulpar.  Del total de dientes con diagnóstico de necrosis pulpar, el 7,69% presentó diagnóstico periapical sano, el 53,84% diagnóstico periapical dudoso y el 38,46% diagnóstico periapical enfermo.
ANÁLISIS DESCRIPTIVO La muestra total analizada estuvo constituida por 40 pacientes, de los cuales el 77,5% (31) pertenecen al género femenino y el 22,5% (9) al género masculino (Figura 14). La media de edad fue de 49,8 con una desviación estándar de +/- 14,09 años, la edad mínima fue de 17 años y la máxima de 73 años y la moda fue 55 años. 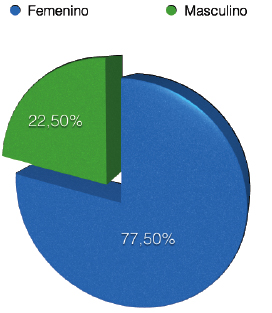
Figura 14. Porcentaje de pacientes según el género de la muestra total.
El diente más afectado fue el primer molar inferior izquierdo (36) con el 17,5% (7) y en segundo lugar el primer molar inferior derecho (46) con el 10% (4). Del total de la muestra específica (13 pacientes y 13 dientes) el 76,92% (10) pertenecen al género femenino y el 23,08% (3) al género masculino (Figura 15). La media de edad fue de 47,30 (+/- 16,60) años, la edad mínima fue de 17 años y la máxima de 66 años y una moda de 59 años.
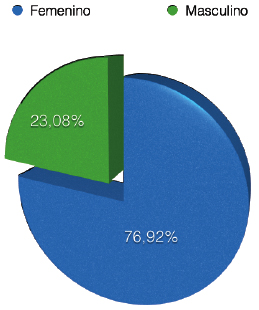
Figura 15. Porcentaje de diagnóstico de necrosis pulpar según el género en la muestra específica.
Antes de la terapia endodóntica, es decir, en el registro preliminar, el 76,9% (10) presentaron algún signo y el 23,1% (3) no presentaron signos (Figura 16). En relación a la integridad de la corona dental, el 84,6% (11) tenía la corona afectada y el 15,4% (2) presentó la corona dental intacta (Figura 17). De los dientes con la corona dental afectada, el 53,8% (7) presentó restauración defectuosa, el 15,4% (2) cámara pulpar abierta o expuesta, el 7,7% (1) caries y el 7,7% (1) restauración adecuada (Figura 18).
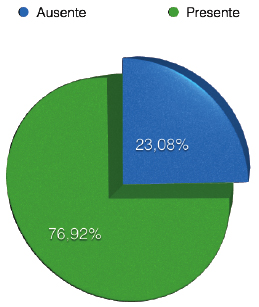
Figura 16. Porcentaje de dientes con diagnóstico de necrosis pulpar que presentaron algún signo.
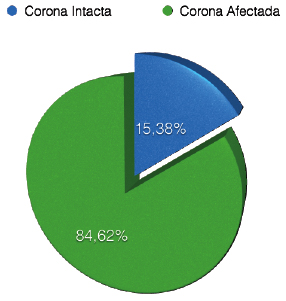
Figura 17. Porcentaje de dientes con diagnóstico de necrosis pulpar según la integridad de la corona clínica.
Figura 18. Porcentaje de dientes con diagnóstico de necrosis pulpar según el tipo de afección de la corona clínica.
En relación a la movilidad dentaria, el 69,2% (9) no presentó movilidad y el 30,8% (4) presentó algún grado de movilidad (Figura 19). Sólo en un (1) diente se observó fistula (7,7%).
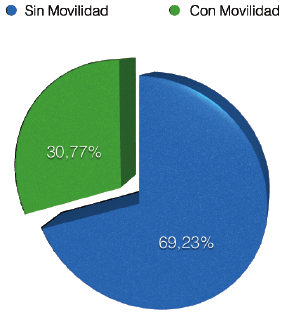
Figura 19. Porcentaje de dientes con diagnóstico de necrosis pulpar según el la presencia o no de movilidad.
El 84,6% (11) no refirieron ninguna sintomatología y el 15,4% (2) refirieron dolor (Figura 20). El 100% resultó negativo a la prueba al frío, el 92,3% (12) negativo al calor (Figura 21), el 53,8% (7) resultó negativo a la percusión vertical y el 46,2% (6) resultó positivo (Figura 22), el 76,9% (10) no presentó sintomatología a la percusión horizontal (Figura 23) y el 76,9% (10) resultó negativo a la palpación sobre apical (Figura 24).
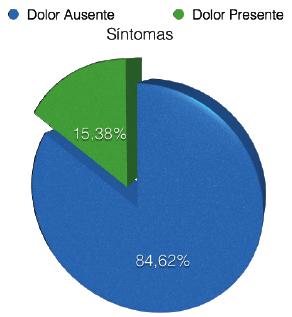
Figura 20. Porcentaje de dientes con diagnóstico de necrosis pulpar según los síntomas.
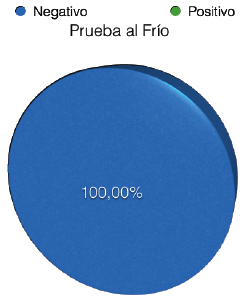
Figura 21. Porcentaje de dientes con diagnóstico de necrosis pulpar según las pruebas al frío y al calor.

Figura 22. Porcentaje de dientes con diagnóstico de necrosis pulpar según la prueba de percusión vertical.
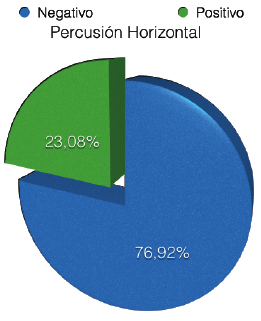
Figura 23. Porcentaje de dientes con diagnóstico de necrosis pulpar según la prueba de percusión horizontal.
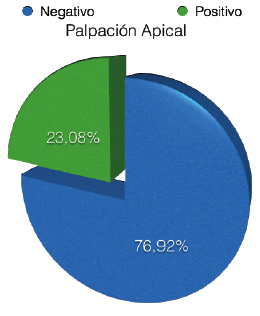
Figura 24. Porcentaje de dientes con diagnóstico de necrosis pulpar según la prueba de palpación apical.
En relación al diagnóstico radiográfico, el 38,46% (5) presentó un índice periapical categoría 4, el 30,77% (4) categoría 2, el 23,08% (3) categoría 3 y el 7,69% (1) categoría 1 (Figura 25).
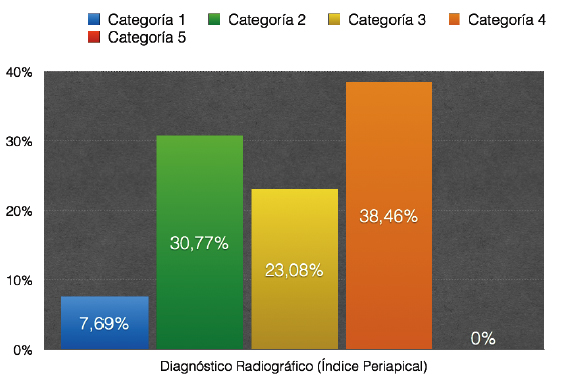
Figura 25. Porcentaje de dientes con diagnóstico de necrosis pulpar según el diagnóstico radiográfico.
El 69,23% (9) presentaron un diagnóstico periapical de Periodontitis Apical Crónica, el 23,08% (3) Periodontitis Apical Aguda y el 7,69% (1) no presentó ningún diagnóstico periapical (Figura 26).
Figura 26. Porcentaje de dientes con diagnóstico de necrosis pulpar según el diagnóstico periapical.
En relación a la etiología, el 69,23% (9) fue por caries dental, el 15,38% (2) por periodontopatía y el 15,38% (2) por razones protésicas o endodónticas (Figura 27).
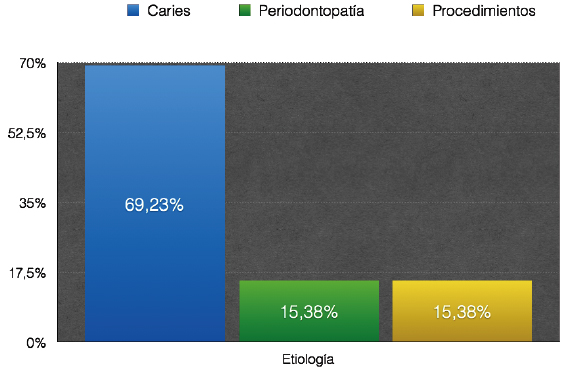
Figura 27. Porcentaje de dientes con diagnóstico de necrosis pulpar según la etiología.
ANÁLISIS COMPARATIVO El presente análisis se realizó con la finalidad de mostrar los cambios en las diferentes variables entre el registro preliminar, el postoperatorio inmediato y el control a los 180 días. En la evaluación preliminar, el 84,62% (11) no presentaron síntomas y el 15,38% (2) presentaron alguna sintomatología, en el postoperatorio inmediato y en el control a los 180 días el 100% no presentó sintomatología (Figura 28).
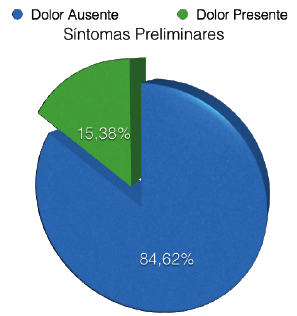
En relación a la movilidad dental, en la evaluación preliminar y en el postoperatorio inmediato el 69,23% (9) no presentó movilidad y el 30,77% (4) presentó algún grado de movilidad dental, sin embargo en el control a los 180 días el 100% no presentó ningún tipo de movilidad (Figura 29).
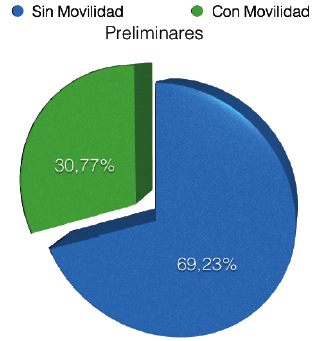
En el diagnóstico radiográfico en la evaluación preliminar, el 38,46% (5) presentó un diagnóstico periapical categoría 4, el 23,08% (3) categoría 3, el 30,77% (4) categoría 2 y el 7,69% (1) categoría 1. En el postoperatorio inmediato, el 23,08% (3) presentaron un diagnóstico periapical categoría 4, el 23,08% (3) categoría 3, el 46,15% (6) categoría 2 y el 7,69% (1) categoría 1. En el control a los 180 días se observó que el 7,69% (1) presentó un diagnóstico periapical categoría 4, el 7,69% (1) categoría 3, el 46,15% (6) categoría 2 y el 38,46% (5) categoría 1 (Figura 30).
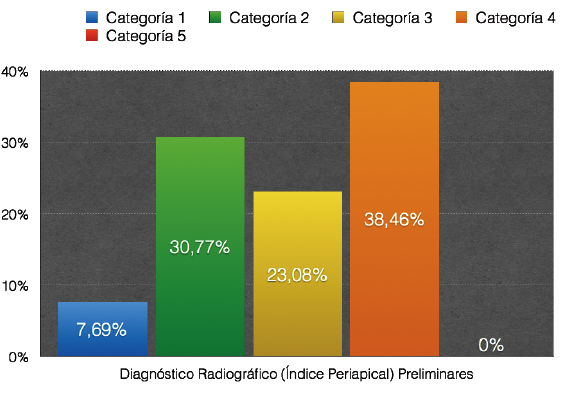
En relación a las pruebas de percusión vertical y horizontal y la palpación sobre apical, en la evaluación preliminar el 46,15% (6) resultó positivo a la percusión vertical, el 23,08% (3) a la percusión horizontal y el 23,08% (3) a la palpación sobre apical. En el postoperatorio inmediato, el 30,77% (4) resultó positivo a la percusión vertical, el 15,38% (2) a la horizontal y el 100% no presentó sintomatología a la palpación sobre apical. En el control a los 180 días el 100% resultaron negativos a ambas percusiones y a la palpación sobre apical (Figura 31).
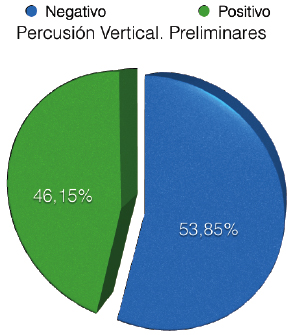
El 84,62% (11) presentaron una restauración definitiva adecuada y el 15,30% (2) presentaban restauración provisional al evaluar el control a los 180 días (Figura 32).
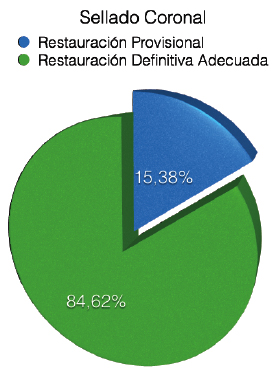
Figura 32. Porcentaje de dientes con diagnóstico de necrosis pulpar según el sellado coronal en el control a los 180 días.
DISCUSIÓN Desde los inicios en la práctica endodóntica, los autores han mostrado interés en la estandarización de la técnica usada en la realización de los tratamientos de conducto y de esta manera poder comparar los resultados obtenidos a corto, mediano y largo plazo 10, 11, para lo cual se han establecido criterios de éxito y fracaso, tanto desde el punto de vista clínico como radiográfico 4, 5, 11, 44, 60, 62, 89, 94, 95, 96. Entre las patologías pulpares, la necrosis es una de las más frecuentes y puede estar asociada a lesiones periapicales como absceso, granuloma o quiste, como lo expresan los resultados del presente estudio, el cual indica una prevalencia de 41,17% de pacientes con dientes con diagnóstico de necrosis pulpar evaluados en el PE de la FO de la UCV durante el período Abril-Julio del año 2014. El objetivo del tratamiento de estas patologías consiste en la eliminación de los microorganismos presentes en el SCR, que constituye su principal factor etiológico, por medio de la realización del tratamiento de conducto con la finalidad de permitir que el diente tratado quede estéril y sea incorporado a la fisiología bucal normal 8. La literatura revisada reporta resultados que varian entre sí de acuerdo a la metodología usada en la investigación, la cual puede dificultar la búsqueda de datos que permitan comparaciones en aspectos tales como 94:
Friedman (2002) indica que la mayoría de los estudios poseen un tamaño de muestra pequeña, motivo por el cual variables específicas pueden emerger como insignificantes, mientras que en estudios con muestras grandes las mismas variables pueden significar una influencia en el pronóstico 99. Esta diversidad puede causar confusión en la búsqueda de datos clínicos que beneficien al tratamiento de conducto en la toma de decisiones clínicas y pronóstico de los casos 94. Otro factor importante a considerar es la preparación y experiencia del clínico que realiza el tratamiento. Autores como Friedman et al. (2003), Farzaneh et al. (2004), Marquis et al. (2006) y Chevigny et al. (2008) contaron en su investigación con estudiantes de postgrado supervisados por especialistas en Endodoncia 5, 94, 95, 96, al igual que en el presente trabajo, obteniendo resultados satisfactorios y Friedman (2002) considera que con operadores experimentados y cuidadosos es menos probable que se cometan errores de procedimiento que puedan comprometer el pronóstico. Por lo tanto, los resultados del estudio pueden variar de acuerdo a los operadores del tratamiento y su experiencia 99. A diferencia, Kerekes y Tronstad (1979), incluyó estudiantes de pregrado en su investigación obteniendo de igual manera resutados satisfactorios 11. En cuanto al período de evaluación es importante señalar que la periodontitis apical es un proceso dinámico, el cual requiere de suficiente tiempo para evaluar el pronóstico y remisión. La evaluación tras cortos períodos de tiempo puede demostrar solo signos de sanación, pudiendo no revelar el verdadero pronóstico 99. De igual manera, Siqueira et al. (2008), basados en el resultado de su investigación, advierten que se hace evidente que el tiempo de reevaluación puede influir en el análisis de los resultados. Tiempos cortos de reevaluación pueden resultar en lesiones interpretadas como incompletamente curadas. Se sugiere un seguimiento mínimo de 1 año para obtener resultados fiables, el cual ha sido sugerido como período para reevaluar, a pesar que algunas lesiones pueden tomar de 4-5 años o incluso más tiempo para sanar completamente 89. La Primera Conferencia Internacional de Endodoncia en 1953 estudió el problema considerando de 1 a 2 años como un período de observación adecuado. El período de observación postoperatoria defendido por varios autores después del tratamiento, es considerado entre 4 meses a 6 años 5, 11, 25, 44, 60, 89, 93, 95, 96. La Sociedad Europea de Endodoncia en 1994, diagnosticó enfermedad postoperatoria cuando la imagen radiolúcida periapical esta todavía presente 4 años posterior a la culminación del tratamiento 100. Caliscan (2004) fue más específico al recomendar realizar el período de reevaluación en intervalos de cada tres meses durante el primer año y subsecuentemente con un intervalo de 6-12 meses durante 2-10 años de seguimiento postoperatorio 62. Nuestra investigación muestra reevaluaciones a los 6 meses, por lo que es importante tener en cuenta al momento de hacer comparaciones con los resultados obtenidos de otros estudios. Otra variable a considerar y discutir es la evaluación intra e inter observadores, partiendo de que la evaluación e interpretación radiográfica puede variar ampliamente entre observadores y en tal interpretación se conjugan diversos factores inherentes al operador y a la radiografía 46. Molven, Halse y Fristad (2002) indican que las discusiones conjuntas de casos particulares pudieran reducir hasta un nivel aceptable la variación entre observadores y aumentar la validez de los hallazgos. Por lo que recomienda la calibración entre observadores 44. En cuanto al operador, los estudios de Caliscan (2004) reportan que las radiografías fueron analizadas por dos observadores independientes entrenados 62, de acuerdo al método descrito por Halse y Molven (1986), quienes indican que el procedimiento de evaluación debe ser realizado por dos observadores (un radiólogo y un endodoncista) 45 cuyos criterios deben ser calibrados antes de realizar el análisis; solo en pocos casos se requirió una evaluación conjunta para llegar a un consenso 45, 62. En la presente investigación el análisis fue realizado por tres observadores previamente calibrados, con el método descrito por Molven, Halse y Fristad (2002), en la cual dos de los observadores son endodoncitas y uno de los mismos es radiólogo 44, leyendo las radiografías en un medio ambiente adecuado para su visualización, según lo descrito por Basrani et al. (2003), Rosa y Tavares (2002) y White y Pharoah (2009) 101, 102, 103. El análisis de los resultados de la presente investigación referente al género, permite inferir que la muestra estuvo distribuida en un porcentaje mayor para el femenino, correspondiéndole un 76,92% de la muestra específica de dientes con necrosis pulpar. La media de edad fue de 47,3 (+/- 16,60). Esta variable no se consideró una limitante en el pronóstico del tratamiento. La literatura revisada no aporta criterios significativos en relación a este punto. Kojima et al. (2004) 104, indican que la edad no posee una influencia estadísticamente significativa, similar a Kerekes y Tronstad (1979) 11. Friedman et al. (2003) indican que ni la edad ni el género influyen en el pronóstico de los tratamientos de conductos realizados 94. coincidiendo con los resultados del presente estudio. La distribución de pacientes con necrosis pulpar en el presente estudio fue de 41,17%, lo que puede considerarse un elevado número de casos que requieren tratamiento de conductos por esta patología. De igual manera, la literatura consultada no especifica este dato y solo hacen referencia nombrando las patologías pulpares presentes sin indicar la prevalencia de las mismas. En relación a la presencia de signos, puede evidenciarse que el 76,9% de la muestra presentó signos clínicos entre los que se incluyen presencia de restauración defectuosa, caries, cámara pulpar abierta al medio bucal, lo que indica que la etiología de la necrosis pulpar esta relacionada a factores irritantes locales y su acción sobre el órgano dentino-pulpar, entre los que se destaca invasión microbiana producida por caries profunda, pulpitis o traumatismo. Siendo menos frecuentes los procesos degenerativos, atróficos y periodontales avanzados de acuerdo a lo reportado por Seltzer (1972) y Lasala (1992) 13, 20. El criterio de cambio de coloración de la corona clínica es un signo importante a considerar 13, 18, 21, sin embargo, en nuestros resultados no fue reflejada como significativa esta variable. En cuanto a la presencia o no de sintomatología, nuestra investigación reportó 84,6% no refirió dolor, 100% negativo a la prueba de sensibilidad al frio y 92,3% negativo al calor. Estos resultados concuerdan con otros autores tales como Milgran (2009) 19, quien expresa que la falta de respuesta a las pruebas térmicas se produce cuando existe necrosis pulpar. La aplicación de pruebas perirradiculares o mecánicas en nuestros hallazgos expresan que la mayoría de los casos resultaron negativos a la percusión vertical y horizontal y a la palpación sobre apical. Dichas pruebas son indicativos de inflamación periapical, lo que concuerda con criterios de varios autores, sin embargo, esta condición no es limitante a la presencia o no de necrosis pulpar 14, 18, 19. En relación a la evaluación radiográfica, puede decirse que el 92,31% de los dientes con necrosis pulpar presentaron signos de cambios radiográficos a nivel periapical, lo que coincide con la mayoría de los autores revisados 12, 13, 14, 17, 18, 19, 21, 24, 25, 26, 27, 30, 34, 38, 40, 48, 49, 62. Con respecto a la evaluación de las radiografías, Friedman (2002) y Zinman (2011) indica que las mismas han sido usadas rutinariamente como el principal medio de evaluación del resultado del tratamiento de conductos 99, 105. Las radiografías pueden ser susceptibles a cambios en la angulación y contraste, así como de interpretación 99, lo que puede alterar su interpretación. Caliscan (2004) y Friedman et al. (2003) indican la importancia de obtener la radiografía periapical con una técnica de cono largo con un tiempo de exposición estandarizado y procesadas manualmente por el mismo operador 5, 62, 94. En el presente estudio, a pesar de no ser realizado el proceso de obtención de la información radiográfica por un único operador en todas las etapas, se entrenó al personal participante en el proyecto. Basados en estos criterios, se manifiesta la importancia de la estadarización de la toma de las radiografías periapicales, para poder ser comparadas entre si 44, 45, 62. Por su parte, Kerekes y Tronstad (1979) utilizaron para la obtención de las radiografías el dispositivo de Eggen, para mantener una proyección similar en las radiografías de reevaluación 11. Camps, Pommel y Bukiet (2004), para mantener la reproductibilidad de la toma de la radiografía, aplicaron un método que consistió en confeccionar un bloque de mordida para reproducir la misma angulación radiográfica, colocado en un instrumento de técnica de cono paralelo 106. En cuanto a la presencia o no de periodontitis apical, los hallazgos clínicos reportados indican que el 69,23% de los casos presentaron un diagnóstico de periodontitis apical crónica, lo que coincide con los hallazgos radiográficos expuestos; y la menor proporción de periodontitis apical aguda (23,08%) coincide con los síntomas clínicos expresados en las figuras 22, 23, 24, 25 y 26. Diversos estudios indican que la tasa de éxito en tratamientos de conductos realizados por primera vez, es significativamente mejor en dientes sin presencia de periodontitis apical 5, 94, 95, 96, y entre los que presentan periodontitis apical, poseen un mayor éxito en cuanto a su remisión los dientes monorradiculares comparado con dientes multirradiculares 5, 94, 95. Resultados de diversos estudios refieren que la existencia de lesiones perirradiculares preoperatorias son un factor desfavorable para el éxito del tratamiento endodóntico 5, 8, 11, 94, 95, 96, 107. Sin embargo, en el presente estudio la presencia o no de periodontitis apical previa parece no ser una variable que tenga incidencia en el pronóstico de los casos. La etiología de la necrosis pulpar reporta que casi el 70% de los casos es debido a la presencia de caries dental y en menor proporción esta asociado a periodontopatías y razones protésicas y endodónticas (30%). Estos hallazgos están relacionados con la figura 27 que representa la presencia de signos clínicos. El análisis comparativo realizado en la presente investigación con la finalidad de mostrar los cambios de las diferentes variables entre el registro preliminar, el postoperatorio inmediato y el control a los 180 días son mostrados desde la figura 28 a la 31. En cuanto a la sintomatología dolorosa y movilidad dental, se encontró una mejoría del 100% en la reevaluación a los 180 dias. La imagen radiolúcida basada en el Índice Periapical, mostró disminución del tamaño de la imágen radiolúcida apical. Siendo estos resultados similares a los estudios consultados para la presente investigación, los cuales se resumirán a continuación: Harty, Parkins y Wengraf (1970) 93, Kerekes y Tronstad (1979) 11, Friedman et al. (2003) 94, Farzaneh et al. (2004) 95, Caliscan (2004) 62, Camps, Pommel y Bukiet (2004) 106, Marquis et al. (2006) 96, Chevigny et al. (2008) 5 y Siqueira et al. (2008) 89 reportaron una tasa de éxito de 73.8% al 91% en tratamientos de conductos. Kerekes y Tronstad (1979) 11, Friedman et al. (2003) 94, Farzaneh et al. (2004) 95, Caliscan (2004) 62, Marquis et al. (2006) 96, Chevigny et al. (2008) 5 y Siqueira et al. (2008) 89 indicaron una tasa de fracaso de 5% al 16,7% en tratamientos de conductos primarios. Diversos autores totalizaron hasta un 97% de los tratamientos como asintomáticos y funcionales 5, 57, 95, 96, 108. Estos hallazgos clínicos y radiográficos se deben a la realización de un correcto tratamiento de conducto y a una restauración definitiva adecuada en dientes con diagnóstico de necrosis pulpar. Es importante resaltar el efecto que tiene en dicho éxito la medicación intraconductos empleada y el protocolo clínico de atención desarrollado. Friedman (2002) evidencia que algunos medicamentos intraconductos usados en algunos estudios pueden ser inefectivos, comprendiendo un punto crítico para el control de la infección del SCR. Los clásicos medicamentos intraconductos, como el fenol alcanforado, paramonoclorofenol, yoduro de potasio de yodo y formocresol poseen vida útil corta, y pueden ser insuficientes para desinfectar entre sesiones el conducto asociado a periodontitis apical 83, 86, 99. A diferencia, Ørstavik y Haapasalo (1990), indican que el paramonoclorofenol alcanforado generalmente es más eficiente que el hidróxido de calcio 87. Sin embargo, el hidróxido de calcio ha comprobado ser un medicamento intraconductos efectivo 83, 84, 86, 99. Algunos autores realizan el tratamiento de conductos en una sola sesión, sin el uso de medicamentos intraconductos, Pekruhn (1986) evidencia que aquellos dientes que presentan lesión periapical con diagnóstico de necrosis pulpar poseen una incidencia mayor de fracaso, debido a la no utilización de medicación antimicrobiana intraconductos 109. Friedman et al. (2003) indican que observó diferencia de cicatrización en dientes que fueron tratados en 2 o más sesiones colocando medicación intraconductos 94. Farzaneh et al. (2004), evidenciaron como un factor de interés el número de sesiones en dientes con periodontitis apical, indicando mejor pronóstico en dientes con periodontitis apical tratados en 2 o más sesiones comparados con una sesión 95. Abbot y Yu (2007) recomiendan el uso de antimicrobianos y antiinflamatorios como medicación intraconductos en casos de dientes con necrosis pulpar 14. Byström, Claesson, Sundqvist (1985), Caliscan (2004), Siqueira et al. (2008) y Chevigny et al. (2008), refieren el empleo en tratamientos de más de una sesión, la utilización de hidróxido de calcio como medicación intraconductos 5, 62, 83, 89. A diferencia de Marquis et al. (2006), determinaron que el número de sesiones de tratamiento no tiene importancia estadísticamente significativa a pesar de utilizar medicación intraconductos entre sesiones 96. Fereira (2005) indicó que el medicamento intraconductos más empleado en los casos de necrosis pulpar fue el hidróxido de calcio, en un 68.8% de los casos 23. En la presente investigación, en el 100% de los casos fue empleada la medicación de hidróxido de calcio. El protocolo de atención clínica propuesto en el presente trabajo emplea un mínimo de 10 días con medicamento intraconducto en el SCR, coincidiendo con Castillo (2011) 72 y Ørstavik y Haapasalo (1990) 87; a diferencia, Sjögren et al. (1991), emplea la medicación intraconductos de hidróxido de calcio por un período de 7 días 75, Andersen et al. (1992), observaron que los mejores resultados del uso del medicamento se evidencia a partir de 7 días 84; Siqueira et al. (2008), en cuyo estudio emplearon medicación de hidróxido de calcio mezclado con paramonoclorofenol alcanforado y glicerina, observaron el mejor resultado en un periodo de 7 días 89. El método de colocación de la medicación intraconductos de la presente investigación fue realizado con un instrumento tipo léntulo en espiral hasta la longitud de trabajo, de igual manera como fue empleado por Sjögren et al. (1991) 75, Fava (1998) 38, Caliskan (2004) 62, Kusgoz et al. (2007) 77, Siqueira et al. (2008) 89, Tasdemir et al. (2011) 110 y Castillo (2011) 72 en sus respectivas investigaciones. A diferencia, la Asociación Americana de Endodoncia (2011) indica que el Ca(OH)2 pude ser colocado dentro del conducto radicular con la ayuda de una lima y removido del conducto radicular usando irrigantes como solución salina, NaOCl o EDTA 69. Tasdemir et al. (2011) evaluaron la eficacia de diversas técnicas para remover el medicamento de hidróxido de calcio del SCR, indicaron que las técnicas de agitación ultrasónica y cepillado dentro del conducto radicular son mas efectivas. El protocolo ejecutado en el presente trabajo consistió en la remoción de la medicación intraconductos con la ayuda de irrigantes químicos (NaOCl) llevados al SCR con una aguja de bajo calibre cercana a la longitud de trabajo. Ninguna técnica remueve completamente la medicación de hidróxido de calcio del SCR 110. Con respecto a los irrigantes empleados en la preparación química del SCR, Andersen et al. (1992), estudiaron la efectividad del hipoclorito de sodio en la disolución del tejido orgánico en un periodo corto de tiempo de trabajo 84. Sin embargo, Ørstavik y Haapasalo (1990) indican que el ioduro de potasio de yodo es mas efectivo que el hipoclorito de sodio al 5,25% 87. Siqueira et al. (1997) evaluaron la efectividad del hipoclorito de sodio para cuantificar la eliminación de Enterococcus faecalis del SCR, irrigando con 2 mL de NaOCl al 4.0%, siendo agitada la solución a mano con una lima tipo K número 30 y permaneciendo en el conducto por 5 minutos, resultando en una eliminación significativa del microorganismo 67. Siendo empleado en el presente trabajo un método clínico similar. Siqueira et al. (2008) emplearon un protocolo clínico, donde utilizaron abundante y frecuente irrigación con NaOCl al 2.5% (1-2 mL después de cada cambio de lima y 5 mL al final de la preparación) 89. Siendo similar la cantidad aproximada de volumen de solución irrigadora utilizada en la preparación química y mecánica del presente trabajo. Siqueira et al. (1997) emplearon un método de irrigación en el conducto radicular con el uso de una jeringa plástica de 3 mL junto a una aguja de calibre #23. Llegaron a la conclusión que la efectividad de diversos métodos de irrigación con NaOCl en el SCR dependen más de la solución de NaOCl que del método de irrigación empleado 67. A diferencia, Crespo (2014) indica que las técnicas de irrigación ultrasónica pasiva e irrigación manual dinámica fueron muy efectivas en la remoción del barrillo dentinario en los tercios coronal y medio del conducto radicular, cuando se empleó solución de EDTA. Concluyendo que el uso de un protocolo de irrigación que incluya activación de la sustancia empleada es indispensable para lograr la eliminación del barrillo dentinario 111. Al-Ali, Sathorn y Parashos (2012) evaluaron diferentes protocolos de irrigación final en conductos curvos. Indicando que el protocolo de irrigación ultrasónica pasiva y cepillado del conducto, redujo significativamente la capa de desecho y restos de tejido orgánico comparado con la agitación manual realizada con la aguja de irrigación 112. Dicho estudio no realizó evaluación de protocolo de irrigación de activación manual dinámica, técnica empleada en nuestro trabajo de investigación. La tasa de asistencia a reevaluación postoperatoria de los tratamientos de conductos en diversos estudios varia ampliamente, comprendiendo desde el 32% hasta el 100% 5, 62, 94, 95, 96, 106, 109. En el presente trabajo, la tasa de reevaluación clínica y radiográfica es significativamente alta, comprendiendo un 78,43% (40 casos) de la muestra total evaluada en el periodo de estudio. Con respecto al tipo de muestra estudiada, Caliskan (2004) incluyó para la realización de su estudio solamente dientes monorradiculares 62; mientras que diversos autores, incluyeron tanto dientes monorradiculares como multirradiculares 5, 11, 94, 95, 96, 106, 109, coincidiendo la muestra evaluada en el presente trabajo con la mayoría de los proyectos consultados. Se ha evidenciado ampliamente la relación entre la calidad de la restauración coronal y condición periapical de los dientes tratados. Se ha sugerido que la restauración coronal, así como la obturación del conducto radicular, sirven como barrera contra los fluidos y la penetración bacteriana al área periapical 43. Ray y Trope (1995) encontraron que la calidad de la restauración coronal es incluso más importante para la condición periapical que la calidad del tratamiento endodóntico 113. Kikervang et al. (2000) concluyeron que un inadecuado tratamiento de conductos e inadecuada restauración se encuentran asociados a un incremento en la incidencia de la periodontitis apical 114. Lin et al. (1992) refieren que la clave para conseguir el éxito en la terapia endodóntica es a través de la limpieza y conformación del SCR con un adecuado sellado coronario, con el fin de curar infecciones persistentes y prevenir reinfección del espacio pulpar 107. Doyle et al. (2006), refieren que los dientes no restaurados después del tratamiento de conductos son más probables que fracasen que aquellos restaurados 4. En nuestro trabajo se realizó el sellado coronal de la entrada del SCR con una restauración definitiva de resina fluida y obturación provisional con ionómero de vidrio o resina compuesta fotopolimerizable; al igual que Caliskan (2004) 62 y Siqueira et al. (2008) 89. Friedman (2002), Friedman et al. (2003), Farzaneh et al. (2004) y Marquis et al. (2006), Siqueira et al. (2008) indican que el tipo de restauración final no influye en el pronóstico de los tratamientos de conductos realizados y solo influencia significativamente la evolución del tratamiento cuando la obturación del conducto radicular ha sido inadecuado y/o no homogéneo 89, 94, 95, 96, 99.
CONCLUSIONES 1. Basados en estudios previos realizados el PE de
la FO de la UCV y de investigaciones reportadas en
la literatura, se diseñó y
aplicó un protocolo clínico de
atención para pacientes con dientes que
presentaron diagnóstico de necrosis pulpar,
el cual se demostró que permitió la
remisión de los síntomas y signos
clínicos y radiográficos de los
pacientes que fueron tratados. 2. Se obtuvo una una prevalencia de 41,17% y
frecuencia de 21 dientes con diagnóstico de
necrosis pulpar que acudieron al servicio del PE de
la FO de la UCV en el periodo Abril-Julio del
año 2014. La muestra estuvo distribuida en un porcentaje
mayor para el género femenino, y la media de
edad fue de 47 años. Estas variables no se
consideraron limitantes en el pronóstico del
tratamiento. 3. Según el IP, el diagnóstico
periapical más frecuente previo al
tratamiento de conductos fueron las
categorías 2 y 3 (dudoso), con una
frecuencia de 7 dientes y una prevalencia de 53,84
%, seguido de dientes con categorías 4 y 5
(enfermo), con una frecuencia de 5 dientes y una
prevalencia del 38,46%. 4. Antes de la terapia endodóntica, el
principal signo clínico observado fue
presencia de corona clínica afectada,
especialmente restauraciones defectuosas; el 30% de
los casos presentó movilidad dental previo
al tratamento de conductos, mejorando esta
condición en un 100% de los casos a la
revaluación a los 180 días. 5. Previo a la realización del tratamiento
de conductos, el 15% de los casos presentaron
síntomas de dolor, y durante la
evaluación postoperatoria y control a los
180 días, esta condición
mejoró en un 100% de los casos. 6. El diagnóstico radiográfico
preoperatorio más frecuente fue la presencia
de imagen radiolúcida periapical, la cual
disminuyó significativamente en la
evaluación postoperatoria inmediata y a la
revaluación a los 180 días. 7. Un alto porcentaje de los dientes presentaron
una restauración definitiva adecuada al
momento de la revaluación, demostrando la
relación entre la realización del
tratamiento de conductos y restauración
definitiva adecuada en la resolución de la
imagen radiolúcida periapical en dientes con
diagnóstico de necrosis pulpar.
RECOMENDACIONES • Se sugiere implementar el protocolo de
atención clínica propuesto, para
dientes con diagnóstico de necrosis pulpar,
a ser atendidos en el Postgrado de Endodoncia de la
Facultad de Odontología de la Universidad
Central de Venezuela. • Se recomienda realizar nuevos estudios
aumentando el tamaño de la muestra y del
tiempo de revaluación postoperatoria, para
determinar si existen interacciones entre las
variables a estudiar, lo cual no fue posible
evidenciar en el presente trabajo. • Se recomienda incluir en el instrumento de
recolección de datos ad hoc, variables
adicionales que pudieran ser pertinentes, para
correlacionarlas y de esa manera, obtener mayor
información que pueda enriquecer los
resultados de futuras investigaciones. • Se sugiere confeccionar posicionadores
individualizados para las películas
radiográficas, que permitan estandarizar la
toma de todas las radiografías con los
mismos parámetros de angulación,
tanto horizontal como vertical.
REFERENCIAS BIBLIOGRÁFICAS 1. Organización Mundial de la Salud.
Estadísticas sanitarias mundiales 2014. Una
mina de información sobre salud
pública mundial. 2014: 1- 10. 2. Instituto Nacional de Estadística.
www.ine.gov.ve tomado en 2013. 3. Swartz D., Skidmore, Griffin JA. Twenty years of
endodontic success and failure. J endod. 1983; 9
(5): 198-202. 4. Doyle S., Hodges J., Pesun I., Law A., Bowles W.
Retrospective cross sectional comparison of initial
nonsurgical endodontic treatment and single-tooth
implants. J endod. 2006; 32: 822-827. 5. Chevigny C., Dao T., Basrani B., Marquis V.,
Farzaneb M., Abitbol S., Friedman S. Treatment
outcome in endodontics: The Toronto study- Phase 4:
Initial treatment. J endod. 2008; 34: 258-263. 6. Loyo K. Evaluación endodóntica de
los pacientes con infección por VIH y/o
hepatitis que acuden al centro de atención
de personas con enfermedades infectocontagiosas,
Facultad de Odontología 2000-2004. UCV.
Universidad Central de Venezuela. Caracas,
Venezuela. 2006. 7. Loyo K. Evaluación
clínica-radiográfica de los
tratamientos de conducto realizados a pacientes que
viven con VIH que asistieron al Centro de
Atención a Pacientes con Enfermedades
Infectocontagiosas "Dra. Elsa La Corte" entre
noviembre de 1998 y junio de 2010. Universidad
Central de Venezuela. Caracas, Venezuela. 2012. 8. Aguilar T. Aspectos microbiológicos de la
periodontitis apical crónica persistente.
Trabajo especial de grado Universidad Central de
Venezuela, Caracas, Venezuela. Abril 2004. 9. Lasala A. Guía de endodoncia
clínica. Editorial Universitaria L.U.Z.
Maracaibo, Venezuela. 1971: 1-50. 10. Ingle, J. A standardized endodontic technique
utilizing newly designed instruments and filling
materials. Oral Surg Oral Med Oral Pathol. 1961; 14
(1): 83-91. 11. Kerekes K., Tronstad L. Long-term results of
endodontic treatment performed with a standardized
technique. J Endod. 1979; 5: 83-90. 12. Seltzer S. Granuloma periapical y quiste
radicular. Endodoncia. Consideraciones
biológicas en los procedimientos
endodónticos. Editorial MUNDI S.A.I.C. y F.
Argentina. 1979: 199-230. 13. Lasala A. Endodoncia. Cuarta edición.
Barcelona, España. Editorial Masson-Salvat
Odontología.1992: 69-104. 14. Abbott P., Yu C. A clinical classification of
the status of the pulp and the root canal system.
Aust Dent J. 2007; 52 : (1 Suppl): S17-S31. 15. AAE Consensus Conference Recommended Diagnostic
Terminology. JOE. 2009; 35 (12): 1634. 16. Rosenberg P., Schindler W., Krell K., Hicks L.,
Davis S. Identifi the endodontic treatment
modalities. J Endod. 2009; 35: 1675-1694. 17. Berman L., Hartwell G. Diagnóstico. En:
Hargreaves K., Cohen S., Berman L., editores.
Vías de la pulpa. Décima
edición. Barcelona, España. Editorial
Elsevier. 2011: 2-39. 18. Levin L., Law A., Holland G., Endo C., Abbott
P., Roda R. Identify and define all diagnostic
terms for pulpal health and disease states. J
Endod. 2009; 35: 1645-1657. 19. Milgram R. Diagnóstico de la
condición pulpar y periapical. Trabajo
especial de grado Universidad Central de Venezuela,
Caracas, Venezuela. Diciembre 2009. 20. Seltzer S. Classification of pulpal pathosis.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod.
1972; 34 (2): 269-287. 21. Castilla L., Diez M. Clasificación
clínica de patología pulpar y
periapical basada en la propuesta de la
Asociación Americana de Endodoncia de
Diciembre de 2009. Rev Odontos. 2010; 35 (12):
40-43. 22. Seltzer S. Pain in Endodotics. J Endod. 2004; 30
(7): 501-503. 23. Fereira M. Medicación intraconducto
empleada en la terapia endodóntica de
dientes con necrosis pulpar en el Postgrado de
Endodoncia de la Universidad Central de Venezuela
en el período Enero 2002-Abril 2005. Trabajo
especial de grado Universidad Central de Venezuela,
Caracas, Venezuela. Noviembre 2005. 24. Bender I. Factors influencing the radiographic
appearance of bone lesions. J Endod. 1982; 8:
161&endash;70. 25. Bender I., Seltzer S., Soltanoff, W. Endndontic
success: a reappraisal of criteria. Oral Surg Oral
Med Oral Pathol. 1966; 22 (6): 790-802. 26. Ricucci D., Bergenholtz G. Histologic features
of apical periodontitis in human biopsies. Endod
Topics. 2004; 8: 68-87. 27. Abbott P. Classification, diagnosis and clinical
manifestations of apical periodontitis. Endod
Topics. 2004; 8: 36-54. 28. Kakehashi S, Stanley H, Fitzgerald R. The
effects of surgical exposures of dental pulps in
germ-free and conventional laboratory rats. Oral
Surg. 1965; 20: 340-9. 29. Stashenko P, Yu S, Wang C. Kinetics of immune
cell and bone resorptive responses to endodontic
infections. J Endod. 1992; 18: 422&endash; 426. 30. Gutmann J., Baumgartner C., Gluskin A., Hartwell
G., Walton R. Identify and define all diagnostic
terms for periapical/periradicular health and
disease states. J Endod. 2009; 35 (12):
1658-1674. 31. Nair P. Pathogenesis of apical periodontitis and
the causes of endodontic failures. Crit Rev Oral
Biol Med. 2004;15 (6):348&endash;381. 32. Velickovic M., Pejnovic N., Mitrovic S.,
Radosavljevic G., Jovanovic I., Kanjevac T.,
Jovicic N., Lukic A. ST2 deletion increases
inflammatory bone destruction in experimentally
induced periapical lesions in mice. JOE. 2015; 41:
369-375. 33. Morsani J., Aminoshariae A., Han Y., Montagnese
T., Mickel A. Genetic predisposition to persistent
apical periodontitis. J Endod. 2011;
37(4):455&endash;9. 34. Lin L., Huang G. Patobiología periapical.
En: Hargreaves K., Cohen S., Berman L., editores.
Vías de la pulpa. Décima
edición. Barcelona, España. Editorial
Elsevier. 2011: 529-558. 35. Saatchi M. Healing of large periapical lesion: A
non-surgical endodontic treatment approach. Aust
Endod J. 200; 33 (3): 136-140. 36. Ricucci D., Pascon E., Pitt Ford T., Lageland K.
Epithelium and bacteria in periapical lesions. Oral
Surg Oral Med Oral Pathol Radiol Endod. 2006; 101
(2): 234-249. 37. Nair P. Apical periodontitis: a dynamic
encounter between root canal infection and host
response. Periodontology 2000. 1997; 13:
121-148. 38. Fava L. Acute apical periodontitis: incidence of
post-operative pain using two different root canal
dressings. Int Endod J. 1998; 31: 343-347. 39. Garcia F., Wu M., Roberto M., Bezerra L.,
Wesselink P. Accuracy of periapical radiography
ando cone-beam computed tomography scans in
diagnosing apical periodontitis using
histopathological findings as a gold standard. J
Endod. 2009; 35: 1009-1012. 40. Ørstavik D., Kerekes K., y Eriksen H. The
periapical index: A scoring system for radiographic
assessment of apical periodontitis. Endod Dent
Traumatol. 1986; 2: 20-34. 41. Nair P., Pajarola G., Schroeder H. Types and
incidence of human periapical lesions obtained with
extracted teeth. Oral Surg Oral Med Oral Pathol
Oral Radiol Endod. 1996; 81: 93-102. 42. World Health Organisation. Application of the
International Classification of Diseases to
dentistry and stomatology, 3rd edn. Geneva: WHO,
1995: 66-67. 43. Kirkevang L., Hørsted-Bindslev P.
Technical aspects of treatment in relation to
treatment outcome. Endod Topics. 2002; 2:
89-102. 44. Molven O., Halse A., Fristad I. Long-term
reliability and observer comparisons in the
radiographic diagnosis of periapical disease. Int
Endod J. 2002; 35: 142-147. 45. Halse A., Molven O. A strategy for the diagnosis
of periapical pathosis. J Endod. 1986; 12 (11):
534-538. 46. Sankarsingh C. Determinación de
éxito y fracaso en el tratamiento de
conductos. Trabajo especial de grado Universidad
Central de Venezuela, Caracas, Venezuela. Noviembre
2002. 47. Reit C., Gröndahl H. Application of
statistical decisión theory to radiographic
diagnosis of endodontically treated teeth. Scand J
Dent Res. 1983; 91: 213-8. 48. Mendoza A., Caleza C., Iglesias A., Solano B.,
Yañez V. Endodontic treatment of large
periapical lesions: An alternative to surgery.
Edorium J Dent. 2015; 2: 1-6. 49. Nunes M., Da Costa E. Aspectos
radiográficos de las periopicopatías.
En de Freitas A., Edu J., Faria I., editores.
Radiología Odontológica. Sao Paulo,
Brasil. Artes Médicas Latinoamérica.
2002: 385-397. 50. The American Academy of Periodontology. Glossary
of Periodontal Terms. 4th ed. 2001:1-53. 51. Sundqvist G., Eckerbom M., Larsson A., Sjogren
U. Capacity of anaerobic bacteria from necrotic
dental pulp to induce purulent infection. Infection
and Immunity. 1979; 25 (2): 685-693. 52. van Winkelhoff A., Carlee A., de Graaff J.
Bacteroides endodontalis and other black-pigmented
bacteroides species in odontogenic abscesses.
Infection and Immunity. 1985; 49 (3):494-497. 53. Oguntebi B., Slee A., Tanzer J., Langeland K.
Predominant microflora associated with human dental
periapical abscesses. J Clin Microbiol. 1982; 15
(5): 964-966. 54. Laskin D. Anatomic considerations in diagnosis
and treatment of odontogenic infections. J Am Dent
Assoc. 1964; 69: 308-316. 55. Iwu C., MacFarlane W., MacKenzie D., Stenhouse
D. The microbiology of periapical granulomas. Oral
Surg Oral Med Oral Pathol. 1990; 69: 502-505. 56. Shindell, E. A study of some periapical
roentgenolucencies and their significance. Oral
Surg Oral Med Oral Pathol. 1961; 14 (9):
1057-1065. 57. Bhaskar S. Periapical lesions-types, incidence
and clinical features. Oral Surg Oral Med Oral
Pathol. 1966; 21 (5): 657-671. 58. Seltzer S., Bender I., Smith J., Feedman I.,
Nazimov H. Endodontic failures: An analysis based
on clinical roentgenographic and histologic
findings. Part I. Oral Surg Oral Med Oral Pathol.
1967; 23 (4): 500-516. 59. Shaik S., Selvakumar T., Uma D., Srinivasa P.,
Nalin K. Radicular cyst- A case report with an
overview on pathogenesis. Indian J Multidiscip
Dent. 2013; 4 (3): 824-827. 60. Morse D., Wolfson E., Schacterle G. Nonsurgical
repair of electrophoretically diagnosed radicular
cysts. J Endod. 1975; 1 (5): 158- 163. 61. Cotti E., Campisi G., Garau V., Puddu G. A new
technique for the study of periapical bone lesions:
ultrasound real time imaging. Int Endod J. 2002;
35: 148-152. 62. Caliskan M., Prognosis of large cyst-like
periapical lesions following nonsurgical root canal
treatment: a clinical review. Int Endod J. 2004;37:
408-416. 63. Simon J. Incidence of periapical cysts in
relation to the root canal. J Endod. 1980; 6 (11):
845-848. 64. Lin L., Ricucci D., Lin J., Rosenberg P.
Nonsurgical root canal therapy of large cyst-like
inflammatory periapical lesions and inflammatory
apical cyst. J Endod. 2009; 35: 607-615. 65. Valderhaug J. A histologic study of
experimentally induced radicular cysts. Int J Oral
Surg. 1972; 1: 137-147. 66. Siqueira J., Lopes H. Mechanisms of
antimicrobial activity of calcium hydroxide: a
critical review. Int Endod J. 1999; 32:
361-369. 67. Siqueira J., Machado A., Silveira R., Lopes H.,
De Uzeda M. Evaluation of the effectiveness of
sodium hypochlorite used with three irrigation
methods in the elimination of enterococcus faecalis
from the root canal, in vitro. Int Endod J. 1997;
30: 279-282. 68. Byström A., Sundqvist G. Bacteriologic
evaluation of the efficacy of mechanical root canal
instrumentation in endodontic therapy. Scand J Dent
Res. 1981; 89: 321-328. 69. American Association of Endodontists. Root Canal
Irrigants and Disinfectans. 2011: 1-8. 70. El Karim I., Kennedy J., Hussey D. The
antimicrobial effects of root canal irrigation and
medication. Oral Surg Oral Med Oral Pat Oral Rad
and Endo. 2007; 103 (4): 560-569. 71. Law A., Messer H. An Evidence-Based Analysis of
the Antibacterial Effectiveness of Intracanal
Medicaments. J endod. 2004; 30 (10): 689- 694. 72. Castillo C. Efectividad del Hidróxido de
Calcio como medicación intraconducto en la
eliminación de enterococcus faecalis en
diferentes intervalos de tiempo. Trabajo especial
de grado Universidad Central de Venezuela, Caracas,
Venezuela. Octubre 2011. 73. Estrela C., Rodrigues C., Luschke L., Pecora J.
Two methods to evaluate the antimicrobial actios of
calcium hydroxide paste. J endod. 2001; 27 (12):
720-723. 74. Peciuliene V., Reynaud A., Balciuniene I.,
Haapasalo M. Isolation of yeasts and enteric
bacteria in root-filled teeth with chronic apical
periodontitis. Int Endod J. 2001; 34: 429-434. 75. Sjögren U., Figdor D., Spangberg L.,
Sundqvist G. The antimicrobial effect of calcium
hydroxide as a short-term intracanal dressing. Int
Endod J. 1991; 24: 119-125. 76. Estrela C., Pékora J., Souza-Neto M.,
Estrela C., Bammann L. Effect of vehicle on
antimicrobial properties of calcium hydroxide
pastes. Brazil Dent J. 1999; 10 (2): 63-72. 77. Kusgoz A., Yildirim S., Gokalp A.. Nonsurgical
endodontic treatments in molar teeth with large
periapical lesions in children: 2-year follow-up.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod.
2007; 104 (1): e60&endash; 65. 78. Farhad A., Mohammadi Z. Calcium hydroxide: A
review. International Dental Journal. 2005; 55 (5):
293-301. 79. Fava L., Saunders W. Calcium hydroxide pastes:
classification and clinical indications. Int Endod
J. 1999; 32: 257-282. 80. Athanassiadis B., Abbott P., Walsh L. The use of
calcium hydroxide, antibiotics y biocides as
antimicrobial medicaments in endodontics. Aust Dent
J. 2007; 52 (1): 564- 582. 81. Stevens R., Grossman L. Evaluation of the
antimicrobial potential of calcium hydroxide as an
intracanal medicament. J endod. 1983; 9 (9):
372-374. 82. Haapasalo M., Quian W., Portenier I., Waltimo T.
Effects of dentin on the antimicrobial properties
of endodontic medicaments. J endod. 2007; 33 (8):
917-925. 83. Byström A., Claesson R., Sundqvist G. The
antibacterial effect of camphorated
paramonochlorophenol, camphorated phenol and
calcium hydroxide in the treatment of infected root
canals. Endodontics and Dental Traumatology. 1985:
1: 170- 175. 84. Andersen M., Lund A., Andreasen J., Andreasen F.
In vitro solubility of human pulp tissue in calcium
hydroxide and sodium hypochlorite. Endod Dent
Traumatol. 1992; 8: 104-108. 85. Tronstad L. Root resorption-etiology,
terminology and clinical manifestations. Endod Dent
Traumatol. 1988; 4: 241-252. 86. Stuart K., Miller C., Brown C., Newton C. The
comparative antimicrobial effect of calcium
hydroxide. Oral Surg Oral Med Oral Pathol. 1991;
72: 101-104. 87. Ørstavik D., Haapasalo M. Desinfection by
endodontic irrigants and dressings of
experimentally infected dentinal tubules. Endod
Dent Traumatol. 1990; 6: 142-149. 88. Rosa K., Cortés M. Estado actual de la
indicación de antimicrobianos para la
medicación intracanal. Acta Odontol Venez.
2005; 43 (2). 89. Siqueira J., Rôças I., Riche F.,
Provenzano J. Clinical outcome of the endodontic
treatment of teeth with apical periodontitis using
an antimicrobial protocol. Oral Surg Oral Med Oral
Pathol and Endo. 2008;106 (5): 757-762. 90. Siqueira J., Rocas I., Paiva S., Guimaraes T.,
Magalhaes K., Lima K. Bacteriologic investigation
of the effects of sodium hypochlorite and
chlorhexidine durin the endodontic treatment of
teeth with apical periodontitis. Oral Surg Oral Med
Oral Pat Oral Rad and Endo. 2007; 104: 122-130. 91. Heithersay G. Calcium hydroxide in the treatment
of pulpless teeth with associated pathology. J Br
Endod Soc. 1975; 8 (2): 74-93. 92. Texeira F., Levin L., Trope M. Investigation of
pH at different dentinal sites after placement of
calcium hydroxide dressing by two methods. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod. 2005;
99: 511-516. 93. Harty F., Parkins B., Wengraf A. Success rate in
root canal therapy. Br Dent J. 1970; 20: 65-70. 94. Friedman S., Abitol S., Lawrence H. Treatment
outcome in endodontics: the Toronto Study. Phase 1:
initial treatment. J endod. 2003; 29 (12):
787-793. 95. Farzaneh M., Abitol S., Lawrence H., Friedman S.
Treatment outcome in endodontics- the Toronto
study. Phase II: initial treatment. J endod. 2004;
30 (5): 302-309. 96. Marquis V., Dao T., Farzaneb M., Abitbol S.,
Friedman S. Treatment outcome in endodontics: The
Toronto study. Phase III: Initial treatment. J
endod. 2006; 32: 299-306. 97. Szkio M, Nieto J. Epidemiología
intermedia: Conceptos y aplicaciones. Madrid: Diez
de Santos. 2003. 98. Edmonds WA, Kennedy TD. An applied reference
guide to research designs: Quantitative,
qualitative, and mixed methods. Thousand Oaks, CA:
Sage. 2013. 99. Friedman S. Prognosis of initial endodontic
therapy. Endodontic Topics. 2002; 2: 59-88. 100. European Society of Endodontology. Quality
guidelines for endodontic treatment. Int Endod J.
1994; 27: 115&endash;120. 101. Basrani E., Blank A., Cañete M.
Radiología en Endodoncia. Primera
Edición. Actualidades Médico
Odontológicas Latinoamérica, C.A.
2003. Pag. 1-13. 102. Rosa J., Tavares D. Principios de
interpretación radiográfica. En: de
Freitas A., Rosa J. Faria I., . Radiología
Odontológica. Primera edición. Sao
Paulo, Brasil. Artes médicas
Latinoamérica. 2002: 323-350. 103. White S., Pharoah M. Principles of radiographic
interpretation. En Oral Radiology. Principles and
Interpretation. 6ta Edición. St. Louis, USA.
Mosby Elsevier. 2009: 256-269. 104. Kojima K., Inamoto K., Nagamatsu K., Hara A.,
Nakata K., Morita I., Nakagaki H., Nakamura H.
Success rate of endodontic treatment of teeth with
vital and nonvital pulps. A meta-analysis. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;
97: 95-99. 105. Zinman E. Registros y responsabilidades legales.
. En: Hargreaves K., Cohen S., Berman L., editores.
Vías de la pulpa. Décima
edición. Barcelona, España. Editorial
Elsevier. 2011: 389-450. 106. Camps J., Pommel L., Bukiet F. Evaluation of
periapical lesión healing by correction of
gray values. J Endodo. 2004; 30 (11): 762-766. 107. Lin L., Skribner J., Gaengler P. Factors
associated with endodontic treatment failures. J
endod. 1992; 18 (12): 625-627. 108. Salehrabi R., Rotstein I. Endodontic treatment
outcomes in a large patient population in the USA:
an epidemiological study. J endod. 2004; 30 (12):
846-850. 109. Pekruhn R. The incidence of failure following
single-visit endodontic therapy. J Endod. 1986; 12
(2): 68-72. 110. Tasdemir T., Celik D., Er K., Yildirim T.,
Ceyhanli K., Yesilyurt C. Efficacy of several
techniques for the removal of calcium hydroxide
medicament from root Canals. Int Endod J. 2011; 44:
505-509. 111. Crespo J. Efecto de distintos protocolos de
irrigación final con ácido
etilendiaminotetraacético sobre el barrillo
dentinario. Trabajo especial de grado Universidad
Central de Venezuela, Caracas, Venezuela. Julio
2014. 112. Al-Ali M., Sathorn C., Parashos P. Root canal
debridement efficacy of different final irrigation
protocols. Int Endod J. 2012; 45: 898-906. 113. Ray H., Trope M. Periapical status of
endodontically treated teeth in relation to the
technical quality of the root filling and the
coronal restoration. Int Endod J. 1995; 28:
12-18. 114. Kirkevang L., Ørstavik D.,
Hörsted-Bindslev P. Wenzel A. Periapical
status and quality of root fillings and coronal
restorations in a Danish population. Int Endod J.
2000; 33: 509-515.
Invitados Anteriores y sus Trabajos
¿Comentarios? carlosboveda@carlosboveda.com.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||